益生菌预防早产儿坏死性小肠结肠炎的系统评价和Meta分析
郭 明 唐晓宇 叶 远 牛佳兰 寇城坤 马 彬 张雪峰
·论著·
益生菌预防早产儿坏死性小肠结肠炎的系统评价和Meta分析
郭 明1, 4唐晓宇2, 3, 4叶 远2, 3牛佳兰2, 3寇城坤2, 3马 彬2, 3张雪峰1
目的 评价益生菌预防早产儿坏死性小肠结肠炎(NEC)的有效性和安全性。方法 计算机检索PubMed、Ovid-Embase、The Cochrane Library、中国知网、维普、中国生物医学文献和万方数据库,收集益生菌预防早产儿NEC的RCT,检索时间均从建库至2016年3月。2名评价员独立筛选文献、提取资料和评价偏倚风险,采用 RevMan5.3软件进行Meta分析。结果 最终纳入33个RCT (n=8 248)。Meta分析结果显示:①低出生体重儿(LBWI):益生菌降低NEC 2级以上(包括2级和3级)发生率[OR=0.26(95%CI:0.10~0.66)]、3级发生率[OR=0.29(95%CI:0.11~0.78)]、缩短达全肠道喂养时间[WMD=-3.57(95%CI:-5.79~-1.34)],差异有统计学意义,益生菌组和对照组总病死率[OR=0.80(95%CI:0.50~1.28)]和脓毒症发生率[OR=0.50(95%CI:0.13~1.99)]差异无统计学意义;②极低出生体重儿(VLBWI):益生菌降低NEC 2级以上发生率[OR=0.34(95%CI:0.26~0.44)]、3级发生率[OR=0.39(95%CI:0.20~0.76)]、总病死率[OR=0.55(95%CI:0.44~0.69)]、NEC相关病死率[OR=0.38(95%CI:0.21~0.69)]和脓毒症发生率[OR=0.77(95%CI:0.62~0.95)],差异均有统计学意义,益生菌组和对照组达全肠道喂养时间 [WMD=-1.28(95%CI:-2.62~0.06)]差异无统计学意义;③超低出生体重儿(ELBWI):益生菌缩短达全肠道喂养时间 [WMD=-1.70(95%CI:-2.85~-0.55)],差异有统计学意义,益生菌组和对照组的NEC 2级以上和3级发病率、总病死率、NEC相关病死率和脓毒症发生率差异无统计学意义。结论 预防性使用益生菌可减少LBWI和VLBWI的NEC 2级以上以及3级发生率,缩短达全肠道喂养时间,并降低VLBW的总病死率、NEC相关病死率和脓毒症发生率,但纳入研究在研究设计、方法学等方面仍存在局限性,仍需开展更多高质量研究予以验证。
益生菌; 坏死性小肠结肠炎; 早产儿; 系统评价; Meta分析; 随机对照试验
坏死性小肠结肠炎(NEC)是一种常见于早产儿的胃肠道急症,病死率30%~50%[1]。国外已有很多临床研究表明益生菌能够降低早产儿NEC发生率。但仍存在一定的争议,如Costeloe等[2]的Ⅲ期临床试验显示益生菌不能减少NEC的病死率。国内程国强[3]与王小玲[4]等对口服益生菌预防早产儿严重NEC的疗效和安全性进行了Meta分析,前者检索时间较早(截止2009年),后者仅纳入极低出生体重早产儿(VLBWI),且2个研究均未采用国际推荐的偏倚风险工具对纳入研究进行偏倚风险评估。有鉴于此,本文系统检索和评价了益生菌预防早产儿NEC的RCT文献,对益生菌的疗效和安全性进行了全面评估,以期为临床预防早产儿NEC提供参考依据。
1 方法
1.1 文献纳入标准 ①RCT;②中文和英文文献;③胎龄<37周的早产儿,不限制出生体重;④干预组和对照组在相同的基础治疗上,干预组给予口服益生菌治疗,不限制益生菌的品种、剂量和疗程,对照组或给予安慰剂或为空白对照。
1.2 文献排除标准 ①重大先天缺陷患儿(例如严重先心病、脊髓脊膜膨出等);②随机方法不正确;③文献无法提取本文设定的主要结局指标;④重复发表的文献只纳入其中最早发表的文献。
1.3 结局指标
1.3.1 主要结局指标 ①根据Bell标准[5],NEC 2级以上(包括2级和3级)和3级发生率;②NEC相关病死率(由2级及以上NEC引起的病死[6,7]);③总病死率(任何原因导致的病死[7,8])。
1.3.2 次要结局指标 ①败血症[49]发生率,以血或骨髓培养阳性(排除污染)为确诊标准;②达全肠道喂养(肠内营养>150mL·kg-1·d-1)所需时间[10]。
1.4 检索策略 计算机检索PubMed、Ovid-Embase、The Cochrane Library、中国期刊全文数据库、中文科技期刊数据库、中国生物医学文献数据库、万方数据库,检索时间均从建库至2016年3月。以PubMed数据库为例,英文检索式为 “(Premature infant OR Prematurity OR Neonate OR Newborn OR Preterm) AND Necrotizing enterocolitis AND (Probiotic OR Lactobacillus OR Streptococcus OR Saccharomyces OR Bifidobacterium)”,以CBM为例,中文检索式为“益生菌 AND 坏死性小肠结肠炎”。采用主题和自由途径结合方式进行检索。
1.5 文献筛选与资料提取 由2位评价员(唐晓宇与牛佳兰)分别独立筛选文献、提取资料并交叉核对,如遇分歧,则咨询第三方(马彬)协助判断,缺乏的资料尽量联系作者予以补充。文献筛选先根据题目与摘要排除明显不相关的文献后,再进一步阅读全文确定是否最终纳入。资料提取内容主要包括:①纳入文献的基本信息,包括作者、发表时间和发表国家等;②研究对象的基线特征,包括人口学特征(胎龄、出生体重、日龄和样本量等)和其他特征(分娩方式、产前激素治疗和抗生素暴露等);③干预措施的具体细节,包括基础治疗方案,益生菌种类、剂量和疗程,安慰剂方案,空白对照方案;④RCT偏倚风险风险评价的条目;⑤本文设定的主要和次要结局指标。
1.6 偏倚风险评估 由2名评价员(唐晓宇与牛佳兰)按照Cochrane Handbook5.0推荐的偏倚风险评价工具评估。
1.7 发表偏倚评估 使用Revman 5.3软件制作漏斗图,进行发表偏倚评估。
1.8 不同出生体重亚组比较 鉴于本研究纳入标准中未对出生体重做限制,故拟对超低出生体重儿(ELBWI,出生体重<1 000 g)、VLBWI(出生体重~1 499 g)和低出生体重儿(LBWI,出生体重~2 500 g)行亚组间比较。
1.9 统计学分析 采用RevMan5.3软件进行Meta分析。计数资料采用OR为效应指标,计量资料采用均数差(MD)为效应指标,各效应量均给出其点估计值和95%CI。纳入研究结果间的异质性采用χ2检验进行分析(检验水准为α=0.1),同时结合I2定量判断异质性的大小。若P>0.1和I2≤50%,采用固定效应模型进行数据合并分析;若各研究结果间存在较高异质性,分析异质性来源,在排除明显临床和/或方法学异质性影响后,仍存在统计学异质性(P<0.1,I2>50%),则采用随机效应模型进行合并分析。
2 结果
2.1 文献检索结果 依据本文设定的文献检索策略,共检索到636篇文献,逐层筛选后,33个RCT进入本文分析,中文文献8篇,英文文献25篇,纳入了8 248例早产儿,益生菌组4 137例,对照组4 111例。文献筛选流程见图1。

图1 文献筛选流程图
2.2 纳入文献的基本特征 表1显示,纳入的33篇RCT文献的研究对象均为胎龄<37周且体重<2 500 g的早产儿,其中LBWI 1 019例,益生菌组516例,对照组503例;VLBWI 6 932例,益生菌组3 478例,对照组3 454例;ELBWI 297例,益生菌组143例,对照组154例。各研究所采用的益生菌的种类和剂量不完全相同。
2.3 偏倚风险评价 33项研究均提及随机分组,其中24篇[7,8,11-13,16,17,19-22,25-34,36-38]研究报告了具体随机方法,9篇研究[6,14,15,18,23,24,35,39,40]未报告;16篇研究[7,8,12,16-22,25,27,28,31,32,37]采用了分配隐藏方案,15篇研究[6,13-15,23,24,29,30,33-36,38-40]未提及,2篇[11,26]未采用;19篇研究[7,8,12,13,15,1,18-22,25,27,31-33,35-37]对医生施盲,9篇研究[12-19,23,33,34,41,43,44]对结局测量人员施盲;3篇研究[32,34,38]存在不完整数据报告,13篇研究[7,8,12,19-22,27-29,32,33,38]在WHO临床试验注册平台以及一级注册平台注册,通过与其研究计划书核对,无选择性报告偏倚。偏倚风险评价结果见图2。
2.4 发表偏倚评价 图3显示,漏斗图总体较为对称,右下角缺失,提示存在阴性结果数据未发表的可能性。
2.5 Meta分析结果
2.5.1 NEC 2级以上发生率 图4显示,28个RCT(n=7 406)报告了益生菌对不同出生体重(LBWI、VLBWI和ELBWI亚组)早产儿NEC 2级以上发生率,亚组分析结果显示:LBWI亚组 [OR=0.26(95%CI:0.10~0.66),P=0.004] 和VLBWI亚组 [OR=0.34(95%CI:0.26~0.44),P<0.000 01] 差异均有统计学意义;ELBWI亚组 [OR=0.67(95%CI:0.25~1.79),P=0.43] 差异无统计学意义。
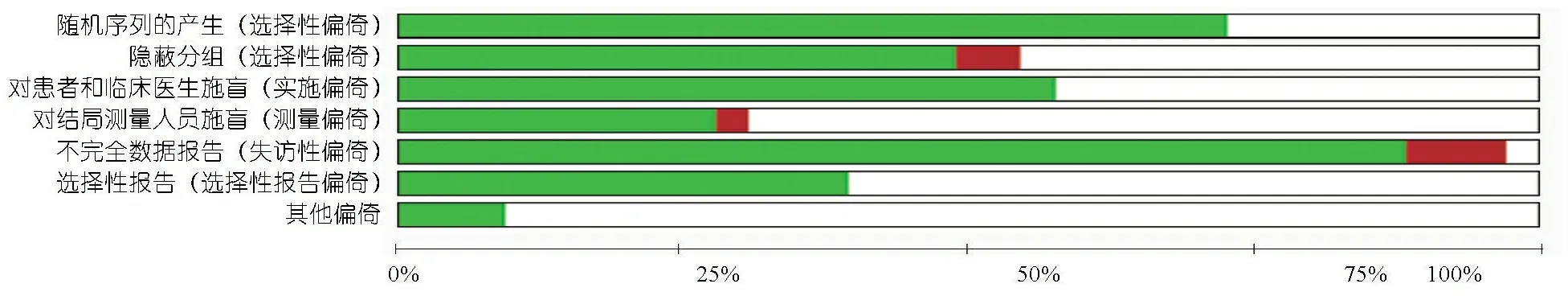
图2 纳入研究的偏倚风险
注:低风险偏倚;:风险不确定偏倚;:高风险偏倚

图3 发表偏倚漏斗图
注:低出生体重儿;:极低出生体重儿;:超低出生体重儿
2.5.2 NEC 3级以上发生率 图5显示,10个RCT(n=2 133)报告了益生菌对不同出生体重(LBWI、VLBWI和ELBWI亚组)早产儿NEC 3级以上发生率,亚组分析结果显示:LBWI亚组[OR=0.29(95%CI:0.11~0.78),P=0.01] 和VLBWI亚组 [OR=0.39(95%CI:0.20~0.76),P=0.006]差异均有统计学意义;ELBWI亚组 [OR=1.02(95%CI:0.14~7.54),P=0.98] 差异无统计学意义。
2.5.3 NEC相关病死率图6显示,11个RCT(n=3 714)报告了益生菌对不同出生体重(VLBWI亚组和ELBWI亚组)早产儿NEC相关病死率,亚组分析结果显示:VLBWI亚组[OR=0.38(95%CI:0.21~0.69),P=0.001] 差异有统计学意义;ELBWI亚组 [OR=0.73(95%CI:0.12~4.48),P=0.74] 差异无统计学意义。
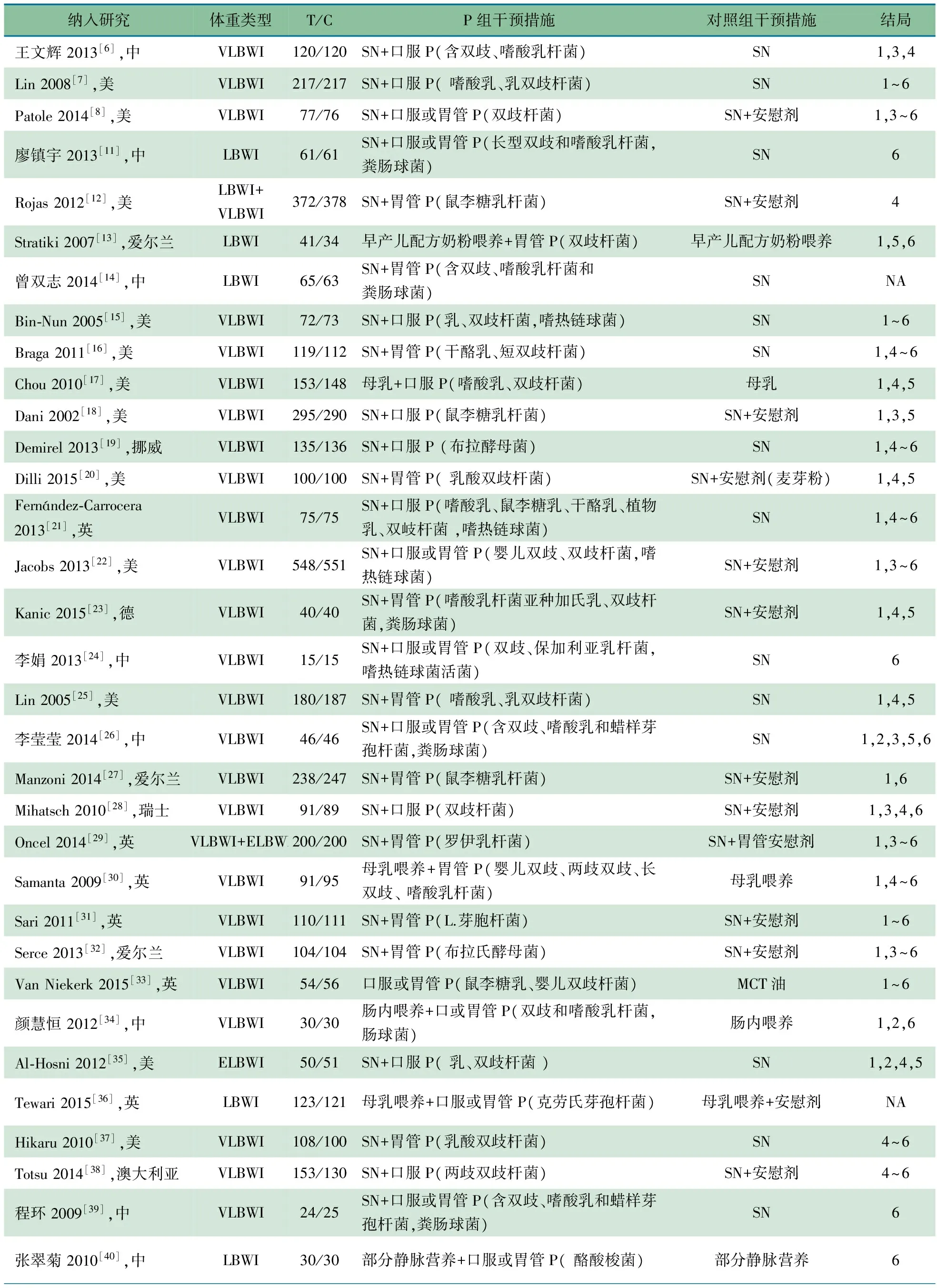
表1 纳入文献的基本特征
注 SN:基础喂养;P:益生菌;1:NEC2级以上发生率,2:NEC3级发生率,3:NEC相关病死率,4:总病死率,5:败血症发生率,6:达全肠道喂养时间

图4 益生菌对NEC 2级以上发生率Meta分析
2.5.4 总病死率 图7显示,22个RCT(n=7 159)报告了益生菌对不同出生体重亚组早产儿总病死率,亚组分析结果显示:VLBWI亚组 [OR=0.55(95%CI:0.44~0.69),P<0.000 01] 差异有统计学意义;LBWI亚组 [OR=0.80(95%CI:0.50~1.28),P=0.35] 和ELBWI亚组 [OR=0.96(95%CI:0.34~1.43),P=0.32] 差异均无统计学意义。
2.5.5 脓毒症发生率 23个RCT(n=6 146)报告了益生菌对不同出生体重(LBWI亚组[13,36]、VLBWI亚组[7,8,15-23,25,26,29-33,37,38]和ELBWI亚组[29,35])早产儿脓毒症发生率,亚组分析结果显示:VLBWI亚组 [OR=0.77(95%CI:0.62~0.95),P=0.02] 差异有统计学意义;LBWI亚组 [OR=0.50(95%CI:0.13~1.99),P=0.33] 和ELBWI亚组 [OR=0.50(95%CI:0.20~1.23),P=0.13] 差异均无统计学意义。
2.5.6 达全肠道喂养时间 19个RCT(n=4 495)报告了益生菌对不同出生体重(LBWI亚组[11,13,40]、VLBWI亚组[7,8,15,16,19,21,22,24,26,27-31,33,39]和ELBWI亚组[29])早产儿达全肠道喂养时间,亚组分析结果显示:LBWI亚组 [WMD=-3.57(95%CI:-5.79~-1.34),P=0.002] 和ELBWI亚组 [WMD=-1.70(95%CI:-2.85~-0.55),P=0.004] 差异均有统计学意义;VLBWI亚组 [WMD=-1.28(95%CI:-2.62~0.06),P=0.06] 差异无统计学意义。

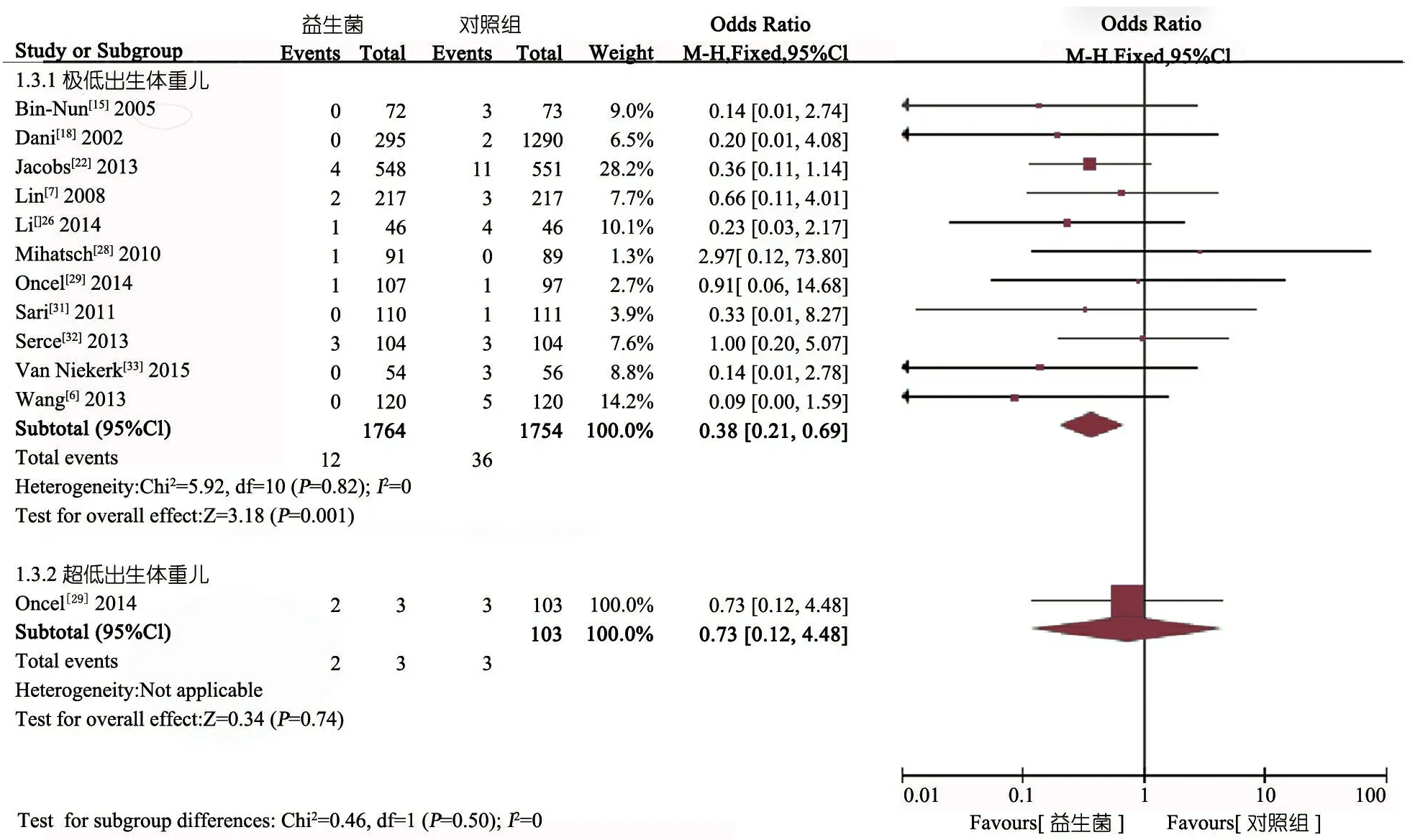
图5 益生菌对NEC 3级以上发生率Meta分析

图6 益生菌对相关病死率Meta分析
图7 益生菌对总病死率Meta分析
3 讨论
3.1 文献质量 虽然本研究纳入的33个RCT中24个(73%)报告了具体的随机方法,但仅16个(48%)实施了隐蔽分组方案。14个(42%)RCT未对医生施盲,仅9个(27%)研究对结局测量人员施盲,可能存在实施偏倚,也会对部分主观结局指标(如脓毒症等)的测量产生测量偏倚。30个研究(91%)无不完整数据报告情况,13个(39%)RCT在WHO临床试验注册平台以及一级注册平台注册,通过与其研究计划书核对,选择性报告偏倚的可能性较低。总体而言,本Meta分析中纳入的研究对其偏倚风险的控制程度一般。另外,漏斗图呈现的倒漏斗状总体对称,右下角存在缺失,提示可能存在阴性结果数据未发表的可能性。
3.2 预防性口服益生菌的疗效 NEC被认为是一种多因素作用于功能未成熟肠道而发生的复杂疾病[41],其中包括肠道感染,早产和喂养不当,肠壁缺血缺氧和再灌注损伤[42]。由于NEC的确切发病机制尚不明了,预防策略的制定困难极大,目前尚在研究中的潜在预防策略包括补充精氨酸、IgA和表皮生长因子等[43],但尚未有定论。益生菌作为一类定植于宿主肠道、能够改善宿主微生态平衡的活性微生物[44],对NEC具有潜在的预防作用,但其有效性和安全性一直未被临床广泛采纳。
本研究采用Meta分析的方法,对国内外益生菌预防早产儿NEC的RCT的有效性和安全性进行定量分析。结果显示:①对于LBWI,益生菌可降低NEC2级以上和3级发生率,缩短达全肠道喂养时间,这与Al Faleh等[9]和Aceti等[45]的研究结果一致。此外,尽管部分研究[41,9]显示益生菌可降低NEC的总病死率,本研究显示益生菌在降低LBWI患儿的总病死率与脓毒症发生率方面并未显示出优势。这可能与LBWI亚组均仅纳入2个研究(总病死率[12,36]共994例早产儿;脓毒症发生率[12,36]共321例早产儿),样本量较少有关;也可能与不同纳入研究对脓毒症的诊断标准不一致有关,在Rojas等[12]的研究中血培养阳性即可认为发生脓毒症,而在Kanic等[23]的研究中需要至少经过血培养和实验室筛选才能判断发生脓毒症;②对于VLBWI,本研究显示益生菌可降低NEC 2级以上及3级发生率,并降低总病死率,这与Deshpande 等[46]和Wang 等[47]的研究一致。此外,虽然本研究显示益生菌可降低NEC相关病死率,但VLBWI亚组纳入的11个RCT均未详细说明NEC相关病死率的判断标准,且其中7个(64%)研究对该结局未报告盲法测定,故不排除其存在测量偏倚的可能性,这可能也是导致目前对该结局指标存在较大争议的原因[9,48]。对脓毒症发生率而言,本研究显示益生菌可降低VLBWI组脓毒症发生率,这与Bernardo等[49]的研究一致,但与Lau等[48]的研究不同,这可能与目前临床对脓毒症的诊断标准存在较大争议有关[12,23,38],加之纳入10个研究均未明确定义其判断疗效标准,5个研究未提及其判断疗效标准。另外,本研究亦显示益生菌未能有效缩短达全肠道喂养时间。尽管公认的全肠道喂养标准为>150 mL·kg-1·d-1,但VLBWI亚组纳入各研究对达全肠道喂养时间的定义不一致,甚至其中11个(69%)研究未说明其判断疗效标准,3个(19%)研究未采用公认的判断疗效标准,均影响其结论的可靠性和准确测评;③对于ELBWI,虽然本研究显示可缩短达全肠道喂养时间,但此指标在ELBWI亚组只纳入1个研究(共196例早产儿)。此外,益生菌未显示能降低NEC 2级以上和3级发生率、总病死率、NEC相关病死率和脓毒症发生率,这可能与纳入研究的样本量较小有关[29,35](共297例早产儿),今后的研究应更加关注ELBWI群体。
3.3 目前存在的争议 ①益生菌的安全性,目前已有部分研究显示益生菌会导致一定的不良反应[50,51],多表现为菌血症等。本文纳入的33个RCT中除10个(30%)未报告不良反应外,其余报告称未发现不良反应,可能与研究的随访时间过短[48]和菌种间的差异[45]有关,也可能与研究人员在观察中的重视程度有关。 ②已有研究报道不同菌种对于NEC的预防效果存在一定的区别[45],本研究纳入文献益生菌种类缺少一致性,无法探讨不同菌种对于NEC的效果。
3.4 本研究的启示 ①益生菌临床使用亟需规范,目前缺少益生菌使用的最佳剂量、疗程等具体问题的研究,对部分菌种是否有效也存在争议,未来该领域的研究应着重于头对头比较研究(head-to-head comparative trial)而非安慰剂对照研究[9];②需进一步验证益生菌的安全性,当前对于益生菌不良反应的记录有限且报道简略,在报道中短期不良反应居多,缺少对长期不良反应的观察性研究[48];③建议采用随机对照试验报告标准(CONSORT 2010)规范论文报告,并鼓励今后的研究进行注册,以保证试验的全过程透明化和质量的提升。
3.5 结论 当前证据表明预防性使用益生菌可减少LBWI和VLBW的NEC 2级以上发生率以及3级发生率,缩短达全肠道喂养时间,并降低VLBW的总病死率、NEC相关病死率和脓毒症发生率。
[1]Zani A, Pierro A. Necrotizing enterocolitis: controversies and challenges. F1000Res. 2015, 4. pii: F1000 Faculty Rev-1373
[2]Costeloe K, Hardy P, Juszczak E, et al. Bifidobacterium breve BBG-001 in very preterm infants: a randomised controlled phase 3 trial. Lancet. 2016, 387(10019): 649-660
[3]程国强, 王来栓, 周文浩. 口服益生菌预防早产儿严重坏死性小肠结肠炎疗效和安全性的Meta分析. 中国循证儿科杂志, 2009, 6: 485-493
[4]王小玲, 李雄, 康兰,等. 预防性使用益生菌对降低极低出生体重早产儿坏死性小肠结肠炎发病率和病死率的Meta分析. 中国当代儿科杂志, 2015, 8: 852-858
[5]Bell MJ, Ternberg JL, Feigin RD, et al. Neonatal necrotizing enterocolitis. Therapeutic decisions based upon clinical staging. Ann Surg, 1978, 187(1): 1-7
[6]王文辉. 益生菌预防早产儿坏死性小肠结肠炎的临床效果分析. 中国妇幼保健, 2013, 23: 3793-3796
[7]Lin HC, Hsu CH, Chen HL, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight preterm infants: a multicenter, randomized, controlled trial. Pediatrics, 2008, 122(4): 693-700
[8]Patole S, Keil AD, Chang A, et al. Effect of Bifidobacterium breve M-16V supplementation on fecal bifidobacteria in preterm neonates--a randomised double blind placebo controlled trial. PLoS One, 2014, 9(3): e89511
[9]AlFaleh K, Anabrees J. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev, 2014, (4): CD005496
[10]Sourabh D, Balpreet S, Lorraine C, et al. Guidelines for feeding very low birth weight infants. Nutrients, 2015, 7(1): 423-442
[11]廖镇宇, 黄瑞文, 肖艾青. 双歧杆菌三联活菌胶囊防治低出生体重早产儿喂养不耐受疗效观察. 儿科药学杂志, 2013, 3: 9-12
[12]Rojas MA, Lozano JM, Rojas MX, et al. Prophylactic probiotics to prevent death and nosocomial infection in preterm infants. Pediatrics, 2012, 130(5): e1113-1120
[13]Stratiki Z, Costalos C, Sevastiadou S, et al. The effect of a bifidobacter supplemented bovine milk on intestinal permeability of preterm infants. Early Hum Dev, 2007, 83(9): 575-579
[14]曾双志, 杨佩, 江欣. 微量喂养联合益生菌思连康预防早产儿坏死性小肠结肠炎发生的有效性分析. 中国医学工程, 2014, 10: 8-9, 11
[15]Bin-Nun A, Bromiker R, Wilschanski M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates. J Pediatr. 2005, 147(2): 192-196
[16]Braga TD, da Silva GA, de Lira PI, et al. Efficacy of Bifidobacterium breve and Lactobacillus casei oral supplementation on necrotizing enterocolitis in very-low-birth-weight preterm infants: a double-blind, randomized, controlled trial. Am J Clin Nutr, 2011, 93(1): 81-86
[17]Chou IC, Kuo HT, Chang JS, et al. Lack of effects of oral probiotics on growth and neurodevelopmental outcomes in preterm very low birth weight infants. J Pediatr, 2010, 156(3): 393-396
[18]Dani C, Biadaioli R, Bertini G, et al. Probiotics feeding in prevention of urinary tract infection, bacterial sepsis and necrotizing enterocolitis in preterm infants. A prospective double-blind study. Biol Neonate, 2002, 82(2): 103-108
[19]Demirel G, Erdeve O, Celik IH, et al. Saccharomyces boulardii for prevention of necrotizing enterocolitis in preterm infants: a randomized, controlled study. Acta Paediatr, 2013, 102(12): e560-565
[20]Dilli D, Aydin B, Fettah ND, et al. The propre-save study: effects of probiotics and prebiotics alone or combined on necrotizing enterocolitis in very low birth weight infants. J Pediatr, 2015, 166(3): 545-551
[21]Fernández-Carrocera LA, Solis-Herrera A, Cabanillas-Ayón M, et al. Double-blind, randomised clinical assay to evaluate the efficacy of probiotics in preterm newborns weighing less than 1500 g in the prevention of necrotising enterocolitis. Arch Dis Child Fetal Neonatal Ed, 2013, 98(1): F5-9
[22]Jacobs SE, Tobin JM, Opie GF, et al. Probiotic effects on late-onset sepsis in very preterm infants: a randomized controlled trial. Pediatrics, 2013 ,132(6): 1055-1062
[23]Kanic Z, Micetic Turk D, Burja S, et al. Influence of a combination of probiotics on bacterial infections in very low birthweight newborns. Wien Klin Wochenschr, 2015, 127 (Suppl 5): S210-215
[24]李娟, 李军华, 何柳. 益生菌防治极低体重早产儿喂养不耐受的临床疗效观察. 中国煤炭工业医学杂志, 2013, 8: 1342-1344
[25]Lin HC, Su BH, Chen AC, et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics, 2005, 115(1): 1-4
[26]李莹莹, 黄启凌, 朱峰,等. 口服益生菌预防极低出生体质量儿坏死性小肠结肠炎的临床观察. 安徽医学, 2014, 9: 1210-1212
[27]Manzoni P, Meyer M, Stolfi I, et al. Bovine lactoferrin supplementation for prevention of necrotizing enterocolitis in very-low-birth-weight neonates: a randomized clinical trial. Early Hum Dev, 2014, 90 (Suppl 1): S60-65
[28]Mihatsch WA, Vossbeck S, Eikmanns B, et al. Effect of Bifidobacterium lactis on the incidence of nosocomial infections in very-low-birth-weight infants: a randomized controlled trial. Neonatology, 2010, 98(2): 156-163
[29]Oncel MY, Sari FN, Arayici S, et al. Lactobacillus Reuteri for the prevention of necrotising enterocolitis in very low birthweight infants: a randomised controlled trial. Arch Dis Child Fetal Neonatal Ed, 2014, 99(2): F110-115
[30]Samanta M, Sarkar M, Ghosh P, et al. Prophylactic probiotics for prevention of necrotizing enterocolitis in very low birth weight newborns. Journal of Tropical Pediatrics, 2009, 55(2): 128-131
[31]Sari FN, Dizdar EA, Oguz S, et al. Oral probiotics: Lactobacillus sporogenes for prevention of necrotizing enterocolitis in very low-birth weight infants: a randomized, controlled trial. Eur J Clin Nutr, 2011, 65(4): 434-439
[32]Serce O, Benzer D, Gursoy T, et al. Efficacy of Saccharomyces boulardii on necrotizing enterocolitis or sepsis in very low birth weight infants: a randomised controlled trial. Early Hum Dev, 2013, 89(12): 1033-1036
[33]Van Niekerk E, Nel DG, Blaauw R, et al. Probiotics reduce necrotizing enterocolitis severity in HIV-exposed premature infants. J Trop Pediatr, 2015, 61(3): 155-164
[34]颜慧恒. 益生菌对早产极低出生体重儿系统水平细胞因子的影响及临床意义. 广州医学院, 2012
[35]Al-Hosni M, Duenas M, Hawk M, et al. Probiotics-supplemented feeding in extremely low-birth-weight infants. J Perinatol, 2012, 32(4): 253-239
[36]Tewari VV, Dubey SK, Gupta G. Bacillus clausii for Prevention of Late-onset Sepsis in Preterm Infants: A Randomized Controlled Trial. J Trop Pediatr, 2015, 61(5): 377-385
[37]Hikaru U, Koichi S, Yayoi S, et al. Bifidobacteria prevents preterm infants from developing infection and sepsis. International Journal of Probiotics & Prebiotics, 2010, 5(1): 33-36
[38]Totsu S, Yamasaki C, Terahara M, et al. Bifidobacterium and enteral feeding in preterm infants: cluster-randomized trial. Pediatr Int, 2014, 56(5): 714-719
[39]程环. 双岐四联活菌在极低出生体重儿喂养管理中的应用观察. 山东大学, 2009
[40]张翠菊. 酪酸梭菌与早产儿喂养不耐受的临床研究. 河北医科大学, 2010
[41]Yang Y, Guo Y, Kan Q, et al. A meta-analysis of probioticsfor preventing necrotizing enterocolitis in preterm neonates. Braz J Med BiolRes, 2014, 47(9): 804-810
[42]曾振华. 新生儿坏死性小肠结肠炎研究现状及发展趋势探究. 中外医学研究, 2014, 27: 152-154
[43]陈小慧, 余章斌, 李亚琴,等. 美国极低出生体质量儿坏死性小肠结肠炎管理指南. 实用儿科临床杂志, 2012, 14: 1134-1136
[44]曾子丹, 姚朔影. 益生菌的研究前景及国内外发展状况. 食品工业科技, 2007, 8: 251-254
[45]Aceti A, Gori D, Barone G, et al. Probiotics for prevention of necrotizing enterocolitis in preterminfants: systematic review and meta-analysis. Ital J Pediatr, 2015, 41: 89 [46]Deshpande G, Rao S, Patole S. Probiotics for prevention of necrotizingenterocolitis in preterm neonates with very low birthweight: a systematic review of randomised controlled trials. Lancet, 2007, 369(9573): 1614-1620
[47]Wang Q, Dong J, Zhu Y. Probiotic supplement reduces risk of necrotizingenterocolitis and mortality in preterm very low-birth-weight infants: an updated meta-analysis of 20 randomized, controlled trials. J Pediatr Surg, 2012, 47(1): 241-248
[48]Lau CS, Chamberlain RS. Probiotic administration can prevent necrotizingenterocolitis in preterm infants: A meta-analysis. J Pediatr Surg, 2015, 50(8): 1405-1412
[49]Bernardo WM, Aires FT, Carneiro RM, et al. Effectivenessof probiotics in the prophylaxis of necrotizing enterocolitis in pretermneonates: a systematic review and meta-analysis. J Pediatr (Rio J), 2013, 89(1): 18-24
[50]Zbinden A, Zbinden R, Berger C, et al. Case series of Bifidobacteriumlongum bacteremia in three preterm infants on probiotic therapy. Neonatology, 2015, 107(1): 56-59
[51]Bertelli C, Pillonel T, Torregrossa A, et al. Bifidobacterium longum bacteremiain preterm infants receiving probiotics. Clin Infect Dis, 2015, 60: 924-927
(本文编辑:张崇凡,孙晋枫)
Prophylacticprobioticsforpreventingnecrotizingenterocolitisinpretermneonates:asystematicreviewandmeta-analysis
GUOMing1, 4,TANGXiao-yu2, 3, 4YEYuan2, 3,NIUJia-lan2, 3,KOUCheng-kun2, 3,MABin2, 3,ZHANGXue-feng1
(1DepartmentofNeonatology, 302MilitaryHospitalofChina,Beijing100039,China;2EvidenceBasedMedicineCenter,SchoolofBasicMedicalSciences,LanzhouUniversity,Lanzhou730000,China;3KeyLaboratoryofEvidenceBasedMedicineandKnowledgeTranslationofGansuProvince,Lanzhou730000,China;4Co-firstauthor)
Corresponding Author:ZHANG Xue-feng,E-mail: Xue-feng_Zhang@outlook.com
ObjectiveTo systematically evaluate the efficacy and safety of prophylactic probiotic supplementation for preventing necrotizing enterocolitis (NEC) in preterm neonates. MethodsDatabases including PubMed, Ovid-EMbase, The Cochrane Library, CNKI, WanFang Data and VIP were searched to collect RCTs about probiotics for preventing necrotizing enterocolitis in preterm neonates up to March 2016. Two reviewers independently screened literature, extracted data and assessed the risk of bias of included studies. Meta-analysis was conducted by RevMan 5.3 software. ResultsA total of 33 RCTs, involving 8 248 patients were included. The results of meta-analysis showed that, for low birth weight infants (LBWI), probiotics could significantly reduce the incidence of NEC (stage Ⅱ or more), the incidence of severe NEC (stage Ⅲ), time to full enteral feeds [the incidence of NEC:OR=0.26(95%CI:0.10 to 0.66),P=0.004;the incidence of severe NEC:OR=0.29(95%CI:0.11 to 0.78),P=0.01;time to full enteral feeds:WMD=-3.57(95%CI:-5.79 to -1.34),P=0.002], but did not decrease overall mortality and the risk for sepsis [overall mortality:OR=0.80(95%CI:0.50 to 1.28),P=0.35;the risk for sepsis:OR=0.50(95%CI:0.13 to 1.99),P=0.33]; for very low birth weight infants (VLBWI), probiotic supplement was associated with a significantly decreased incidence of NEC and severe NEC, overall mortality, NEC related mortality, the risk for sepsis [the incidence of NEC:OR=0.34(95%CI:0.26 to 0.44),P<0.000 01;the incidence of severe NEC:OR=0.39(95%CI:0.20 to 0.76),P=0.006;overall mortality:OR=0.55(95%CI:0.44 to 0.69),P<0.000 01;NEC related mortality:OR=0.38(95%CI:0.21 to 0.69),P=0.001;the risk for sepsis:OR=0.77(95%CI:0.62 to 0.95),P=0.02]. There was no evidence of significant reduction of time to full enteral feeds [WMD=-1.28(95%CI:-2.62 to 0.06),P=0.06]; for extreme low birth weight infants (ELBWI), probiotics administration didn't decrease the incidence of NEC and severe NEC, overall mortality, NEC related mortality, the risk for sepsis [the incidence of NEC:OR=0.67(95%CI:0.25 to 1.79),P=0.43;the incidence of severe NEC:OR=1.02(95%CI:0.14 to 7.54),P=0.98;overall mortality:OR=0.96(95%CI:0.34 to1.43),P=0.32;NEC related mortality:OR=0.73(95%CI:0.12 to 4.48),P=0.74;the risk for sepsis:OR=0.50(95%CI:0.20 to 1.23),P=0.13], but could significantly shorten time to full enteral feeds [WMD=-1.70(95%CI:-2.85 to -0.55),P=0.004]. ConclusionProbiotic supplement could reduce risk of NEC and time to full enteral feeds in LBWI and VLBW, and showed a decreasing trend of mortality and the risk for sepsis. The above conclusions need more high quality studies to be verified.
Probiotics; Necrotizing enterocolitis; Premature infant; Systematic review; Meta-analysis; Randomized controlled trial
1 解放军第302医院新生儿科 北京,100039; 2 兰州大学循证医学中心,兰州大学基础医学院 兰州,730000; 3 甘肃省循证医学与临床转化重点实验室 兰州,730000; 4 共同第一作者
张雪峰,E-mail: Xue-feng_Zhang@outlook.com
10.3969/j.issn.1673-5501.2016.06.001
2016-10-13
2016-12-06)

