pH区带逆流色谱法分离纯化丹参中的丹酚酸B和迷迭香酸
李怀志,宫成玉,李云,杨鹏,李佳,王晓
(1.山东中医药大学药学院,山东 济南250355; 2. 烟台出入境检验检疫局,山东 烟台 264000; 3. 济南三峰生物工程有限责任公司,山东 济南 250014; 4. 山东省中药质量控制技术重点实验室,山东省分析测试中心,山东 济南 250014)
pH区带逆流色谱法分离纯化丹参中的丹酚酸B和迷迭香酸
李怀志1, 4,宫成玉2,李云1, 4,杨鹏3,李佳1,王晓4*
(1.山东中医药大学药学院,山东 济南250355; 2. 烟台出入境检验检疫局,山东 烟台 264000; 3. 济南三峰生物工程有限责任公司,山东 济南 250014; 4. 山东省中药质量控制技术重点实验室,山东省分析测试中心,山东 济南 250014)
摘要:采用pH区带精制逆流色谱技术(pH-ZRCCC)快速分离纯化丹参中的丹酚酸B和迷迭香酸。以乙酸乙酯-水(1∶1, V/V)为溶剂体系,上相加入三氟乙酸,使浓度达到10 mmol/L,作为固定相;下相加入氨水使浓度达到20 mmol/L,作为流动相;设置主机转速为850 r/min,流速为2.0 mL/min,检测波长为280 nm,对样品进行分离制备。从500 mg丹参粗提物中一次分离得到386 mg丹酚酸B以及25 mg迷迭香酸,经HPLC分析纯度分别为96.3%和98.1%,各化合物通过电喷雾电离(ESI)谱和1H-NMR进行了化学结构鉴定。研究结果表明,pH-ZRCCC是一种快速、高效分离纯化丹酚酸B和迷迭香酸的方法。
关键词:pH区带逆流色谱;丹酚酸B;迷迭香酸
丹参药材来源于唇形科植物丹参(SalviamiltiorrhizaBge.)的干燥根和根茎,是临床常用中药,具有活血祛瘀、通经止痛、清心除烦以及凉血消痈等功效[1]。丹酚酸B是丹参水溶性物质中的主要成分,在丹参酚酸类成分中含量最高。现代药理研究证实,丹酚酸B具有抗氧化、清除自由基、抑制血小板聚集、抑制神经细胞凋亡、预防心脑血管疾病、抗动脉粥样硬化以及抗肝损伤等活性[2-4]。迷迭香酸是丹参水溶性成分之一,是天然的抗氧化剂,有免疫调节、抗炎、抗菌和抗病毒等多种活性[5-6]。
传统柱色谱对丹酚酸B和迷迭香酸的分离纯化存在耗时长、易导致样品的变性和回收率低等缺点,无法满足高效快速制备纯品的需求。pH区带精制逆流色谱技术(pH-zone-refining counter-current chromatography, pH-ZRCCC)作为一种新型制备分离技术,基于高速逆流色谱发展起来。其利用待分离有机酸(碱)的酸(碱)解离常数及疏水性的不同进行分离,通过添加保留酸(或碱)到溶剂体系的固定相中,同时洗脱碱(或酸)被加入到流动相中,使得不同的物质被逐个洗脱出来,其洗脱过程中伴随着pH值的改变,色谱图形成按pH值的大小排列边界陡峭的矩形平台峰,平台区内的产物高度浓缩,而平台峰的两侧是被浓缩的杂质。相比传统的逆流色谱分离,在保留其分离纯度和分离效率高等优点的基础上,具有更大的样品分离量,现已被广泛用于天然产物有效成分的分离[7-11]。
目前,pH-ZRCCC已经用于丹酚酸B的分离制备[12],具有分离速度快和进样量大等优点,但是所得的丹酚酸B和迷迭香酸的纯度不够高。本实验根据丹酚酸B的极性较大的特点,选用乙酸乙酯-水体系,为丹酚酸B和迷迭香酸(结构见图1)的分离制备提供一种更简便高效、分离纯度更高的方法。
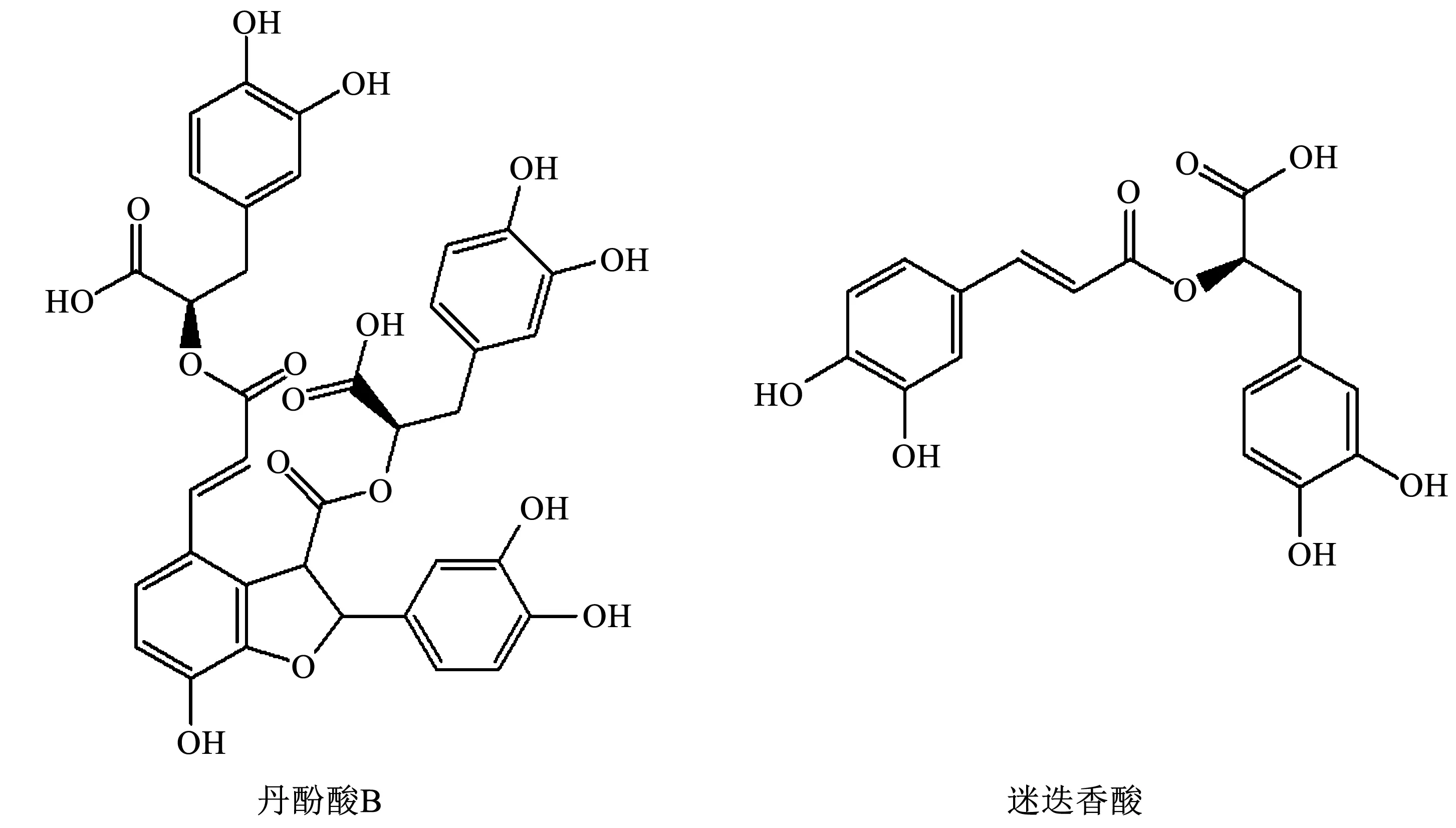
图1 丹酚酸B和迷迭香酸的化学结构Fig.1 Chemical structures of salvianolic acid B and rosmarinic acid
1实验部分
1.1仪器、试剂与材料
TBE300A高速逆流色谱仪(上海同田生化技术有限公司),包括TBP5002泵、8823B紫外检测仪、3057-11便携式记录仪;Waters 600-996高效液相色谱系统(二极管阵列PDA检测器,美国Waters公司);高速中药粉碎机(瑞安市百信药机器械厂);Varian INOVA-400 Hz型核磁共振波谱仪 (美国Varian公司);GF254硅胶板(青岛海洋化工厂)。
高效液相色谱所用乙腈为色谱纯(美国天地公司),水为过滤蒸馏水;大孔树脂(D101)和pH-ZRCCC分离用溶剂均为分析纯(国药集团化学试剂有限公司),所用水为去离子水。
干燥的丹参根购自于莱芜紫光生态园有限公司,由山东中医药大学李佳教授鉴定,确定是唇形科植物丹参SalviamiltiorrhizaBge.。
1.2样品制备
取干燥的丹参150 g,粉碎,加300 mL二氯甲烷浸泡过夜,过滤,得丹参残渣,晾干。以65%乙醇回流提取两次,每次1.5 h,过滤。合并两次滤液,减压浓缩,浓缩液以2 mol/L盐酸调pH值至2.08,冷藏沉降过夜。取上清液过大孔树脂柱(m=165 g,V=232 mL),出液浅色浑浊,以水洗涤至洗出液变清,再以50%的乙醇洗脱,以三氯化铁溶液监测,并接收丹酚酸B组分,减压蒸干,得6.4 g丹参提取物,冷藏保存备用。
1.3两相溶剂体系和样品溶液的制备
pH-ZRCCC的溶剂系统为乙酸乙酯-水(1∶1,V/V)按比例置于分液漏斗中,震荡后充分静置使其分层。取上相加10 mmol/L的三氟乙酸,下相加20 mmol/L的氨水,超声脱气15 min备用。
取500 mg的丹参粗提物,用6 mL加了三氟乙酸的上相和6 mL未加氨水的下相溶解,作为样品溶液。
1.4pH区带逆流色谱分离过程
首先以20 mL/min的速度将已经脱气的固定相泵入HSCCC分离管,待整个分离管被固定相充满后,开启主机,缓慢调节速度控制器至850 r/min (正转),此时,由进样阀注入样品溶液,同时以2.0 mL/min的速度泵入流动相,并打开检测器和记录仪开始采集数据,于280 nm下检测流出物,根据色谱图,每10 mL为一管收集流出物,同时用pH计检测每管的pH值。
1.5HPLC分析
用高效液相色谱法分析丹参粗提物和pH-ZRCCC分离所得的各化合物。色谱柱为Waters Symmetry RP18柱(250 mm×4.6 mm I.D., 5 μm);检测波长280 nm;流动相为乙腈-水(0.026%磷酸) (30∶70,V/V)等度洗脱;流速为1.0 mL/min;进样体积20 μL。
2结果与讨论
2.1HPLC条件优化
最优高效液相色谱条件旨在最短的分析时间内相邻的两个峰有很好的分离度,考察以甲醇-0.1%甲酸水溶液、乙腈-0.1%乙酸水溶液、乙腈-0.02%乙酸水溶液和乙腈-0.03%磷酸水溶液作为HPLC流动相时丹参粗提物中各组分的分离效果。结果表明,当采用乙腈-0.03%磷酸水溶液体系等度洗脱(30∶70,V/V),流速设定为1.0 mL/min时,各成分能够实现基线分离,并检测到粗提物中丹酚酸B的纯度(峰面积比)为82%,分析结果见图2a。利用优化好的液相条件对分离的各组分进行检测,纯度分别为96.3%和98.1%,分析结果见图2b和图2c。
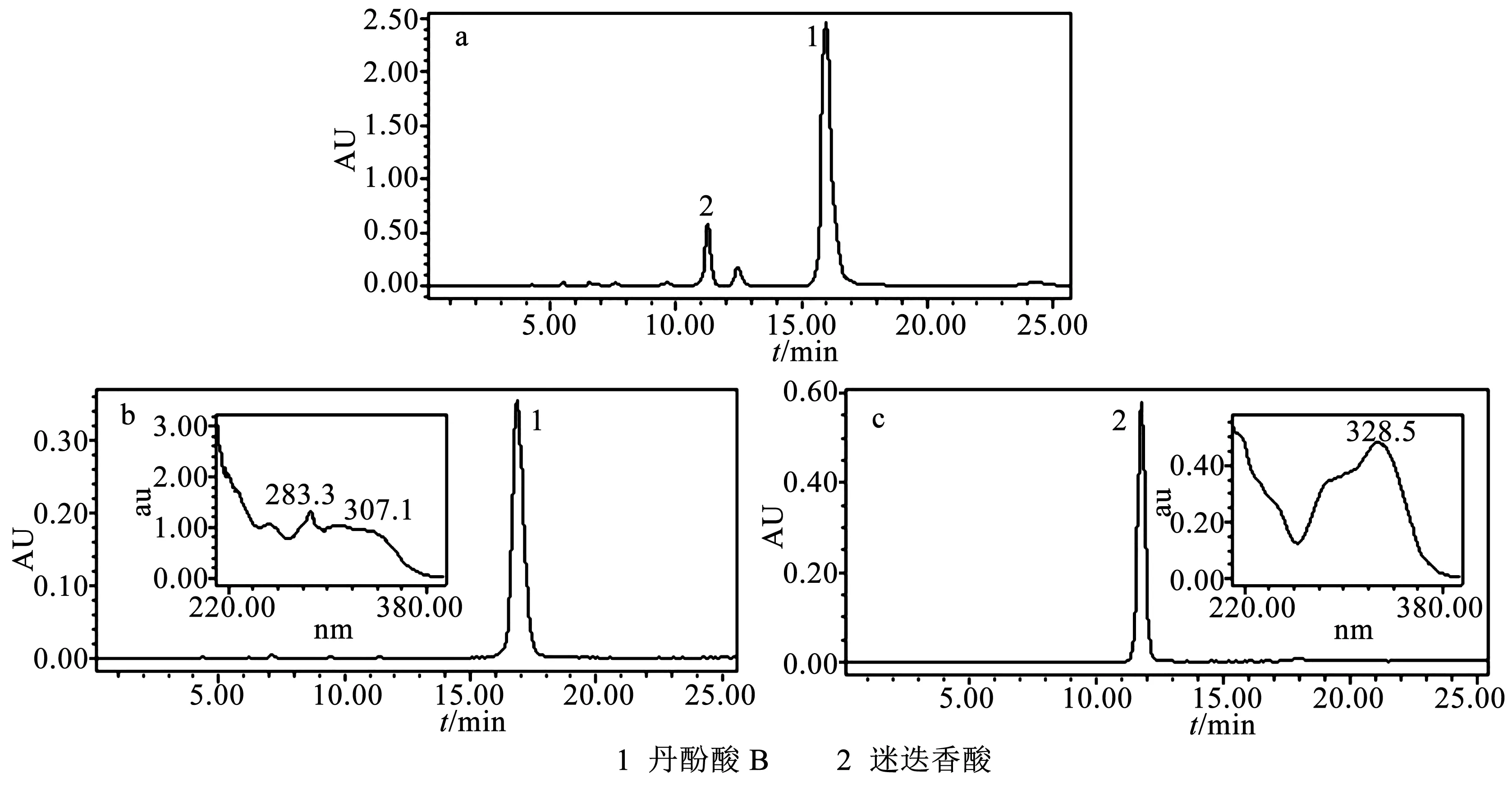
图2 丹参粗提物和pH-区带逆流色谱分离组分的HPLC分析图Fig.2 HPLC chromatogram of crude extract from Salvia miltiorrhiza Bge. and separated fractions by pH-ZRCCC
2.2pH区带逆流色谱分离条件优化
在pH区带逆流色谱中,选择合适的两相溶剂系统是成功分离纯化天然植物中活性成分的关键。本实验根据酚酸类化合物的极性,选择了乙酸乙酯-水(1∶1,V/V)溶剂系统,并考察了该溶剂系统在不同碱度流动相时,各化合物的分离情况,结果发现在上相添加10 mmol/L三氟乙酸,下相添加10 mmol/L氨水的溶剂系统时,虽然实现了丹酚酸B和迷迭香酸的分离,但是所需要的洗脱时间太长 (见图3a)。为了缩短分离时间,加快洗脱速度,我们尝试将流动相的氨水浓度调高到15 mmol/L,测试后发现洗脱时间有一定程度的缩短,我们继续增加氨水的浓度到20 mmol/L时,时间被大幅度缩短,并且不影响分离组分的纯度。取丹参粗提物500 mg,采用乙酸乙酯-水(1∶1,V/V),上相添加10 mmol/L三氟乙酸,下相添加20 mmol/L氨水溶剂系统进行分离,丹酚酸B和迷迭香酸以不规则的矩形峰形式被洗脱出来,在102~235 min得到化合物1丹酚酸B 389 mg, 252~268 min得到化合物2迷迭香酸25 mg,杂质和次要成分集中在矩形峰的两侧,固定相保留率为43%,分离效果见图3b。
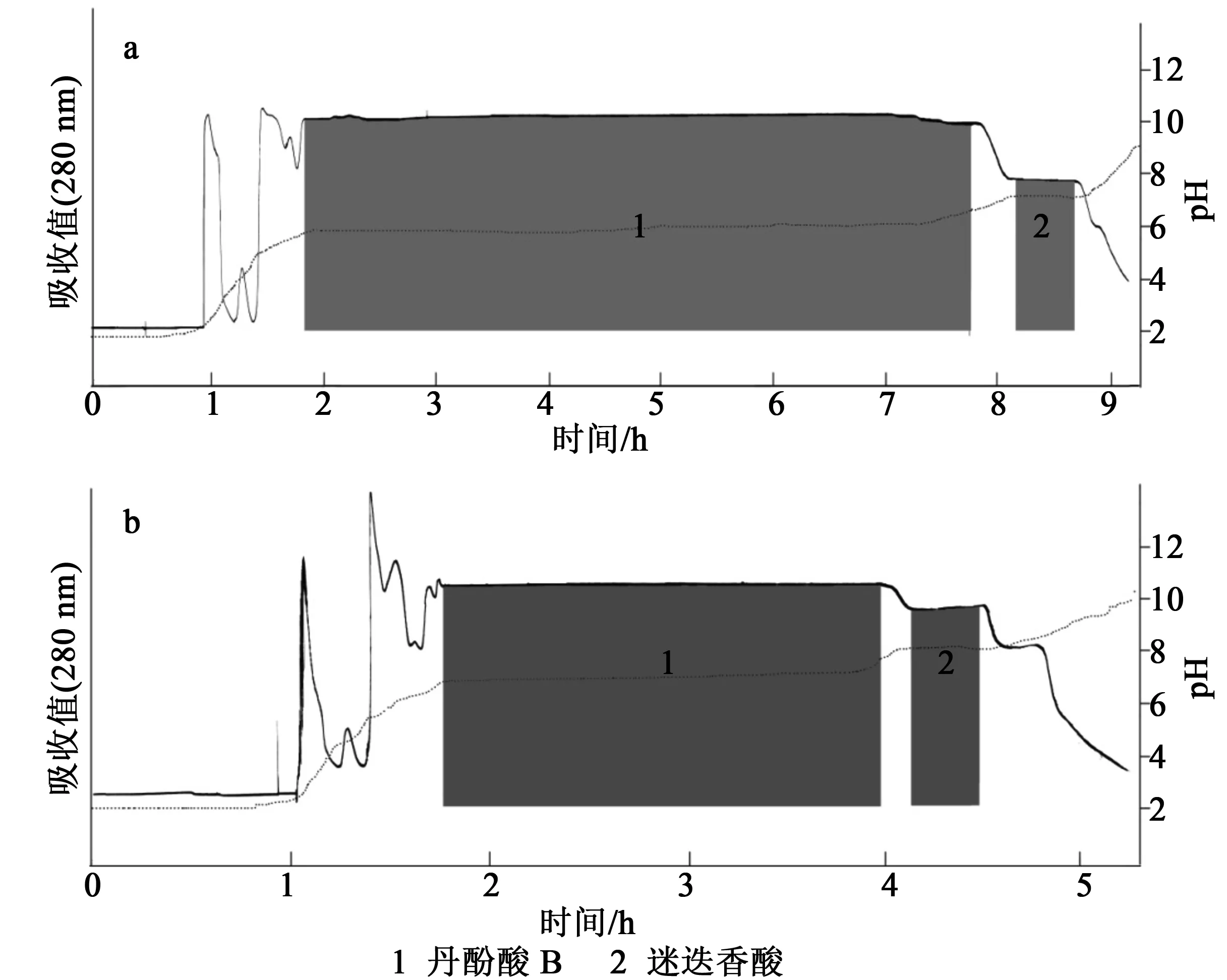
图3 丹参粗提物的pH-ZRCCC色谱图Fig.3 pH-ZRCCC chromatogram of crude extract from Salvia miltiorrhiza Bge.
2.3分离化合物的结构鉴定
化合物1,类白色粉末,ESI-MS,m/z719 [M+H]+;1H-NMR (CD3OD, 400 MHz) δ: 6.88 (1H, d,J=8.7 Hz, C5-H), 7.20 (1H, d,J= 8.4 Hz, C6-H), 7.42 (1H, d,J= 16.2 Hz, C7-H), 6.21 (1H, d,J= 16.3 Hz, C8-H), 6.55~6.61 (1H, m, C6′-H), 6.77 (1H, d,J= 3.6 Hz, C5′-H), 6.79 (1H, d,J= 1.9 Hz, C2′-H), 5.93 (1H, d,J= 4.6 Hz, C7′-H), 6.74 (1H, d,J= 2.6 Hz, C2″-H), 6.70 (1H, d,J= 8.7 Hz, C5″-H), 4.29 (1H, d,J= 4.7 Hz, C8″-H), 2.80 (1H, dd,J= 9.6, 14.3 Hz, C7″a-H),3.01(2H, dd,J= 4.5, 14.3 Hz, C7″b-H, C7‴a-H), 3.09 (1H, dd,J= 4.1, 14.3 Hz, C7‴b-H), 5.23 (2H, dd,J= 5.8, 12.9 Hz, C8″-H, C8‴-H), 6.26~6.33 (1H, m, C6‴-H), 6.56 (1H, d,J= 8.0 Hz, C5‴-H), 6.54 (1H, d,J= 1.9 Hz, C2‴-H), 6.66 (1H, dd,J= 2.1, 8.2 Hz, C6″-H)。以上数据和文献[13]报道一致,并且样品色谱保留时间与丹酚酸B对照品一致,由此确定化合物1是丹酚酸B。
化合物2,白色粉末,ESI-MS,m/z361 [M+H]+;1H-NMR (CD3OD, 400 MHz) δ: 6.30 (1H, d,J= 15.6 Hz, C8-H), 6.89 (1H, dd,J= 1.8, 8.7 Hz, C5-H), 7.09 (1H, d,J= 1.8 Hz, C2-H), 7.66 (1H, d,J=15.6 Hz, C7-H), 2.93~3.09 (2H, m, C7′-H), 5.12 (1H, s, C8′-H), 6.60 (1H, d,J= 8.1 Hz, C6′-H), 6.69 (1H, d,J=7.9 Hz, C5′-H), 6.77~6.89 (2H, m, C6-H, C2′-H)。以上数据和文献报道一致,并且样品色谱保留时间与迷迭香酸对照品一致,由此确定化合物2是迷迭香酸。
3结论
pH-ZRCCC在普通逆流色谱仪器的基础上,以化合物不同的解离常数(Ka)和疏水性来实现制备分离,并且在分离制备有机酸和生物碱等化合物方面具有独特的优势。本文报道应用pH-ZRCCC从丹参中分离丹酚酸B和迷迭香酸,通过增加流动相洗脱碱的浓度来加快洗脱速度,从而实现了pH区带逆流色谱对丹酚酸B和迷迭香酸的快速分离,该法简单易行,省时省力,并且纯化效果明显,具有较好的实际应用价值。
参考文献:
[1]国家药典委员会.中华人民共和国药典2015年版一部[M].北京:中国医药科技出版社,2015: 76.
[2]夏鑫华, 刘梅, 张志敏,等. 丹参中水溶性成分体外抗氧化活性研究[J].中华中医药学刊, 2009, 27 (5): 1085-1087.
[3]ZHOU L M, CHOW M S S, ZUO Z. Effect of sodium caprate on the oral absorptions of danshensu and salvianolic acid B [J].Int J Pharm, 2009, 379 (1): 109-118.
[4]尹音, 王峰. 丹酚酸B研究进展 [J].中国药师, 2007, 10 (10): 1034-1037.
[5]吴建章, 郁建平, 赵东亮. 迷迭香酸的研究进展[J].天然产物研究与开发, 2005, 17 (3): 383-388.
[6]张玉杰, 徐文清, 沈秀. 迷迭香酸的提取分离及药理学新发现 [J].中国新药杂志, 2013, 22 (4):433-437.
[7]WANG X, GENG Y L, LI F W, et al. Large-scale separation of salvianolic acid B from the Chinese medicinal plant salvia miltiorrhiza by pH-zone-refining countercurrentchromatography [J].J Sep Sci, 2007, 30(18): 3214-3217.
[8]张天佑, 王晓. 高速逆流色谱技术 [M].北京: 化学工业出版社,2011.
[9]ITO Y. Golden rulesand pitfalls in selecting optimum conditions for high-speedcounter-current chromato graphy[J].J Chromatogr A, 2005, 1065(2):145-158.
[10]郑振佳, 杨滨, 徐美霞, 等. pH区带逆流色谱法分离制备荷叶中生物碱[J].中草药,2011,42(4):684-686.
[11]李嬛, 刘晓, 蔡皓, 等. pH区带逆流色谱法分离纯化马钱子中马钱子碱和士的宁[J].分析化学,2010,38(12):1703-1707.
[12]刘浩, 杭伟, 陈义伦, 等. pH-区带精制逆流色谱分离纯化丹参中的丹酚酸B(英文)[J].林产化学与工业,2015,35(6):47-52.
[13]李行诺, 张文强, 楚楚, 等. 高速逆流色谱法分离纯化丹参中丹酚酸B和迷迭香酸[J].浙江工业大学学报,2014, 42(5):509-512.
DOI:10.3976/j.issn.1002-4026.2016.03.003
收稿日期:2016-02-22
基金项目:山东省科技发展计划(2014GZX219003)
作者简介:李怀志(1991-),女,硕士研究生,研究方向为天然产物与纯化。 *通信作者,王晓(1971-),男,研究员。Email: wangx@sdas.org
中图分类号:R284.2
文献标识码:A
文章编号:1002-4026(2016)03-0013-05
Separation and purification of salvianolic acid B and rosmarinic acid fromSalviamiltiorrhizaBge. by pH-zone-refining counter-current chromatography
LI Huai-zhi1, 4,GONG Cheng-yu2, LI Yun1, 4, YANG Peng3, LI Jia1,WANG Xiao4*
( 1. School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China; 2. Yantai Entry-exit Inspection and Quarantine Bureau, Yantai 264000, China; 3. Sanfeng Biological Engineering Technology Co. Ltd.,Jinan 250014, China; 4. Shandong Provincial Key Laboratory of Traditional Chinese Medicine Quality Control Technology, Shandong Analysis and Test Center, Jinan 250014, China)
Abstract∶We rapidly separated and purified salvianolic acid B and rosmarinic acid from Salvia miltiorrhiza Bge.by pH-zone-refining counter-current chromatography (pH-ZRCCC). The extraction conditions included solvent system of ethyl acetate-water (1∶1, V/V), upper stationary phase of 10 mmol/L trifluoroacetic acid, lower mobile phase of 20 mmol/L NH3H2O, rotation speed of 850 r/min, flow speed of 2.0 mL/min, and detection wavelength of 280 nm. Salvianolic acid B of 386 mg and rosmarinic acid of 25 mg were extracted from crude extract of 500 mg, whose purities were 96.3% and 98.1% through HPLC analysis. Their compound structures were identified by ESI-MS and1H-NMR. Experimental results show that pH-ZRCCC is a rapid and efficient method to separate and purify salvianolic acid B and rosmarinic acid.
Key words∶ pH-zone-refining counter-current chromatography; salvianolic acid B; rosmarinic acid
【中药与天然活性产物】

