HIF-1α和E-cadherin蛋白在大肠腺癌中的表达及临床意义
王 远 徐 放 解志娟 高志安
(锦州医科大学病理教研室,辽宁 锦州 121001)
HIF-1α和E-cadherin蛋白在大肠腺癌中的表达及临床意义
王远徐放1解志娟2高志安
(锦州医科大学病理教研室,辽宁锦州121001)
〔摘要〕目的为了探讨缺氧诱导因子(HIF)-1α和上皮型钙黏蛋白(E-cadherin)在大肠腺癌中的表达及临床意义。方法采用免疫组织化学PV6000二步法检测78例大肠腺癌、42例大肠腺瘤和20例距肿瘤边缘5 cm的癌旁黏膜组织中HIF-1α和E-cadherin蛋白的表达。结果HIF-1α在大肠腺癌组织中的阳性率(62.8%)明显高于大肠腺瘤组织(38.1%)和癌旁正常黏膜组织(15%);E-cadherin在大肠腺癌组织中的阳性率(48.7%)明显低于大肠腺瘤组织(76.2%)及癌旁正常黏膜组织(100%)。HIF-1α和E-cadherin蛋白在大肠腺癌中的表达异常均与TNM分期、肿瘤分化程度以及淋巴结转移有关(P均<0.05)。结论HIF-1α和E-cadherin蛋白在大肠腺癌的发生及癌组织的侵袭和转移过程中可能起重要作用。
〔关键词〕大肠腺癌;大肠腺瘤;缺氧诱导因子-1α;上皮型钙黏蛋白
大肠腺癌的发生涉及多种基因和因子的调控。缺氧微环境可以刺激肿瘤血管的生成,增强细胞运动能力,从而增强癌组织的侵袭转移潜能。而缺氧诱导因子(HIF)-1α是缺氧状态下广泛存在于哺乳动物和人体内的一种转录因子,其过度表达与肿瘤细胞的增殖和转移有着密切的关系〔1,2〕。E-cadherin是介导上皮性肿瘤细胞间黏附和信号转导的重要因子,它的低表达可以导致癌细胞去分化和侵袭转移能力增强〔3,4〕。本研究应用免疫组化的方法检测大肠腺癌、大肠腺瘤及癌旁正常黏膜中HIF-1α和E-cadherin蛋白的表达情况,以探讨二者在大肠腺癌发生发展中的作用和临床意义。
1资料与方法
1.1一般资料78例大肠腺癌,42例大肠腺瘤及20例对应的距肿瘤边缘5 cm的大肠黏膜标本均选自2010年11月至2012年3月辽宁医学院附属第一医院病理科手术存档蜡块;所有患者术前均未接受化疗和放疗;其中高、中分化者45例,低分化者33例;发生淋巴结转移的有34例,未发生淋巴结转移的有44例;根据国际抗癌联盟(UICC)TNM分期:其中Ⅰ、Ⅱ期的病例51例,其余的27例为Ⅲ、Ⅳ期。大肠腺癌、腺瘤及正常黏膜组织标本都经过10%甲醛固定,石蜡包埋,4 μm厚连续切片后,分别做HE染色和免疫组化染色。
1.2试剂兔抗人HIF-1α单克隆抗体购自美国Santa Cruz公司,鼠抗人E-cadherin单克隆抗体工作液、PV-6000试剂盒、浓缩DAB试剂盒均购自北京中杉金桥生物技术有限公司。
1.3试验方法免疫组化染色:石蜡切片常规脱蜡至水,HIF-1α在EDTA 修复液(pH8.0)中经高压抗原修复2.5 min,E-cadherin在柠檬酸缓冲液中经高压抗原修复2 min,使用3%H2O2在室温下孵育15 min后,一抗4℃冰箱过夜,用新鲜配制的DAB显色。
1.4结果判断标准HIF-1α表达于细胞核中,少数细胞质中也有表达,以细胞核出现清晰的棕褐色为阳性;E-cadherin表达于细胞膜,以细胞膜内出现棕黄色染色为阳性。判断标准①按切片中阳性细胞占细胞总数的比例计分:0分,无阳性细胞;1分,阳性细胞比例1%~25%;2分,阳性细胞比例26%~50%;3分,阳性细胞比例51%~100%。②按细胞中细胞的显色强弱计分:0分,细胞无显色;1分,显现为浅黄色;2分,显现为棕黄色;3分,显现为棕褐色。(1) × (2) <3分计为阴性,≥3分计为阳性。见图1。
1.5统计学方法应用SPSS 13.0统计软件进行χ2检验,相关性分析用Spearman相关分析法。
2结果
2.1HIF-1α和E-cadherin蛋白在三种组织中的表达HIF-1α在正常黏膜组和腺瘤组与腺癌组表达差异显著(P<0.05);E-cadherin在正常黏膜和腺癌组与腺瘤组表达差异显著(P<0.05)。见表1。

表1 HIF-1α 和E-cadherin在三种不同组织中的阳性表达〔n(%)〕
与腺癌组比较:1)P<0.05;与正常组比较:2)P<0.05
2.2HIF-1α和E-cadherin在大肠腺癌的表达及与临床病理参数的关系HIF-1α和E-cadherin在大肠腺癌的过表达均与TNM分期、肿瘤分化程度及淋巴结转移有关。见表2。
2.3HIF-1α和E-cadherin在大肠腺癌中表达的相关性HIF-1α与E-cadherin的表达之间呈显著负相关(r=-0.630,P=0.000)。
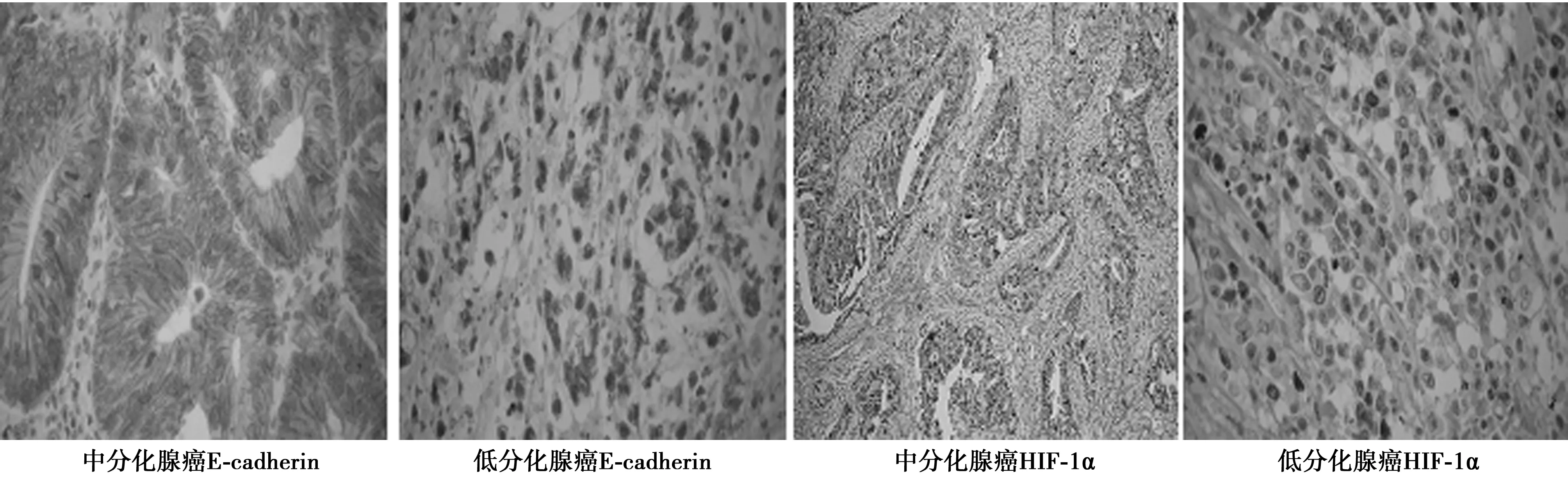
图1 E-cadherin、HIF-1α在不同分化程度腺癌中的阳性表达(PV,×400)
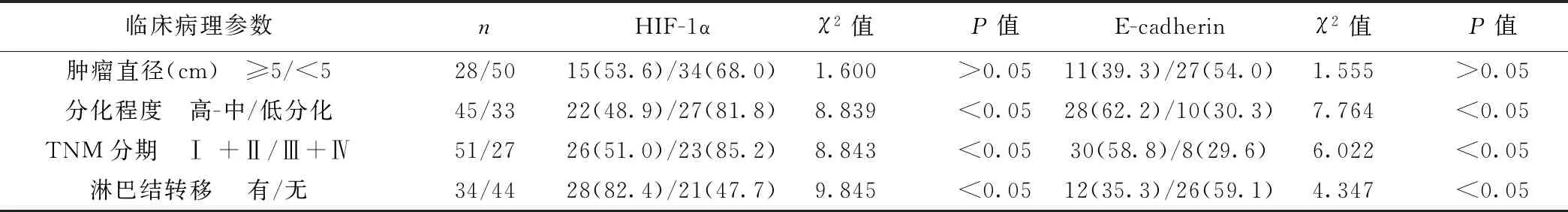
临床病理参数nHIF-1αχ2值P值E-cadherinχ2值P值肿瘤直径(cm) ≥5/<528/5015(53.6)/34(68.0)1.600>0.0511(39.3)/27(54.0)1.555>0.05分化程度 高-中/低分化45/3322(48.9)/27(81.8)8.839<0.0528(62.2)/10(30.3)7.764<0.05TNM分期 Ⅰ+Ⅱ/Ⅲ+Ⅳ51/2726(51.0)/23(85.2)8.843<0.0530(58.8)/8(29.6)6.022<0.05淋巴结转移 有/无34/4428(82.4)/21(47.7)9.845<0.0512(35.3)/26(59.1)4.347<0.05
3讨论
恶性增殖是肿瘤细胞的一个主要特征,目前公认缺氧是肿瘤细胞增殖、转移等的主驱动力,而HIF-1α在此过程中起到了关键的作用,它作为介导细胞对缺氧微环境进行适应性反应的关键性转录调控因子〔5〕,在肿瘤血管的生成以及肿瘤侵袭性方面起促进作用〔6〕。Yamamoto等〔7〕分析了171例浸润型乳腺癌标本,发现HIF-1α蛋白在肿瘤组织中的表达率明显高于对应的正常乳腺和良性增生组织中的表达率,且HIF-1α蛋白表达与肿瘤大小、肿瘤分化程度、有无淋巴结转移和临床分期明显相关;另有研究显示,HIF-1α可通过对肿瘤细胞黏附分子,如上皮型钙黏素(E-cad) 与β链接素(β-cat) 等表达的影响而促进肿瘤细胞的分离、移动而转移〔8〕。在本实验中,大肠腺癌中HIF-1α的表达率明显高于大肠腺瘤和癌旁5 cm正常黏膜组织中的表达率,提示缺氧微环境可以促进肿瘤细胞的转移:并且HIF-1α的高表达与E-cadherin的低表达密切相关,这说明大肠癌组织中HIF-1α的高表达可能通过调节E-cadherin的表达和转录来促进肿瘤的发生。
E-cadherin隶属于细胞黏附分子,是一类主要介导细胞间的黏附连接,维持细胞间支架稳定的钙依赖性跨膜糖蛋白。研究表明E-cadherin表达下调可以引起上皮间质转化(EMT)的发生〔9〕。Klymkowsky等〔10〕认为在肿瘤发生发展过程中,伴随着E-cadhein的丢失,细胞形态发生改变,从而使肿瘤细胞具备了强大的侵袭能力。本研究显示:大肠腺癌细胞和腺瘤细胞中E-cadherin也有不同程度的表达,但均明显低于正常组织中的表达率,说明它的表达下调可以增加肿瘤细胞的侵袭转移能力。
恶性肿瘤的转移是肿瘤治疗中最大的障碍,而缺氧和EMT均可以抑制大肠腺癌的凋亡,促进肿瘤的侵袭和迁移,随着人们对HIF-1α和E-cadherin蛋白的深入研究和对大肠腺癌转移机制的进一步探索,可能会为大肠腺癌早期诊断、治疗和预后评估提供有效的参考依据。
4参考文献
1Semenza GL.Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics〔J〕.Oncogene,2010;29(5):625-34.
2Kim JW,Gao P,Liu YC,etal. Hypoxia-inducible factor-1 and dysregulated c-Myc cooperatively induce vascular endothelial growth factor and metabolic switches hexokinase 2 and pyruvate dehydrogenase kinase 1〔J〕.Mol Cell Biol,2007;27(21):7381-93.
3Mohammadizadeh F,Ghasemibasir H,Rajabi P,etal. Correlation of E-cadherin expression and routine immunohistochemistry panel in breast invasive ductal carcinoma〔J〕.Cancer Biomark,2009;5:1-8.
4Ray ME,Mehra R,Sandler HM,etal. E-cadherin protein expression predicts prostate cancer salvage radiotherapy outcomes〔J〕.J Urol,2006;176(4pt1):1409-14.
5Huang LE,Bunn HF. Hypoxia-inducible factor and its biomedical relevance〔J〕. Biol Chem,2003;278(22):19575-8.
6Kaur B,Khwaja FW,Severson EA,etal.Hypoxia and the hypoxia- inducible- factor pathway in glioma growth and angiogenesis〔J〕.Neurol Oncol,2005;7(2):134-53.
7Yamamoto Y,Ibusuki M,Okumura Y,etal. Hypoxia-inducible factor 1 alpha is closely linked to an aggressive phenotype in breast cancer〔J〕.Breast Cancer Res Treat,2008;110(3):465-75.
8Zhao JH,Luo Y,Jiang YG,etal. Knockdown of β-catenin through shRNA cause a reversal of EMT and metastatic phenotypes induced by HIF-1α〔J〕.Cancer Invest,2011;29(6):377-82.
9Browne G,Sayan AE,Tulchinsky E. ZEB proteins link cell motility with cell cycle control and cell survival in cancer〔J〕.Cell Cycle,2010;9(5):886-91.
10Klymkowsky MW,Savagner P. Epithelial-mesenchymal transition:a cancer researcher's conceptual friend and foe 〔J〕.Am J Pathol,2009;174(5):1588-93.
〔2015-03-17修回〕
(编辑苑云杰/曹梦园)
通讯作者:高志安(1955-),男,博士,教授,主要从事肿瘤病理学研究。
〔中图分类号〕R735.3
〔文献标识码〕A
〔文章编号〕1005-9202(2016)13-3206-03;
doi:10.3969/j.issn.1005-9202.2016.13.054
1锦州市第二医院2山东省临沭县人民医院
第一作者:王远(1988-),女,硕士,住院医师,主要从事肿瘤病理学研究。

