两种纯化工艺对大黄水提液中蒽醌类成分的影响研究
张 驰,夏新华*,周莉莉,李 朝,周 宇
(湖南中医药大学药学院,湖南 长沙 410208)
·文献综述·
两种纯化工艺对大黄水提液中蒽醌类成分的影响研究
张驰,夏新华*,周莉莉,李朝,周宇
(湖南中医药大学药学院,湖南 长沙 410208)
目的 探索壳聚糖絮凝澄清工艺与醇沉工艺对大黄水提液中蒽醌类成分的影响规律。方法 以大黄中5种蒽醌类成分的保留率为评价指标,考察两种纯化工艺在不同条件下对大黄水提液中蒽醌类成分的影响。结果 两种纯化工艺在不同的条件下,大黄水提液中5种蒽醌类成分的保留率大小几乎具有一致的规律,即大黄酸>芦荟大黄素>大黄素>大黄酚>大黄素甲醚,醇沉工艺对于大黄蒽醌类成分的保留率优于壳聚糖絮凝澄清工艺。结论 醇沉工艺对极性小的成分的保留优于壳聚糖絮凝澄清工艺,而对极性高的成分的保留则相反。
大黄;蒽醌类;壳聚糖;絮凝澄清;醇沉
〔Abstract〕Objective To explore the effect laws of chitosan flocculation clarification and alcohol precipitation process on the anthraquinones in aqueous extract solution of Rheum palmatum.Methods The retention rates of five anthraquinones in Rheum palmatum are as evalution indexes,the influences of two purification processes under the different conditions on the anthraquinones were investigated.Results Under the different conditions of two purification processes,the retention rates of five anthraquinones in aqueous extract solution of Rheum palmatum almost had the same laws:rhein>aloe emodin>emodin>chrysophanol>emodin methyl ether.Comparing two purification processes,the retention rates of alcohol precipitation process on anthraquinones were superior to ones of chitosan flocculation clarification process.Conclution The retention rates of low polarity constituents by alcohol precipitation were better than the chitosan flocculation clarification process,while the high polarity constituents were opposite.
〔Keywords〕Rheum palmatum;anthraquinones;chitosan;flocculation clarification;alcohol precipitation
相对于传统的水提醇沉法,絮凝澄清法用于中药水提液的纯化具有操作简单、澄清剂用量小、能耗低等优点[1],因而近年受到许多中药制剂工作者的极大关注。本课题组前期研究发现,壳聚糖絮凝澄清工艺对水提液中极性大的成分的保留优于醇沉工艺,对中等极性成分的保留与醇沉工艺相近,而对极性小的成分的保留则差于醇沉工艺[2-4]。大黄为临床常用中药,主含芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚等蒽醌类有效成分[5-6]。有关上述两种纯化方法对大黄成分的影响研究目前已有一些报道,研究结果显示二者均可造成上述大黄蒽醌类成分不同程度的损失[7-8],但未见系统考察上述两种纯化方法的不同工艺条件对大黄中芦荟大黄素、大黄酸、大黄素等成分的影响规律。为进一步探讨醇沉工艺与壳聚糖絮凝澄清工艺对中药水提液中有效成分的影响规律,并探索大黄水提液合适的纯化工艺,本文系统地考察了两种纯化工艺对大黄水提液中所含5种主要蒽醌类成分的影响并进行了对比。
1仪器与试药
Waters 1525型高效液相色谱仪 (美国Waters公司),Kromasil C18色谱柱(4.6 mm×200 mm,5μm),YD601N型电子天平(上海恒平科学仪器有限公司),SHZ-Ⅲ型循环水试药式真空泵(上海亚荣生化仪器厂),KQ5200BE型数控超声清洗器(昆山市超声仪器有限公司)。
对照品大黄酸、大黄素、大黄酚、大黄素甲醚、芦荟大黄素对照品(中国药品生物制品检定所,批号分别为110757-200206、110756-200110、110757-201210、110758-201415、110795-201308,供含量测定用),纯净水(怡宝),其余试剂为色谱纯。
大黄饮片购自长沙市东塘药店,经湖南中医药大学中药鉴定教研室刘塔斯教授鉴定为蓼科植物掌叶大黄Rheum palmatum L.。
2方法和结果
2.1大黄蒽醌类成分的含量测定
2.1.1色谱条件采用Kromasil C18色谱柱,以甲醇-0.4%冰醋酸溶液为流动相进行梯度洗脱 (见表1);流速:0.8 mL/min;检测波长:254 nm;柱温:25℃;进样量为20 μL。

表1梯度洗脱程序
2.1.2混合对照品溶液的制备精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,加甲醇溶解并定容,制成芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量浓度分别为25.0、43.0、60.0、100.0、50.0 μg/mL的混合对照品溶液。
2.1.3供试品溶液的制备与测定精密量取大黄水提纯化液5mL,过0.45μm微孔滤膜,取续滤液作为供试品溶液。精密吸取对照品溶液与供试品溶液各20 μL,注入高效液相色谱仪,按“2.1.1”项下色谱条件进行测定。
2.1.4线性关系考察分别吸取上述混合对照品溶液10、12、14、16、18、20 μL,注入液相色谱仪,以对照品质量浓度对峰面积进行线性回归,得回归方程分别为:Y芦荟大黄素=4 678x+84 950(r=0.999 6),Y大黄酸=7 091.7x+48 311(r=0.999 3),Y大黄素=5 065x+80 810(r=0.999 1),Y大黄酚=8 772.7x-208 682(r=0.999 4),Y大黄素甲醚=3 400.3x-2 206.3(r=0.999 8),其线性范围分别为0.9~16.8 mg/L、0.1~18.9 mg/L、1.2~23.6 mg/L、0.9~20.0 mg/L、0.9~11.7 mg/L。
2.1.5精密度试验精密称取同一批大黄水提纯化液样品5 mL,按“2.1.1”项下方法依法测定5种蒽醌成分的含量,连续进样6次,结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的相对峰面积的RSD均在0.40%~2.99%之内,表明实验仪器精密度良好。
2.1.6稳定性试验取同一供试品溶液,室温下放置,分别于配置后0、4、8、16、24、36 h进样,结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的峰面积 RSD分别为 1.89%、1.87%、1.78%、1.66%、1.89%,说明5种成分在36 h内稳定。
2.1.7重复性试验精密量取同一批号的大黄水提纯化液样品5 mL,共6份,按“2.1.1”项下方法依法测定5种蒽醌成分的含量,结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的RSD分别为1.59%、1.69%、1.68%、1.86%、1.72%,表明该方法重复性良好。
2.1.8加样回收率试验精密量取已知含量的大黄水提纯化液样品2.5 mL,共6份,分别精密加入适量对照品溶液,混匀,按“2.1.1”项下方法依法测定5种蒽醌成分的含量,结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的加样回收率分别为97.1%、96.3%、97.5%、96.4%、95.9%,表明该方法可行。
2.2大黄水提液的制备
取大黄粗粉适量,加水浸泡0.5 h,第一次加10倍量水煎煮2 h,第二次加8倍量水煎煮1.5 h,滤过,收集两次水提液,备用。
2.3醇沉工艺对大黄蒽醌类成分的影响
2.3.1药液相对密度的考察取大黄水提液适量,真空浓缩至相对密度为1.20(60℃),取浓缩液3等份(每份含大黄50 g),其中2份加水分别稀释至相对密度约为1.15、1.10(60℃),放冷,搅拌下分别缓缓加入计算量的95%乙醇使含醇量为60% (g/g),静置24 h,滤过,收集滤液,定容,然后过0.45 μm的微孔滤膜,取续滤液作为供试品溶液,按“2.1.1”项下方法测定蒽醌类成分的含量。对实验数据进行双因素方差分析,结果表明3种不同浓度的大黄溶液经醇沉处理后其5种大黄蒽醌成分的保留率差异明显(P<0.01),以浓度最低者(相对密度1.10)为佳;而5种大黄蒽醌成分之间的保留率在各种浓度下均存在较大差异(P<0.01),其保留率大小依次为:大黄酸>芦荟大黄素>大黄素>大黄酚>大黄素甲醚(见表2)。

表2醇沉法药液相对密度对5种大黄蒽醌成分保留率的影响
2.3.2药液含醇量的考察取上述相对密度1.20 (60℃)的大黄浓缩液适量,共6份(每份含大黄50 g),加水分别稀释至相对密度约为 1.15 (60℃),搅拌下分别缓缓加入计算量的95%乙醇使含醇量为40%、50%、60%、70%、80%、90%,静置24 h,滤过,收集滤液,定容,按“2.3.1”项下方法操作。对实验数据进行双因素方差分析,结果表明大黄溶液经不同浓度的醇处理后其5种大黄蒽醌成分的保留率差异明显(P<0.01),且随着药液含醇量升高,5种大黄蒽醌成分的保留率均呈递增趋势(P<0.01),结果见表3。
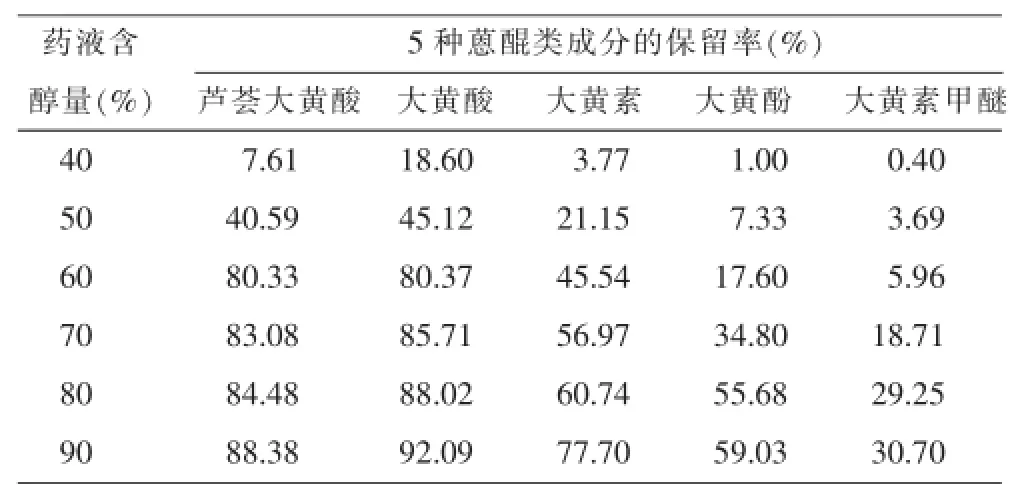
表3醇沉法药液含醇量对5种大黄蒽醌成分保留率的影响
2.4壳聚糖絮凝澄清工艺对大黄蒽醌类成分的影响
2.4.1药液浓度的考察取上述大黄水提液适量,共5份,分别浓缩至生药与药液比为1∶2、1∶3、1∶4、1∶5、1∶6(g∶mL),调节pH至6,于水浴上70℃恒温,在 400 r/min的搅拌条件下按每 1g生药加入1.5 mL的1%壳聚糖溶液 (用1%HAc配制),搅拌10 min,静置24 h,滤除絮凝物,收集滤液,定容,按“2.3.1”项下方法操作。对实验数据进行双因素方差分析,结果表明5种不同浓度的大黄溶液经壳聚糖絮凝澄清法处理后其5种大黄蒽醌成分的保留率差异明显(P<0.01),当药液的生药-药液比为1∶4~1∶5时,5种大黄蒽醌成分的保留率相对较高(P<0.01),结果见表4。

表4絮凝法药液浓度对5种大黄蒽醌成分保留率的影响
2.4.2药液pH考察取大黄水提液浓缩至生药与药液比为1∶4,取5等份,分别调节 pH为4、5、6、7、8,于水浴上70℃恒温,以下操作同“2.4.1”项下方法。对实验数据进行双因素方差分析,结果表明5种不同pH的大黄溶液经壳聚糖絮凝澄清法处理后其5种大黄蒽醌成分的保留率差异明显(P<0.01),当药液pH为6时,5种大黄蒽醌成分的保留率相对较高(P<0.01),结果见表5。

表5絮凝法药液pH对5种大黄蒽醌成分保留率的影响
2.4.3壳聚糖用量的考察取大黄水提液浓缩至生药与药液比为1∶4,调节pH为6,取3等份,于水浴上70℃恒温,在400 r/min的搅拌条件下加不同量的1%壳聚糖溶液,以下操作同“2.4.1”项下方法。对实验数据进行双因素方差分析,结果表明加入不同量的壳聚糖处理大黄溶液后其5种大黄蒽醌成分的保留率差异明显(P<0.01),当药液中加入的壳聚糖的量为每克生药1.0 mL时,5种大黄蒽醌成分的保留率相对较高(P<0.01),结果见表6。
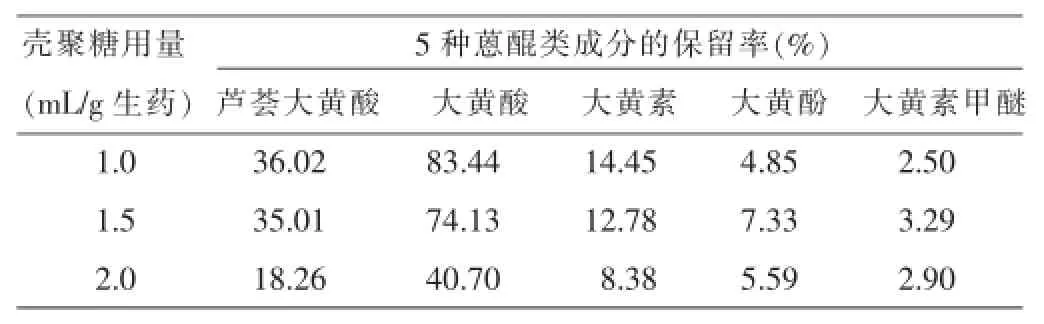
表6壳聚糖用量对5种大黄蒽醌成分保留率的影响
2.4.4药液温度的考察取大黄水提液浓缩至生药与药液比为1∶4,调节 pH为6,取3等份,分别于水浴上50℃、70℃、90℃恒温,以下操作同“2.4.1”项下方法。对实验数据进行双因素方差分析,结果表明大黄溶液在不同温度下经壳聚糖絮凝澄清法处理后其5种大黄蒽醌成分的保留率差异明显(P<0.01),当药液温度为50℃时,5种大黄蒽醌成分的保留率相对较高(P<0.01),见表7。

表7絮凝法药液温度对5种大黄蒽醌成分保留率的影响
2.5壳聚糖絮凝澄清工艺与醇沉工艺的比较
取大黄水提液适量,真空浓缩至相对密度为1.10(60℃),取3等份,放冷,搅拌下分别缓缓加入95%乙醇使含醇量为 70%(g/g),静置 24 h,按“2.3.1”项下方法操作。另取大黄水提液适量,真空浓缩至生药与药液比为1∶4,调节 pH至6,取3等份,于水浴上50℃恒温,在400 r/min的搅拌条件下按每1 g生药加入1.0 mL的1%壳聚糖溶液,以下操作同“2.4.1”项下方法。对实验数据进行t-检验,结果表明以5种大黄蒽醌成分保留率为评价指标,采用醇沉法处理大黄水溶液明显优于壳聚糖絮凝澄清法。见表8。

表8两种纯化工艺的大黄蒽醌类成分保留率 (x,n=3)
3小结与讨论
采用醇沉法处理大黄水提浓缩液,药液浓度与含醇量对芦荟大黄素、大黄酸等5种大黄蒽醌成分的保留率均有明显的影响。实验表明,药液浓度较低、含醇量较高时,有助上述5种大黄蒽醌成分的保留,这可能与药液浓度低时醇沉药液体积相对增大及高浓度乙醇对难溶于水的大黄蒽醌类成分具有较好的溶解性有关。
采用壳聚糖絮凝澄清法处理大黄水提浓缩液,药液浓度、pH、温度及壳聚糖用量对芦荟大黄素、大黄酸等5种大黄蒽醌成分的保留率均有明显的影响,其中温度、壳聚糖用量对保留率的影响具有一定的规律性,即在考察范围内随温度的升高和壳聚糖用量的增加,上述蒽醌成分保留率呈现递减趋势,这说明大黄蒽醌成分对热不稳定,应注意控制絮凝的温度,另外应控制作为絮凝剂的壳聚糖用量。
比较大黄中5种蒽醌类成分在不同试验条件下的保留率,不难发现无论大黄水提液是采用醇沉法还是壳聚糖絮凝澄清法进行处理,它们的保留率大小几乎具有一致的规律,即大黄酸>芦荟大黄素>大黄素>大黄酚>大黄素甲醚,其中大黄酸的保留率在各种试验条件下均远高于大黄素甲醚。对上述5种成分的结构进行分析,根据它们母核上的取代基的极性大小不同,可以推测上述大黄蒽醌成分的极性大小与上述它们在纯化过程中的保留率大小顺序是一致的[5-6],这表明大黄蒽醌类成分本身的结构与极性大小亦是纯化过程中影响其保留率的主要因素。以上述极性大小不同的5种大黄蒽醌成分为指标,对比醇沉法与壳聚糖絮凝澄清法,可以发现无论哪一种方法均难以使大黄水提液在纯化中使所有的成分均达到很好的保留,但醇沉法对大黄上述5种蒽醌成分的保留率总体优于壳聚糖絮凝澄清法,这可能与所考察的5种大黄蒽醌成分在性质上总体属于低极性成分(脂溶性强)有关。这一结果与我们前期的研究发现是一致的[2-4],但与文献报道稍有不同(可能与其醇沉工艺采用50%醇浓度低于本实验70%醇浓度有关)[7]。因此,对中药水提液进行纯化处理时,要特别注意有效成分的理化性质,并考虑采用多指标进行评价,以便选择合理的纯化方法,避免中药有效成分在纯化中大量损失而影响药效。
[1]杨明.中药药剂学[M].北京:中国中医药出版社,2012:106-107.
[2]楚笑辉,唐路梅,夏新华,等.壳聚糖絮凝澄清工艺与醇沉工艺纯化乙肝宁复方水提液的对比[J].中国实验方剂学杂志,2011,17(21):1-2.
[3]雷昌,夏新华,黄玛莎,等.二种纯化工艺对茵陈水提液的影响研究[J].中成药2013,12(35):12-13.
[4]杨磊,夏新华,朱青,等.两种纯化工艺对白芍水提液化学成分的影响规律研究[J].中药材,2013,8(1):12-15.
[5]匡海学.中药化学[M].北京:中国中医药出版社,2013:74-75.
[6]徐庆,秦永俊,苏小建,等.掌叶大黄化学成分研究[J].中草药2009,11(04):9-10.
[7]战兵,张超,盛华刚,等.壳聚糖絮凝沉降法对蒽醌类成分的影响[J].中国实验方剂学杂志,2013,19(2):4-8.
[8]张拴,穆晓红,李娜,等.壳聚糖对大黄有效成分吸附作用的研究[J].西北药学杂志,2012,27(2):109-110.
(本文编辑苏维)
Influences of Two Purification Processe on Anthraquinones in Aqueous Extract Solution of Rheum palmatum
ZHANG Chi,XIA Xinhua*,ZHOU Lili,LI Chao,ZHOU Yu
(School of Pharmacy,Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
R283
B
10.3969/j.issn.1674-070X.2016.08.008
2016-03-24
国家自然科学基金面上项目(30973955)。
张驰,女,在读硕士研究生,从事中药新制剂及制剂质量标准的研究。
〔通迅作者〕*夏新华,男,博士,教授,博士研究生导师,E-mail:xiaxinhua001@163.com。

