不同抗原肽刺激方式对HIV特异性CD8 T细胞体外增殖的影响
金聪 涂婷 牟丹蕾 李群辉 李涛 吴昊 陈华标
·论著·
不同抗原肽刺激方式对HIV特异性CD8 T细胞体外增殖的影响
金聪涂婷牟丹蕾李群辉李涛吴昊陈华标
102206 北京,中国疾病预防控制中心性病艾滋病预防控制中心(金聪);212013 镇江,江苏省检验医学重点实验室江苏大学医学院(涂婷、李涛、陈华标);100069 北京,首都医科大学附属北京佑安医院感染中心(牟丹蕾、李群辉、吴昊);美国麻省总医院(陈华标)
金聪和涂婷为共同第一作者
【摘要】目的研究人类免疫缺陷病毒(HIV)特异性CD8T细胞在体外增殖反应的影响因素。方法应用3种不同的抗原刺激方式在体外刺激HIV感染者病毒特异性CD8 T细胞增殖,并比较在培养体系中添加外源性细胞生长因子IL-2对HIV特异性CD8 T细胞增殖的影响。结果与将MHC I匹配HIV抗原肽直接加入外周血淋巴细胞(PBMCs)持续刺激CD8 T 细胞和仅刺激CD8 T 细胞2 h这两种方法相比,从PBMCs中去除CD8 T细胞获得混合抗原递呈细胞APCs,并用混合APCs结合承载抗原肽呈递给CD8 T细胞可以更有效地刺激HIV特异性CD8 T细胞的增殖。培养体系中添加细胞因子IL-2与不添加IL-2相比虽然明显提高CD8T细胞增殖数目,但引起非特异性增殖。结论在不添加外源性IL-2培养条件下应用混合APCs呈递抗原肽的刺激方法可通过同时递呈抗原信号和细胞共刺激信号更特异地刺激了HIV特异性CD8 T细胞的有效增殖。
【主题词】获得性免疫缺陷综合征; T细胞,CD8;增殖,体外
人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)特异性CD8 T细胞是HIV感染中重要的一群自身保护性免疫细胞,可有效产生杀伤HIV感染细胞的保护性宿主免疫应答[1]。研究显示缺乏CD8 T细胞免疫应答与外周血中增加的HIV病毒载量相关并加速进展为艾滋病(Acquired Immunodeficiency Syndrome,AIDS)[2]。在HIV急性感染灵长类动物模型中去除CD8 T细胞导致持续高水平病毒血症,重新输入CD8 T细胞可有效降低病毒血症[3]。新近研究发现超急性期HIV感染者体内,HIV特异性CD8 T细胞的活化程度可影响病毒调定点水平[4]。
通过体外培养增殖HIV感染者的病毒特异性CD8 T细胞,能够对这一群细胞的增殖能力以及影响抗原活化增殖反应的影响因素进行更加细致深入的研究[5,6]。对HIV感染者的病毒特异性CD8 T细胞进行体外增殖主要通过应用MHC-I分子限制的HIV特异性抗原肽刺激外周血淋巴细胞(peripheral blood lymphocytes, PBMCs),并应用CFSE荧光染料在子代细胞中荧光减半的特性对体外增殖的CD8 T细胞进行标记[7]。目前的研究使用多种不同的CD8 T细胞体外增殖实验,但至今没有研究比较不同体外增殖模型对CD8 T细胞增殖反应的影响。本研究比较了不同抗原肽刺激方式以及是否添加外源性细胞因子IL-2对病毒特异性CD8 T细胞体外增殖特性的影响。
1材料与方法
1.1HIV感染者PBMCs的处理HIV感染病例标本来自美国麻省总医院的冻存PBMCs。感染病例检测病毒载量HIV RNA低于50拷贝/ml,未经抗逆转录病毒治疗。冻存PBMCs在实验前置于56 ℃水浴快速融化,以RPMI1640培养基洗3遍之后重悬于细胞培养液待用。细胞培养液为含有10%热灭活人血清(Human serum,Sigma公司)的RPMI1640培养基,培养基中添加有50 U/ml青霉素/链霉素、2 mmol/L L-谷氨酰胺和10 mmol/L HEPES。标本使用经患者知情同意,并通过麻省总医院伦理委员会的伦理审查。
1.2HIV特异性抗原肽刺激CD8T细胞体外增殖采用3种不同的抗原肽刺激方式诱导CD8 T细胞增殖,所用抗原肽均为HLA匹配的HIV特异性优势短肽段(HLA-matched optimal HIV peptides)。①抗原肽直接刺激PBMCs组:将抗原肽直接加入5×106已经用0.25 μmol/LCFSE荧光标记的PBMCs中共培养,细胞培养浓度为2×106细胞/ml,抗原肽终浓度为2 μg/ml。②抗原肽刺激PBMCs 2 h组:终浓度为2 μg/ml的抗原肽加入5×106已经用0.25 μmol/L CFSE荧光标记的PBMCs中,在37 ℃培养2 h后,以不含抗原肽的培养基洗2遍,之后将抗原肽刺激过的细胞重悬在新鲜培养基中以2×106细胞/ml浓度培养。③抗原肽通过抗原递呈细胞(Antigen Presenting Cells,APCs)呈递组:应用CD8 T细胞阴性磁珠分离试剂盒(Life tech公司)从5×106PBMCs中纯化获得CD8 T细胞并用0.25 μmol/L CFSE荧光标记,然后再取5×106PBMCs使用去除CD8 T细胞的磁珠试剂盒(Life tech公司)特异性去除CD8 T细胞后留下含有多种APCs的非CD8 T细胞。所有非CD8 T细胞与抗原肽在37 ℃培养2 h后洗脱未结合的抗原肽,加载有抗原肽的混合APCs与CFSE荧光标记的CD8 T细胞以5×106起始细胞数在2×106细胞/ml浓度共培养。④无抗原肽刺激对照组:5×106用0.25 μmol/L CFSE荧光标记的PBMCs不加抗原肽以2×106细胞/ml培养浓度与其他各培养组平行培养。在添加有外源细胞因子IL-2的培养组中,IL-2浓度为50 U/ml。每3 d吸去一半细胞培养液再加入同等体积新鲜细胞培养液。培养体系中的细胞数目和活细胞比例用Nuclear Counter(Chemometec)进行自动测定。
1.3流式细胞分析实验在培养不同时间点收获细胞。应用荧光抗体抗CD8 Alexa Fluor 700A和抗CD3 Qdot655(Life tech公司)标记CD 8 T细胞亚群。减弱的CFSE荧光所标记的CT8T细胞指示增殖的CD8T细胞。死细胞通过Live/Dead Blue (Life tech公司)染色进行排除。荧光抗体染色后的细胞即刻在 LSRII流式细胞仪 (BD Biosciences公司)上获取数据。用FlowJo 软件(Tree star)对数据进行分析。
1.4统计学方法用GraphPad Prism 5.0软件(GraphPadSoftware,Inc.)进行统计作图和分析。
2结果
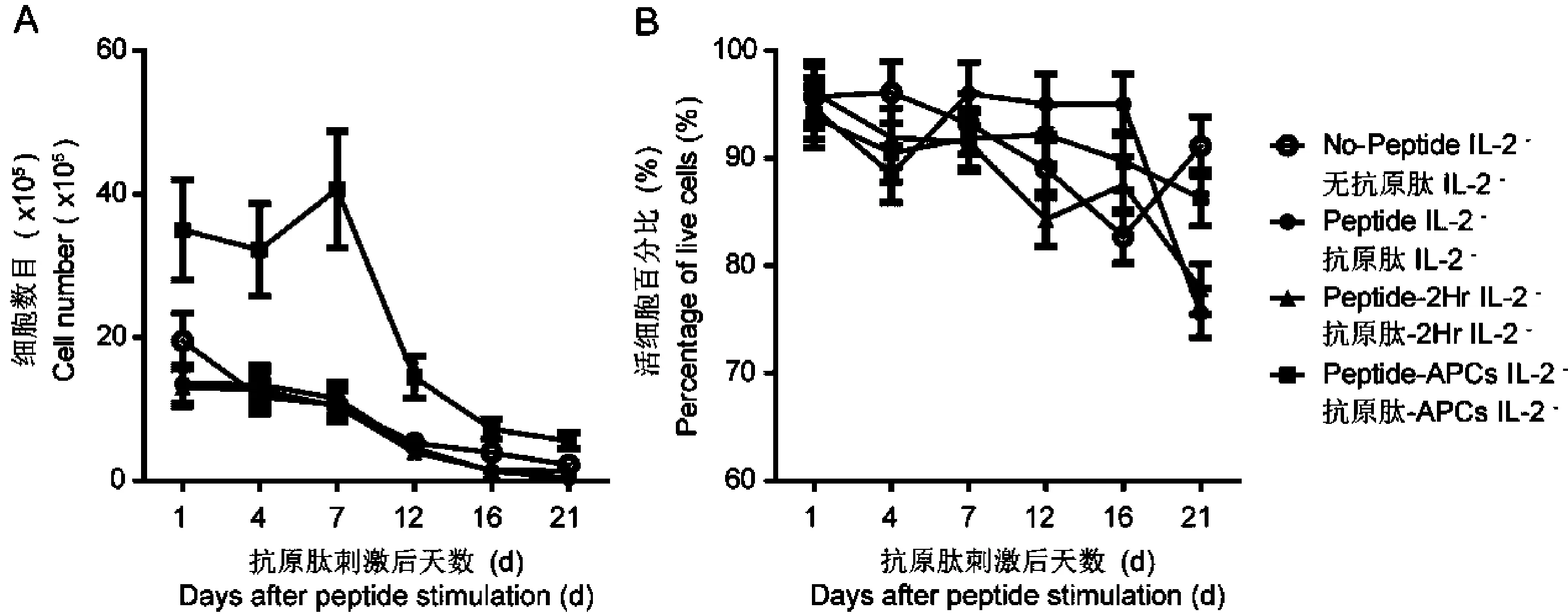
图1 无IL-2培养体系中的总细胞数目和活细胞比例Fig.1 Total cell numbers and live cell percentages in absence of IL-2
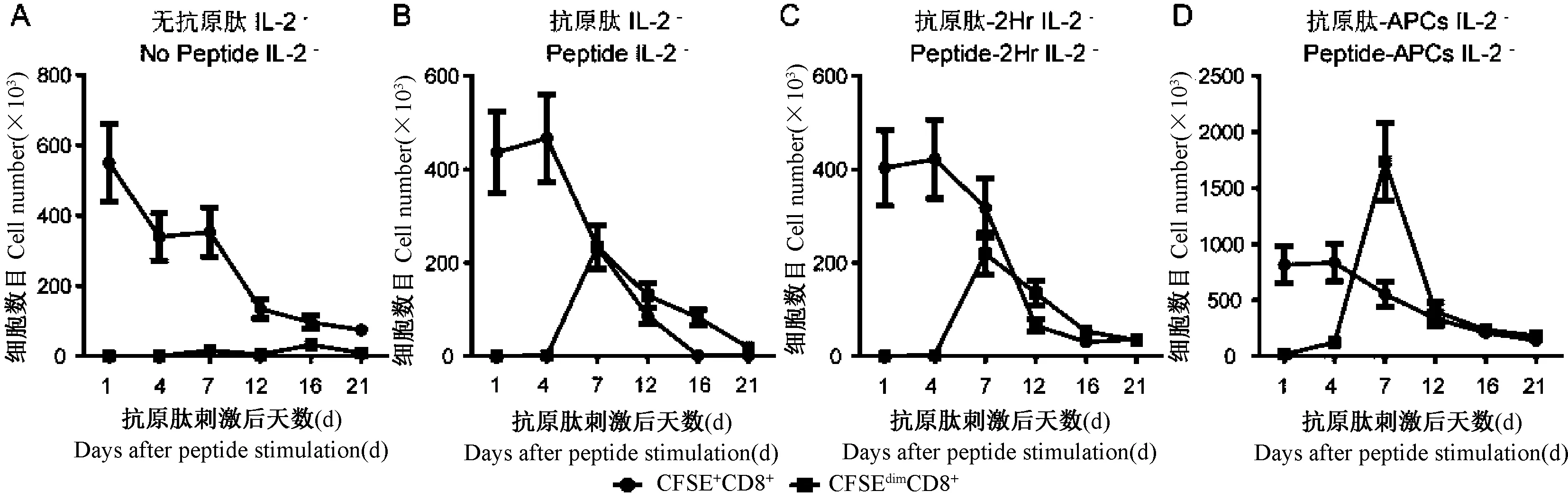
图2 无IL-2添加时增殖CD8 T细胞和未增殖CD8 T细胞的数目Fig.2 Dynamic analysis on proliferating and non-proliferating CD8 T cells in absence ofIL-2
2.1不同抗原肽刺激方式在无IL-2培养条件下对CD8T细胞体外增殖的影响在未加入外源性细胞因子IL-2培养条件下应用3种不同的抗原肽刺激方式对5×106PBMCs进行刺激,在不同时间点对各组培养体系中的总细胞数目进行计数(图1A)。第1天到第7天,各组细胞数目维持在平台期,抗原肽直接加入PBMCs组和抗原肽与PBMCs作用2 h组的细胞数目与未加入抗原肽培养组相近,APCs呈递抗原组的细胞数目显著高于其他组。第7天后,各组细胞数目均开始下降。在不同时间点对各组培养体系中活细胞比例进行测定(图1B),活细胞比例在第1天到第7天均维持在85%以上,在第12天到第16天活细胞比例略降低但仍在80%以上,在第21天各组仍然保持较高活细胞比例在75%以上。各组活细胞比例之间无显著差异。

图3 IL-2添加时CD8 T细胞增殖第7天细胞数目Fig.3 Cell number on day 7 of proliferation in absence ofIL-2
进一步通过减弱的CFSE荧光对增殖CD8 T细胞在不同时间点的动态增殖进行定量分析(图2),显示在培养第4天,APCs呈递抗原肽组就开始出现增殖,而其他各组此时还未出现明显增殖。在培养后第7天,3个抗原肽刺激组均出现增殖峰值,APCs呈递抗原肽组刺激增殖的CD8 T细胞峰值数目最高达到1.5~2×106细胞,抗原肽直接刺激PBMCs组和抗原肽刺激PBMCs 2 h组的增殖CD8 T细胞峰值数目均约为2.5×105细胞。APCs呈递抗原肽组刺激增殖的CD8 T细胞峰值数目显著高于其他抗原刺激组(P<0.05,图3)。无抗原肽刺激组未出现显著增殖的CD8 T细胞。各抗原肽刺激组中CFSE强荧光标记的未增殖CD8 T细胞从第4天开始出现明显下降。因此,在未添加IL-2共培养条件下,与其他抗原肽刺激组相比,APCs呈递抗原肽组刺激增殖CD8 T细胞较早出现并具有较高增殖峰值数目。
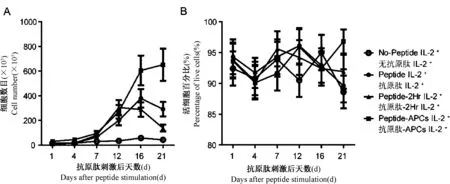
图4 无IL-2添加培养体系中的总细胞数目和活细胞比例Fig.4 Total cell numbers and live cell percentages in presence of IL-2
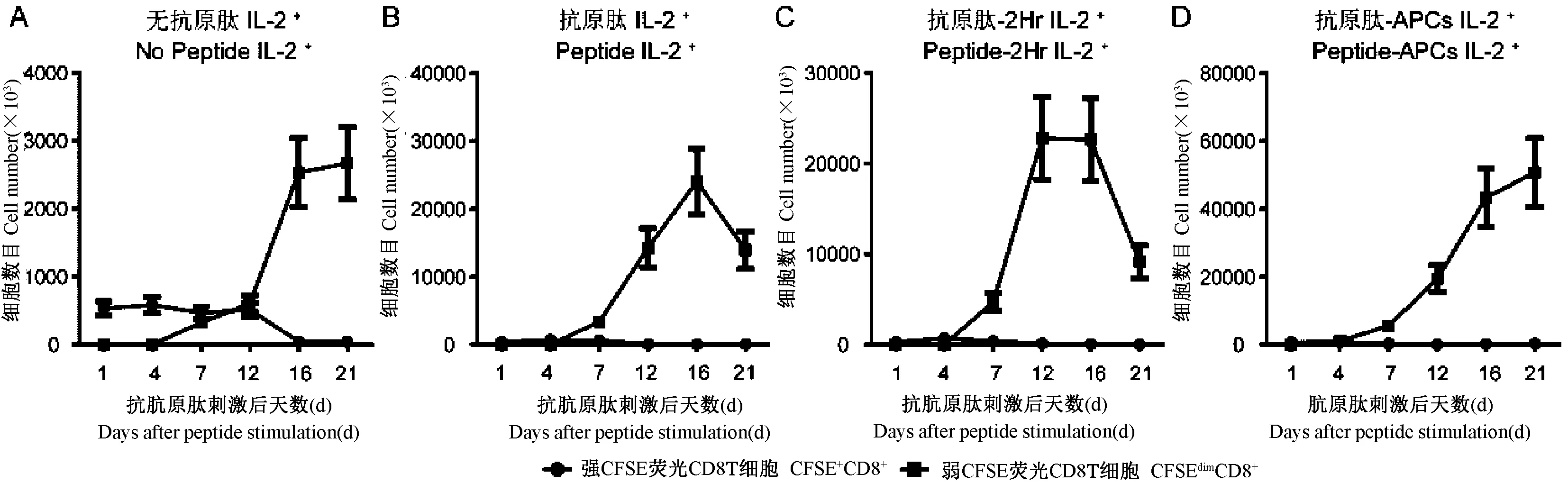
图5 IL-2添加培养时增殖CD8 T细胞和未增殖CD8 T细胞的数目Fig.5 Dynamic analysis on proliferating and non-proliferating CD8 T cells in presence ofIL-2
2.2不同抗原肽刺激方式在IL-2培养条件下对CD8 T细胞体外增殖的影响在共培养体系中加入外源性细胞因子IL-2的条件下,以3种不同的抗原肽刺激方式对5×106PBMCs进行刺激。对培养体系中的总细胞数目进行计数(图4A),从第7天起,各组细胞数目出现明显增殖,抗原肽直接加入PBMCs组和抗原肽与PBMCs作用2 h组的细胞数目与未加入抗原肽培养组相近,APCs呈递抗原组的细胞数目显著高于其他组。抗原肽直接加入PBMCs组和抗原肽与PBMCs作用2 h组的细胞数目在第16天达到峰值,在第21天出现下降。APCs呈递抗原组的细胞数目在第16天达到峰值,在第21天仍保持较高数目。对各组培养体系中活细胞比例进行测定(图4B),活细胞比例在第1天到第21天均维持在85%以上,各组活细胞比例之间无显著差异。
在共培养体系中添加外源性细胞因子IL-2的条件下,通过减弱的CFSE荧光对不同时间点的增殖CD8 T细胞进行定量分析(图5),显示在培养第4天,APCs呈递抗原肽组就开始出现增殖,而其他各组此时还未出现明显增殖。在培养后第7天,3个抗原肽刺激组均出现增殖,但无抗原肽刺激组也出现明显的非特异性增殖。在第16天,各培养组中增殖的CD8 T细胞达到峰值,APCs呈递抗原肽组刺激增殖的CD8 T细胞峰值数目最高达到约4.5×107细胞,抗原肽直接刺激PBMCs组和抗原肽刺激PBMCs 2 h组的增殖CD8 T细胞峰值数目均约为2.5×107细胞,无抗原肽刺激组的增殖CD8 T细胞峰值数目约在2.5×106细胞,APCs呈递抗原肽组刺激增殖的CD8 T细胞峰值数目显著高于其他抗原刺激组(P<0.05),图6。与未添加IL-2培养条件相似,各抗原肽刺激组中CFSE强荧光标记的未增殖CD8 T细胞也从第4天开始出现明显细胞数目下降,无抗原肽刺激组中未增殖CD8 T细胞从第12天开始出现明显细胞数目下降。因此,在添加IL-2共培养条件下,与其他抗原肽刺激组相比,APCs呈递抗原肽组刺激增殖的CD8 T细胞出现较快速并达到较高增殖峰值数目。但在共培养体系中添加IL-2条件下,存在有非特异性的CD8 T细胞增殖。
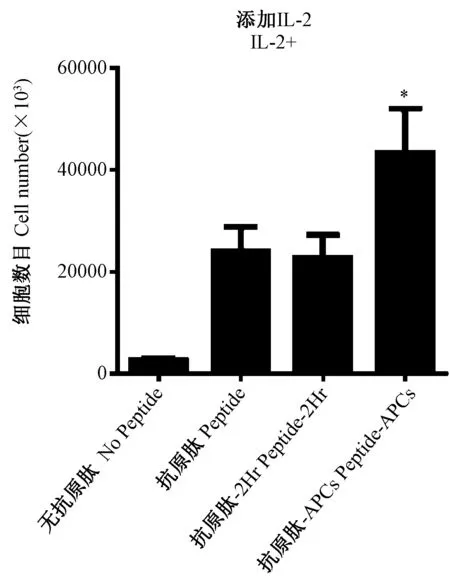
图6 IL-2添加培养时CD8 T细胞增殖第16天细胞数目Fig.6 Cell number on day 16 of proliferation in presence of IL-2
3讨论
HIV感染者的病毒特异性CD8 T细胞能够产生有效增殖反应对控制病毒感染非常重要[8]。体外增殖模型为研究HIV特异性CD8 T细胞增殖反应的特性和调控因素,以及增殖子代细胞的表型和功能提供了重要的研究手段[7]。目前的研究应用多种体外CD8 T细胞增殖模型,所用模型之间的区别在于不同的培养条件、抗原刺激方式、培养体系中的细胞组分、培养体系中添加的外源性细胞因子、以及对增殖细胞的分析方法。本研究比较分析了不同的抗原刺激方式对HIV特异性CD8 T细胞体外增殖的影响,发现与大部分研究直接将MHC I匹配的HIV抗原肽加入PBMCs刺激CD8 T细胞增殖的方法相比,在PBMCs中去除CD8 T细胞获得包括CD4 T辅助细胞和树突状细胞在内的混合APCs,并用混合APCs结合承载抗原肽呈递给CD8 T细胞可以更加有效地刺激CD8 T细胞的增殖反应。这种通过混合APCs呈递抗原肽的刺激方法通过同时递呈抗原信号和细胞共刺激信号更好地刺激了HIV抗原特异性CD8 T细胞的有效增殖。另外,与用单一抗原呈递细胞承载抗原肽刺激CD8 T细胞相比,多种混合APCs之间的相互作用也可有效地刺激CD8 T细胞的增殖,例如CD4 T细胞可通过CD40L-CD40相互作用活化树突状细胞从而使CD8 T细胞获得自分泌IL-2的能力而促进CD8 T细胞的增殖[9]。尽管已知APCs通过细胞表面的MHC I和抗原表位复合物被T细胞受体(T cell receptor,TCR)识别并通过表面的共刺激分子有效刺激曾经被抗原活化过的记忆性T细胞扩增,本研究第一次通过对不同体外增殖方法进行比较,证明了自体混合APCs呈递抗原肽刺激HIV特异性CD 8 T细胞增殖与常用的将抗原肽直接加入PBMCs刺激增殖的方法相比更加有效。
研究还发现,HIV抗原肽直接加入PBMCs并持续存在培养体系中的刺激方法和HIV抗原肽与PBMCs仅作用2 h之后不存在于培养体系中的刺激方法产生同样的增殖反应。说明抗原肽最初的刺激方式决定了抗原刺激HIV特异性CD8 T细胞增殖的时相和强度。这个结果一致于近来研究发现最初TCR的活化决定了CD8 T 细胞的扩增和扩增后数目回缩,之后可不依赖于抗原的存在[10,11]。有研究证明,抗原与CD8 T细胞短暂的接触就足以刺激CD8 T细胞的增殖和分化为效应与记忆细胞,并且不需要进一步的抗原刺激[12,13]。
IL-2是T细胞生长因子,通常用于CD8 T细胞在体外增殖实验中的外源性支持因子[14]。本研究发现培养体系中用IL-2细胞因子作为外源支持成分与不添加IL-2相比虽然明显提高增殖的CD8T细胞数目,但也引起非特异性增殖。没有添加IL-2的培养组, 活细胞比例在培养后16 d仍可维持在80%以上,这是由于CD8T细胞在活化后具有自分泌IL-2的功能[9],并且共培养体系中的CD4 T细胞等也分泌IL-2和其他细胞因子比如IL7和IL15支持抗原肽活化CD8T细胞的增殖[15]。此外,在不添加IL-2的条件下,CD8T细胞增殖7 d后细胞数大量减少,一致于体内发现抗原活化CD8 T细胞在扩增一周后由于大量细胞活化后凋亡导致细胞数目出现回落的增殖规律[16]。
本研究通过使用不同抗原刺激方式,以及评价在培养体系中添加外源性IL-2的效果,对目前常用的体外扩增HIV特异性CD8 T细胞的培养模型进行了比较。发现在不添加外源性IL-2培养条件下应用混合APCs呈递抗原肽的刺激方法可通过同时递呈抗原信号和细胞共刺激信号更好地模拟体内抗原递呈从而特异地刺激了HIV特异性CD8 T细胞的有效增殖。本研究仅从增殖细胞数目对不同抗原刺激方式进行了评价,还需进一步研究分析不同抗原刺激方式增殖CD8T细胞的功能和靶细胞杀伤活性以及抗原特异性T细胞所占比例。研究结果将有助于根据不同研究目的选取适合的体外模型分析HIV特异性CD8 T细胞的增殖反应以及调控机制。
4参考文献
[1]McMichael AJ, Rowland-Jones SL. Cellular immune responses to HIV [J]. Nature, 2001, 410(6831):980-987.doi: 10.1038/3507365835073658 [pii]
[2]Goulder PJ, Phillips RE, Colbert RA, et al. Late escape from an immunodominant cytotoxic T-lymphocyte response associated with progression to AIDS [J]. Nat Med, 1997, 3(2):212-217.PMID:9018241
[3]Schmitz JE, Kuroda MJ, Santra S, et al. Control of viremia in simian immunodeficiency virus infection by CD8+ lymphocytes [J]. Science, 1999, 283(3403):857-860.PMID:9933172
[4]Ndhlovu ZM, Kamya P, Mewalal N, et al. Magnitude and Kinetics of CD8+ T Cell Activation during Hyperacute HIV Infection Impact Viral Set Point [J]. Immunity, 2015, 43(3):591-604.doi: 10.1016/j.immuni.2015.08.012 [pii]
[5]Ndhlovu ZM, Proudfoot J, Cesa K, et al. Elite controllers with low to absent effector CD8+ T cell responses maintain highly functional, broadly directed central memory responses [J]. J Virol, 2012, 86(12):6959-6969.doi: JVI.00531-12 [pii]10.1128/JVI.00531-12
[6]Ndhlovu ZM, Stampouloglou E, Cesa K, et al. The Breadth of Expandable Memory CD8+ T Cells Inversely Correlates with Residual Viral Loads in HIV Elite Controllers [J]. J Virol, 2015, 89(21):10735-10747.doi:JVI.01527-15 [pii]10.1128/JVI.01527-15
[7]Quah BJ, Warren HS, Parish CR. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester [J]. Nat Protoc, 2007, 2(9):2049-2056.doi: nprot.2007.296 [pii]10.1038/nprot.2007.296
[8]Lichterfeld M, Kaufmann DE, Yu XG, et al. Loss of HIV-1-specific CD8+ T cell proliferation after acute HIV-1 infection and restoration by vaccine-induced HIV-1-specific CD4+ T cells [J]. J Exp Med, 2004, 200(6):701-712.doi: 10.1084/jem.20041270jem.20041270 [pii]
[9]Feau S, Arens R, Togher S, et al. Autocrine IL-2 is required for secondary population expansion of CD8(+) memory T cells [J]. Nat Immunol, 2011, 12(9):908-913.doi: ni.2079 [pii]10.1038/ni.2079
[10]Kaech SM, Ahmed R. Memory CD8+ T cell differentiation: initial antigen encounter triggers a developmental program in naive cells [J]. Nat Immunol, 2001, 2(5):415-422.doi: 10.1038/8772087720 [pii]
[11]Badovinac VP, Porter BB, Harty JT. Programmed contraction of CD8(+) T cells after infection [J]. Nat Immunol, 2002, 3(7):619-626.doi: 10.1038/ni804ni804 [pii]
[12]van Stipdonk MJ, Lemmens EE, Schoenberger SP. Naive CTLs require a single brief period of antigenic stimulation for clonal expansion and differentiation [J]. Nat Immunol, 2001, 2(5):423-429.doi:10.1038/8773087730 [pii]
[13]Wong P, Pamer EG. Cutting edge: antigen-independent CD8 T cell proliferation [J]. J Immunol, 2001, 166(10):5864-5868. PMID:11342598
[14]Waldmann TA. The IL-2/IL-15 receptor systems: targets for immunotherapy [J]. J Clin Immunol, 2002, 22(2):51-56.PMID:11998892
[15]Kittipatarin C, Khaled AR. Ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7 [J]. J Immunol Methods, 2009, 344(1):45-57.doi:S0022-1759(09)00073-8 [pii]10.1016/j.jim.2009.03.001
[16]Murali-Krishna K, Altman JD, Suresh M, et al. Counting antigen-specific CD8 T cells: a reevaluation of bystander activation during viral infection [J]. Immunity, 1998, 8(2):177-187.doi: S1074-7613(00)80470-7 [pii]
通信作者:陈华标,Email: chenhuabiao@hotmail.com
DOI:10.3760/cma.j.issn.1003-9279.2016.03.001
(收稿日期:2016-04-04)
Effects of different antigen stimulation methods on the proliferation of HIV specific CD8 T cells
JinCong,TuTing,MouDanlei,LiQunhui,LiTao,WuHao,ChenHuabiao
NationalCenterforAIDS/STDControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China(JinC);JiangsuKeyLaboratoryofClinicalLaboratoryMedicine,SchoolofMedicine,JiangsuUniversity,Zhenjiang212013,China(TuT,LiT,ChenHB);BeijingYou′anHospitalAffilitedCapitalMedicalUniversity,Beijing100069,China(MouDL,LiQH,WuH);MassachusettsGeneralHospital,USA(ChenHB)JinCongandTuTingarethefirstauthorswhocontributedequallytothearticleCorrespondingauthor:ChenHuabiao,Email:chenhuabiao@hotmail.com
【Abstract】ObjectiveTo study the factors that influence the ex vivo proliferation of human immunodeficiency virus (HIV) specific CD8 T cells. MethodsThree methods to use HIV-specific antigen peptides stimulating the proliferation of virus specific CD8 T cells from HIV patients were compared, and the effect of adding exogenous IL-2 into co-culture on proliferation was evaluated. ResultsIn comparison to directly adding MHC I matched HIV peptides into peripheral blood mononuclear cells (PBMCs) by presence during co-culture or incubating for 2 hours, the more efficient proliferation of HIV-specific CD8 T cells was stimulated by loading HIV peptides on the mixed antigen presenting cells (APCs) that harvested by removing CD8 T cells from PBMCs. Adding IL-2 into co-culture could largely enhance the number of proliferated HIV-specific CD8 T cells but also induced non-specific proliferation of CD8 T cells. ConclusionsStimulation of HIV-specific CD8 T cells by loading HIV-specific antigen peptides on mixed APCs and in absence of IL-2 can specifically induce the efficient proliferation of HIV-specific CD8 T cells by providing both antigen and co-stimulation signals.
【Key words】Acquired immunode�ciency syndrome; CD8 T cells; Ex vivo proliferation

