腹水来源胃癌原代细胞的建立及鉴定*
姜文静,张忠献,王尧河,石海亮,赵瑞华,宗 红#,曹风雨#
1)郑州大学第一附属医院肿瘤科 郑州 450052 2)郑州大学中英分子肿瘤学研究中心 郑州 450052
腹水来源胃癌原代细胞的建立及鉴定*
姜文静1),张忠献2),王尧河2),石海亮2),赵瑞华1),宗红1)#,曹风雨2)#
1)郑州大学第一附属医院肿瘤科 郑州 4500522)郑州大学中英分子肿瘤学研究中心 郑州 450052
摘要目的:以胃癌患者腹水来源的胃癌细胞为研究对象,旨在探索出一种相对成熟的肿瘤细胞原代培养技术及鉴定方法。方法:对腹水来源胃癌细胞进行原代培养,通过低浓度胰蛋白酶消化法及差速贴壁法进行原代细胞纯化,获得能够稳定传代的胃癌转移瘤细胞系,并通过观察细胞形态、免疫荧光检测、绘制细胞增殖曲线、构建裸鼠皮下移植瘤模型等方法对其进行鉴定。结果:获得1例能够稳定传代的腹水来源胃腺癌细胞株(命名为CFJ),细胞形态一致,表达上皮性生物标志物,细胞核呈现明显的异型性,能在裸鼠皮下成功构建移植瘤模型,增殖和转移能力强,可见裸鼠纵隔、腋窝等多处淋巴结转移。结论:胃癌转移性腹水可以成为建立原代肿瘤细胞的很好来源。
胃癌是全球人口的第三大恶性肿瘤死亡原因[1]。胃癌在中国的发病率及病死率仍稳居所有肿瘤的第2位[2],5 a生存率也只有大约20%[3]。许多经过胃根治性切除手术的胃癌患者依旧会发生肿瘤的复发和转移。其中,腹膜转移就是最常见的胃癌根治性手术患者治疗失败的原因,占总复发率的20.0%~53.5%[4-6]。胃癌腹膜转移患者都会产生恶性腹水。原代细胞培养就是将取得的肿瘤组织或细胞在体外进行首次培养。原代培养细胞离体时间短,性状与体内相似,为肿瘤的研究提供了一个有效平台。然而,手术标本获取不易,而且许多患者发现时已是晚期,丧失了手术治疗的时机,使得通过原发肿瘤进行原代培养获取肿瘤细胞株变得比较困难。而获得进展期胃癌患者的腹水相对容易,给患者带来的痛苦更小,可以成为建立原代肿瘤细胞很好的来源。由此,作者选择腹水来源胃癌细胞为研究对象,获得1例能够稳定传代的胃癌转移瘤细胞株,报道如下。
1材料与方法
1.1材料CO2细胞培养箱(德国Thermo公司),倒置显微镜(日本Olympus Optical 公司),超净工作台(德国Thermo公司),低速离心机(德国Thermo公司),RTCA细胞功能分析仪(杭州ACEA公司),DMEM/F12+GlutaMAXTM-1细胞培养基(美国Gibco公司),胎牛血清(美国Gibco公司),胰蛋白酶(美国Sigma公司),二甲基亚砜(美国Sigma公司),Matrigel(美国Gibco公司)。4~5周的BALB/c(nu/nu)雌性裸鼠购于北京维通利华实验动物技术有限公司。
1.2腹水来源胃癌患者细胞的分离及培养胃癌患者腹水的搜集获得郑州大学第一附属医院伦理委员会的批准,患者及家属均签署知情同意书。用离心管收集腹膜转移进展期胃癌患者的新鲜腹水100~200 mL,1 000 r/min离心5 min后弃上清(血性腹水视情况于离心管中加入适量肝素抗凝)。用含体积分数5%胎牛血清的DMEM/F12培养基(加入氢化可的松、上皮生长因子)重悬沉淀后转入底面积为25~75 cm2的培养瓶中,置于体积分数5% CO2、37 ℃培养箱中培养。
1.3纯化方法原代培养非常容易受到成纤维细胞的污染,而腹水中除了成纤维细胞外,往往混有大量脱落的间皮细胞,为腹水来源的肿瘤细胞的原代培养带来严重的干扰,需及时清除[7-9],可采用差速贴壁法和低浓度胰蛋白酶消化法。
1.3.1差速贴壁法根据肿瘤细胞比成纤维细胞贴壁速度慢的特点,把含有混合细胞的细胞悬液置于培养瓶中,放入37 ℃培养箱静置30 min后,取出上清置于另一个培养瓶中继续培养[10]。当混杂细胞贴壁生长达到一定数量后,消化传代时再重复差速贴壁。
1.3.2低浓度胰蛋白酶消化法 选择低浓度的胰蛋白酶消化,在倒置显微镜下观察并轻轻摇动培养瓶,当大多数成纤维细胞脱落而肿瘤细胞克隆未脱落的时候立即终止消化,去上清,加条件培养基继续培养[10]。
1.4纯化肿瘤细胞的鉴定
1.4.1免疫荧光检测采用免疫荧光检测方法测定纯化细胞CFJ中特异性的生物标志物的表达。细胞角蛋白(CK)是上皮细胞最常见标记物,但是部分间皮细胞CK也可以呈阳性表达。而癌细胞只表达CK,抗钙视网膜蛋白(CR)表达为阴性。
于24孔板中培养CFJ至80%融合;PBS洗2次,5 min/次;后用40 g/L多聚甲醛固定细胞15 min;PBS洗2次,5 min/次;加入100 μL体积分数0.25%的Triton X-100,室温放置5 min;PBS洗2次,5 min/次;一抗室温孵育2 h;PBS洗3次,5 min/次;加入TRITC标记的荧光二抗100 μL,室温避光孵育1 h;PBS洗3次, 5 min/次;加入含有DAPI的封片液100 μL/孔,置于倒置显微镜下观察。即用型鼠单抗CK和兔单抗CR均购于上海杰浩生物技术有限公司,荧光二抗山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司,山羊抗兔IgG购自康为世纪公司。
1.4.2细胞形态观察将培养不同阶段的细胞于倒置显微镜下进行形态学观察,记录细胞的生长情况。
1.4.3细胞增殖、迁移实验细胞增殖实验:首先制备CFJ细胞悬液,细胞密度为5×104mL-1。在96孔培养板中加入50 μL培养基(共4个复孔),将其放到RTCA细胞功能分析仪上,经过RTCA系统自动扫描和基线检测,保证所有孔的细胞指数低于0.063。取出96孔板,在孔中加入100 μL混合均匀的CFJ细胞悬液,放回培养箱中的RTCA细胞功能分析仪上,系统将定时自动扫描检测,绘制细胞增殖曲线。
细胞迁移实验:首先进行CIM-Plate迁移浸润检测板装配[下室的孔中加入165 μL培养基,CFJ细胞阴性对照组加入无血清培养基,CFJ细胞组及A549细胞组(阳性对照)加入含体积分数10%胎牛血清培养基,在上室中加入30 μL无血清培养基],制备CFJ与A549细胞悬液,细胞密度为4×105mL-1。向CIM-Plate上室加入100 μL细胞悬液,室温静置30 min待细胞沉降后放回RTCA仪的检测台,进行细胞迁移的实时动态监测,自动绘制细胞迁移曲线。

2结果
2.1患者病例资料患者,男,63岁,河南省南阳市人。(胃底)腺癌,Lauren分型为混合型。腹腔穿刺腹水细胞病理学检查结果:发现癌细胞,倾向腺癌。腹水离心沉渣涂片镜下见少量团状排列的核大深染细胞,并见中等量间皮细胞、淋巴细胞(图1)。
2.2细胞形态见图2。其中图2A为纯化前的原代细胞,镜下观察可见较多贴壁生长的细胞,但细胞大小、形态差异明显,为不同种类细胞的混合生长;图2B为通过低浓度胰蛋白酶消化法纯化后的细胞,大部分成纤维细胞已经脱落,镜下可观察到上皮性细胞克隆,细胞折光性强,饱满、立体感强;图2C为纯化后扩增的上皮性细胞克隆,细胞形态一致,折光性强,饱满、立体感强。纯化细胞无细菌、真菌及支原体污染。

图1 患者腹水HE染色发现癌细胞(×200)

A:纯化前的原代细胞(×100);B:通过低浓度胰蛋白酶消化法纯化后的细胞(×100);C:纯化后扩增的上皮性细胞克隆(×200)。图2 原代培养不同阶段的细胞形态
2.3免疫荧光检测结果见图3。纯化过的细胞CK呈强阳性表达,而CR不表达,证实为上皮来源的癌细胞。

A、B:CK呈强阳性表达;C、D:CR不表达。图3 CFJ的免疫荧光染色结果(×200)
2.4CFJ细胞增殖实验及迁移实验结果显示,CFJ体外增殖能力强,但迁移能力较弱,见图4。

左:CFJ细胞的增殖曲线;右:CFJ细胞的迁移曲线。图4 CFJ细胞增殖实验及迁移实验结果
2.5裸鼠皮下移植瘤模型的构建裸鼠皮下移植瘤模型构建成功,细胞佐以Matrigel时成瘤率可达100%。长时间观察可见裸鼠腋窝、纵隔等多处淋巴结转移,见图5。裸鼠皮下移植瘤的生长曲线见图6。
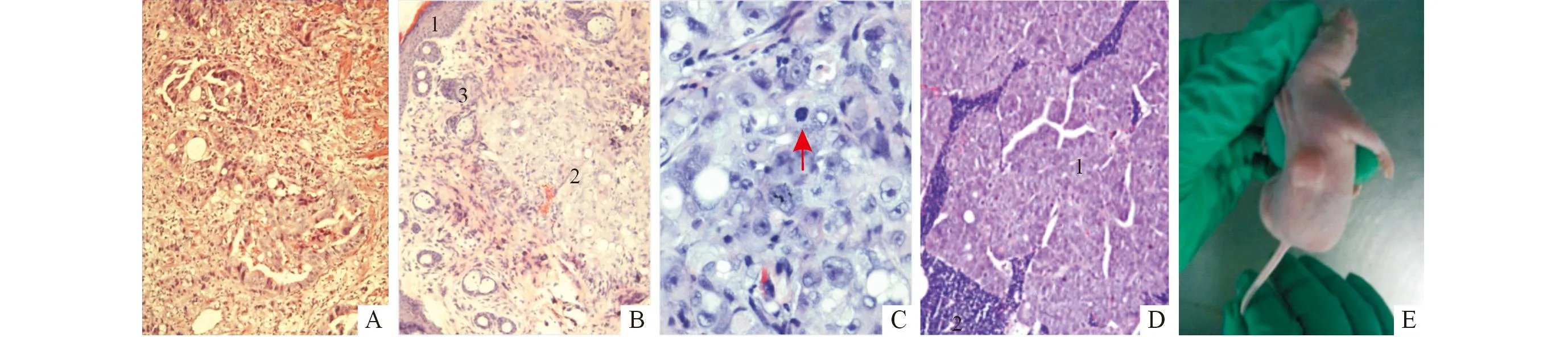
A:该患者原发肿瘤组织HE染色,可见到呈腺样排列的癌组织(×100);B:裸鼠皮下移植瘤HE染色,1为裸鼠表皮,2为癌组织,3为毛囊和皮脂腺,癌组织呈腺样及实体状排列(×100);C:裸鼠皮下移植瘤瘤体HE染色,箭头示癌细胞病理性核分裂像(×400);D:裸鼠纵隔转移淋巴结HE染色,1为转移癌,2为残余淋巴组织(×100); E:CFJ细胞裸鼠皮下移植瘤。图5 患者原发肿瘤及裸鼠皮下移植瘤模型

图6 裸鼠皮下移植瘤的生长曲线
3讨论
胃癌的发病率和病死率均较高,由于大多数胃癌患者确诊时已发展为局部晚期或已出现转移,因此平均生存时间很少超过12个月,5 a生存率小于7%[11]。近20 a来胃癌诊断、治疗等方面取得了较大进展,但胃癌患者的总体预后仍不理想[12]。
该研究对腹水来源胃癌细胞进行原代培养,通过低浓度胰蛋白酶消化法及差速贴壁法进行原代细胞纯化,获得能够稳定传代的胃癌转移瘤细胞系。并通过免疫荧光检测、绘制细胞增殖曲线、构建裸鼠皮下移植瘤模型等方法对其进行鉴定,逐步找到一种相对成熟的腹水来源胃癌细胞的原代培养及鉴定方法,成功获得1例能够稳定传代的腹水胃腺癌细胞株CFJ。该胃癌细胞能在裸鼠皮下构建移植瘤模型,肿瘤细胞在裸鼠皮下生长迅速,并可见腋窝、纵隔等多处淋巴结转移病灶,证明该细胞在体内有较强的增殖和迁移、转移能力。体外迁移实验的结果却显示其迁移能力很弱,体内、外实验结果存在一定的差异,提示应改进现有的实验技术。对此作者将结合二代测序技术,希望可以发现分子传导信号关联,进一步解释这种差异的原因。
参考文献
[1]FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359
[2]CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115
[3]KARIMI P,ISLAMI F,ANANDASABAPATHY S,et al.Gastric cancer:descriptive epidemiology,risk factors,screening, and prevention[J].Cancer Epidemiol Biomarkers Prev,2014,23(5):700
[4]HUANG B,SUN Z,WANG Z,et al.Factors associated with peritoneal metastasis in non-serosa-invasive gastric cancer: a retrospective study of a prospectively-collected database[J].BMC Cancer,2013,13:57
[5]INOUE K,NAKANE Y,MICHIURA T,et al.Trends in long-term survival following surgery for gastric cancer: a single institution experience[J].Oncol Rep,2004,11(2):459
[6]WU CW,LO SS,SHEN KH,et al.Incidence and factors associated with recurrence patterns after intended curative surgery for gastric cancer[J].World J Surg,2003,27(2):153
[7]COLE SP,BHARDWAJ G,GERLACH JH,et al.Overexpression of a transporter gene in a multidrug-resistant human lung cancer cell line[J].Science,1992,258(588):1650
[8]KRISHNAMACHARY N,CENTER MS.The MRP gene associated with a non-P-glycoprotein multidrug resistance encodes a 190-kDa membrane bound glycoprotein[J].Cancer Res,1993,53(16):3658
[9]COLEY HM,AMOS WB,TWENTYMAN PR,et al.Examination by laser scanning confocal fluorescence imaging microscopy of the subcellular localisation of anthracyclines in parent and multidrug resistant cell lines[J].Br J Cancer,1993,67(6):1316
[10]INCE TA,SOUSA AD,JONES MA,et al.Characterization of twenty-five ovarian tumour cell lines that phenocopy primary tumours[J].Nat Commun,2015,6:7419
[11]PASINI F,FRACCON AP,DE MANZONI G.The role of chemotherapy in metastatic gastric cancer[J].Anticancer Res,2011,31(10):3543
[12]JEMAL A,BRAY F,CENTER MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69
(2016-03-03收稿责任编辑姜春霞)
doi:10.13705/j.issn.1671-6825.2016.04.016
#通信作者:宗红,女,1968年4月生,博士,主任医师,研究方向:消化道肿瘤,E-mail:zonghong522@126.com;曹风雨,女,1976年12月生,博士,副教授,研究方向:肿瘤基因治疗,E-mail:9175539@qq.com
中图分类号R73-3
关键词腹水;胃癌;原代培养;转化;成瘤
Primary cell culture and identification of ascites-derived gastric cancer cells
JIANG Wenjing1),ZHANG Zhongxian2),WANG Yaohe2),SHI Hailiang2),ZHAO Ruihua1),ZONG Hong1),CAO Fengyu2)
1)DepartmentofOncology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou4500522)Sino-BritishResearchCenterforMolecularOncology,ZhengzhouUniversity,Zhengzhou450052
Key wordsascites;gastric cancer;primary cell culture;transformation;tumourgenesis
AbstractAim: To develop an optimal system for primary cell culture and identification technique with the ascites-derived gastric cancer cells as the research object.Methods: The ascites-derived gastric cancer cells were cultured and purified through the combination of digestion with low concentration trypsin and differential attachment. And the cell morphology was observed by HE and immunocytochemical staining.The cellular proliferation was detected. The tumor growth of established cell line in vivo was also investigated by the subcutaneous transplantation in nude mice model.Results: An ascites-derived gastric adenocarcinoma cell line(named as CFJ) that could passage steadily had been successfully developed. The cells were consistent in morphology with obvious atypia nuclei and with cytoplasm expressing epithelial biomarkers. Furthermore, it succeeded in establishing the subcutaneous transplantation model in nude mice, and found the cells could locally metastasize to the lymph nodes of mediastinum and axilla in the mice.Conclusion: Metastatic ascites of gastric cancer patients could be a good source of the primary cell culture.
*国家自然科学基金面上项目81272525;郑州市科学技术局科技创新团队项目131PCXTD633;河南省医学科技攻关计划项目201202001

