电针预处理对大鼠脑缺血再灌注损伤后炎性因子及细胞凋亡的影响①
朱路文,叶涛,姜云飞,吴孝军,李宏玉,宋名扬,唐强
电针预处理对大鼠脑缺血再灌注损伤后炎性因子及细胞凋亡的影响①
朱路文1,叶涛2,姜云飞2,吴孝军2,李宏玉2,宋名扬2,唐强1
目的探讨电针预处理对大鼠脑缺血再灌注损伤后白细胞介素(IL)-1β、IL-6含量及细胞凋亡的影响。方法36只清洁级雄性Sprague-Dawley大鼠按随机数字表法分为假手术组、模型组和电针预处理组,每组12只。大脑中动脉阻塞(MCAO)建立脑缺血2 h再灌注模型。再灌注后24 h,酶联免疫吸附法检测血清、脑组织IL-1β、IL-6的含量,TUNEL染色检测缺血半暗区神经细胞凋亡。结果与模型组比较,电针预处理组大鼠血清、脑组织IL-1β、IL-6的含量明显下降(P<0.01),TUNEL阳性细胞数显著下降(P<0.001)。结论电针预处理降低炎症反应,减少细胞凋亡。
脑缺血再灌注;电针;预处理;白细胞介素-1β;白细胞介素-6;细胞凋亡;炎症反应;大鼠
[本文著录格式]朱路文,叶涛,姜云飞,等.电针预处理对大鼠脑缺血再灌注损伤后炎性因子及细胞凋亡的影响[J].中国康复理论与实践,2016,22(7):765-768.
CITED AS:Zhu LW,Ye T,Jiang YF,et al.Effects of electro-acupuncture pretreatment on interleukin-1β,interleukin-6 and apoptosis in rats after cerebral ischemia-reperfusion injury[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(7):765-768.
脑缺血再灌注后,机体免疫系统激活,分泌白细胞介素1(interleukin-1,IL-1)、白细胞介素6(interleukin-6,IL-6)等炎症细胞因子,引起神经元细胞损伤与凋亡,导致脑组织结构缺失与功能障碍[1-2]。近年国内外研究证实,电针预处理可诱导脑缺血耐受,减轻脑缺血再灌注损伤,发挥脑保护作用[3-5]。本实验探讨电针预处理百会穴对脑缺血再灌注大鼠血清、脑组织IL-1β、IL-6含量及缺血半暗区细胞凋亡的影响。
1材料与方法
1.1实验动物
清洁级雄性Sprague-Dawley大鼠36只,体质量220~240 g,由黑龙江中医药大学实验动物中心提供,许可证号SCXK(黑)2008001。于温度24~26℃、湿度60%~70%、噪音<60 dB环境下饲养,明暗各12 h交替(7:00~19:00开灯)。
1.2主要仪器和试剂
G6805-1A型电针仪:上海华谊医用仪器厂。MK3酶标仪:THERMO SCIENTIFIC公司。KDC-160HR高速冷冻离心机:中科中佳科学仪器有限公司。RM2235型切片机:LEICA公司。PeriFlux 5000型激光多普勒血流仪:帕瑞医学公司。TUNEL试剂盒:ROCHE公司。IL-1β、IL-6 ELISA检测试剂盒:北京诚林生物技术有限公司。考马斯亮蓝蛋白定量试剂盒:北京赛驰生物科技有限公司。
1.3动物分组及干预
将36只大鼠编1~36号。计算机生成一个含36个数的随机数字表,以表中第一数对应大鼠编号1,从左到右,自上而下分别对应1~36号大鼠。用表中随机数字除以3得余数确定各编号的组别,余数0、1、2分别对应假手术组、模型组、电针预处理组,最终各组随机分入12只大鼠。假手术组接受类似电针预处理组的各项手术操作,但不行模型制作;模型组仅接受模型制作;电针预处理组电针预处理2周后制作模型。
1.3.1电针预处理
大鼠固定于大鼠固定器上,根据《实验动物图谱》选取大鼠百会穴(双耳前缘连线中点),采用直径0.25 mm,长25 mm毫针(贵州安迪医疗器械有限公司),45°进针2 mm。连接电针仪,另一极连接耳尖,采用疏密波,频率2/15 Hz,强度1 mA,干预30 min,每天1次,每周5 d,共2周。
1.3.2模型制备
线栓法制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)再灌注模型。术前12 h禁食不禁水。10%水合氯醛3.5 ml/kg腹腔注射麻醉,恒温加热板保持大鼠体温于36.5~37.5℃。碘伏颈部消毒,颈正中处切口,钝性剥离软组织,暴露颈总动脉、颈外动脉及颈内动脉,结扎靠近分叉处的颈总动脉和颈外动脉,颈总动脉分叉处下方用眼科剪剪一“V”型切口,将头端过蜡、直径0.26 mm的鱼线插入颈内动脉,深距离分叉处17~18 mm。激光多普勒监测血流阻闭情况,于大脑中动脉脑血流降基线值30%以下视为造模成功。结扎颈内动脉,2 h后拔出栓线。各组于再灌注2 h根据Longa等的5分制法进行神经功能缺损评分[6],评分1、2、3分的大鼠视为造模成功,纳入实验。
1.4取材及检测方法
1.4.1血清IL-1β、IL-6含量
再灌注24 h后,各组取6只大鼠,腹腔注射10%水合氯醛4 ml/kg麻醉,真空采血管于心尖采血4 ml,室温静置30 min,4℃ 3000 r/min离心15 min,取上清,保存于-20℃冰箱。严格按照试剂盒说明检测各组血清IL-1β、IL-6含量。
1.4.2脑组织IL-1β、IL-6含量
再灌注24 h后,取余下6只大鼠,腹腔注射10%水合氯醛4 ml/kg麻醉,快速断头取脑,切取缺血侧脑梗死周边组织,称重后,4℃预冷PBS制备10%脑组织匀浆,4℃ 3000 r/min离心10 min,取上清,保存于-20℃冰箱。运用考马斯亮蓝法标定蛋白含量,酶联免疫吸附法测定脑组织匀浆中IL-1β、IL-6含量,除以蛋白含量后即得到每毫克组织蛋白中IL-1β、IL-6含量。
1.4.3TUNEL染色
采血结束后,动脉夹或止血钳夹闭腹主动脉或流向下肢的血管,心内灌注。冰板上快速断头取脑,保存于4%多聚甲醛中,4℃冰箱过夜。视交叉后1 mm冠状位向后切取厚4 mm脑组织,置10%中性福尔马林缓冲液中固定18 h。常规梯度乙醇脱水、二甲苯透明,石蜡包埋,连续冠状切片,厚3~5 μm,烤片后4℃保存。
65℃烤片1 h,二甲苯脱蜡(二甲苯Ⅰ、Ⅱ,各5 min),下行梯度酒精水合,室温下蛋白酶K消化30 min,PBS漂洗3次,各5 min(下同);37℃暗湿盒中滴加TUNEL反应液50 μl,孵育1 h,PBS漂洗;37℃暗湿盒中滴加POD反应液50 μl,孵育30 min,PBS漂洗;室温下DAB显色,PBS漂洗,苏木素对比染色,温水返蓝。上行梯度酒精脱水,二甲苯透明,封片,镜检。每只大鼠取1张切片,低倍镜(10×10)下定位缺血半暗区,高倍镜(10×40)下观察拍照,计数TUNEL阳性细胞数。
1.5统计学分析
2结果
2.1血清IL-1β、IL-6含量
与假手术组比较,模型组血清IL-1β、IL-6均显著升高(P<0.001)。与模型组比较,电针预处理组血清IL-1β、IL-6含量显著降低(P<0.001)。见表1。
2.2脑组织IL-1β、IL-6含量
与假手术组比较,模型组脑组织IL-1β、IL-6均显著升高(P<0.001)。与模型组比较,电针预处理组脑组织IL-1β、IL-6均明显降低(P<0.01)。见表1。
2.3TUNEL染色
假手术组少见TUNEL阳性细胞。与假手术组比较,模型组大鼠TUNEL阳性细胞数显著增加(P<0.001)。与模型组比较,电针预处理组TUNEL阳性细胞显著减少(P<0.001)。见表1。
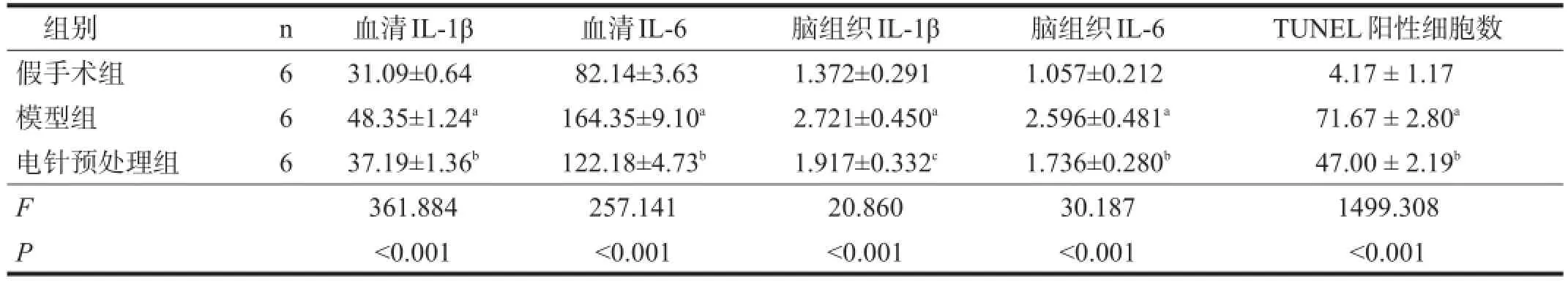
表1 各组血清和脑组织IL-1β、IL-6含量及TUNEL阳性细胞数比较
3讨论
脑缺血再灌注损伤中医学称为“中风”,由窍闭神匿,神不导气所致,治疗遵循“病变在脑,首取督脉”的理论。百会属督脉,有醒脑开窍,升阳举陷,益气补虚、平肝息风的功效。电针刺激百会穴可减轻脑缺血损伤,降低脑梗死体积,抑制细胞凋亡,促进神经功能恢复[7-9]。
电针预处理是于脑缺血前进行单次或多次电针刺激,预防及保护脑损伤的一种方法[7,10]。电针预处理可通过内质网应激途径、低氧诱导因子-1α、非受体酪氨酸激酶-信号转导和转录激活因子信号转导通路等,抑制细胞凋亡,发挥脑保护作用[8,11-12];还可通过抗氧化应激,调节血脑屏障、内源性大麻素系统等途径,诱导脑缺血耐受[13-15]。
近年来,脑缺血再灌注后炎症反应被认为是治疗脑缺血的重要靶点。脑缺血再灌注后,可产生大量炎症因子,激活和趋化炎性细胞及合成分泌黏附因子等,多种因素相互作用引起级联反应,导致脑组织继发炎症性损伤[16]。
IL-1β、IL-6是炎症反应中的重要因子。IL-1β是炎症细胞的强烈趋化因子,可引起星形细胞、小胶质细胞活化与增多,星形胶质细胞增殖活化[17];还可致白细胞浸润、增加兴奋性氨基酸和氧自由基的释放等,引起级联反应,使炎症反应加剧甚至失控,导致脑组织继发性损伤[18-19]。
IL-6表达水平是脑缺血再灌注损伤程度的重要指标[20]。IL-6可诱导T淋巴细胞作用于脑组织,还可引起炎症介质的生成与增多,促进基质金属蛋白酶-1表达,从而加速炎症反应,引起神经元、胶质细胞及内皮细胞受损[21-23]。
本研究显示,脑缺血再灌注24 h,可诱发炎症反应,而电针预处理可降低该炎症反应相关炎症因子,发挥抑制炎症级联反应的作用。
炎症反应与细胞凋亡在时间和空间上相互重叠、彼此影响,共同构成损伤过程中的级联反应,从而加速脑缺血再灌注损伤的出现。细胞凋亡又称细胞程序性死亡,是由细胞内外因素刺激导致细胞本身自杀程序被激活而引起。神经细胞凋亡程序在脑缺血损伤,特别是脑缺血再灌注损伤中起着重要作用[24-26]。细胞凋亡在脑缺血后所引起的迟发性神经元死亡占比较大。本研究显示,脑缺血再灌注可诱发缺血半暗带神经细胞大量凋亡,而电针预处理可降低细胞凋亡水平,减轻脑损伤程度。
总之,本研究显示,电针预处理可以有效抑制脑缺血再灌注后的炎症反应,减弱其诱导级联反应的发生,抑制损伤脑组织的细胞凋亡,从而诱导脑缺血耐受。本研究进一步证实电针预处理的脑保护作用,为电针预处理作为缺血性脑卒中的防治措施提供坚实的理论基础。
[1]Yang Y,Zhang ZX,Lian D,et al.IL-37 inhibits IL-18-induced tubular epithelial cell expression of pro-inflammatory cytokines and renal ischemia-reperfusion injury[J].Kidney Int,2015,87(2):396-408.
[2]Chen S,Yin ZJ,Jiang C,et al.Asiaticoside attenuates memory impairment induced by transient cerebral ischemia-reperfusion in mice through anti-inflammatory mechanism[J].Pharmacol Biochem Behav,2014,122:7-15.
[3]Wang MS,Zhou HP,Shi F.Acupuncture preconditioning protects hippocampal neurons from transient ischemia/reperfusion injury[J].Neural Regen Res,2011,6(15):1175-1179.
[4]刘建勋,林咸明.不同时程电针预处理对脑缺血大鼠血脑屏障功能的保护效应[J].上海针灸杂志,2014,33(12): 1169-1172.
[5]叶涛,朱路文,唐强.电针预处理诱导脑缺血耐受的研究进展[J].针灸临床杂志,2015,31(2):87-90.
[6]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[7]Xiong L,Lu Z,Hou L,et al.Pretreatment with repeated electroacupuncture attenuates transient focal cerebral ischemic injury in rats[J].Chin Med J(Engl),2003,116(1):108-111.
[8]徐浩,沈剑,赵昱,等.电针预处理大鼠百会穴对脑缺血保护作用及HIF-1α相关机制的研究[J].神经解剖学杂志,2015,31 (5):617-622.
[9]孙思斯,高杨,刘瞾宇,等.电针预处理对脑缺血再灌注后SOD2的表达影响[J].中华神经外科疾病研究杂志,2014,13 (3):236-240.
[10]吕凯,李凤,龚标,等.电针对局灶性脑梗死大鼠皮质Slit2/Robo1表达的影响[J].针刺研究,2013,38(4):265-270.
[11]陈怀龙,齐慧,刘孝洁,等.电针预处理对全脑缺血再灌注损伤大鼠海马葡萄糖调节蛋白78和生长停滞及DNA损伤基因153表达的影响[J].针刺研究,2014,39(6):431-436.
[12]王振宇,王希文,孙忠人,等.电针预处理对局灶性脑缺血再灌注大鼠pSTAT3蛋白表达的影响[J].针灸临床杂志,2012,28(7):49-51.
[13]林咸明,陈丽萍,姚旭.不同时程电针预处理对脑缺血再灌注大鼠血脑屏障基质金属蛋白酶-9,血管内皮生长因子的影响[J].针刺研究,2015,40(1):40-44.
[14]高杨,孙思斯,刘曌宇,等.电针预处理通过上调Peroxiredoxin 6减轻大鼠脑缺血再灌注损伤[J].神经解剖学杂志,2014,30(5):507-513.
[15]张业贵,龚鑫,侯良芹.电针预处理对脑缺血再灌注大鼠大脑皮质一氧化氮合酶及胶质纤维酸性蛋白表达的影响[J].针刺研究,2015,40(2):113-118.
[16]王硕,康立源,秦秀德,等.丹红注射液抗脑损伤作用研究进展[J].天津中医药大学学报,2012,31(3):183-186.
[17]段乐,白利群,田苗苗,等.炎症反应在脑缺血中作用机制研究进展[J].中华实用诊断与治疗杂志,2013,27(9):837-839.
[18]莎兰,李运曼.炎症与脑缺血的关系及其药物治疗研究进展[J].疾病监测与控制,2013,7(6):348-351.
[19]张小芸,尹昌浩,郭艳芹.炎症反应与脑缺血-再灌注损伤的研究进展[J].牡丹江医学院学报,2013,34(6):81-84.
[20]Clark WM,Rinker LG,Lessov NS,et al.Lack of interleukin-6 expression is not protective against focal central nervous system ischemia[J].Stroke,2000,31(7):1715-1720.
[21]Huang J,Upadhyay UM,Tamargo RJ.Inflammation in stroke andfocal cerebral ischemia[J].Surg Neurol,2006,66(3): 232-245.
[22]Waje-Andreassen U,Kråkenes J,Ulvestad E,et al.IL-6:an early marker for outcome in acute ischemic stroke[J].Acta Neurologica Scandinavica,2005,111(6):360-365.
[23]曾靖,黎晓,黄志华.脑缺血再灌注损伤与炎症反应关系的研究进展[J].时珍国医国药,2011,22(3):698-700.
[24]Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanismsaftercerebralischemia[J].Stroke,2009,40(5): e331-e339.
[25]Niizuma K,Yoshioka H,Chen H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J].Biochim BiophysActa,2010,1802(1):92-99.
[26]Zhang F,Yin W,Chen J.Apoptosis in cerebral ischemia:executional and regulatory signaling mechanisms[J].Neurol Res,2004,26(8):835-845.
Effects of Electro-acupuncture Pretreatment on Interleukin-1β,Interleukin-6 and Apoptosis in Rats after Cerebral Ischemia-reperfusion Injury
ZHU Lu-wen1,YE Tao2,JIANG Yun-fei2,WU Xiao-jun2,LI Hong-yu2,SONG Ming-yang2,TANG Qiang1
1.The Second Hospital Affiliated to Heilongjiang University of Chinese Medicine,Harbin,Heilongjiang 150001,China;2.Heilongjiang University of Chinese Medicine,Harbin,Heilongjiang 150040,China
Correspondence to TANG Qiang.E-mail:tangqiang1963@163.com
Objective To investigate the effect of electro-acupuncture pretreatment on content of interleukin(IL)-1β and IL-6 in serum and ischemic penumbra,and apoptosis in ischemic penumbra in rats after cerebral ischemia-reperfusion injury.Methods Thirty-six male Sprague-Dawley rats were randomly divided into sham group(n=12),model group(n=12),and electro-acupuncture pretreatment group(n= 12).The middle cerebral arteries were occluded for 120 minutes and reperfused.Twenty-four hours after reperfusion,the level of IL-1β and IL-6 in serum and brain tissue was detected with enzyme-linked immunosorbent,and apoptosis of ischemic penumbra was detected with TUNEL.Results The content of IL-1β and IL-6 in the serum and brain tissue,and the number of TUNEL-positive cells decreased in the electro-acupuncture pretreatment group compared with that in the model group(P<0.01).Conclusion Electro-acupuncture pretreatment may inhibit inflammatory response and apoptosis in cerebral ischemia-reperfusion injury.
cerebral ischemia-reperfusion;electro-acupuncture;pretreatment;interleukin-1β;interleukin-6;inflammatory response;apoptosis;rats
10.3969/j.issn.1006-9771.2016.07.005
R743.32
A
1006-9771(2016)07-0765-04
1.哈尔滨市科技创新人才专项基金项目(青年后备人)(No.2014RFQGJ150);2.黑龙江省自然科学基金项目(No.QC2015103);3.国家自然科学基金项目(No.81503666)。
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001;2.黑龙江中医药大学,黑龙江哈尔滨市150040。作者简介:朱路文(1983-),男,山东邹城市人,博士,主治医师,主要研究方向:针刺预处理预防脑血管病。通讯作者:唐强(1963-),男,四川大竹县人,教授,博士生导师,主要研究方向:中医康复基础与临床研究。E-mail:tangqiang1963@163.com。
2016-03-28
2016-05-19)

