蒙脱石对水溶液中甘氨酸的吸附特性及机理
郭玉婷,董发勤,刘明学,秦永莲,周青,吴传龙,宗美荣,黄婷,刘媛媛
(1. 西南科技大学 生命科学与工程学院,四川 绵阳,621010;2. 西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳,621010;3. 西南科技大学 材料科学与工程学院,四川 绵阳,621010)
蒙脱石对水溶液中甘氨酸的吸附特性及机理
郭玉婷1,董发勤2,刘明学1,秦永莲2,周青2,吴传龙3,宗美荣2,黄婷1,刘媛媛1
(1. 西南科技大学 生命科学与工程学院,四川 绵阳,621010;2. 西南科技大学 固体废物处理与资源化教育部重点实验室,四川 绵阳,621010;3. 西南科技大学 材料科学与工程学院,四川 绵阳,621010)
研究蒙脱石对不同浓度甘氨酸在水溶液中的吸附特性及机理。采用X线衍射(XRD)、全反射傅里叶变换红外光谱(ATR-FTIR)和等离子体发射光谱(ICP-AES)等手段对吸附样品进行性质表征。研究结果表明:蒙脱石平衡吸附量随甘氨酸浓度升高而增加,在甘氨酸浓度为0.01~0.20 mol/L范围内,蒙脱石吸附甘氨酸符合Freundlich等温吸附模型。蒙脱石层间阳离子解吸总量小于其对甘氨酸的平衡吸附量,且蒙脱石 d(001)由 1.528 nm 减小到1.446 nm,揭示蒙脱石吸附甘氨酸是通过层间阳离子交换机制,但阳离子交换非惟一方式。蒙脱石吸附甘氨酸存在阳离子交换和端面吸附2种机制:通过COO-与蒙脱石端面正电基团间的静电作用力吸附甘氨酸两性离子;通过与蒙脱石层间基面氧原子形成氢键吸附甘氨酸正离子。
蒙脱石;甘氨酸;端面吸附;阳离子交换;全反射傅里叶变换红外光谱
目前,对于黏土矿物表面与氨基酸相互作用的研究已深入到广泛的领域,如水地球化学[1]、土壤科学[2]和生命起源探索[3]等。早在 1987年,HEDGES等[1]的研究已证实自然界的水体和沉积物中均存在可检测的溶解性游离氨基酸,其迁移过程与自然条件下的吸附作用密切相关。生命起源以前,地壳中大量存在着黏土矿物,其在生命起源的化学演化过程中的作用至关重要。从氨基酸小分子到多肽的生命进化过程中,SiO2,Al2O3和黏土矿物等都起到了重要的催化作用。也有相关研究表明氨基酸与黏土矿物间存在的键合作用能较好地解释生命起源以前氨基酸的化学演化[4-5]。生命出现后,氨基酸作为多肽、蛋白质的基本结构单元,广泛存在于自然界的各生命体中。因此,研究黏土矿物对可溶性氨基酸的吸附行为及其机制对阐明黏土矿物与氨基酸分子在生命进化过程中的相关反应至关重要。氨基酸作为一种两性物质,其解离状态与溶液pH密切相关。目前已有报道称氨基酸的活性基团可以通过静电吸引、疏水作用、共价键合以及氢键等方式与黏土或氧化物发生吸附作用[3, 6]。现有研究发现由于黏土矿物的阳离子交换性,通常其对碱性氨基酸的吸附较中性和酸性氨基酸强[4, 7-8]。而且黏土矿物的层间阳离子类型也会对其吸附氨基酸造成影响。有关黏土矿物对自然环境中氨基酸的吸附研究多在实验室可控条件下进行,但主要是对吸附条件、吸附量等的研究,而且其结果受黏土和氨基酸种类以及具体实验条件的影响也较大[9]。鉴于黏土矿物和氨基酸在生命演化中的重要地位以及环境中二者的相互作用机制仍不明确等现状,本文作者借助XRD,ATR-FTIR以及ICP-AES等分析手段对蒙脱石与甘氨酸在水溶液中的吸附特性进行探讨。
1 实验部分
1.1材料与试剂
蒙脱石样品购自浙江三鼎科技有限公司,采用XRD和定量 X线荧光(XRF)光谱法测定其物相和成分。经XRF定量分析可知,各元素组分含量(质量分数,下同)分别为SiO259.33 %,Al2O319.91 %,CaO 1.86%,MgO 3.64%,K2O 0.59%,Fe2O31.68%,Na2O 1.00%,LOI 9.98%;经XRD分析可知蒙脱石纯度较高,d(001)为1.528 nm(d为距离),d(300)为0.149 nm,该蒙脱石样品为钙基蒙脱石。在吸附实验中,甘氨酸和蒙脱石样品不再经任何加工处理。实验所用甘氨酸、无水乙醇、HCl、NaOH和茚三酮均为分析纯试剂,所有用水均为去离子水。
1.2吸附实验方法
为了确定蒙脱石对甘氨酸吸附平衡时间和吸附最合适pH,首先进行时间和pH影响蒙脱石吸附甘氨酸的批量吸附实验。准确量取20 mL浓度为0.05 mol/L的氨基酸水溶液,于 50 mL锥形瓶中,加入蒙脱石0.2 g,分别吸附2~24 h后终止反应。
采用1 mol/L NaOH和1 mol/L HCl调节上述甘氨酸水溶液pH在1~10之间,准确量取不同pH的甘氨酸水溶液20 mL于50 mL锥形瓶中,分别加入0.2 g蒙脱石,吸附12 h后终止反应(时间影响吸附的实验中蒙脱石对甘氨酸的吸附于12 h达到平衡,下同)。在上述吸附实验中,同时设置氨基酸水溶液染菌对照组,且处理组和对照组均重复3次(下同)。
确定了吸附条件之后,进行了甘氨酸浓度对蒙脱石吸附甘氨酸的影响实验。配制浓度为 0.01,0.05,0.10,0.15和0.20 mol/L的甘氨酸水溶液,调节pH为3(pH影响吸附的实验中pH在2~4范围吸附较好),量取不同浓度甘氨酸水溶液20 mL于50 mL锥形瓶中,加入蒙脱石0.2 g,同时设置对照组(20 mL去离子水+0.2 g蒙脱石,pH=3)和氨基酸水溶液染菌对照组。吸附12 h后终止反应。
上述吸附实验的整个吸附过程均在温度为25 ℃、转速为120 r/min的恒温振荡器中进行,恒温振荡平衡相应时间后,取反应终止液于4 000 r/min离心20 min,并将上清液用0.22 μm微孔滤膜过滤,获得的上清液用于测定剩余氨基酸浓度、pH和元素溶出;沉淀物用去离子水洗涤3次,自然干燥后进行XRD分析。
1.3表征方法
1.3.1甘氨酸浓度、元素溶出及pH测定
将吸附实验中获得的上清液进行甘氨酸浓度、元素溶出及pH测定。甘氨酸浓度测定采用经典的茚三酮显色法[10]进行测定。根据标准曲线法计算溶液中氨基酸浓度,平衡时的吸附量 qe按下式计算:qe=10-3V(ρ0-ρe)/m。其中:qe为吸附剂吸附氨基酸平衡吸附量,mg/g;ρ0为氨基酸初始质量浓度,mg/L;ρe为吸附平衡时氨基酸质量浓度,mg/L;V为溶液体积,mL;m为吸附剂的质量,g。
溶出元素采用等离子发射光谱仪(iCAP6500,美国Thermo Fisher公司)进行测定,所得结果以处理组减去对照组来表示。
1.3.2XRD测定
将吸附实验中获得的蒙脱石干燥沉淀物采用荷兰帕纳科公司的X’Pert Pro 型X线衍射仪进行XRD分析。分析条件:辐射源为Cu靶,Kα(Kα1=1.540 598× 10-10m,Kα2=1.544 426×10-10m),管电压为40 kV,管电流为 40 mA,扫描范围为 2θ=3°~80°,步长为0.03°,用X'Pert HighScore Plus软件对XRD图谱进行分析。
1.3.3ATR-FTIR测定
1.3.3.1溶液中甘氨酸的ATR-FTIR测定
配制浓度为0.05 mol/L的甘氨酸水溶液,调节pH 为4.33,6.18和9.07,对不同pH下的甘氨酸水溶液进行ATR测试,获得的谱图与水的谱图作差谱,得到水溶液中甘氨酸的谱图。
1.3.3.2蒙脱石吸附甘氨酸的ATR-FTIR测定
准确量取上述不同pH的甘氨酸水溶液5 mL于10 mL反应管中,分别加入准确称量好的蒙脱石0.05 g,同时设置对照组(5 mL去离子水+0.05 g蒙脱石)。将混合体系置于25 ℃,120 r/min的恒温振荡器中进行吸附,恒温振荡吸附12 h后,取部分反应混合液直接进行ATR测试,获得的图谱分为4部分:被吸附的甘氨酸、未被吸附的甘氨酸、蒙脱石和水。为了只得到被吸附到蒙脱石上的甘氨酸的谱图,将剩余反应液于4 000 r/min离心20 min,并将上清液用0.22 μm微孔滤膜过滤,所得的上清液进行ATR测试,得到未被吸附甘氨酸的谱图;将对照组进行ATR测试,获得蒙脱石和水的谱图。将混合液谱图与上清液和对照谱图作差谱,最终获得被吸附甘氨酸的谱图。
在红外吸收光谱仪(Nicolet-5700,美国尼高力仪器公司)的ATR附件上进行ATR测试,测试条件:谱图采集范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数为64次。红外谱图处理包括基线校准、平滑等,作差谱时差减因子为 0.95~1.00,通过 OMIC软件完成。
2 结果与讨论
2.1蒙脱石吸附甘氨酸的定量分析
甘氨酸是一种中性非极性氨基酸,是组成多肽、蛋白质结构的最小单元。甘氨酸是一种两性电解质,等电点pI为5.97,存在酸式和碱式电离2种方式,解离方程式如图1所示。图2所示为甘氨酸在不同pH下各离子的摩尔分数。

图1 甘氨酸的酸式和碱式解离方程式Fig. 1 Acid and alkaline dissociation equation of glycine

图2 甘氨酸在不同pH下各离子的摩尔分数Fig. 2 Mole fraction of different dissociation states of dissolved glycine as function of pH
当溶液pH<pI时,甘氨酸为碱式电离,随着pH降低,甘氨酸正离子逐渐增加,两性离子逐渐减少;当溶液pH>pI时,甘氨酸为酸式电离,随着pH升高,甘氨酸两性离子逐渐减少,负离子逐渐增加;当溶液pH=pI时,甘氨酸主要以两性离子形式存在(图2[11])。因此甘氨酸电离出的不同离子种类的相对量与不同pH下的甘氨酸的电离状态密不可分。蒙脱石对甘氨酸的吸附在不同pH范围有所不同,主要由甘氨酸的电离特性和蒙脱石的结构性质共同决定。
在时间和pH影响蒙脱石吸附甘氨酸的批量吸附实验中(在吸附前后,染菌对照组的甘氨酸浓度无变化表明吸附中没有染菌现象发生,下同),不同吸附时间蒙脱石对甘氨酸的吸附如图3所示。吸附0~8 h时,蒙脱石对甘氨酸的平衡吸附量随时间增加较快; 吸附8~12 h之间时,蒙脱石对甘氨酸的平衡吸附量随时间增长较缓;吸附12 h后趋于稳定。因此,蒙脱石对甘氨酸的吸附于12 h左右达到平衡。蒙脱石在不同pH条件下对甘氨酸的平衡吸附量如图4所示。当pH为1~3时,蒙脱石对甘氨酸的平衡吸附量较大;当pH为3~5时,蒙脱石对甘氨酸的平衡吸附量较 pH为 1~3有所降低;当pH为5~9时,蒙脱石对甘氨酸的平衡吸附量大大减少,且趋于稳定,表明酸性条件下,蒙脱石对甘氨酸的吸附较佳。且有学者指出在酸性条件下,尤其是pH为3时对蒙脱石吸附甘氨酸最有利[11]。因此,根据上述结果确定了本研究的吸附条件:pH为3,吸附时间为12 h。

图3 蒙脱石对甘氨酸的平衡吸附量随时间变化曲线Fig. 3 Equilibrium adsorption quantity of glycine onto montmorillonite as the function of time

图4 不同初始pH下蒙脱石对甘氨酸的平衡吸附量Fig. 4 Equilibrium adsorption quantity glycine onto montmorillonite at different initial pH values
在蒙脱石对不同浓度甘氨酸的吸附特性研究实验中,图5所示为蒙脱石对不同浓度甘氨酸的平衡吸附量和 Freundlich吸附等温式。 随着甘氨酸浓度升高,蒙脱石对甘氨酸的平衡吸附量逐渐增大,线性相关性较好,线性关系为:y =850.05x-6.089 8,R2=0.97。在甘氨酸浓度范围内(0.01~0.20 mol/L),蒙脱石的平衡吸附量并未达到最大值(图5)。为了明确蒙脱石对甘氨酸的吸附特性,本研究采用Freundlich等温吸附模型对蒙脱石吸附不同浓度甘氨酸进行拟合,公式为logqe=logKf+(1/n)logρe,其中:qe为蒙脱石对甘氨酸的平衡吸附量;Kf为与最大吸附能有关的常数[12]。在所研究浓度范围内,蒙脱石对甘氨酸的吸附基本符合Freundlich等温吸附模型,其中log Kf=-3.85,n=0.67,R2=0.91。该吸附实验结果与RAMOS等[11]对甘氨酸的吸附研究结果(log Kf=-0.18,n=0.69,R2=0.97)一致,表明在所研究的甘氨酸浓度范围内蒙脱石对甘氨酸的吸附机制相同。但PARBHAKAR等[4]在对蒙脱石吸附赖氨酸的研究中发现,在较低赖氨酸浓度(0.025 mol/L)下,蒙脱石对赖氨酸的吸附不符合Freundlich等温吸附模型,表明蒙脱石对赖氨酸的吸附与甘氨酸有所差异。

图5 蒙脱石对甘氨酸的等温吸附模型Fig. 5 Isotherm adsorption of glycine on montmorillonite
吸附平衡后溶液体系中蒙脱石层间阳离子解吸和甘氨酸平衡吸附量对比如图6所示。从图6可知:对比分析蒙脱石对甘氨酸的平衡吸附量和反应后溶液体系中层间主要阳离子(Ca2+,Mg2+和K+)解吸情况发现,随着甘氨酸浓度升高,3种主要层间阳离子浓度呈现增加趋势,Ca2+解吸量最多,Mg2+次之,解吸最少的是K+,这可能与3种阳离子在蒙脱石层间的质量分数有关。在甘氨酸的所有处理浓度下,蒙脱石的3种层间阳离子的解吸总量均低于甘氨酸平衡吸附量(图6),表明蒙脱石吸附甘氨酸可能与层间阳离子交换机制有关,而且还必然涉及到一些其他机制,这与PARBHAKAR等[4]以及RAMOS等[11]的研究结果一致。

图6 蒙脱石层间阳离子解吸量与甘氨酸平衡吸附量对比Fig. 6 Comparison of cations desorbed from montmorillonite interlayer and equilibrium adsorption quantity of glycine
另外,蒙脱石与不同浓度甘氨酸吸附平衡后溶液体系pH变化如表1所示。甘氨酸溶液初始pH约为3,吸附平衡之后,不同甘氨酸浓度下pH均有所升高。溶液体系pH增大是H+与蒙脱石层间阳离子发生交换的直接证据。相关研究证实蒙脱石吸附氨基酸可以通过蒙脱石表面与氨基酸间的静电相互作用、与氨基酸两性离子间的氢键作用力或通过阳离子交换等机制实现[8]。本研究中层间阳离子的解吸暗示蒙脱石吸附氨基酸可能是通过阳离子交换机制,因为在pH为3时,甘氨酸主要以正离子形式存在(图2)。但是阳离子解吸总量低于甘氨酸平衡吸附量,一方面是因为能与蒙脱石层间阳离子发生交换的不只是甘氨酸正离子,还有可能是溶液体系中的H+;另一方面,3种阳离子的解吸总量与被吸附甘氨酸不同表明层间阳离子交换机制并不是蒙脱石吸附甘氨酸的惟一方式,还可能通过端面吸附的方式,这在蒙脱石吸附甘氨酸的ATR-FTIR分析中将得到证实。另外,也有相关研究发现蒙脱石对甘氨酸的吸附可能存在阳离子交换和端面吸附2种方式[11]。

表1 蒙脱石吸附甘氨酸前后溶液的pH变化Table 1 pH value of suspensions of montmorillonite in glycine solutions before and after adsorption
2.2蒙脱石的XRD分析
图7所示为蒙脱石与不同浓度甘氨酸作用后XRD变化图。不同初始浓度甘氨酸与蒙脱石吸附平衡后,同对照组相比,处理组蒙脱石d(001)峰的强度、位置和形状都与甘氨酸初始浓度密切相关(图7)。
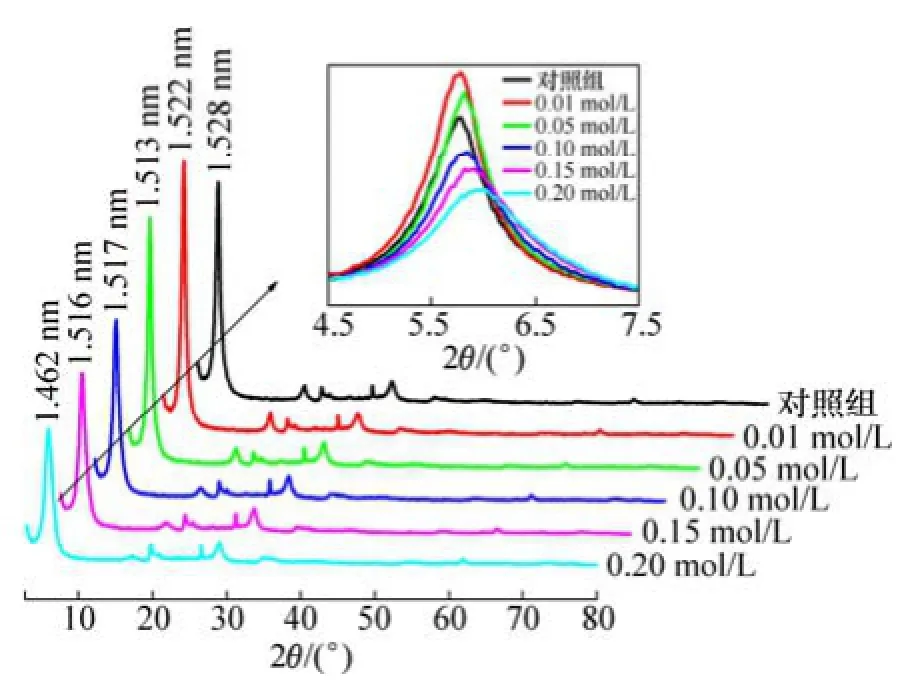
图7 蒙脱石与不同浓度甘氨酸作用后XRD图谱Fig. 7 XRD patterns of glycine adsorbed on montmorillonite at different glycine concentrations
随着甘氨酸初始浓度增加,d(001)由对照组的1.528 nm减小到1.446 nm,表明蒙脱石吸附甘氨酸后层间距减小;且蒙脱石的d(001)衍射峰位随甘氨酸浓度增加均往高角度方向偏移(由5.78°偏移至6.04°),衍射角变大反映出蒙脱石晶面间距有所减小。当甘氨酸浓度较低(0.01和0.05 mol/L) 时,吸附平衡后蒙脱石的 d(001)峰强度明显增强;当甘氨酸浓度大于0.1 mol/L时,蒙脱石的d(001)衍射峰强度明显降低,同时半高峰较对照组明显增大,说明低浓度和高浓度甘氨酸对蒙脱石d(001)峰的影响存在差异,较高浓度的甘氨酸处理下蒙脱石的晶面间距发生了变化,反映出晶格畸变引起的结晶度下降现象。
蒙脱石吸附甘氨酸后使其自身结构发生了一定程度的改变。一方面,d(001)变小是由于甘氨酸溶液中H+与晶层层间域中可交换阳离子发生交换作用[13]。因为H+半径小于K+和Ca2+等阳离子半径,因而发生阳离子交换后蒙脱石的晶层厚度减小[14]。另一方面,有研究表明氨等小分子在蒙脱石表面吸附后,将取代蒙脱石的物理吸附水,由于氨分子动力学直径(0.26 nm)小于水分子直径(0.40 nm),导致层间距减小,d(001)降低[15]。因此,甘氨酸被蒙脱石吸附后可能进入了蒙脱石层间取代水分子,由于甘氨酸分子动力学直径与水分子直径(0.40 nm)相近,所以,对蒙脱石晶层厚度的改变不明显。王生新等[16]研究发现蒙脱石在吸附之后,晶层间距未增大,说明胶粒吸附在晶层端面。因此,本研究也有可能由于蒙脱石对甘氨酸的吸附以端面吸附为主,而甘氨酸对蒙脱石层间阳离子的交换吸附为辅,从而对晶层厚度的改变也有限。
2.3蒙脱石吸附甘氨酸的ATR-FTIR分析
为了进一步揭示甘氨酸与蒙脱石相互作用的本质,对比分析了甘氨酸在水溶液和被吸附到蒙脱石上的基团变化情况。
图8(a)所示为甘氨酸水溶液在 pH为 4.33,6.18和8.07下测得的ATR-FTIR图谱;图8(b)所示为在对应pH处理下蒙脱石吸附甘氨酸的ATR-FTIR图谱。在不同pH下,甘氨酸在水溶液中的ATR吸收峰型非常相似,这是因为在所研究的 pH范围内,甘氨酸的热力学解离状态主要是以甘氨酸两性离子形式存在(图2)。表2所示为本研究对甘氨酸的基团解谱对比。

图8 蒙脱石与不同pH甘氨酸相互作用的FTIR-ATR分析Fig. 8 ATR-FTIR spectra of glycine interacting with montmorillonite at different pH values

表2 水溶液中氨基酸和蒙脱石吸附氨基酸在1 800~1 200 cm-1范围的红外吸收Table 2 Assignments of main aqueous and adsorbed glycine IR bands in 1 800~1 200 cm-1region 波数/cm-1
由图8可知:蒙脱石吸附的甘氨酸的ATR图谱8(b)中的吸收峰型与甘氨酸水溶液图8(a)很相似,表明甘氨酸两性离子被吸附到了蒙脱石上。对比分析图8(a)和图8(b)可见:蒙脱石吸附的甘氨酸相应吸收峰位发生了明显偏移,这是甘氨酸与蒙脱石发生吸附作用的直接证据。在不同pH条件下,δs(NH3)由1 508 cm-1偏移到较高波数1 516 cm-1,表明甘氨酸的质子化氨基与蒙脱石之间存在相互作用;υas(COO-)由 1 616 cm-1偏移到低波数1 606 cm-1以及υs(COO-)由1 414 cm-1偏移到1 412 cm-1,反映了甘氨酸去质子化的羧基与蒙脱石之间存在吸附作用。这一结果与一些黏土矿物对其他氨基酸吸附研究的FTIR分析结果一致[17]。目前针对蒙脱石与氨基酸相互作用的研究认为:氨基酸能通过 NH3+与蒙脱石层间基面氧原子上的残余负电荷由于库仑力而形成氢键,发生相互作用[4]。本研究中被吸附到蒙脱石上的甘氨酸ATR-FTIR光谱中主要基团的对应峰位发生的变化再次验证了上述相互作用机制。δs(NH3)由1 508 cm-1偏移到较高波数1 516 cm-1是氨基与蒙脱石层间基面氧原子存在吸附作用的直接证据,也有关于石英吸附甘氨酸的相关研究表明,二者的吸附机制在于甘氨酸的氨基与石英表面基团形成了氢键[18]。另外也有研究表明,蒙脱石对氨基酸的吸附在较低浓度(0.15 mmol/L)下主要是端面吸附,在高浓度时端面吸附达饱和后,还存在阳离子交换吸附机制[11]。
本研究的平衡吸附量与层间阳离子解吸量不一致已证实阳离子交换并不是吸附的惟一机制。而在ATR-FTIR结果中,υas(COO-)由1 616 cm-1偏移到低波数1 606 cm-1以及υs(COO-)由1 414 cm-1偏移到1 412 cm-1,这一现象是甘氨酸通过去质子化的COO-与蒙脱石发生端面吸附作用的直接体现。酸性体系中COO-能和蒙脱石端面发生吸附主要取决于2个因素:1) 产生于蒙脱石硅氧四面体片的基面和硅氧四面体片、铝氧八面体片的端面破键正电荷;2) 铝氧八面体片中离子离解形成的正电荷。故甘氨酸两性离子能与蒙脱石带正电的端面因静电作用力发生吸附作用。且RAMOS等[11, 19]已证实静电作用主要产生于COO-与之间。
此外,从图8(b)可见:当pH为4.33时,在1 262 cm-1处存在吸收峰,该吸收峰为羧基中COH的变形振动δ(COH)。该振动只有在羧基为质子化形式时才会出现,表明尽管在pH为4.33时甘氨酸的解离形态为正离子的存在形式极少(图2),但是被吸附到蒙脱石上的甘氨酸也有正离子形式。结合δs(NH3)由1 508 cm-1偏移到较高波数1 516 cm-1可推断,甘氨酸正离子由于氨基质子化使其成为正一价离子而进入了蒙脱石层间域中,进一步为甘氨酸通过阳离子交换被吸附到蒙脱石层间提供了证据。
因此,蒙脱石吸附甘氨酸主要是通过甘氨酸的氨基和羧基实现。图9所示为蒙脱石与水溶液中甘氨酸相互作用示意图(忽略比例和定量关系)。二者的相互作用较复杂,蒙脱石对甘氨酸两性离子存在端面吸附,主要通过 COO-与蒙脱石端面正电基团之间的静电作用力实现;甘氨酸正离子与蒙脱石层间阳离子也存在交换吸附,正离子进入蒙脱石层间后主要是通过NH3+与蒙脱石层间基面氧原子形成氢键进行吸附。此外,溶液体系中还存在着H+与层间阳离子的交换效应,这也就增加了对自然界中蒙脱石吸附氨基酸的定量研究难度。另外,常温条件下没有发现甘氨酸低聚反应的发生。因为在ATR-FTIR结果中,并未观察到酰胺键的存在,说明蒙脱石吸附甘氨酸后没有肽键出现。这表明:在一般条件下即使有黏土矿物的参与,氨基酸的聚合也较难发生。BUJDAK等[20]采用不同成分的黏土矿物研究了一些氨基酸的聚合,结果发现只有质量分数为 1.5%的甘氨酸在蒙脱石的参与下发生了聚合反应,因此,氨基酸在一般条件下聚合率很低。
3 结论
1) 在甘氨酸浓度0.01~0.20 mol/L范围内,蒙脱石对甘氨酸的吸附随甘氨酸浓度增加而增加,呈现出较好的线性关系,且符合Freundlich等温吸附模型。
2) 蒙脱石吸附甘氨酸后,其层间距减小、d(001)峰位发生偏移主要因为 H+的阳离子交换效应对蒙脱石d(001)减小的影响强于甘氨酸阳离子交换对层间吸附水的取代效应。
3) 蒙脱石对甘氨酸的宏观吸附、蒙脱石XRD分析以及ATR-FTIR结果证实蒙脱石对甘氨酸的吸附机制有2种:一个是对甘氨酸两性离子的端面吸附机制,通过 COO-与蒙脱石端面正电基团之间的静电作用力实现;另一个是甘氨酸正离子与蒙脱石层间阳离子的交换吸附机制,通过NH3+与蒙脱石层间基面氧原子形成氢键进行吸附。
4) 蒙脱石对甘氨酸的吸附实验揭示了自然界中黏土矿物的存在对可溶性游离氨基酸的分布和迁移具有重要影响。

图9 蒙脱石与水溶液中甘氨酸相互作用示意图Fig. 9 Schematic diagram of montmorillonite/glycine interaction in aqueous solutions
[1] HEDGES J I, HARE P E. Amino acid adsorption by clay minerals in distilled water[J]. Geochimica et Cosmochimica Acta,1987, 51(2): 255-259.
[2] SENWO Z N, TABATABAI M A. Amino acid composition of soil organic matter[J]. Biology and Fertility of Soils, 1998, 26(3):235-242.
[3] LAMBERT J F. Adsorption and polymerization of amino acids on mineral surfaces: a review[J]. Origins of Life and Evolution of the Biosphere, 2008, 38(3): 211-242.
[4] PARBHAKAR A, CUADROS J, SEPHTON M A, et al. Adsorption of L-lysine on montmorillonite[J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2007, 307:142-149.
[5] RAMOS M E, HUERTAS F J. Adsorption of lactate and citrate on montmorillonite in aqueous solutions[J]. Applied Clay Science, 2014, 90: 27-34.
[6] TAKANO Y, HORIUCHI T, MARUMO K, et al. Vertical distribution of amino acids and chiral ratios in deep sea hydrothermal sub-vents of the Suiyo Seamount, Izu-Bonin Arc,Pacific Ocean[J]. Organic Geochemistry, 2004, 35(10):1105-1120.
[7] CUADROS J, ALDEGA L, VETTERLEIN J, et al. Reactions of lysine with montmorillonite at 80 ℃: implications for optical activity, H+transfer and lysine-montmorillonite binding[J]. Journal of Colloid and Interface Science, 2009, 333(1): 78-84.
[8] KITADAI N, YOKOYAMA T, NAKASHIMA S. In situ ATR-IR investigation of L-lysine adsorption on montmorillonite[J]. Journal of Colloid and Interface Science, 2009, 338(2): 395-401.
[9] DASHMAN T, STOTZKY G. Physical properties of homoionic montmorillonite and kaolinite complexed with amino acids and peptides[J]. Soil Biology and Biochemistry, 1985, 17(2):189-195.
[10] 杨远帆, 倪辉, 吴黎明. 茚三酮法测定蜂蜜及果葡糖浆中的氨基酸含量[J]. 中国食品学报, 2013, 13(2): 171-176. YANG Yuanfan, NI Hui, WU Liming. Determination of amino acid in honey and high fructose corn syrup (HFCS) by the method of ninhydrin colorization[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(2): 171-176.
[11] RAMOS M E, HUERTAS F J. Adsorption of glycine on montmorillonite in aqueous solutions[J]. Applied Clay Science,2013, 80/81(8): 10-17.
[12] 冯其明, 王倩, 刘琨, 等. 纤蛇纹石吸附Cu(Ⅱ)的动力学及热力学研究[J]. 中南大学学报(自然科学版), 2011, 42(11):3225-3231. FENG Qiming, WANG Qian, LIU Kun, et al. Adsorption kinetics and thermodynamics of copper (Ⅱ) on chrysotile[J]. Journal of Central South University (Science and Technology),2011, 42(11): 3225-3231.
[13] BIBI I, SINGH B, SILVESTER E. Dissolution of illite in saline-acidic solutions at 25 ℃[J]. Geochimica et Cosmochimica Acta, 2011, 75(11): 3237-3249.
[14] NIETO F, MELLINI M, ABAD I. The role of H3O+in the crystal structure of illite[J]. Clays and Clay Minerals, 2010, 58(2):238-246.
[15] 刘冬, 袁鹏, 刘红梅, 等. 利用氨吸附漫反射红外光谱法探测蒙脱石的固体酸性[J]. 矿物学报, 2010, 30(1): 33-39. LIU Dong, YUAN Peng, LIU Hongmei, et al. A Study on the acidity of montmorillonite by using ammonia DRIFT spectroscopy[J]. Acta Mineralogica Sinica, 2010, 30(1): 33-39.
[16] 王生新, 吕擎峰, 王得楷, 等. 水玻璃固化黏土矿物的试验研究[J]. 中南大学学报(自然科学版), 2013, 44(7): 2656-2662. WANG Shengxin, LÜ Qingfeng, WANG Dekai, et al. Experimental study of clay minerals solidified by sodium silicate[J]. Journal of Central South University (Science and Technology), 2013, 44(7): 2656-2662.
[17] BENETOLI L O B, DE SOUZA C M D, DA SILVA K L, et al. Amino acid interaction with and adsorption on clays: FT-IR and Mossbauer spectroscopy and X-ray diffractometry investigations[J]. Origins of Life and Evolution of Biospheres,2007, 37(6): 479-493.
[18] STIEVANO L, PIAO L Y, LOPES I, et al. Glycine and lysine adsorption and reactivity on the surface of amorphous silica[J]. European Journal of Mineralogy, 2007, 19(3): 321-331.
[19] ROZALÉN M, BRADY P V, HUERTAS F J. Surface chemistry of K-montmorillonite: ionic strength, temperature dependence and dissolution kinetics[J]. Journal of Colloid and Interface Science, 2009, 333(2): 474-484.
[20] BUJDAK J, RODE B M. The effect of smectite composition on the catalysis of peptide bond formation[J]. Journal of Molecular Evolution, 1996, 43(4): 326-333.
(编辑 罗金花)
Adsorption characteristics and mechanism of glycine on montmorillonite in aqueous solutions
GUO Yuting1, DONG Faqin2, LIU Mingxue1, QIN Yonglian2, ZHOU Qing2,WU Chuanlong3, ZONG Meirong2, HUANG Ting1, LIU Yuanyuan1
(1. School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang 621010, China;2. Key Laboratory of Solid Waste Treatment and Resource Recycle of Ministry of Education,Southwest University of Science and Technology, Mianyang 621010, China;3. School of Materials Science and Engineering,Southwest University of Science and Technology, Mianyang 621010, China)
Adsorption characteristics and mechanism of different concentrations of glycines adsorbed on the surface of montmorillonite from aqueous solutions were studied. The reaction products were characterized using X-ray diffraction (XRD) and attenuated total reflectance Fourier-transform infrared (ATR-FTIR) spectroscopy and inductively coupled plasma-atomic emission spectrometry (ICP-AES). The results show that the equilibrium amount of glycine adsorbed by montmorillonite increases with the variable glycine concentrations from 0.01 to 0.20 mol/L. And the dependence of glycine adsorption with its aqueous concentration fits for a Freundlich equation at the studied concentration range of glycine. The total amount of the desorbed interlayer cations is less than the equilibrium amount of glycine adsorbed by montmorillonite, and the cation exchange reaction produces a decrease of the montmorillonite interlayer space from1.528 to 1.446 nm, demonstrating that the glycine adsorbed by montmorillonite mainly through cation exchange mechanism, but the cation exchange is not the only adsorption way. ATR-FTIR results confirm two adsorption mechanisms, one is the glycine cation exchange through hydrogen bonding between thegroup and the basal oxygen of the interlayer surface, and the other mechanism is edge adsorption by electrostatic force between the COO-group and the positively charged groups at the edge surface of montmorillonite.
montmorillonite; glycine; edge adsorption; cation exchange; attenuated total reflection Fourier-transform infrared spectroscopy
P575.4;P592
A
1672-7207(2016)04-1092-08
10.11817/j.issn.1672-7207.2016.04.002
2015-04-13;
2015-06-20
国家自然科学基金资助项目(41130746,41272371);国家重点基础研究发展规划(973计划)项目(2014CB46003);西南科技大学研究生创新基金资助项目(14ycx073)(Projects (41130746, 41272371) supported by the National Natural Science Foundation of China;Project (2014CB46003) supported by the National Basic Research Development Program (973 Program) of China; Project (14ycx073) supported by Postgraduate Innovation Fund Project by Southwest University of Science and Technology)
董发勤,教授,博士生导师,从事生态环境材料、矿物环境研究;E-mail:fqdong@swust.edu.cn

