AtDME1化学诱导表达载体的构建及其瞬时表达1)
常英英 高亚南 梁立雄 丁昌俊 苏晓华 张冰玉
(国家林业局林木培育重点实验室(中国林业科学研究院林业研究所),北京,100091)
AtDME1化学诱导表达载体的构建及其瞬时表达1)
常英英高亚南梁立雄丁昌俊苏晓华张冰玉
(国家林业局林木培育重点实验室(中国林业科学研究院林业研究所),北京,100091)
以拟南芥去甲基化转移酶基因DME1为目的基因,采用酶切、连接和重组反应的方法构建了以17-β-雌二醇为诱导剂的植物表达载体pER8-DME1。将其转入农杆菌LBA4404菌株中,通过烟草瞬时表达技术,对该载体的诱导表达特性进行了研究。qPCR结果表明,较低浓度的17-β-雌二醇处理能够有效调控pER8-DME1中目的基因的表达,诱导处理后目的基因表达量逐渐升高,在12 h后达到最高,之后缓慢下降。该载体的成功构建为深入研究DNA去甲基化与植物的生殖发育调控奠定了基础。
pER8-DME1;17-β-雌二醇;化学诱导表达载体;瞬时表达
Dethylansferase geneDME1 fromArabidopsisthalialawas used as the target gene, and digestion, ligation and recombination reaction methods were applied for constructing the plant expression vector pER8-DME1, which could be induced by 17-β-estradiol. The vector was transferred toAgrobacteriumtumefaciensLBA4404, and the inducible expression characteristics were verified by the transient expression system ofNicotianatabacum. By qPCR, low concentration of 17-β-estradiol could be effective for the expression of the target gene in pER8-DME1 vector. The expression level ofDME1 gene gradually increased with 17-β-estradiol treating time and reached the highest level at 12 h.
DNA甲基化是一种重要的表观遗传修饰,在生物体内相对稳定且可遗传,参与了多种生物学过程,如胚胎发育、细胞分化、基因组印记、基因的表达调控等[1-4]。DNA甲基化的模式和水平主要靠DNA甲基化转移酶和去甲基化酶的作用调节。目前的研究表明,植物中的甲基化转移酶主要有甲基化转移酶1(MET1)[5]、结构域重排甲基转移酶(DRM)[6]和染色质甲基化酶(CMT3)[7]3类;植物DNA去甲基化酶包括DME、ROS1、DML2和DML3等4个家族,它们均含有最保守的DNA糖基化酶结构域[8-10]。DNA去甲基化酶通过碱基切除修复机制在DNA主动去甲基化中发挥作用,其中,DME是双功能团的糖苷酶,具有DNA糖基化酶和AP(apurillic/apyrimidinic)裂解酶活性,最终使5-甲基胞嘧啶(5mC)被胞嘧啶代替[11-12]。目前,仅在双子叶植物中发现DME,其主要在雌配子体的中央细胞和助细胞中优先表达[13]。此外,DME也在拟南芥胚乳发育过程基因组印记建立中发挥作用。IKEDA et al.[14]在拟南芥的种子发育阶段发现,DME在中央细胞中的特异性表达,使印记基因FAW、MEA、MPC和FIS2等发生去甲基化,导致受精后胚乳的甲基化水平降低,从而建立了胚和胚乳的发育之间甲基化的不对称结构。与甲基化酶基因相比,DME基因在植物生长发育中的作用研究还有待于进一步深入。
化学诱导表达系统是研究基因功能的有效手段之一[16]。其中,类固醇激活系统是基于糖皮质激素受体、雌激素受体等建立的较为精密化学诱导表达系统,其主要是通过糖皮质激素受体、雌激素受体作为转录激活因子与融合启动子结合,来调控下游基因的表达。当类固醇存在时,受体从细胞质中的热休克蛋白90(HSP90)中解离出来,转移到细胞核中,并与融合启动子结合,激活目的基因的表达。2000年,ZUO et al.[17]构建了雌激素激活表达系统(XVE系统),该系统能够精密的调控下游基因的表达,并且对植物没有毒害作用,是研究基因功能的理想工具。本研究以拟南芥甲基化转移酶基因DME1为目的基因,构建了以17-β-雌二醇为诱导剂的XVE系统载体pER8-DME1,将其转入农杆菌LBA4404菌株中,通过烟草瞬时表达,对该载体的诱导表达特性进行了研究,为研究DNA甲基化与表型变化之间的相互关系奠定了基础。
1 材料与方法
烟草(NicotianatabacumL.)由中国林业科学研究院林业研究所卢孟柱课题组馈赠。播种于土壤中,并将其放入人工气候培养箱中培养(温度(26±1)℃、光照16 h·d-1、光强50 μmol·m-2·s-1)。60 d后用于农杆菌介导的基因瞬时表达。
含有雌二醇诱导型启动子的pER8-GFP质粒由Nam. Hai Chua博士(The Rockefeller University, USA)赠送,含拟南芥DME1基因cDNA的pET30b-DME1质粒由Roldán-Arjona博士(Universidad de Córdoba,Spain)赠送。农杆菌LBA4404为本实验室保存。
1.1DME1诱导表达载体构建
DME1基因cDNA全长为5 964 bp,将其分成3段D3、D1-1和D1-2,用酶切、连接结合重组反应的方法将DME1基因整合到pER8载体中。PCR反应的引物见表1,下划线分别为XhoⅠ和SpeⅠ的识别位点。
注:下划线分别为XhoⅠ和SpeⅠ的识别位点。
以pET30b-DME1质粒为模版,用DME1全长引物(DME1-F、DME1-R)PCR扩增DME1基因的cDNA全长。采用TA克隆的方法将DME1重组到pMDTM19-T Vector(Takara公司,日本)。转化E.coliDH5α,经过蓝白斑筛选,挑取阳性克隆进行序列测定。
用XhoⅠ和SpeⅠ(NEB公司,美国)双酶切pMD19-T-DME1和pER8-GFP,酶切回收的D3片段和pER8线性片段,用T4 DAN酶(NEB公司,美国)连接,转化大肠杆菌后挑取单克隆进行PCR检测,所用引物为pER8载多克隆位点通用引物pXhoⅠ-F和pSpeⅠ-R,获得中间载体pER8-D3(图1)。并用XhoⅠ单酶切pER8-D3质粒,获得线性化的pER8-D3备用。
以pET30b-DME1质粒为模版,分别以D1-1F、D1-1F和D1-2F、D1-2F为引物,扩增D1-1和D1-2片段,分别纯化后,按照无缝连接试剂盒的说明书的方法,与线性化的pER8-D3片段混合,进行重组反应。将全部重组混合物转化大肠杆菌感受态,在琼脂培养板经过抗性筛选,阳性克隆PCR验证后提取质粒,最终获得pER8-DME1载体(图2)。
1.2pER8-DME1载体的诱导表达特性
烟草的处理方法:用电击法分别将质粒pER8-GFP、pER8-DME1转入农杆菌LBA4404,得到1#和2#菌株;在含Rif(50 mg/L)和Spectinomycin(50 mg/L)的YEP培养基中培养,于28 ℃,200 r/min培养直至OD600为0.4~0.6。先用1#农杆菌注射烟草叶片,26 ℃控湿培养箱中培养12 h,再用17-β-雌二醇涂抹烟草叶面,浓度处理分别为0、0.08、0.2、1、5、25、50、100和200 μmol/L,12 h之后打孔取叶片,每个处理3次重复,每次重复约取样100 mg,立即投入液氮中,保存于-80 ℃冰箱中。以50 μmol/L 17-β-雌二醇处理烟草叶面,本别于0、0.5、1、3、6、12、24、48、96 h后取样。
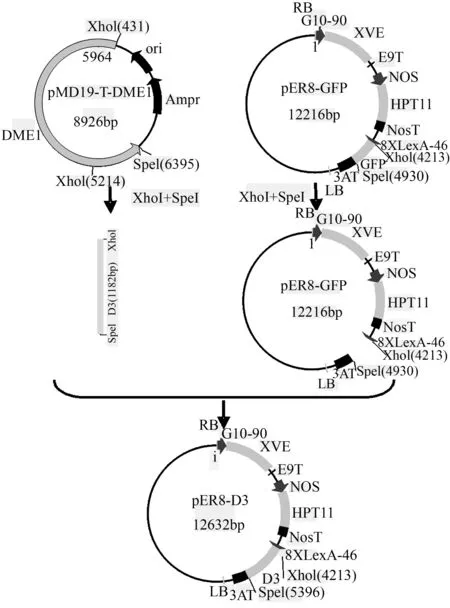
图1 中间载体pER8-D3的构建
用2#农杆菌注射烟草叶片,共培养12 h后用17-β-雌二醇涂抹烟草叶面,浓度处理为0、1、25、50、100、和200 μmol/L,继续培养12 h之后取样。采用筛选出DME1基因的最佳17-β-雌二醇浓度,以涂抹的方法处理烟草叶面,处理时间分别为0、1、6、12、24和48 h,取样及保存方法同上。该材料用于检测pER8-DME1载体中DME1基因的诱导表达情况。
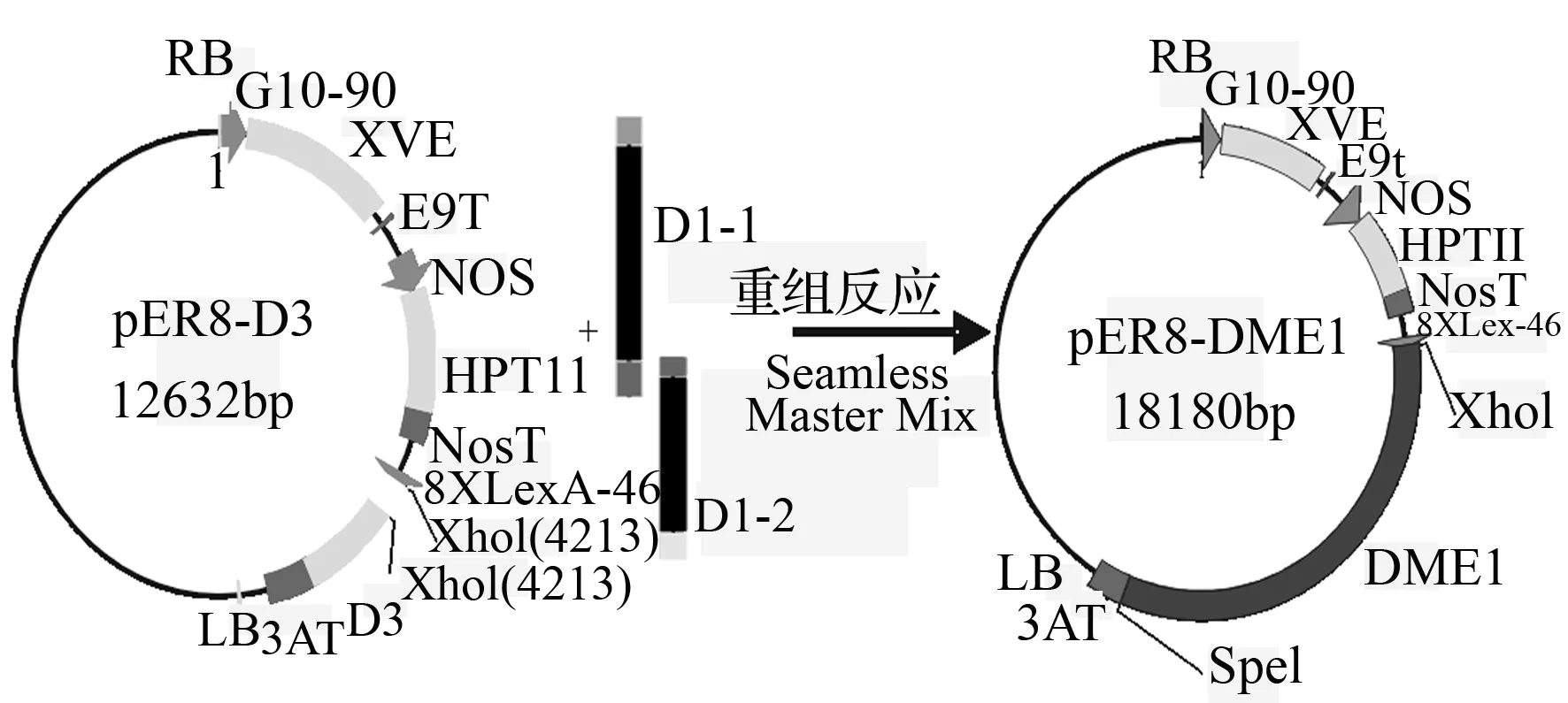
图2 融合载体pER8-DME1的构建
总RNA提取及cDNA合成:使用Qiagen公司RNeasy Plant Mini Kit试剂盒提取不同处理的叶片总RNA,用NaNo Drop 8000分光光度计测RNA的浓度和纯度。采用Reverse transcriptase-PCR方法合成cDNA具体反应过程参照Promega公司的说明书进行。
实时定量PCR反应:以获得的不同处理的cDNA稀释20倍的反转录产物为模板,采用Roche LightCycle 480Ⅱ型荧光定量PCR仪进行qRT-PCR反应。以actin为内参基因序列(定量引物为5’-T GTGTTGGACTCTGGTGATG-3’和5’-CGCTCGGTA-
AGGATCTTCATC-3’),DME1基因qPCR引物为:5’-TGTGGGTATGGTAAATGGTCC-3’和5’-AAAGAGGCTTGTT ACACGCTG-3’,GFP基因qPCR引物为:5’-TGTTCCATGGCCAACACTTG-3’和5’-ACGTGTCTTG TAGTTCCCGT-3’。应用2-ΔΔCt算法进行分析[18]。
2 结果与分析
2.1诱导表达载体pER8-DME1的构建
2.1.1pER8-D3中间载体的构建
用DME1全长引物扩增pET30b-DME1质粒,获得了长度为5 964 bp的DME1基因cDNA全长。用TA克隆的方法把DME1序列连入T载体中,转化大肠杆菌进行蓝白班筛选,挑取6个单克隆PCR检测,其中2个为阳性克隆,扩增产物片段大小为5 964 bp(图3A)。将其中一个阳性克隆送至上海美吉测序,结果与GenBank中DME1的序列一致。提取pMDTM19-T-DME1质粒后用XhoⅠ和SpeⅠ进行双酶切,将DME1切成2个小片段D1和D3,片段大小分别为4 782 bp和1 182 bp(图3B)。将D3片段连入pER8载体中,获得的pER8-D3中间载体构,用pXhoⅠ-F和pSpeⅠ-R引物PCR验证,扩增片段与D3大小相等(图3C)。

A.pMDTM19-DME1的PCR检测(M:1 kb Marker,1-6:6个单克隆的PCR电泳结果);B.T-DME1质粒双酶切(M:1 kb Marker,1:D3片段1 182 bp,2:pMDTM19-T vector线性片段,3:D1(D1-1+D1-2)片段4 782 bp);C.pER8-D3中间载体的PCR检测(M:1 kb Marker,水:以H2O为模板的PCR产物,pD3:以pER8-D3质粒为模板的PCR产物)。
图3pER8-D3中间载体构建
2.1.2pER8-DME1载体的构建
根据无缝连接试剂盒反应原理设计D1片段的分段PCR引物,PCR扩增获得D1片段的两个小片段D1-1(2 812 bp)和D1-2(1 982 bp)。将胶回收的D1-1、D1-2以及pER8-D3线性片段与无缝连接试剂盒中Seamless Master Mix混合,反应后经大肠杆菌转化和抗性筛选,提取重组质粒,以pXhoⅠ-F和pSpeⅠ-R引物进行PCR验证,PCR产物大小约为6 006 bp,与DME1加引物序列的长度相符(图4)。质粒测序结果表明,pER8-DME1中DME1序列正确,插入位点准确无误,载体构建成功。
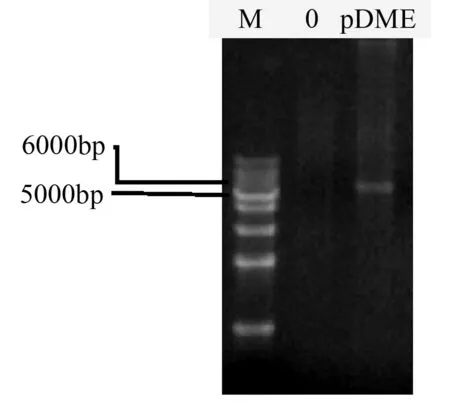
M.1 kb Marker;0.以H2O为模板的PCR产物;pDME.以pER8-DME1质粒为模版的PCR产物。
图4重组质粒pER8-DME1的PCR验证
2.2化学诱导表达载体中DME1的诱导表达特性
2.2.1最佳诱导剂浓度及诱导时间的确定
将含有pER8-GFP质粒的LBA4404菌株注射到烟草中,共培养12 h后检测不同浓度17-β-雌二醇处理下GFP基因的表达情况。结果表明,17-β-雌二醇能有效诱导烟草瞬时表达系统中GFP的表达,随着17-β-雌二醇浓度增加,GFP的表达量逐渐增加。17-β-雌二醇浓度为0.2 μmol/L即可检测到GFP基因的表达,25 μmol/L时GFP基因的表达量显著增加,浓度达到100 μmol/L后,GFP的表达量增加趋势趋于平缓,因此,我们确定有效诱导剂浓度为5~50 μmol/L(表2)。
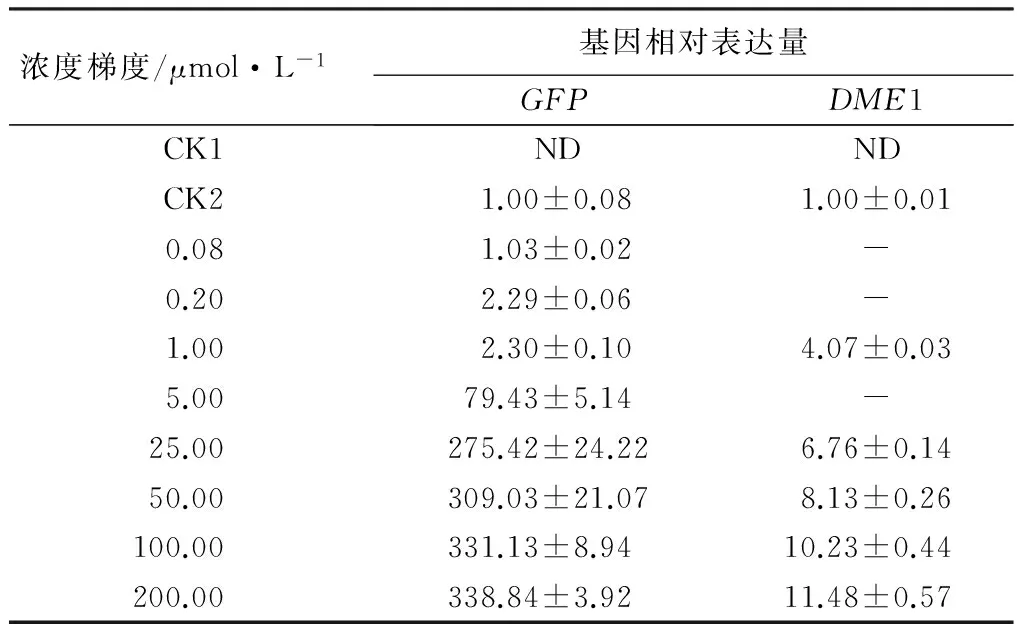
表2 在不同浓度17-β-雌二醇诱导后基因的相对表达量
注:CK1为未注射农杆菌,CK2为没有进行诱导处理;ND为未检到荧光信号;表中表达量的数值为2-ΔΔCt的平均值±标准差。
我们采用qPCR方法检测了在烟草瞬时表达体系中XVE系统的目的基因表达水平随17-β-雌二醇处理时间变化的趋势。结果表明,1 h时即能检测到诱导表达,随着17-β-雌二醇处理时间的增加,GFP的表达量逐渐增加,6 h时GFP的表达量显著增加,12 h时表达量最大,之后逐渐降低(表3)。
2.2.2植物表达载体pER8-DME1中DME1的诱导表达特性
在此基础上,我们采用烟草瞬时表达体系对构建好DME1基因的植物化学诱导表达系统的诱导特性进行了研究。结果表明,1~200 μmol/L的浓度范围内,17-β-雌二醇能够有效诱导DME1的表达,并且随着17-β-雌二醇浓度增加,DME1的表达量逐渐增加,17-β-雌二醇浓达到100 μmol/L后,DME1的表达量进入平台期(表2)。因此,较低浓度的17-β-雌二醇也能有效诱导外源基因的表达,说明该载体对诱导剂的反应较为灵敏。但在同样浓度条件下,DME1的表达量比GFP要低。
在100 μmol/L的17-β-雌二醇处理下,烟草叶片中DME1的表达量随处理时间而逐渐增加,处理1 h后DME1即有少量表达,6 h后表达量略有上升,在处理12 h后表达量达到最高,之后缓慢下降(表3)。其表达模式与GFP相似,但表达量较GFP要低。
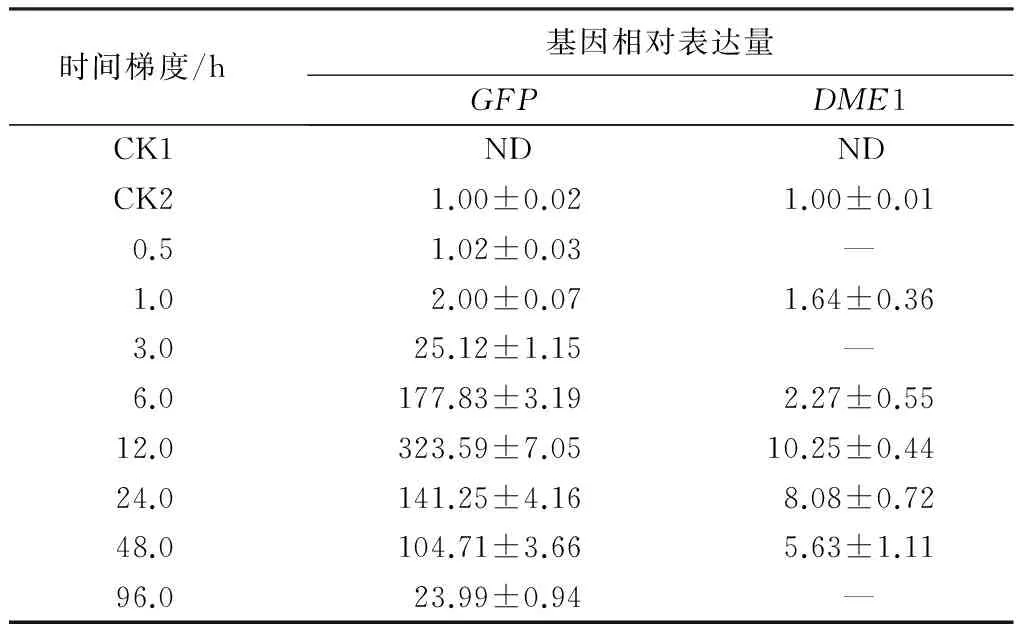
表3 17-β-雌二醇在不同处理时间后基因的相对表达量
注:CK1为未注射农杆菌,CK2为没有进行诱导处理;ND为未检到荧光信号;表中表达量的数值为2-ΔΔCt的平均值±标准差。
3 结论与讨论
为了更加深入研究AtDME1基因在植物DNA去甲基化过程中的作用,选用雌激素激活系统构建了受17-β-雌二醇诱导表达的pER8-DME1双元载体,并利用烟草的瞬时表达技术和qRT-PCR技术,检测了该系统中DME1随17-β-雌二醇处理条件变化的趋势。研究结果表明,较低浓度的17-β-雌二醇即能有效诱导DME1的表达,处理12 h后表达量最高。ZUO et al[17]在拟南芥转基因植株中研究发现,17-β-雌二醇处理浓度为5 μmol/L、处理时间为24 h时,XVE系统中目的基因表达量最大。而本研究中17-β-雌二醇浓度提高到50~100 μmol/L时,目的基因表达量才能达到最大,可能是因为本研究中诱导剂处理的方法为叶片涂抹法,诱导剂容易挥发,导致处理浓度降低;而拟南芥转基因研究中诱导剂处理的方法为根部吸收,这能为植物提供稳定的诱导条件[19]。本研究中17-β-雌二醇处理12 h后即可诱导目的基因的表达水平达到最高,原因可能是恒定表达与瞬时表达方法不同导致的。本研究还发现,雌激素激活系统对GFP基因和对DME1基因的调控水平也有差异,可能是由于基因片段大小不同导致转化效率的差异[20]。
植物中DNA甲基化以5—甲基胞嘧啶(5-methylcytisine)为主,DNA甲基化酶和去甲基化酶的协同作用维系甲基化模式和水平的相对稳定。目前,在植物中对DNA主动去甲基化的调控机制已经比较清楚[21]。然而DNA去甲基化酶的作用机理、生物学意义及其在表观遗传变异中发挥的作用仍需要更进一步探索。由于DME1基因在雌蕊、胚乳中的表达量明显高于其他组织[22],说明该基因可能在植物的生殖发育中起作用。本研究成功构建了DME1的化学诱导表达载体pER8-DME1,并采用烟草瞬时表达体系对其诱导表达特性进行了研究,为深入DME1基因在研究植物基因组中的调控表达,特别是其在雌配子体发育过程中的作用奠定了基础。
[1]FINNEGAN E J, PEACOCK W J, DENNIS E S. Reduced DNA methylation inArabidopsisthalianaresults in abnormal plant development[J]. Proceedings of the National Academy of Sciences,1996,93(16):8449-54.
[2]HUANG J J, WANG H H, LIANG W H, et al. Developmental expression ofArabidopsismethyltransferase genes MET1, DRM2, and CMT3[J]. Molecular Biology,2014,48(5):782-789.
[3]LIU R, HOWK A, STAMMITTI L, et al. A DEMETER-like DNA demethylase governs tomato fruit ripening[J]. Proceedings of the National Academy of Sciences,2015,112(34):1-6.
[4]ZILBERMAN D, GEHRING M, TRAN R K, et al. Genome-wide analysis ofArabidopsisthalianaDNA methylation uncovers an interdependence between methylation and transcription[J]. Nature Genetics,2007,39(1):61-69.
[5]FINNEGAN E J, DENNIS E S. Isolation and identificationby sequence homology of a putative cytosine methyltransferase fromArabidopsisthaliana[J]. Nucleic Acids Research,1993,21(10):2383-2388.
[6]JACKSON J P, LINDROTH A M, CAO X, et al. Control of CpNpG DNA methylation by the KRYPTONITE histone H3 methyltransferase[J]. Nature,2002,416:556-560.
[7]SCHMITZ R J, SCHULTZ M D, URICH M A, et al. Patterns of population epigenomic diversity[J]. Nature,2013,495:193-198.
[8]CHOI Y, GEHRING M, JOHNSON L, et al. DEMETER, a DNA glycosylase domain protein, is required for endosperm gene imprinting and seed viability inArabidopsis[J]. Cell,2002,110(1):33-42.
[9]GONG Z Z, RUIZ T M, ARIZA R R, et al. ROS1, a Repressor of TRANscriptional Gene Silencing inArabidopsis, Encodes a DNA Glycosylase/Lyase[J]. Cell,2002,111(6):803-814.
[10]ORTEGA A P, MORALES R T, ARIZA R R, et al. Arabidopsis DEMETER-LIKE proteins DML2 and DML3 are required for appropriate distribution of DNA methylation marks[J]. Plant Molecular Biology,2008,67(6):671-681.
[11]MORALESR T, ORTEGAG A P, PONFERRAD M I, et al. Demeter and repressor of silencing 1 encode 5-methylcytosine DNA glycosylases[J]. Proceedings of the National Academy of Sciences,2006,103(18):6853-6858.
[12]MCCULLOUGH A K, DODSON M L, LLOYD R S. Initiation of base excision repair: glycosylase mechanisms and structures[J]. Annual Review of Biochemistry,1999,68(1):255-285.
[13]ZHANG H, ZHU J K. Active DNA demethylation in plants and animals[J]. Cold Spring Harbor Symposia on Quantitative Biology,2012,37:242-243.
[14]IKEDA Y, KINOSHITA T. DNA demethylation: a lesson from the garden[J]. Chromosoma,2009,118(1):37-41.
[15]HSIEH T F, IBARRA C A, SILVA P, et al. Genome-wide demethylation ofArabidopsisendosperm[J]. Science,2009,324:1451-1454.
[16]张健,徐金相,孔英珍,等.化学诱导激活型拟南芥突变体库的构建及分析[J].遗传学报,2006,32(10):1082-1088.
[17]ZUO J, NIU Q W, CHUA N H. An estrogen receptor-based transactivator XVE mediates highly inducible gene expression in transgenic plants[J]. The Plant Journal,2000,24(2):265-273.
[18]PFAFFL M W, HORGAN G W, DEMPFLE L. Relative expression software tool (REST©) for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J]. Nucleic Acids Research,2002,30(9):36.
[19]MARTIN L, DECOURTEIX M, BADEL E, et al. The zinc finger protein PtaZFP2 negatively controls stem growth and gene expression responsiveness to external mechanical loads in poplar[J]. New Phytologist,2014,203(1):168-181.
[20]朱俊华,竺晓平,温孚江,等.马铃薯Y病毒衣壳蛋白基因片段长度对RNA介导抗病性的影响[J].中国科学:C辑,2004,34(1):23-30.
[21]PENTERMAN J, ZILBERMAN D, HUH J H, et al. DNA demethylation in theArabidopsisgenome[J]. Proceedings of the National Academy of Sciences,2007,104(16):6752-6757.
[22]KINOSHITA T, MIURA A, CHOI Y, et al. One-way control of FWA imprinting inArabidopsisendosperm by DNA methylation[J]. Science,2004,303:521-523.
Constructing A Chemical-inducible Expression Vector ofAtDME1 and Its Transient Expression//
Chang Yingying, Gao Ya’nan, Liang Lixiong, Ding Changjun, Su Xiaohua, Zhang Bingyu
(Key Laboratory of Tree Breeding and Cultivation of State Forestry Administration, Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, P. R. China)//Journal of Northeast Forestry University,2016,44(2):75-79.
pER8-DME1; 17-β-estradiol; Chemical-inducible expression vector; Transient expression
常英英,女,1987年6月生,国家林业局林木培育重点实验室(中国林业科学研究院林业研究所),硕士研究生。E-mail:15510642172@163.com
张冰玉,国家林业局林木培育重点实验室(中国林业科学研究院林业研究所),研究员。E-mail:byzhang@caf.ac.cn。
2015年8月20日。
Q782
1)林木遗传育种国家重点实验室基本科研业务费专项资金课题(TGB2013010);国家高技术研究发展计划(863计划)课题(2013AA102703)。
责任编辑:潘华。

