催乳素对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响
邢媛媛 李大彪 李红磊 于永强 王卫云
(内蒙古农业大学动物科学学院,呼和浩特010018)
催乳素对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响
邢媛媛李大彪*李红磊于永强王卫云
(内蒙古农业大学动物科学学院,呼和浩特010018)
本试验旨在探讨催乳素对奶牛乳腺上皮细胞(BMECs)乳脂和乳蛋白合成相关基因表达的影响。选取中国荷斯坦奶牛BMECs为试验材料,经纯化培养后,培养基中添加不同浓度催乳素[0(对照)、100、300、500和1 000 ng/mL],继续培养24 h。通过四甲基偶氮唑盐(MTT)比色法检测细胞活力;利用试剂盒检测胞内甘油三酯的含量;采用实时定量PCR法检测乳脂和乳蛋白合成相关基因的表达。结果表明:1)催乳素浓度为100、300 ng/mL时,BMECs相对增殖率显著高于对照组与其他试验组(P<0.05)。2)与对照组相比,300 ng/mL催乳素能够显著提高BMECs乙酰辅酶A羧化酶(ACC)、二酰甘油酰基转移酶(DGAT)、脂肪酸结合蛋白3(FABP3)基因表达量及甘油三酯的含量(P<0.05),硬脂酰辅酶A去饱和酶(SCD)、过氧化物酶体增殖物激活受体γ(PPARγ)基因表达量有增加的趋势。3)与对照组相比,100、300 ng/mL催乳素能够显著提高哺乳动物雷帕霉素靶蛋白(mTOR)、催乳素受体(PRLR)基因表达量(P<0.05);300 ng/mL催乳素能显著提高αS1酪蛋白(CSN1S1)基因表达量(P<0.05)。综上所述,100~300 ng/mL的催乳素对BMECs乳脂和乳蛋白合成有较好的促进效果。
奶牛乳腺上皮细胞;催乳素;细胞活力;甘油三酯;乳脂和乳蛋白合成相关基因
催乳素(prolactin,PRL)是一种多肽类激素,与其受体结合后引发催乳素介导的细胞信号转导通路,从而促进乳腺发育,发动并维持泌乳及促进乳脂和乳蛋白合成分泌等功能[1-2]。关于催乳素对泌乳性能的研究前人已经取得了一定的成果。体内研究表明,催乳素对单胃动物和反刍动物都可以刺激乳腺发育和促进泌乳。Wall等[3]连续3周给牛注射少量催乳素(1 μg/kg,2次/d)发现产奶量增加;Plaut等[4]发现催乳素能够增加乳成分中β-乳球蛋白的含量;而给泌乳奶牛注射催乳素抑制剂溴麦角隐亭可使产奶量下降[5]。研究表明,敲除雌性鼠催乳素或催乳素受体(PRLR)基因,乳腺发育停止。催乳素基因缺陷导致产奶量持续降低,48 h内乳腺泌乳细胞数目减少20%~25%[6]。泌乳期间,用溴麦角环肽使催乳素缺失也能迅速诱使DNA出现梯型带和细胞调亡,甚至使泌乳停滞[7],Ben-Jonathan等[8]的研究指出,催乳素可以促进哺乳动物乳蛋白的合成,也可以增加乳脂和乳糖的合成。体外研究表明,催乳素与胰岛素、生长激素一样直接影响细胞的增殖和激素分泌的作用,且这种作用与浓度有关[9-10]。奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)利用营养物质合成乳脂和乳蛋白的过程,不论是在基因转录阶段还是蛋白质翻译阶段,催乳素的调控作用都是非常重要的。在泌乳过程中,催乳素可以刺激一些氨基酸的吸收,用于乳蛋白的合成[11],催乳素与乳腺分泌细胞膜上的相应受体结合,刺激乳蛋白(尤其是酪蛋白)和酶(如乳糖合成酶)mRNA产生,加速葡萄糖的转运,促进乳糖及乳脂的合成[1,12]。研究证实,在BMECs的培养基中添加催乳素,可以促使花生四烯酸短暂而快速地释放,而花生四烯酸可以刺激酪蛋白分泌。催乳素与生长激素、胰岛素、瘦素等其他激素关系密切,它们之间有许多交叉活性。有研究报道,用催乳素刺激培养的泌乳期奶牛乳腺组织,瘦素基因表达量增加。有催乳素作用时瘦素可促进脂肪酸合成,没有催乳素刺激这种作用就会丧失[13],并且催乳素协同卵巢类固醇激素,促进乳腺小叶腺泡的生长和上皮细胞增殖[14],同时添加胰岛素可以促进乳蛋白的合成[15]。在乳脂合成的过程中,过氧化物酶体增殖物激活受体γ(PPARγ)和固醇调节元件结合蛋白1(SREBP1)在细胞调控因子通路中处于枢纽位置,可以通过结合脂肪酸结合蛋白3(FABP3)、脂肪酸结合蛋白4(FABP4)、硬脂酰辅酶A去饱和酶(SCD)和胰岛素诱导基因1(INSIG1)等靶基因,影响脂肪酸的摄取、转运、从头合成和酯化过程[16]。
目前我国奶牛的良种率已达到95%以上,但乳中乳脂、乳蛋白含量均低于发达国家,未能发挥奶牛应有的遗传潜力,乳营养品质低下已成为制约我国奶业持续健康发展的瓶颈[16]。为了探讨催乳素对BMECs乳脂和乳蛋白的影响,本研究以BMECs为模型,研究不同浓度催乳素对BMECs活力和胞内甘油三酯(triglyceride,TAG)含量的影响,以及对乳脂和乳蛋白信号通路中相关基因表达的影响,旨在为调控乳脂和乳蛋白合成提供理论依据。
1 材料与方法
1.1材料
DMEM/F12、胎牛血清、氢化可的松、胰岛素转铁蛋白溶液均购自Gibco公司,表皮生长因子、催乳素、胶原酶Ⅱ、青霉素、链霉素、胰蛋白酶/乙二胺四乙酸(EDTA)、四甲基偶氮唑盐(thiazoly blue tetrazolium bramide,MTT)、二甲基亚砜均购自Sigma公司,磷酸盐缓冲液(PBS)(HyClone)、总RNA提取试剂盒RNA isoplus、反转录PCR试剂盒Prime ScriptTMRT reagent kit、实时定量PCR(RT-qPCR)试剂盒均购自TaKaRa公司。
1.2试验设计
采用单因子完全随机试验设计。选取健康的中国荷斯坦奶牛的BMECs进行体外培养,经纯化后,收集第2代的乳腺上皮细胞,置于37 ℃、5% CO2的恒温培养箱中培养至细胞长满60%~70%时,先用无血清无激素含有50 U/mL青霉素和50 μg/mL链霉素和1 ng/mL两性霉素B的DMEM/F12培养基过渡16 h以上(饥饿处理),然后添加含有不同催乳素浓度[0(对照)、100、300、500和1 000 ng/mL]的诱导培养基,诱导培养基为添加2 mmol/L谷氨酰胺、1 ng/mL氢化可得松及5 μg/mL胰岛素转铁蛋白溶液的DMEM/F12培养基。培养24 h后收集细胞,提取总RNA,测定浓度,制备RT-qPCR反应液,应用RT-qPCR方法,检测乳脂合成相关基因[乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FASN)、二酰甘油酰基转移酶(DGAT)、SCD]、乳脂合成相关转运调控因子[FABP3、PPARγ、固醇调节原件结合蛋白1(SREBP-1)]、乳蛋白合成相关基因[αS1酪蛋白(CSN1S1)、κ-酪蛋白(CSN3)]、信号通路相关基因[哺乳动物雷帕霉素靶蛋白(mTOR)、信号转导和转录激活因子5(STAT5)、真核起始因子4E结合蛋白1(4EBP1)、核糖体蛋白S6激酶1(S6K1)、蛋白激酶B(AKT)]及PRLR的表达,各基因表达量用2-△△Ct值表示[17]。
1.3测定指标与方法
1.3.1乳腺上皮细胞培养的获取与纯化
选取处于泌乳高峰期体况良好的荷斯坦奶牛进行试验,从奶牛乳腺组织取样,剪取腺泡丰富的乳腺组织约50 g,利用胶原酶Ⅱ消化法获得原代乳腺上皮细胞。待原代细胞长满培养瓶底的80%左右时,利用乳腺上皮细胞和成纤维上皮细胞对胰蛋白酶的敏感度不同来纯化乳腺上皮细胞并传代。传至第1代冻存备用。
1.3.2BMECs细胞活力的检测
利用MTT法检测乳腺上皮细胞的活力。按照1×104个/孔的密度将细胞悬浮液接种于96孔培养板中,置于培养箱中培养,待细胞生长至80%左右时,进行饥饿处理16 h,之后分别添加含不同浓度催乳素的DMEM/F12诱导培养基,置于37 ℃、5% CO2培养箱中继续培养24 h,试验每组均设5个重复,每个培养孔为1个重复;在培养结束前4 h,各培养孔加入MTT(5 mg/mL)20 μL;4 h后,弃上清液,每孔加入二甲基亚砜(DMSO)100 μL,振荡10 min,用全自动酶标仪检测各孔490 nm波长下的吸光度值(OD)。
细胞相对增殖率(relative growth rate,RGR)=试验组OD490 nm/对照组OD490 nm。
1.3.3BMECs内TAG含量的测定
将第2代的BMECs用胰蛋白酶/EDTA消化后,以8×105个/瓶的密度接种于最大生长面积75 cm2的培养瓶中,待细胞生长至培养瓶底80%时,进行饥饿处理,16 h后添加含有催乳素的诱导培养液继续培养24 h,利用胰蛋白酶/EDTA消化细胞,用TAG试剂盒测定BMECs中TAG的含量。试验每组设3个重复,每个培养瓶为1个重复。
1.3.4BMECs中乳脂和乳蛋白合成相关基因的表达量的测定
将第2代细胞悬浮液接种于75 cm2培养瓶中,每瓶10 mL含有8×105个细胞,置于37 ℃、5% CO2恒温培养箱中培养,待细胞生长至80%汇合后,先用无血清无激素含有青-链霉素和两性霉素B的培养基过渡16 h,然后分别添加含不同浓度催乳素的DMEM/F12诱导培养基,置于37 ℃、5% CO2培养箱中继续培养24 h,使用胰蛋白酶/EDTA消化细胞,将细胞悬液128×g离心10 min,弃去上清液,用PBS清洗,细胞总RNA的提取采用试剂盒按说明书进行,用分光光度计测定提取的总RNA的浓度及OD260 nm/OD280 nm,反转录PCR按照试剂盒说明进行操作。本试验以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,引物序列及参数见表1。试验每组设3个重复,每个培养瓶为1个重复。

表1 引物序列及参数

续表1基因Genes序列SequencesGenBank登录号GenBankaccessionNo.硬脂酰辅酶A去饱和酶SCDF:5'-TCCTGTTGTTGTGCTTCATCC-3'R:5'-GGCATAACGGAATAAGGTGGC-3'AY241993脂肪酸结合蛋白3FABP3F:5'-GAACTCGACTCCCAGCTTGAA-3'R:5'-AAGCCTACCACAATCATCGAAG-3'DN518905过氧化物酶体增殖物激活受体γPPARγF:5'-ATGTCTCATAATGCCATCAGGTT-3'R:5'-GATAACAAACGGTGATTTGTCTGTC-3'NM_181024固醇调节原件结合蛋白1SREBP-1F:5'-CGCTCTTCCATCAATGACAA-3'R:5'-TTCAGCGATTTGCTTTTGTG-3'NM_001113302催乳素受体PRLRF:5'-GATGACTGTGAGGACCAGCA-3'R:5'-AAGGCCATGTGGAAGATTTG-3'NM_174155
1.4数据统计
试验数据采用Excel 2007进行计算和整理,RT-qPCR试验结果采用2-△△Ct法进行相对定量分析。利用SAS 9.0软件的one-way ANOVA程序对数据进行单因素方差分析,P<0.05表示差异显著。
2 结 果
2.1催乳素对BMECs增殖的影响
催乳素对BMECs RGR的影响见表2。100和300 ng/mL催乳素组RGR显著高于对于其他各组(P<0.05),500 ng/mL催乳素组显著高于对照组和1 000 ng/mL催乳素组(P<0.05),1 000 ng/mL催乳素组与对照组无显著差异(P>0.05)。

表2 催乳素对奶牛乳腺上皮细胞相对增殖率的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无小写字母表示差异不显著(P>0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05), while with the same or no small letter superscripts mean no significant difference (P>0.05). The same as below.
2.2催乳素对BMECs乳脂合成的影响
催乳素对BMECs内TAG含量的影响见表3。100和500 ng/mL催乳素能够促进BMECs内TAG合成,但影响不显著(P>0.05);300ng/mL催乳素组与对照组相比显著提高了TAG含量(P<0.05);1 000 ng/mL催乳素组TAG含量显著低于对照组(P<0.05)。
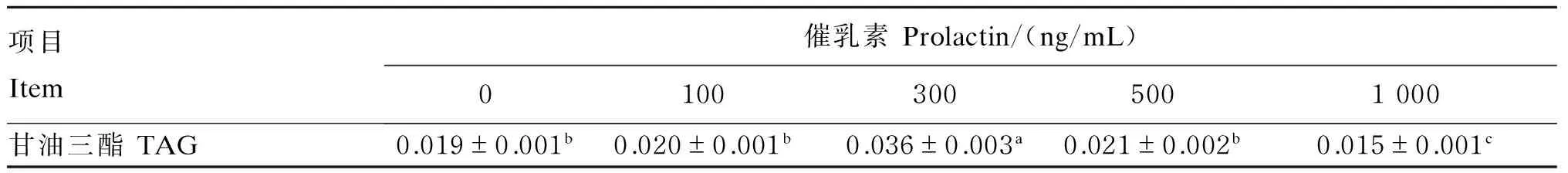
表3 催乳素对奶牛乳腺上皮细胞内甘油三酯含量的影响
2.3催乳素对BMECs乳脂合成相关基因表达的影响
催乳素对BMECs乳脂合成相关基因表达的影响见表4。与对照组相比,催乳素组ACC基因表达量升高,其中300和500 ng/mL催乳素组显著高于对照组(P<0.05);100 ng/mL催乳素组FASN基因表达量显著高于对照组(P<0.05),300和500 ng/mLFASN基因表达量高于对照组,但差异不显著(P>0.05);催乳素组SCD基因表达量随催乳素浓度的增加呈先增加后下降趋势,300 ng/mL催乳素组高于对照组,随后降低,500和1 000 ng/mL催乳素组显著低于对照组(P<0.05);对于DGAT基因的表达量而言,各催乳素组均高于对照组,其中300 ng/mL显著高于对照组(P<0.05);与对照组相比,添加100、300、500与1 000 ng/mL催乳素提高了SREBP-1的基因表达量,但统计分析差异不显著(P>0.05);300 ng/mL催乳素组PPARγ的基因表达量高于100、500和1 000 ng/mL催乳素组(P<0.05),与对照组无显著差异(P>0.05),500和1 000 ng/mL催乳素组显著低于对照组(P<0.05);300 ng/mL催乳素组FABP3基因表达量显著高于对照组及其他催乳素组(P<0.05)。
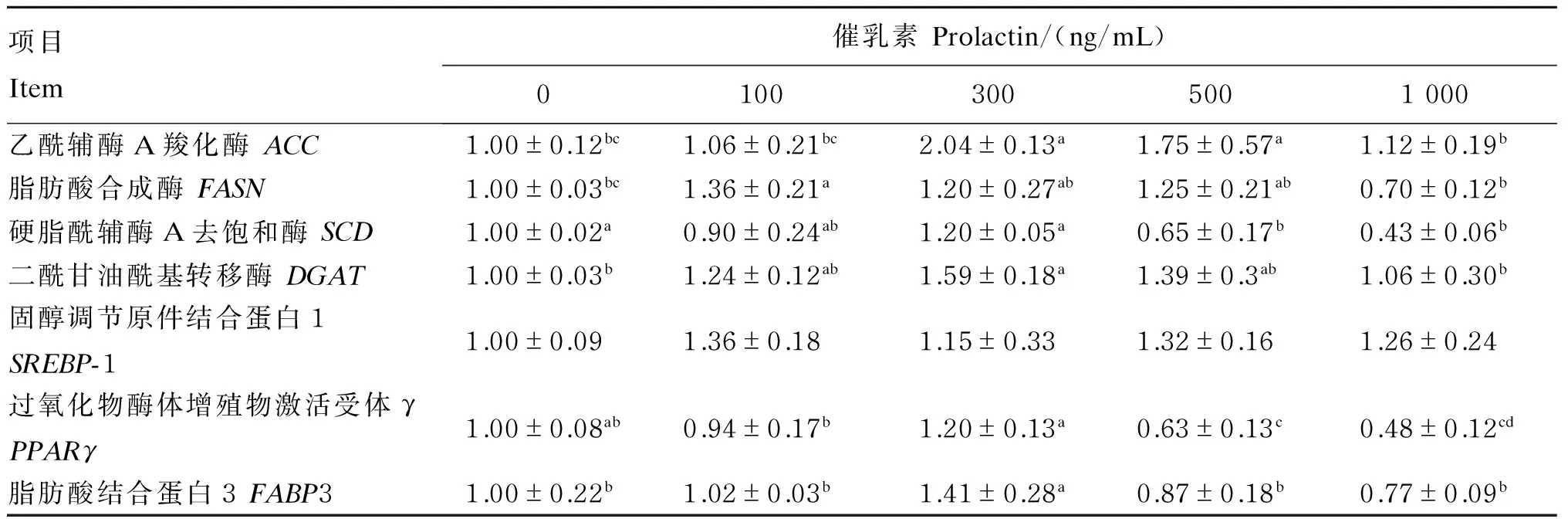
表4 催乳素对奶牛乳腺上皮细胞乳脂合成相关基因表达的影响
2.4催乳素对BMECs乳蛋白合成相关基因表达的影响
催乳素对BMECs乳蛋白合成相关基因表达的影响见表5。随着催乳素浓度的增加,mTOR基因表达量先增加随后降低,100、300和500 ng/mL催乳素组显著高于与对照组(P<0.05);100 ng/mL催乳素组4EBP1和S6K1基因表达量显著高于对照组(P<0.05),而300、500和1 000 ng/mL催乳素组显著低于对照组(P<0.05),且随着浓度的增加表达量呈下降趋势;100、300和500 ng/mL催乳素组STAT5基因表达量高于对照组,1 000 ng/mL催乳素组低于对照组,但统计分析差异均不显著(P>0.05);各催乳素组AKT基因表达量无显著差异(P>0.05);300 ng/mL催乳素组CSN1S1基因表达量显著高于对照组与其他试验组(P<0.05),100 ng/mL催乳素组显著低于对照组(P<0.05);300 ng/mL催乳素组CSN3基因表达量高于其他各组,但统计分析差异不显著(P>0.05);100和300 ng/mL催乳素组PRLR基因表达量显著高于对照组(P<0.05),而500和1 000 ng/mL催乳素组显著低于对照组(P<0.05)。
3 讨 论
3.1催乳素对BMECs增殖的影响
在反刍动物乳腺上皮细胞培养中,催乳素具有维持乳腺细胞数量及分化状态的作用[18]。本试验研究结果表明,低浓度(100~500 ng/mL)催乳素能够促进BMECs的增殖,而高浓度(1 000 ng/mL)催乳素对BMECs增殖产生抑制效应。有研究表明,长期处于高浓度激素环境下对乳腺上皮细胞有损伤[19],由于催乳素的浓度过大造成乳腺上皮细胞催乳素反应性降低,PRLR基因表达量减少,进而使催乳素作用减弱。田青等[20]研究表明,催乳素能显著促进BMECs增殖,在48 h之前,50 ng/mL的催乳素能起到很好的促细胞增殖效果,随着培养时间的延长,需要催乳素的浓度为500 ng/mL。本研究得出,催乳素浓度为100~500 ng/mL,BMECs的RGR较高,而更高剂量的催乳素会抑制BMECs的增殖活性,这与前人研究结果相一致。STAT5与AKT介导的信号通路有维持细胞生长并保护细胞免受不同细胞凋亡因子影响的作用。从STAT5与AKT的基因表达量可看出,100~500 ng/mL催乳素组高于对照组,1 000 ng/mL催乳素组则低于对照组,这与细胞活力检测结果相一致。

表5 催乳素对奶牛乳腺上皮细胞乳蛋白合成相关基因表达的影响
3.2催乳素对乳脂合成相关基因表达及TAG合成的影响
乳品质的形成与饲粮营养水平及组成息息相关,是多基因共同作用的结果。乳汁中的酪蛋白、β-乳球蛋白、α-乳清蛋白、几乎所有的短链和中链脂肪酸都由乳腺上皮细胞合成[21],而乳腺上皮细胞的增殖、分化与泌乳功能主要受催乳素、糖皮质激素和胰岛素等多种激素的调节。Ma等[22]通过转染技术使MAC-T细胞低表达SREBP-1基因,研究了SREBP-1基因对脂肪酸合成过程中关键酶基因表达的影响,结果表明,SREBP-1基因的低表达会降低脂肪酸的摄取和从头合成过程;抑制SREBP-1基因的表达会导致脂肪酸代谢相关基因ACC、FASN、FABP3、SCD的表达量降低。PPARγ有可能是SREBP-1活性在乳腺组织中的调节因子[23]。Kadegowd等[24]研究了PPARγ基因对奶牛乳脂合成的调节作用,使用PPARγ激动剂Rosiglitazone后,脂肪酸摄取基因(CD36)、脂肪酸内源合成与转录调控基因(ACC、FASN、SREBP-1)和TAG合成基因(SCD)的表达量均上调,这表明PPARγ与SREBP-1在脂肪合成细胞调控因子通路中处于枢纽位置,可以通过结合其靶基因,影响脂肪酸的合成。本试验结果表明,300 ng/mL催乳素组SREBP-1和PPARγ基因表达量高于对照组,由乳脂合成相关基因的表达量可以看出,SREBP-1和PPARγ基因的表达量升高会促进脂肪酸代谢相关基因ACC、FABP3、DGAT的表达,这与前人研究结果相一致,也与本试验300 ng/mL催乳素显著促进BMECs内TAG合成的试验结果相一致。
ACC和FASN是乳脂合成的关键调节酶,孙晓静[25]研究发现,400 ng/mL催乳素显著促进ACC与FASN的表达。本试验研究表明,催乳素在100~500 ng/mL内促进ACC与FASN的表达,这与前人研究结果一致。SCD是催化饱和脂肪酸合成单不饱和脂肪酸的限速酶,FABP3在奶牛乳腺组织中一个很重要的作用是为SCD提供脂肪酸[23],DGAT可能是TAG合成的唯一限速酶,SCD对于中链和长链脂肪酸(C10~C16)的作用更加明显,而DGAT对长链脂肪酸(≥C18)的作用更加明显[26],而这些脂肪酸成为TAG合成酶的底物。Bionaz等[24]在对奶牛乳腺乳脂合成相关的基因进行定量分析后,发现SCDmRNA的丰度是所有检测基因中最高的,而且高丰度的SCDmRNA与其他脂肪合成基因,如与ACC、FASNmRNA表达量变化趋势一致。本试验结果与前人研究相符,300 ng/mL催乳素组ACC、FASN、SCD、DGAT、FABP3基因表达量均提高。Shao等[27]研究表明,催乳素显著增加了乳腺组织中α-乳清蛋白和β-酪蛋白的基因表达量,并且极显著提高了SREBP-1、FASN、ACC和SCD的基因表达量。本研究得出,100~300 ng/mL催乳素促进了乳脂合成相关基因的表达,而浓度过大反而抑制上述基因的表达。结果提示,催乳素能够通过调控以PPARγ与SREBP-1为核心的乳脂合成相关的信号通路,调控脂肪酸合成关键酶及相关基因的表达,进而影响TAG的分泌与脂肪的合成,这种调节作用具有剂量依赖效应。
3.3催乳素对乳蛋白合成相关基因表达的影响
乳蛋白的产出并不只依赖于氨基酸的供给和乳腺对氨基酸的摄取,同样依赖于内分泌激素。当前,人们关注的重点是在基因转录水平上Janus激酶(JAK)/信号转导和转录激活因子(STAT)信号转导途径和蛋白质翻译水平上mTOR信号转导途径对乳蛋白合成的调控作用。用体外培养的乳腺组织研究证实,与STAT5的结合对于激素诱导的酪蛋白基因表达是必须的[28]。高浓度或生理范围的催乳素、生长激素或胰岛素样生长因子(IGF)均能提高体外培养的奶牛乳腺组织的STAT5-DNA结合活性[29]。
PRLR激活的JAK2-STAT5途径能促进乳腺上皮细胞分化及乳蛋白基因表达,而STAT5能激活AKT在乳腺中特异表达。mTOR信号通路上游受到AKT磷酸化的正调节,下游可促进S6K1和4EBP1的磷酸化,调节翻译起始,这2条下游通路是2条平行的信号通路,分别控制特定亚基的mRNA翻译过程。AKT调节脂肪合成主要是通过促进细胞内SREBP-1通路信号转导过程,并进一步促进SREBP-l靶基因ACC、FAS、FABP等的表达[30]。本试验结果表明,与对照组相比,100 ng/mL催乳素组促进了JAK-STAT及mTOR信号通路中各正向调节基因的表达量,这与前人研究结果一致。
CSN1S1、CSN3是2个主要酪蛋白的基因,BMECs这2个基因表达水平与乳蛋白的合成有很强的相关性[31]。Boutinaud等[32]用催乳素抑制剂处理奶牛9周降低了PRLRmRNA表达水平,同时α-乳白蛋白和CSN3基因表达量也随之降低。Burgos等[33]通过体外培养奶牛乳腺腺泡证实了营养物质和激素可能通过mTOR信号通路调控乳蛋白合成,发现单独补充糖皮质激素、胰岛素、催乳素能显著促进mTOR上游AKT的磷酸化。催乳素在刺激乳蛋白的合成的同时,也提高了mTOR底物S6K1和4EBP1的磷酸化水平。本试验结果表明,300 ng/mL催乳素组CSN1S1及PRLR表达量高于对照组。结果提示,催乳素通过JAK-STAT5与磷酯酰肌醇-3(PI3)/AKT/mTOR信号通路诱导体外培养BMECs乳蛋白合成相关基因的表达,且100~300 ng/mL内作用效果较好。
4 结 论
催乳素对乳脂和乳蛋白合成的调控有一定的剂量依赖关系,低浓度时随着催乳素浓度的增加呈正向调控关系,100~300 ng/mL的浓度作用效果最好,而高浓度(1 000 ng/mL)的催乳素对奶牛乳腺乳脂和乳蛋白的合成有一定抑制作用。
[1]FREEMAN M E,KANYICSKA B,LERANT A,et al.Prolactin:structure,function,and regulation of secretion[J].Physiological Reviews,2000,80(4):1523-1631.
[2]WU W,CHEN Y H,UEDA E,et al.Different forms of prolactin have opposing effects on the expression of cell cycle regulatory proteins in differentiated mammary epithelial cells[J].Oncology Research,2006,16(2):75-84.
[3]Wall E H,CRAWFORD H M,ELLIS S E,et al.Mammary response to exogenous prolactin or frequent milking during early lactation in dairy cows[J].Journal of Dairy Science,2006,89(12):4640-4648.
[4]PLAUT K,BAUMAN D E,AGERGAARD N,et al.Effect of exogenous prolactin administration on lactational performance of dairy cows[J].Domestic Animal Endocrinology,1987,4(4):279-290.
[5]SMITH V G,BECK T W,CONVEY E M,et al.Bovine serum prolactin,growth hormone,cortisol and milk yield after ergocryptine[J].Neuroendocrinology,1974,15(3/4):172-181.
[6]FLINT D J,KNIGHT C H.Interactions of prolactin and growth hormone (GH) in the regulation of mammary gland function and epithelial cell survival[J].Journal of Mammary Gland Biology and Neoplasia,1997,2(1):41-48.
[7]TRAVERS M T,BARBER M C,TONNER E,et al.The role of prolactin and growth hormone in the regulation of casein gene expression and mammary cell survival:relationships to milk synthesis and secretion[J].Endocrinology,1996,137(5):1530-1539.
[8]BEN-JONATHAN N,HUGO E R,BRANDEBOURG T D,et al.Focus on prolactin as a metabolic hormone[J].Trends in Endocrinology & Metabolism,2006,17(3):110-116.
[9]CHOI K M,BARASH I,RHOADS R E.Insulin and prolactin synergistically stimulate β-casein messenger ribonucleic acid translation by cytoplasmic polyadenylation[J].Molecular Endocrinology,2004,18(7):1670-1686.
[10]BOSSAERT P,DE COCK H,LEROY J L M R,et al.Immunohistochemical visualization of insulin receptors in formalin-fixed bovine ovaries post mortem and in granulosa cells collected in vivo[J].Theriogenology,2010,73(9):1210-1219.
[11]BOLE-FEYSOT C,GOFFIN V,EDERY M,et al.Prolactin (PRL) and its receptor:actions,signal transduction pathways and phenotypes observed in PRL receptor knockout mice[J].Endocrine Reviews,1998,19(3):225-268.
[12]AKERS R M.Major advances associated with hormone and growth factor regulation of mammary growth and lactation in dairy cows[J].Journal of Dairy Science,2006,89(4):1222-1234.
[13]王春艳.瘦素对奶牛乳腺上皮细胞乳蛋白合成的调控作用研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2012:36-37.
[14]NEVILLE M C,MEDINA D,MONKS J,et al.The mammary fat pad[J].Journal of Mammary Gland Biology and Neoplasia,1998,3(2):109-116.
[15]田青,季昀,庞学燕,等.胰岛素对奶牛乳腺上皮细胞酪蛋白合成调节机理的研究[J].动物营养学报,2013,25(3):550-560.
[16]王加启.牛奶乳脂肪和乳蛋白的合成与调控机理[C]//2010中国畜牧兽医学会动物营养学分会第六次全国饲料营养学术研讨会论文集.杨凌:中国畜牧兽医学会,2011:12.
[17]塔娜,李红磊,侯先志,等.乙酸钠和β-羟丁酸钠对奶牛乳腺上皮细胞乳脂和乳蛋白合成相关基因表达的影响[J].动物营养学报,2014,26(6):1527-1534.
[18]LACASSE P,LOLLIVIER V,DESSAUGE F,et al.New developments on the galactopoietic role of prolactin in dairy ruminants[J].Domestic Animal Endocrinology,2012,43(2):154-160.
[19]陈静,王根林,李莲,等.雌激素对奶牛乳腺上皮细胞增殖及抗氧化性的影响[J].农业生物技术学报,2013,21(2):216-222.
[20]田青,王洪荣.胰岛素、催乳素和氢化可的松对奶牛乳腺上皮细胞增殖和凋亡的影响[J].中国饲料,2013(2):8-12.
[21]ERDMANN B,BRETER H.Irregular distribution of mammary-derived growth inhibitor in the bovine mammary epithelium [J].Cell and Tissue Research,1993,272(2):383-389.
[22]MA L,CORL B A.Transcriptional regulation of lipid synthesis in bovine mammary epithelial cells by sterol regulatory element binding protein-1[J].Journal of Dairy Science,2012,95(7):3743-3755.
[23]BIONAZ M,LOOR J J.Gene networks driving bovine mammary protein synthesis during the lactation cycle[J].Bioinformatics and Biology Insights,2011,5:83-98.
[24]KADEGOWDA A K G,BIONAZ M,PIPEROVA L S,et al.Peroxisome proliferator-activated receptor-γ activation and long-chain fatty acids alter lipogenic gene networks in bovine mammary epithelial cells to various extents[J].Journal of Dairy Science,2009,92(9):4276-4289.
[25]孙晓静.奶牛泌乳相关激素周期性变化规律及激素对乳腺外植体中基因表达的影响[D].硕士学位论文.泰安:山东农业大学,2012.
[26]胡菡,王加启,李发弟,等.奶牛乳腺脂肪酸合成相关基因研究进展[J].生物技术通报,2009(10):34-39.
[27]SHAO Y,WALL E H,MCFADDEN T B,et al.Lactogenic hormones stimulate expression of lipogenic genes but not glucose transporters in bovine mammary gland[J].Domestic Animal Endocrinology,2013,44(2):57-69.
[28]JOLIVET G,L’HOTTE C,PIERRE S,et al.A MGF/STAT5 binding site is necessary in the distal enhancer for high prolactin induction of transfected rabbit α s1-casein-CAT gene transcription[J].FEBS Letters,1996,389(3):257-262.
[29]YANG J,ZHAO B,BARACOS V E,et al.Effects of bovine somatotropin on β-casein mRNA levels in mammary tissue of lactating cows[J].Journal of Dairy Science,2005,88(8):2806-2812.
[30]PORSTMANN T,SANTOS C R,GRIFFITHS B,et al.SREBP activity is regulated by mTORC1 and contributes to Akt-dependent cell growth[J].Cell Metabolism,2008,8(3):224-236.
[31]LEE G Y,KENNY P A,LEE E H,et al.Three-dimensional culture models of normal and malignant breast epithelial cells[J].Nature Methods,2007,4(4):359-365.
[32]BOUTINAUD M,LOLLIVIER V,FINOT L,et al.Mammary cell activity and turnover in dairy cows treated with the prolactin-release inhibitor quinagolide and milked once daily[J].Journal of Dairy Science,2012,95(1):177-187.
[33]BURGOS S A,DAI M,CANT J P.Nutrient availability and lactogenic hormones regulate mammary protein synthesis through the mammalian target of rapamycin signaling pathway[J].Journal of Dairy Science,2010,93(1):153-161.
(责任编辑王智航)
, associate professor, E-mail: dkyldb@imau.edu.cn
Effects of Prolactin on Gene Expressions Involved in Milk Fat and Milk Protein Synthesis in Bovine Mammary Epithelial Cells
XING YuanyuanLI Dabiao*LI HongleiYU YongqiangWANG Weiyun
(College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
The aim of this study was to determine the effects of prolactin on gene expressions involved in milk fat and milk protein synthesis in bovine mammary epithelial cells (BMECs). mammary epithelial cells of Chinese Holstein cows were used, after purification culture, different concentrations [0 (control), 100, 300, 500 and 1 000 ng/mL] of prolactin were added in culture medium for a 24 h cultivation. Cell viability was detected by thiazoly blue tetrazolium bramide (MTT); triglyceride (TAG) content was measured by using TAG determination kit; gene expressions involved in milk fat and milk protein synthesis were measured by real-time quantitative PCR (RT-qPCR). The results showed as follows: 1) 100 and 300 ng/mL prolactin significantly promoted the proliferation of BMECs compared with control and other experimental groups (P<0.05). 2) The content of TAG in BMECs and gene expressions of acetyl-CoA carboxylase (ACC), diacylgycerol acyltransferase (DGAT), fatty acid-binding protein 3 (FABP3) were significantly higher in 300 ng/mL prolactin group compared with those in control group (P<0.05), and gene expressions of stearoyl-coenzyme A desaturase (SCD) and peroxisome proliferator-activated receptor γ (PPARγ) tended to be higher. 3) Compared with control group, 100 and 300 ng/mL prolactin significantly upregulated gene expressions of mammalian target of rapamycin (mTOR) and prolactin receptor (PRLR) (P<0.05), and 300 ng/mL prolactin significantly upregulated αS1 casein (CSN1S) gene expression (P<0.05). In conclusion, 100 to 300 ng/mL prolactin is an optimal level considering its improvement effects on milk fat and milk protein synthesis.[ChineseJournalofAnimalNutrition, 2016, 28(8):2439-2447]
bovine mammary epithelial cells; prolactin; cell viability; triglyceride; genes related in milk fat and milk protein synthesis
10.3969/j.issn.1006-267x.2016.08.015
2016-03-01
国家自然科学基金(31360559);内蒙古自治区高等学校“青年科技英才支持计划”(NJYT-14-B05)
邢媛媛(1991—),女,内蒙古丰镇人,硕士研究生,从事反刍动物营养生理及瘤胃微生态研究。E-mail: xingyuanyuan2014@163.com
李大彪,副教授,硕士生导师,E-mail: dkyldb@imau.edu.cn
S826
A
1006-267X(2016)08-2439-09

