人G1型轮状病毒TaqMan荧光定量检测方法的建立与应用
彭 杰,胡晓星,冯 悦,甸子芩,孙 鷖,牛 华,夏雪山
人G1型轮状病毒TaqMan荧光定量检测方法的建立与应用
彭杰1,2,胡晓星2,冯悦2,甸子芩1,孙鷖1,牛华1,夏雪山2
目的本研究旨在建立一种快速准确定量检测人G1型轮状病毒的TaqMan探针荧光实时PCR检测方法。方法以轮状病毒VP6基因为靶基因,分别设计2对引物及其相应的TaqMan探针,扩增目的片段,将目的片段克隆于PCDNA3.1+载体上,体外转录获得RNA,系列稀释后为标准品,建立TaqMan探针荧光定量实时PCR检测方法并对该方法进行验证。结果设计实验找到最优条件下的引物浓度(250 nmol/L)、探针浓度(300 nmol/L);通过对引起腹泻的人柯萨奇病毒、呼肠孤病毒等进行检测,结果均为阴性,表明该方法具有很好的特异性。该方法的最低检测量为5 copies/μL。对该方法进行重复性实验,发现变异率均小于1%,重复性好。用已建立的方法对4份粪便临床样品进行3次重复试验,病毒RNA的检出率为100%。结论本实验初步建立了人G1型轮状病毒TaqMan探针荧光实时PCR检测方法,为G1型轮状病毒的诊断、检测和分子流行病学研究提供了一种新的方法。
人轮状病毒;VP6基因;TaqMan荧光定量PCR
Supported by the National Sci-Tech Support Plan (No.2014BAI01B01)
轮状病毒属于呼肠孤病毒科,是一种由11条不连续的双链RNA片段构成的无包膜病毒,外层由3层蛋白壳包被(外衣壳,内衣壳,核衣壳)。轮状病毒感染及其引起的腹泻病遍及全球各地,是导致全球婴幼儿腹泻和死亡率最高的病原体[1]。轮状病毒颗粒共由6个结构蛋白(VP1、VP2、VP3、VP4、VP6与VP7)和6个非结构性蛋白质(NSP1、NSP2、NSP3、NSP4、NSP5与NSP6)构成。外壳蛋白VP7 (G糖蛋白)具有抗原活性,能刺激机体产生中和抗体,对机体免疫有重要作用。VP7是轮状病毒血清学分型的重要依据,根据VP7特异性的不同,将轮状病毒分为14个G血清型,其中G1、G2、G3、G4和G9血清型是世界各地比较常见的流行株[2]。中国2001年以前,G1血清型为主要流行株,占67.1%~83.4%,虽然2001年之后流行的以G3型为主,G1型仍然占有25%的比例,不同地区流行情况也不尽相同,以广东地区为例,1998-2001年G1血清型占84.1%,G3血清型占6.8%;2007-2008年G3血清型成为流行株,占48.1%,G1血清型下降为33.3%;2008-2009年G1血清型上升为52.4%[3],由于G1型轮状病毒感染的多样性,因此,对G1型轮状病毒腹泻的长期监测显得格外重要。
目前,轮状病毒的主要检测方法包括病变检测、ELISA、PAGE电泳以及RT-PCR。由于某些类型的RV所致细胞病变不明显,使得病变检测方法产生较多假阴性;ELISA受到主观因素影响较大,出现假阳性概率较大;PAGE的灵敏性不高且不能保证RNA的完整性;常规的RT-PCR易污染且不能定量。荧光定量PCR技术作为一种新型的分子检测技术,可通过实时监测荧光信号积累对未知样本中病毒载量进行准确定量,不仅操作快捷简便,具有高度灵敏度和特异性,而且可防止传统PCR普遍存在的污染问题,在病原体检测中具有良好的应用前景。
轮状病毒VP6基因编码的蛋白占编码病毒蛋白总量的51%,在不同血清型间具有高度保守性(87%~99%)[4],VP6蛋白在轮状病毒感染的诊断上是一个重要的检测指标[5-6]。因此,本实验针对G1型轮状病毒VP6基因设计引物和探针,以轮状病毒G1型WA株型为标准株构建标准品,优化反应体系,建立轮状病毒G1型荧光定量PCR检测方法,为扩大G1型轮状病毒的监测范围,提高分子流行病学的监测力度,掌握腹泻的动态流行特征奠定了方法学基础。
1 材料和方法
1.1病毒株和细胞株人轮状病毒(HRV-WA株)和罗猴胚胎肾细胞(MA-104)均购自中国典型培养物保藏中心,呼肠孤病毒和柯萨奇A16病毒由本实验室保存。
1.2标准品的构建在GenBank中下载HRV-WA株的所有vp6基因序列,用MEGA6进行序列比对,选取同源性好的片段,用Primer premier5.0软件设进行引物设计,引物信息参见表1。引物由大连宝生物公司合成。
表1用于构建PC-VP6载体的外围引物
Tab.1The external primer used to construct a PC-VP6 vector

引物序列(5'-3')Primersequences(5'-3')位置site大小size/bpTM/℃F-AGGAAGCTTGTATG-TATGGATGAAATGGC305-3252153.4R-AGGGAATTCTAATG-GAAGCTACCGTGAAA1178-11972053.7
注:下划线部分分别为HindⅢ和EcoRⅠ酶切位点
Note: The nucleotide underlined representingHindⅢ andEcoRⅠ
以提取的人轮状病毒RNA为模板,扩增目的基因,扩增产物大小为893 bp,目的基因和PCDNA3.1+载体用HindⅢ和EcoRⅠ进行酶切、T4连接酶连接后转化到感受态细胞JM-109中进行扩增;筛选阳性克隆子并进行纯化。将克隆好的质粒,用大连宝生物公司DNA纯化试剂盒进行纯化,纯化完成后用大连宝生物公司T7体外转录酶进行体外转录,并对转录完成的RNA进行RNA纯化并测其OD值,将已知拷贝数的RNA按照合适的稀释倍数,利用优化的荧光定量PCR反应条件,进行实时PCR反应,建立Ct/LogCopynumber工作曲线。
1.3TaqMan PCR检测体系的建立
1.3.1TaqMan PCR引物和探针的设计根据目的基因893 bp的序列,利用Primer express3.0设计引物和探针,引物和探针均由大连宝生物公司合成,引物和探针序列见表2。
表2HRV TaqMan RT-PCR引物和探针
Tab.2TaqMan RT-PCR primer and probe of HRV

引物/探针primersandprobes序列位置site大小size/bpTM/℃FTTATTATTTCAGTTGAT-GCGTCCA891-9142459.7RTGCTAACAGAGTTTCAT-TTGCG1034-10552258.6PFAM-TCCACAAGCACAAC-CTTTTCAGCACC-TAMRA947-9722670.4
注:根据HRV-VP6基因序列设计而成
Note:The primer was designed based on the HRV-vp6 gene
1.3.2试剂系统的选择,引物、探针浓度的优化根据One Step PrimeScript RT PCR Kit(TaKaRa,RR064A)说明书,在20 μL的体系中分别加入ExTaqHS 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ0.4 μL,ROX Reference Dye II 0.5 μL上下游引物(10 μmol/L)各0.5 μL,探针(5 μmol/L)0.8 μL,2×OneStepRT-PCRBufferⅢ 10 μL,模板RNA 5 μL补加RNase Free dH2O至20 μL。扩增程序为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,60 ℃ 34 s;45个循环。固定引物浓度分别用200、300和400 nmol/L的探针浓度按照如上体系反应,固定探针浓度分别用200、250和300 nmol/L的引物浓度按照如上体系反应,以ΔRN值最大且所用的引物和探针浓度最小为评判标准。
1.4TaqMan PCR检测方法的评价
1.4.1方法特异性分析分别以轮状病毒、呼肠孤病毒、柯萨奇病毒A16为模板,按照20 μL最佳反应体系,按照42 ℃ 5 min,95 ℃ 10 s;95 ℃ 5 s、60 ℃ 34 s,45个循环进行反应。
1.4.2方法灵敏性分析将已知拷贝数的RNA进行10倍梯度稀释,选取107~100 copies/μL 8个浓度的RNA为模板,以优化的荧光定量PCR反应条件进行反应。以CT值>35个循环为下限检测该体系的灵敏性。
1.4.3方法重复性、稳定性分析该体系的重复性和稳定性从批间和组间2个方面来设计实验进行验证。
批间:不同批次间配置的109~103copies的RNA标准品,各批间不同时间检测3次(每5 d一次),分别计算他们各自曲线相关系数的变异系数。
组间:选取108、106、104拷贝的3个不同浓度的定量标准品,分别进行3次重复,计算他们各自的CT值变异系数。
1.5荧光定量PCR的初步应用收集临床粪便样品,用PBS溶解后3 000 r/min,离心30 min,收集上清并提取RNA,取4份样品的RNA,每份做3个重复,用已经建立的TaqMan荧光定量PCR方法对其进行检测并对结果进行分析。
2 结 果
2.1外参的构建
2.1.1PC-VP6克隆载体的构建与鉴定经PCR获得的目的片段用1%的琼脂糖凝胶电泳检测,获得WA标准株型的特异性条带(893 bp)(见图1)。目的基因和PCDNA3.1+载体用HindⅢ和EcoRⅠ进行酶切、T4连接酶连接后转化到感受态细胞JM-109中进行扩增;筛选阳性克隆子并进行纯化,并对阳性克隆进行双酶切验证,结果如图2所示。
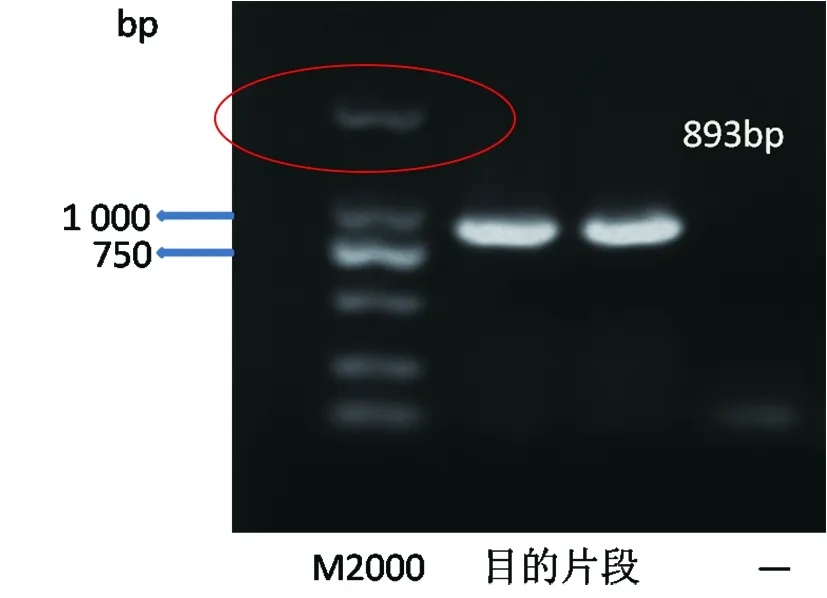
图1 目的基因电泳结果图Fig.1 The PCR result of target gene
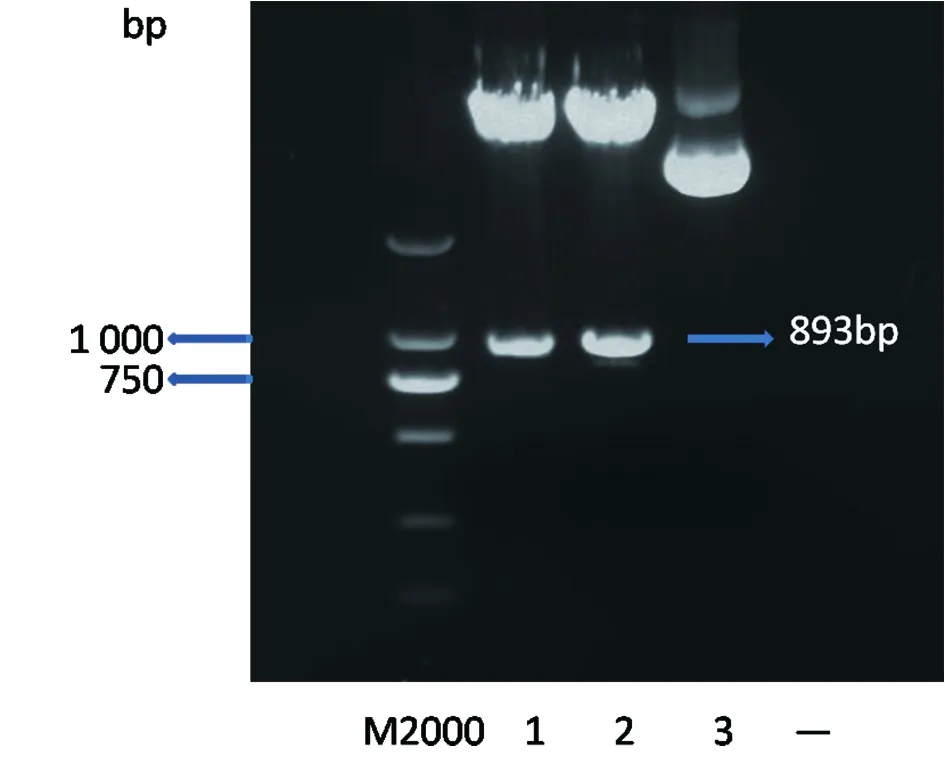
注:1和2为克隆载体双酶切验证结果,3为未经酶切的对照载体Note:1,2: Digested product of cloning vector,3: undigested product of cloning vector图2 克隆载体双酶切验证结果Fig.2 Digested product of cloning vector
2.1.2克隆载体体外转录后RNA拷贝数的确定 对克隆好的PC-VP6克隆载体进行体外转录并将获得的RNA进行纯化,采用紫外分光光度计测其OD值为294 ng/μL。根据公式:拷贝数(copise/μL)=质粒浓度(g/μL)×阿式常数/RNA分子量。阿式常数为6.02×1023,RNA分子量=一个碱基的分子量(340)×重组RNA总长度(bp),测得拷贝数为5×1011copies/μL。
2.2TaqMan方法的建立与优化
2.2.1试剂系统的选择,引物、探针浓度的优化实验结果表明,本实验最优的反应体系为ExTaqHS 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ0.4 μL,ROX Reference Dye II 0.5 μL上下游引物(10 μmol/L)各0.5 μL,探针(5 μmol/L)1.2 μL,2×One Step RT-PCRBufferⅢ 10 μL,模板RNA 5 μL补加RNase Free dH2O至20 μL。扩增程序为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,60 ℃ 34 s;45个循环。
2.2.2TaqMan PCR工作曲线的建立将拷贝数为5×1011copies/μL的RNA样品进行10倍梯度稀释,以5×109~5×103copies/μL为模板绘制标准曲线,以标准品稀释拷贝数为横坐标以PCR反应的循环数(CT)为纵坐标,建立TaqMan实时荧光定量PCR标准曲线,其线性回归方程为y=-3.585x+43.526,标准曲线斜率为-3.585,R2=0.999扩增效率为EFF=90.092%.说明PCR扩增该标准品的效率高,线性关系和准确度良好,符合PCR反应标准曲线的要求,结果见图3。
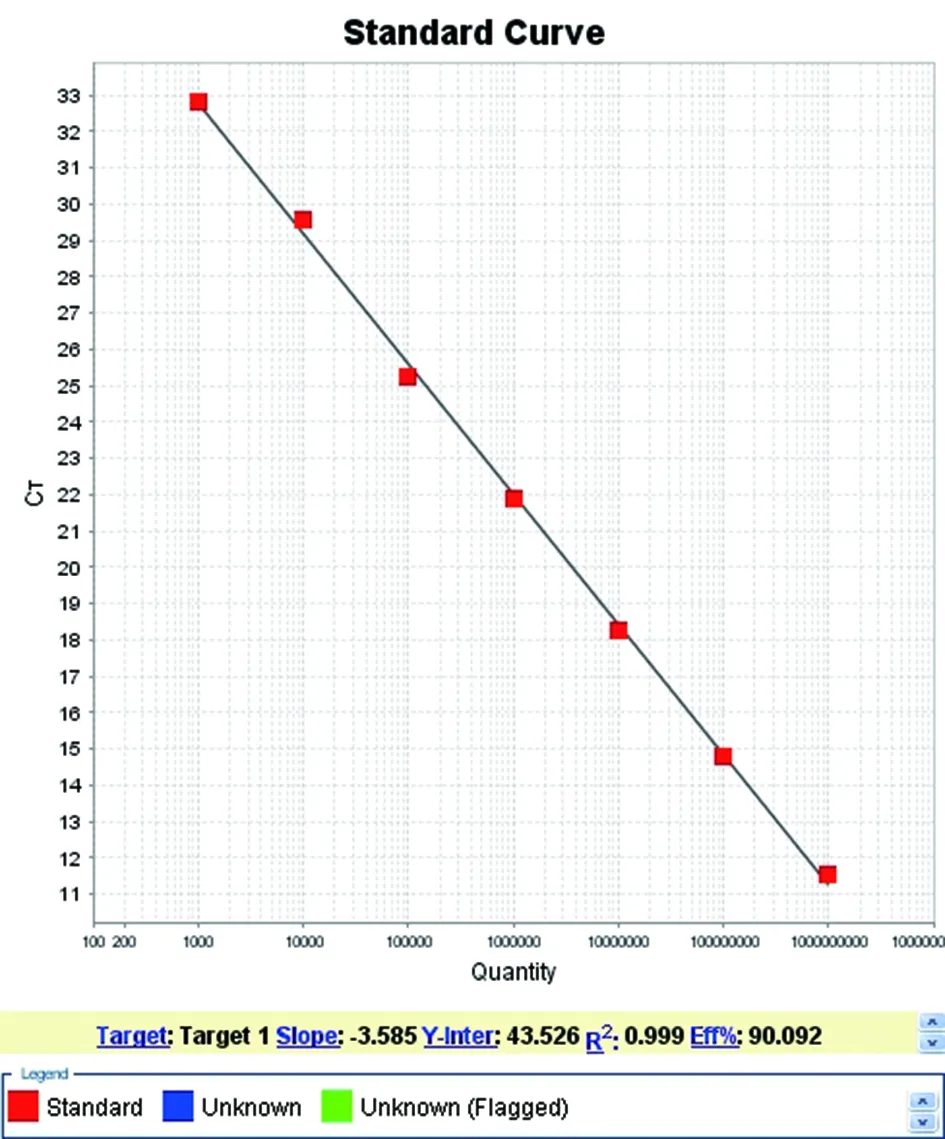
图3 TaqMan实时荧光定量PCR标准曲线Fig.3 Standard curve of TaqMan real-time PCR
2.3TaqMan方法的评价
2.3.1特异性分析分别用同为儿童呼吸道传播且引起儿童腹泻的轮状病毒、呼肠孤和柯萨奇A16病毒进行TaqMan荧光定量PCR反应,从图4中发现,只有轮状病毒具有良好的扩增曲线,表明该对引物用于检测轮状病毒具有良好的特异性。

图4 TaqMan PCR方法特异性分析结果图Fig.4 Specific analysis of quantitative PCR
2.3.2灵敏性分析将已知拷贝数的RNA进行10倍梯度稀释,以5×107~5×100copies/μL 8个浓度的RNA为模板,以优化的荧光定量PCR反应条件进行反应。通过扩增曲线可知,5×100copies/μL RNA的扩增CT值>35个循环,表明该检测体系可以检测到5×100copies/μL(图5)。
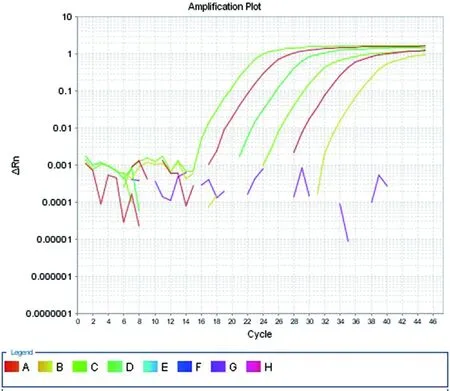
图5 TaqMan PCR方法灵敏性分析结果Fig.5 Sensitivity analysis of quantitative PCR
2.3.3重复性和稳定性分析从批间和组间2个方面来设计实验进行验证,批间重复性分析结果不同批次间配置的5×109~5×103copies的RNA标准品,各批间不同时间检测3次(每5 d一次),测得他们的相关系数R2分别为0.995、0.999、0.995、0.997、0.995、0.996。计算出他们的平均值和标准差(s)分别为0.995 5和0.001 8,进而得到批间重复的变异系数CV=0.181%,小于0.5%,该体系的批间重复性和稳定性良好(见表3)。

表3荧光定量PCR批间重复试验
Tab.3Inter variation of quantitative PCR

Group(Lot-Day)R2SCV1-10.9950.00180.181%1-50.9991-100.9952-10.9972-50.9952-100.996
表4荧光定量PCR组间重复试验
Tab.4Intra variation of quantitative PCR

CopiesCtValuex s CV10814.9514.9715.0714.950.050.35%10622.5822.4022.0822.350.250.94%10429.3929.5628.9129.280.280.96%

图6 荧光定量PCR组间重复试验Fig.6 Intra variation of quantitative PCR

表5TaqMan荧光定量PCR方法临床样品检测结果
Tab.5Clinical samples test results using TaqMan real-time fluorescent RT-PCR

nCtValuex s CV115.6516.0915.9115.880.1810.010%230.8230.9730.9630.920.0690.002%330.9830.9530.8430.920.0790.003%431.3231.4231.2831.340.0590.001%
3 讨 论
针对轮状病毒已经建立了多种检测技术,以免疫学检测技术最为常用,该技术是WHO推荐的免疫检测技术,可靠性和实用性较高。其中,ELISA方法具有操作简便,价格低廉,灵敏度和特异度高,无放射性污染,无需特殊仪器等特点而广泛应用,但该方法的主观因素影响较大,出现假阳性概率较大。普通PCR技术,虽然简单快速,但其特异性以及灵敏度不够,容易造成污染。本实验建立的TaqMan荧光定量PCR方法,相对于电镜检测,TaqMan荧光定量PCR针对轮状病毒vp6基因进行检测,可以避免因病毒颗粒降解而造成的误诊,且定量PCR仪价格适中,更适合推广。相对于ELISA的主观性较大且假阳性较高,荧光定量PCR对引起腹泻的呼肠孤和柯萨奇进行特异性检测,发现其他病毒均为阴性,表明该检测方法具有很好的特异性,且荧光定量PCR的批内和批间变异系数均小于1%,说明该方法具备很好的稳定性。荧光定量PCR最低检测病毒拷贝数为5copies/μL,灵敏度远远高于ELISA和普通PCR。荧光定量PCR特异性更强,自动化程度更高,为RV的诊断、检疫、食品安全检验和病原生物学、分子流行病学研究提供了一种新的方法,逐渐得到普及推广[7-8]。
轮状病毒荧光定量PCR检测技术多是SYBR Green I 染料提供荧光信号、检测靶基因主要是变异性较高的VP7基因[9-10]、标准品主要以DNA为主[9-11]。本实验采用高特异性的TaqMan荧光探针,针对VP6基因,采用RNA为标准品建立人轮状病毒荧光定量PCR检测方法。TaqMan荧光探针法较SYBR Green法的特异性、灵敏性以及准确性都要高,采用TaqMan荧光探针使得检测的可信度大大提高。Green K等[12]的研究确定了VP7氨基酸序列中存在9个高变区(VRl~VR9),这表明VP7基因易发生变异,而VP6基因编码全场为1 356 bp,具有单一的开放阅读框,编码397个氨基酸,不同于VP7蛋白,作为群共同抗原的VP6蛋白具有高度保守性,因此也具有高度的抗原交叉反应性。作为RV 重要的组抗原和亚组抗原,在病毒感染的早期就开始合成,参与大部分病毒颗粒的组装[13],因此VP6基因更适合轮状病毒的早期检测。目前大部分荧光定量检测方法的标准品是DNA,在样本提取过程中需要把RNA逆转录成DNA再进行定量,在逆转录过程中试剂的选择和操作都将导致实验的误差,不仅操作繁琐,还大大增加了实验的误差,实验的可信度降低。本实验,采用RNA作为标准品,TAKARA一步法定量试剂盒,减少了实验步骤,降低了实验误差,得到的结果更直观可信。
目前国内虽然己经发展了轮状病毒疫苗,但针对G1型轮状病毒的疫苗还尚未出现。因此对G1型轮状病毒的预防监测将是公共卫生工作的长期任务,这一工作的开展离不开快速、准确的RV检测技术。本研究采用标准曲线绝对定量的方法,利用TaqMan探针技术,建立了针对人轮状病毒G1型VP6基因的荧光定量RT-PCR检测方法,用于RV拷贝数定量分析,可对临床样本进行快速、大批量检测,为扩大G1型轮状病毒的监测范围,提高分子流行病学的监测力度提供了技术支持。
[1] Widdowson MA,Bresee JS,Gentsch JR,et al.Rotavirus disease and its prevention[J]. Curr Opin Gastroenterol, 2005, 21(1): 26-31.
[2] Orenstein EW, Fang ZY, Xu J, et al. The epidemiology and burden of rotavirus in China: a review of the literature from 1983 to 2005[J]. Vaccine, 2007, 25(3): 406-413. DOI: 10.1016/j.vaccine.2006.07.054.
[3] Zong WP,Xiang WL,Yu SY,et al.Rotavirus molecular epidemiological characteristics of autumn and winter diarrhea patients in guangzhou areas[J]. J Practical Medicine, 2011, 27(4): 682-684(in Chinese)
宗文萍,向文龙,俞守义,等.广州地区秋冬季腹泻患者轮状病毒分子流行病学特征研究[J].实用医学杂志,2011, 27(4): 682-684
[4] Ramig RF. Pathogenesis of intestinal and systemic rotavirusinfection[J]. J Virol,2004, 78(19): 10213-10220. DOI: 10.1128/JVI.78.19.10213-10220.2004
[5] Yang K, Wang S, Chang KO, et al. Immune responses and protection obtained with rotavirus VP6 DNA vaccines given by intramuscular injection[J]. Vaccine, 2001, 19(23/24): 3285-3291. DOI: 10.1016/S0264-410X(00)00543-0
[6] Lee S, Belitsky BR, Brinker JP, et al. Development of a Bacillus subtilis-based rotavirus vaccine[J]. Clin Vaccine Immunol, 2010, 17(11): 1647-1655. DOI: 10.1128/CVI.00135-10
[7] Schwarz BA, Bange R, Vahlenkamp TW, et al. Detection and quantitation of group A rotaviruses by competitive and real-time reverse transcription polymerase chainreaction[J]. J Virol Methods, 2002,105(2): 277-285. DOI: 10.1016/S0166-0934 (02)00118-0
[8] Krumbholz A, Wurm R, Scheck O, et al. Detection of porcine teschoviruses and enteroviruses by LightCycler real-time PCR[J]. J Virol Methods, 2003, 113(1): 51-63. DOI: 10.1016/s0166-0934(03)00227-1
[9] Fan Q, Xie ZX, Liu JB, et al. The TaqMan real-time fluorescent RT-PCR rapid detection method establishment of Bovine rotavirus[J]. Chin Animal Husbandry & Veterinary Med,2011, 4: 105-108(in Chinese)
范晴,谢芝勋,刘加波,等.牛轮状病毒TaqMan实时荧光RT-PCR快速检测方法的建立[J].中国畜牧兽医,2011,4:105-108.
[10] Pang XL, Lee B, Boroumand N, et al. Increased detection of rotavirus using a real time reverse transcription-polymerase chain reaction (RT-PCR) assay in stool specimens from children with diarrhea[J]. J Med Virol, 2004, 72(3): 496-501. DOI: 10.1002/jmv.20009
[11] Wang ZY, Wang JW, He SY, et al. Quantitation of rotavirus by real time reverse transcription polymerase chain reaction [J], J Shandong University(Health Sciences)2006,3:217-221. DOI:10.3969/j.issn.1671-7554.2006.03.001(in Chinese)
王志宇,王健伟,何深一,等.荧光定量RT-PCR在轮状病毒检测中的应用[J].山东大学学报(医学版),2006,3:217-221.
[12] Green KY, Sears JF, Taniguchi K, et al. Prediction of human rotavirus serotype by nucleotide sequence analysis of the VP7 protein gene[J].J Virol,1988,62(5): 1819-1823.
[13] Yi XX, Wen YL, Zhao QH, et al. Immun ofluorescence Assay of Rotavirus Vp6 Protein[J]. Chin J Bilogicals, 2008, 21(5): 434-437.(in Chinese)
尹兴晓,文喻玲,赵庆欢,等.轮状病毒VP6蛋白的免疫荧光检测[J].中国生物制品学杂志,2008, 21(5):434-437.
Establishment and application of TaqMan real-time fluorescence quantitative PCR for G1 serotype rotavirus detection
PENG Jie1,2, HU Xiao-xing2, FENG Yue2, DIAN Zi-qin1,SUN Yi1,NIU Hua1, XIA Xue-shan2
(1.TheAffiliatedHospitalofKunmingUniversityofScienceandTechnology,Kunming650034,China2.KunmingUniversityofScienceandtechnology,facultyoflifescienceandtechnology,YunnanProvincialresearchcenterofmolecularmedicine,Kunming650034,China)
The aim of this study is to develop a method of TaqMan real-time PCR for quantitative detection on G1 serotype human rotavirus. Based on theVP6 gene, a set of primer and TaqMan probe were designed. TheVP6 gene fragment was amplified and cloned into the PCDNA3.1+vector. RNA was transcribedinvitroand serial diluted to establish the external standards. With the optimization for PCR parameters, the optimized primer concentration was determined as 250 nM and probe concentration as 300 nmol/L. The human coxsackievirus and reovirus couldn’t be detected which proved the high specificity of this method. The low limitation of this method was detected to be less than 5 copies/μL, and variation coefficient less than 1%. With the 3 times repeated detection on 4 clinical samples, this method was verified to have the good performance. Finally, a TaqMan real-time fluorescence quantitative PCR for human rotavirus detection was established, which may provide a new approach for the RV diagnosis, food safety inspection and epidemiological investigation.
human rotavirus;VP6 gene; TaqMan fluorescence quantitative PCR
Niu Hua, Email: nh_ynccl@163.com
牛华,Email:nh_ynccl@163.com
1.昆明理工大学医学院,昆明理工大学附属医院,昆明650500;2.昆明理工大学生命科学与技术学院,云南省分子医学研究中心,昆明650500
R373文献识别码:A
1002-2694(2016)06-0512-06
2015-09-14;
2016-03-03
DOI:10.3969/j.issn.1002-2694.2016.06.002
国家科技支撑计划项目(No.2014BAI01B01)

