白蛋白结合型紫杉醇联合铂类对晚期妇科肿瘤患者的疗效及并发症分析
张峻霄,胡春燕,楚光华,刘晨
(西北妇女儿童医院 妇二科,陕西 西安 710061)
白蛋白结合型紫杉醇联合铂类对晚期妇科肿瘤患者的疗效及并发症分析
张峻霄Δ,胡春燕,楚光华,刘晨
(西北妇女儿童医院 妇二科,陕西 西安 710061)
目的分析白蛋白结合型紫杉醇联合铂类对晚期妇科肿瘤患者的疗效及并发症。方法选取2013年6月~2016年6月在西北妇女儿童医院妇科就诊的复发或者晚期肿瘤患者76例,所有患者予以白蛋白结合型紫杉醇175 mg/m2,其中58例患者采用白蛋白结合型紫杉醇联合奥沙利铂治疗方案,200 mg/m2,dl;18例患者采用白蛋白结合型紫杉醇联合卡铂治疗方案,200 mg/m2,dl;所有患者均采用全身静脉进行化疗,治疗21 d为一个疗程,共治疗2个疗程。治疗结束后,对患者近期临床效果及并发症发生情况进行比较分析。结果有66例患者进行近期疗效评价,疾病进展15例(22.7%)、疾病稳定18例(27.3%)、部分缓解30例(45.5%)、完全缓解3例(4.6%),客观缓解率为50.1%;中位PFS 5.5个月,有32例患者死亡。联合奥沙利铂客观缓解率56.3%显著的优于联合卡铂33.3%(P<0.05);骨髓抑制为最为常见的并发症,中性粒细胞减少III级发生率为17.1%,无IV级患者发生;周围神经感觉异常发生率为53.9%,III、IV级发生率为3.9%;仅有2例患者出现过敏反应;不良反应中III、IV级发生率总体较低。结论白蛋白结合型紫杉醇联合铂类治疗复发性和晚期妇科肿瘤患者的近期临床效果较优,不良反应发生风险在可预估的范围内。
白蛋白结合型紫杉醇;铂类;晚期妇科肿瘤
目前,紫杉醇类化疗药物在子宫内膜癌、宫颈癌、卵巢癌等妇科恶性肿瘤的临床治疗中广泛应用,溶剂型紫杉醇为临床中常用药物剂型[1]。临床中常以无水乙醇和聚氧乙烯蓖麻油来作为药物载体,但却可能存在引发神经毒性、血液毒性和严重过敏反应等不良反应的缺陷,对紫杉醇的药效造成直接影响[2]。白蛋白结合型紫杉醇为一种新型的化疗药物,已经得到广泛而深入的研究,由于无需类固醇药物的处理,故降低了过敏反应的发生,加大了紫杉醇在人体中的转运、吸收以及药效利用率[3-4]。关于白蛋白结合型紫杉醇在肺癌、乳腺癌等妇科肿瘤中的应用研究较多,一般以单药方式进行应用[2,4],关于白蛋白结合型紫杉醇联合铂类在妇科肿瘤晚期中的应用研究较少。本文对从2013年6月~2016年6月在西北妇女儿童医院妇科就诊的76例复发、晚期肿瘤患者施予白蛋白结合型紫杉醇联合铂类进行治疗,现报告如下。
1 资料与方法
1.1 一般资料 选取2013年6月~2016年6月西北妇女儿童医院妇科就诊的76例复发或晚期肿瘤患者临床资料进行分析,52例宫颈癌,22例卵巢癌,2例子宫内膜癌,年龄29~71岁,平均(48.5±7.8)岁。按照2009年肿瘤患者FIGO分期标准进行分析[5],其中54例复发患者,22例初治晚期患者。54例复发患者中有宫颈癌40例,包括中盆腔局部复发12例,肺转移14例,腹膜后淋巴结转移8例,全身多处转移患者6例;40例复发宫颈癌患者均接受放射化疗,其中16例患者接受过其他化疗治疗(12例复发卵巢癌患者均发生盆腹腔多发转移,有6例进行了10疗程的一、二线化疗,但病情并未得到显著控制;2例子宫内膜癌患者,均接受过化疗和放疗,现发生肺转移)。22例初治晚期患者中有宫颈癌12例,包括I期和Ⅳ期患者分别6例,卵巢癌Ⅲ期患者10例。
1.2 方法
1.2.1 治疗方法:本文中的治疗方案为白蛋白结合型紫杉醇联合卡铂和奥沙利铂。采用全身静脉滴注进行化疗,一个疗程为21 d。所有患者白蛋白结合型紫杉醇的治疗剂量均为175 mg/m2,在0.9%氯化钠注射液20 mL中融入100 mg白蛋白结合型紫衫醇,缓缓滴注,前30 min对患者进行观察,无异常反应后,将剩余药物按5:1的配比溶于0.9%氯化钠注射液中,滴注30 min。首次化疗前,要进行白蛋白结合型紫杉醇过敏预防试验,静推400 mg西米替丁,静推20 mg地塞米松,肌内注射40 mg苯海拉明,若患者没有出现过敏反应,后续治疗不再进行抗过敏预处理。在进行白蛋白结合型紫杉醇静脉滴注时,要实施心电全程监护,每15 min测1次呼吸、心率以及血压,滴注完成后,58例患者给予静脉滴注奥沙利铂200 mg/m2,dl,18例患者给予静脉滴注卡铂200 mg/m2,dl,在进行铂类滴注时,为防止呕吐恶心事件发生,需静推5 mg托烷司琼。治疗2个疗程后,对治疗效果进行评价,有效者继续治疗评价,无效者改变治疗方法。
1.2.2 检测指标:每个化疗完成后,进行血常规检测,分析其对骨髓肿瘤细胞抑制状况;并对患者进行血肿瘤指标检测、妇科检查、B超检查,标志物下降和肿瘤缩小患者为治疗有效,进行下一个治疗周期;在化疗后第17天,静脉取血进行肝肾功能、血常规等检测,分析化疗对骨髓肿瘤细胞抑制状况进行评估;并分析化疗后疼痛、周围神经感觉异常、便秘、过敏、乏力、骨髓抑制等不良反应[6-7]。
1.2.3 评价标准:根据实体肿瘤疗效评定标准对治疗2个疗程后的近期疗效进行评估[6]。临床分为疾病进展(progressive disease,PD):出现新的病变,病变增加率≥25%;疾病稳定(stable disease,SD):肿块增大<25%,肿块缩小<50%;部分缓解(partial remission,PR):肿块缩小≥50%,且持续时间4 w以上;完全缓解(complete remission,CR):肿块完全消失,且持续时间4 w以上),客观缓解率(objective response rate,ORR)=(PR+CR)/总例数×100%,并记录患者肿瘤指标变化状况[7]。无进展生存时间(progression free survival,PFS)为被接受化疗日时起到患者局部肿瘤复发、增大、远处转移的时间。根据WHO抗肿瘤药物亚急性及急性毒性反应评估标准[5],将化疗不良反应分成0~IV 5个级别。
1.3 统计学方法 应用SPSS 22.0统计学软件进行统计分析,计数资料采用率表示,采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 近期疗效分析比较 76例患者中,白蛋白结合型紫杉醇联合奥沙利铂治疗患者中有2例宫颈癌患者行肺叶切除术后治愈,8例卵巢癌患者术后行巩固化疗,排除以上10例患者,共有66例患者可以进行近期疗效评价。在66例化疗患者中,化疗4~7个疗程的患者20例,其余46例患者2~3个疗程结束,共194个疗程,平均2.94个疗程。近期疗效表明,白蛋白结合型紫杉醇联合铂类疾病进展15例(22.7%)、疾病稳定18例(27.3%)、部分缓解30例(45.5%)、完全缓解3例(4.6%),客观缓解率为50.1%,中位PFS 5.5个月,有32例患者死亡。
由于子宫内膜癌患者数量偏少,不参与统计分析。统计分析可知,晚期肿瘤患者客观缓解率78.5%高于复发患者42.4%(P=0.031<0.05);晚期中位PFS为12.8月高于复发患者的3.5月,差异无统计学意义(P=0.087);不同病种、不同发病部位患者的客观缓解率均不存在着显著性差异。联合奥沙利铂患者的客观缓解率56.3%显著高于联合卡铂患者33.3%(P=0.014<0.05);另外,联合奥沙利铂患者的中位PFS为3.9个月,显著短于联合卡铂患者6.3月(P=0.016<0.05)。见表1。
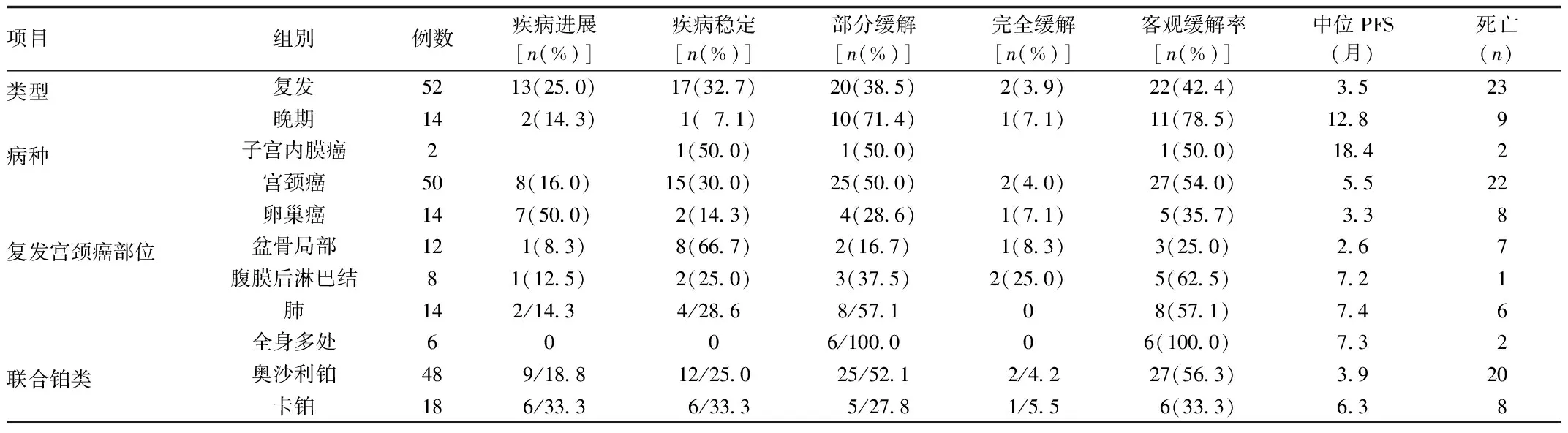
表1 66例患者的近期疗效评价比较
2.2 不良反应发生情况分析 患者出现乏力症状较为普遍为90.8%,III、IV级发生率为6.6%;患者出现呕吐、恶心的发生率为80.3%,III、IV级发生率为3.9%;周围神经感觉异常发生率为53.9%,III、IV级发生率为3.9%;骨髓抑制并发症最为常见,中性粒细胞降低,III级发生率为17.1%,但无IV级患者发生;患者白细胞减少发生率为72.4%,III、IV级发生率为22.4%;有2例患者出现过敏等其他不良反应。见表2。
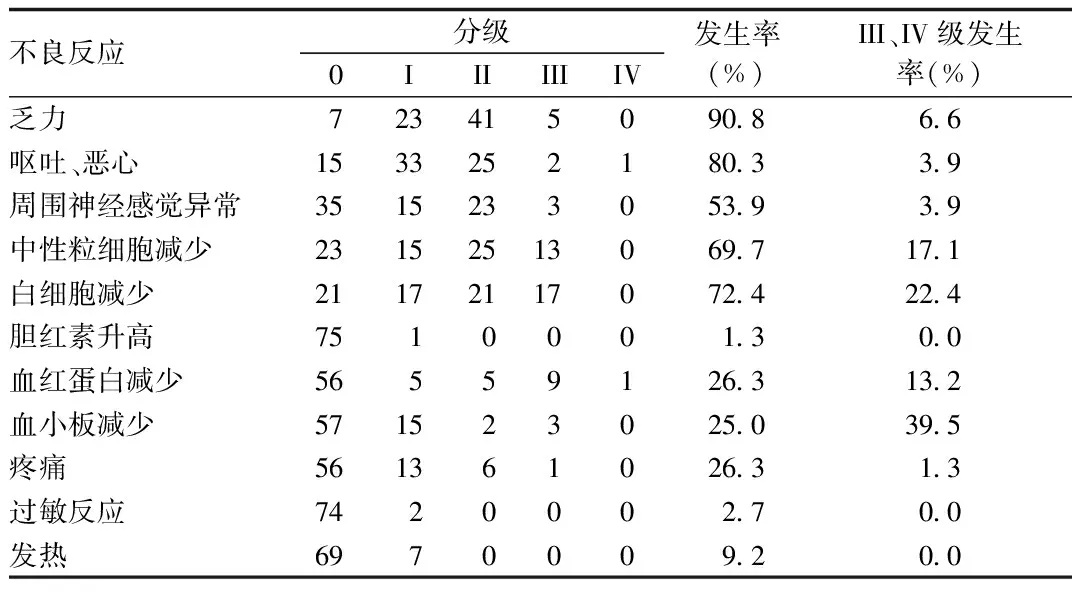
表2 白蛋白结合型紫杉醇联合铂类治疗不良反应发生情况分析Tab.2 Analysis of adverse reactions in patients treated with albumin - bound paclitaxel combined with platinum
3 讨论
紫杉醇联合铂类在妇科肿瘤的临床治疗中具有重要的意义,而白蛋白结合型紫杉醇联合铂类在复发性、晚期肿瘤患者中的应用研究较少;Socinski等[9]研究发现白蛋白结合型紫杉醇联合铂类在肺癌晚期临床治疗中,取得显著治疗效果,以此为基础展开其在复发、晚期妇科肿瘤患者中的应用研究。关于白蛋白结合型紫杉醇联合化疗的最优剂量目前没有科学定论,Nabholtz等[10]研究表明,在剂量为175 mg/m2时,临床效果较好,故本文采用此剂量,并联合铂类进行化疗。
本文对66例患者进行近期疗效评价,疾病进展15例(22.7%)、疾病稳定18例(27.3%)、部分缓解30例(45.5%)、完全缓解3例(4.6%),客观缓解率为50.1%,中位PFS 5.6个月,近期效果较为显著;这表明白蛋白结合型紫杉醇联合铂类化疗方案在复发、晚期妇科肿瘤患者中的临床治疗效果较好;虽然晚期患者中位PFS12.8个月与复发患者3.5个月之间差异不显著,但仍具有复发短于晚期趋势。Alberts等[11]研究表明,在转移性中晚期、复发宫颈癌患者的II期临床研究中,给予白蛋白结合型紫杉醇单药治疗,疾病稳定率为42.9%,部分缓解率为28.6%,中位PFS为5.0个月;而本文的研究结果客观缓解率比例要高出许多,且中位PFS也较高,这可能是由于白蛋白结合型紫杉醇联合铂类化疗方案药效优于单药治疗;类似结果也得到了Rose等[12]和Potter等[13]等的证实。
溶剂型紫杉醇的主要不良反应为周围神经毒性、发烧、骨髓抑制、乏力、过敏反应等[14-16]。本研究在第1次的化疗时对患者应用抗过敏预处理,之后的化疗中均未做抗过敏处理,而溶剂型紫杉醇即便在每个疗程的治疗时都进行抗过敏预处理,但其发生率仍为50%左右;骨髓抑制是限制性的抑制因素,本研究中,中性粒细胞减少发生率为69.7%,III级发生率为17.1%,且没有IV级发生。Nabholtz等结果表明[10]白蛋白结合型紫杉醇剂量为135~175 mg/m2时,其感觉神经异常发生率46%~70%,而本文的研究表明周围神经异常率仅为3.9%,这表明白蛋白结合型紫杉醇仍存在着感觉神经不良反应,但发生率较低。
综上,本文的研究表明对于复发及晚期妇科肿瘤患者采用白蛋白结合型紫杉醇联合铂类临床治疗效果较好,客观缓解率为50.1%,中位PFS 5.5个月,乏力、骨髓抑制、周围神经毒性反应以及胃肠道反应等不良反应少且轻,在妇科肿瘤单病研究中具有研究的价值。
[1] Uenami T,Mori M,Ageshio F,et al.Safe treatment of lung squamous cell carcinoma with nanoparticle albumin-bound Paclitaxel in a patient with a previous hypersensitivity reaction after docetaxel administration[J].Gan To Kagaku Ryoho, 2015,42(3):375-377.[2] 陈力,黄亮,张伶俐,等.紫杉类药物的研发现状及治疗卵巢癌的研究进展[J].中华妇幼临床医学杂志(电子版),2011,7(5):488-492.
[3] Desai N, Trieu V, Yao Z, et al.Increased antitumor activity, intratumor paclitaxel concentrations, and endothelial cell transport of cremophor-free, albumin-bound paclitaxel, ABI-007, compared with cremophor-based paclitaxel [J].Clin Cancer Res, 2006, 12(4): 1317-1324.
[4] 曾靖,张蓉.白蛋白结合型紫杉醇在妇科肿瘤中的研究进展[J].国际妇产科学杂志,2014,41(3):232-235.
[5] 曾靖,张蓉,黄曼妮,等.白蛋白结合型紫杉醇联合铂类治疗晚期或复发性妇科肿瘤的临床分析[J].癌症进展,2014,12(4):387-394.[6] 曾冬香,毕延智,凌扬.白蛋白结合型紫杉醇治疗晚期恶性肿瘤的疗效[J].江苏医药,2011,37(21):2508-2510.
[7] 廖富毅,潘瑞琳,杨劼,等.白蛋白结合型紫杉醇在乳腺癌新辅助化疗中的应用[J].国际医药卫生导报,2011,17(11):1343-1346.
[8] 郎景和,丁晓曼.当代妇科肿瘤临床诊治的特点和问题[J].癌症进展,2007,4(1):2-6.
[9] Socinski MA,Bondarenko I, Karaseva NA,et al.Weekly nab-paclitaxel in combination with carboplatin versus solvent- based paclitaxel plus carboplatin as firstline therapy in patients with advanced non- small- cell lung cancer: final results of a phase Ill trial[J].J Clin Oncol,2012,30(17):2055-2062.
[10] Nabholtz JM, Gelmon K, Bontenbal M,et al.Multicenter, randomized comparative study of two doses of paclitaxel in patients with metastatic breast cancer[J].J Clin Oncol,1996,14(6):1858-1867.
[11] Alberts DS, Blessing JA, Landrum LM, et al.Phase II trial of nab-paclitaxel in the treatment of recurrent or persistent advanced cervix cancer: a gynecologic oncology group study[J].Gynecol Oncol, 2012, 127(3): 451-455.
[12] Rose PG, Blessing JA, Gershenson DM, et al.Paclitaxel and cisplatin as first-line therapy in recurrent or advanced squamous cell carcinoma of the cervix: a gynecologic oncology group study[J].J Clin Oncol,1999,17(9): 2676-2680.
[13] Potter ME, Hatch KD,Potter MY,et al.Factors affecting the response of recurrent squamous cell carcinoma of the cervix to cisplatin[J].Cancer,1989,63(7):1283-1286.
[14] 吴妙芳,李晶,谢玲玲,等.紫杉醇在常见妇科恶性肿瘤中的应用[J].临床药物治疗杂志,2012,10(3):27-31.
[15] 颜笑健,梁立治,曾宗渊,等.铂类化疗敏感型卵巢上皮癌复发的影响因素[J].癌症,2014, 24 (6) :751-754.
[16] 成莉,李琳,邢辉.XRCC1基因多态性与卵巢癌对铂类药物化疗敏感性的相关性研究[J].临床肿瘤学杂志,2014,19(4):312-317.
(编校:苗加会)
Efficacyandcomplicationsofalbumin-boundpaclitaxelplusplatinuminadvancedgynecologiccancerpatients
ZHANG Jun-xiaoΔ, HU Chun-yan, CHU Guang-hua, LIU Chen
(Department of Gynecology, Northwest Women and Children’s Hospital, Xi’an 710061, China)
ObjectiveTo analyze the albumin-bound paclitaxel plus platinum treatment of recurrent and advanced gynecologic cancer patients the efficacy and complications.Methods76 patients with recurrent or advanced cancer patients (52 cases of cervical cancer and 22 patients with ovarian cancer, 2 cases of endometrial cancer) from June 2013 to June 2016 in our hospital were selected,and applied I albumin-bound paclitaxel 175 mg/m2,respectively, 58 cases of patients combined with platinum oxaliplatin (200 mg/m2, dl) and 18 cases of patients combined with carboplatin (200 mg/m2, dl), all patients were treated with intravenous chemotherapy, 21 days for a course of treatment; after two courses of treatment, recent clinical results and complications were analyzed.Results66 patients underwent primary efficacy, disease progression in 15 cases (22.7%), stable disease in 18 (27.3%), partial remission in 30 cases (45.5%), complete remission in 3 cases (4.6%), objective response rate 50.1%, median PFS 5.5 months, 32 patients died.The objective response rate of combined oxaliplatin 56.3% was significantly better than that of combined carboplatin 33.3% (P<0.05).Bone marrow suppression is the most common complication of neutropenia 17.1% incidence of grade III, but no grade IV patients; peripheral nerve paresthesia incidence of 53.9%, III, IV grade rate was 3.9%; only 2 patients allergic reactions; adverse reactions III, IV grade lower incidence overall.ConclusionThe albumin-bound paclitaxel plus platinum-term clinical effects of treatment for recurrent and advanced gynecologic cancer patients is excellent, the risk of adverse events can be estimated in the range of you.
albumin-bound paclitaxel; platinum; advanced gynecological tumors
10.3969/j.issn.1005-1678.2016.10.034
张峻霄,通信作者,男,博士,副主任医师,研究方向:妇科肿瘤治疗,E-mail:jun166123@163.com。
R73.3
A

