氨苄青霉素钠分子印迹传感器的研制与应用*
赵晓娟,张其美,2,曾景娣,白卫东,陈海光
(1 仲恺农业工程学院轻工食品学院,广东 广州 510225;2 广州酒家集团利口福食品有限公司,广东 广州 511442)
特稿
氨苄青霉素钠分子印迹传感器的研制与应用*
赵晓娟1,张其美1,2,曾景娣1,白卫东1,陈海光1
(1 仲恺农业工程学院轻工食品学院,广东广州510225;2 广州酒家集团利口福食品有限公司,广东广州511442)
以氨苄青霉素钠为模板分子,邻苯二胺为功能单体,利用电聚合法在金电极表面形成聚邻苯二胺膜,经0.5 mol/L NaOH-乙醇混合溶液(VNaOH:V乙醇=4:1)将模板分子洗脱,制得氨苄青霉素钠分子印迹传感器。以K3Fe(CN)6为探针,建立了氨苄青霉素钠的间接测定方法,并利用循环伏安法和方波伏安法对传感器的电化学性能进行评价。该传感器的方波伏安峰电流变化值与氨苄青霉素钠浓度在1.0×10-6~9.0×10-6mol/L范围内呈良好的线性关系,检出限为6.4×10-7mol/L。
分子印迹;电化学传感器;电聚合;氨苄青霉素钠;聚邻苯二胺
氨苄青霉素钠(Ampicillin sodium,AMP),又称氨苄西林钠,是一种广谱半合成的β-内酰胺类抗生素,具有较强的抗感染能力,广泛用于治疗敏感菌引起的奶牛感染性疾病。人们长期食用含AMP残留的牛奶及乳制品会产生耐药性和过敏反应。因此,检测牛奶等食品中AMP的含量具有重要意义。
目前测定AMP的方法主要有光谱法[1-2]、色谱及色谱-质谱联用法[3-4]、免疫分析法[5-6]和化学与生物传感器法[7-8]等。其中,传感器法由于具有灵敏快速、成本低廉等优点而备受关注。分子印迹聚合物(MIP)是一种具有良好选择性的高分子仿生材料,近年来已被广泛应用于制备不同药物残留的分子印迹传感器[9-10],但目前关于AMP分子印迹传感器的研究报道较少[11]。
本文以AMP为模板分子,邻苯二胺(o-PD)为功能单体,在金电极(AuE)表面通过循环伏安法电聚合形成聚邻苯二胺膜(PPD),除去模板分子后得到AMP分子印迹膜电极(AMP-MIP/AuE)。以K3Fe(CN)6为探针,建立AMP的间接测定方法,并对市售牛奶样品进行分析。
1 实 验
1.1仪器与试剂
CHI 1030B型电化学分析仪,三电极系统:工作电极为AuE或AMP-MIP/AuE,参比电极为Ag/AgCl(饱和KCl溶液)电极,辅助电极为铂丝电极,上海辰华仪器公司。
氨苄青霉素钠和盐酸金霉素,生工生物工程(上海)股份有限公司;头孢氨苄,上海源叶生物科技有限公司;青霉素钾和盐酸强力霉素,广州市齐云生物技术有限公司;邻苯二胺,西格玛奥德里奇(上海)贸易有限公司;铁氰化钾和乙酸,天津福晨化学试剂厂。所用试剂均为分析纯。
所有溶液均用超纯水(电阻率18.2 MΩ·cm)配制。
1.2实验方法
1.2.1AMP分子印迹膜的制备
将金电极分别用粒径为1.0、0.3、0.05 μm的α-Al2O3在专用绒毛垫上抛光,用超纯水洗净后,依次在1:1硝酸、无水乙醇和超纯水中超声清洗。将三电极体系置于含10 mmol/L o-PD、5 mmol/L AMP的0.20 mol/L HAc-NaAc(pH 5.2)缓冲溶液中,在0~0.8 V范围内循环伏安扫描20圈,在AuE表面形成包覆了AMP的聚邻苯二胺膜(AMP-PPD/AuE)。将AMP-PPD/AuE置于0.5 mol/L NaOH-乙醇混合溶液(VNaOH:V乙醇=4:1)中浸洗15 min,得到AMP分子印迹膜电极(AMP-MIP/AuE)。除不加AMP外,非印迹膜电极(nMIP/AuE)与印迹膜电极的制备步骤完全相同。
1.2.2 检测方法
循环伏安法(CV)测定条件:在含5.0 mmol/L K3Fe(CN)6的0.20 mol/L PBS(pH 7.0)中,于-0.2~0.6 V范围内进行测定。扫描速率为100 mV/s。
方波伏安法(SWV)测定条件:将电极置于含5.0 mmol/L K3Fe(CN)6和一定浓度AMP的0.20 mol/L PBS(pH 7.0)中富集一定时间后,于-0.2~0.6 V范围内进行测定。电位增量为4 mV,方波振幅为25 mV,方波频率为15 Hz。
2 结果与分析
2.1分子印迹膜的电聚合
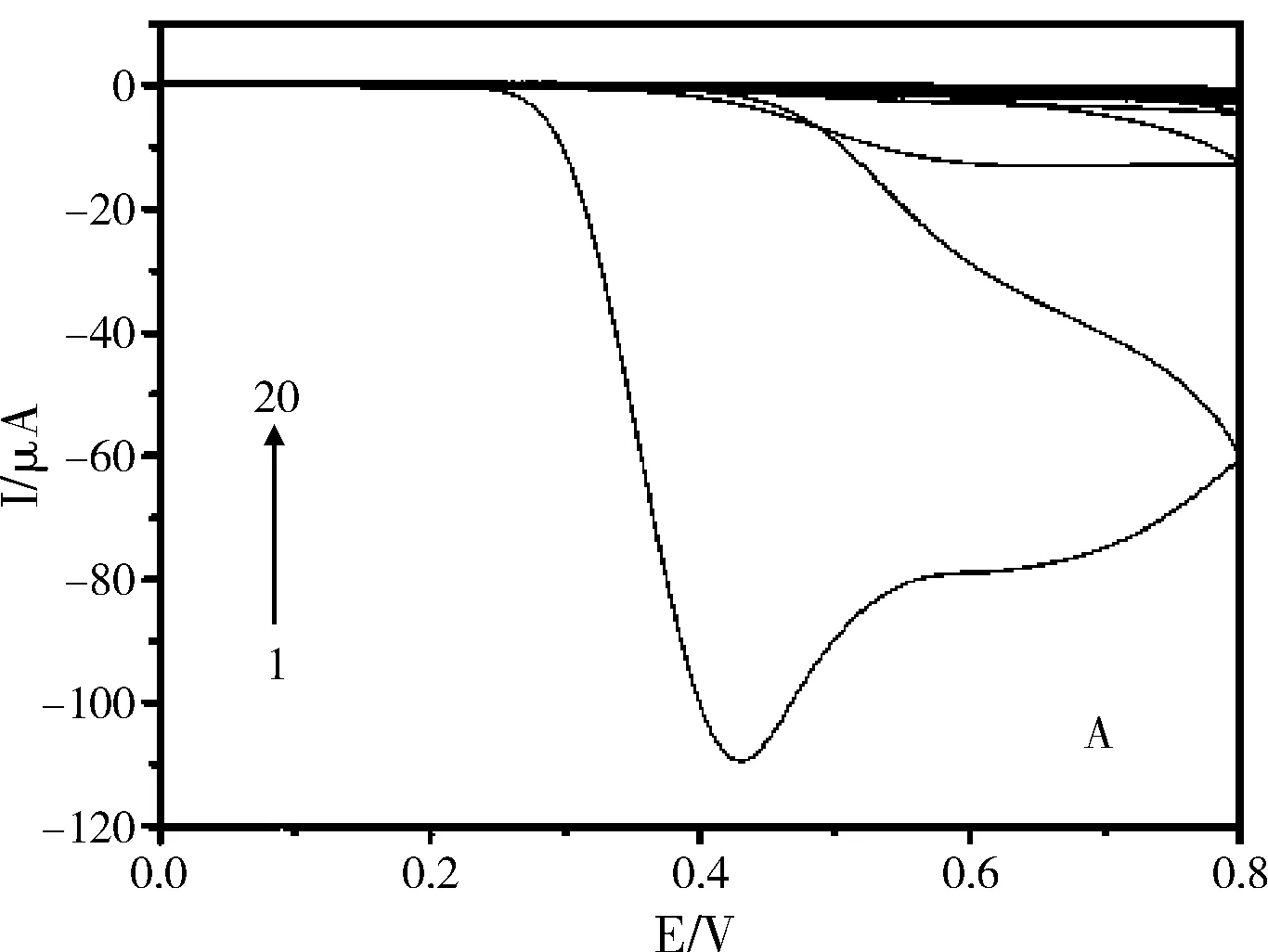

图1 不含AMP(A)和含AMP(B)时o-PD的电聚合曲线
图1A为o-PD在AuE表面的电聚合曲线,图1B为含有AMP时o-PD的电聚合曲线。第一圈扫描时在0.4~0.5 V间出现了1个不可逆的氧化峰。随扫描圈数的增加,该氧化峰的峰电流逐渐减小直至消失,表明在AuE表面逐渐形成不导电的PPD膜。比较图1A和B可知,当AMP存在时,o-PD的电聚合曲线没有明显变化,表明在AMP分子印迹膜形成过程中,聚合液中AMP的存在不会影响o-PD的电聚合。
2.2分子印迹膜制备条件优化
2.2.1单体和模板分子的浓度及配比
AMP浓度为5 mmol/L时,按照o-PD与AMP的摩尔浓度比为1:1、2:1和3:1的配比制备印迹膜电极,研究不同配比时制备的AMP-MIP/AuE对K3Fe(CN)6的响应电流值大小。结果表明,o-PD与AMP的摩尔浓度分别为10 mmol/L和5 mmol/L,即o-PD与AMP的摩尔浓度比为2:1时得到的AMP-MIP/AuE具有最高的响应灵敏度,因此选择单体与模板分子的摩尔浓度比为2:1。
2.2.2聚合圈数
印迹膜的厚度可通过电聚合时的扫描圈数(即聚合圈数)进行控制,而膜厚直接影响传感器的电化学性能。对聚合15、20、25和30圈时制备的AMP-PPD/AuE中模板分子的洗脱时间和传感器的响应灵敏度进行比较。结果发现,聚合15圈时所得传感器的测试重现性较差,主要原因是膜厚较小且稳定性差;随圈数的增加,传感器的响应电流增加,但同时膜厚增加,导致模板分子的洗脱时间相应延长,因此选择聚合圈数为20圈。
2.2.3模板分子的洗脱方法
将AMP-PPD/AuE和非印迹电极分别置于10%稀酸(硫酸、硝酸、盐酸、乙酸)、0.5 mol/L NaOH和0.5 mol/L NaOH-乙醇混合溶液(VNaOH:V乙醇=4:1)中浸洗15 min。通过比较洗脱AMP后得到的AMP-MIP/AuE在K3Fe(CN)6溶液中的响应峰型和峰电流的大小判断洗脱效果,并通过非印迹电极的对照测试考察上述洗脱液对PPD膜结构及稳定性的影响。结果表明,0.5 mol/L NaOH-乙醇混合溶液(VNaOH:V乙醇=4:1)对PPD膜的结构及稳定性无明显影响,且对模板分子的洗脱效果较好。因此,选择0.5 mol/L NaOH-乙醇混合溶液(VNaOH:V乙醇=4:1)作为洗脱溶液。
2.2.4模板分子的洗脱时间
考察洗脱不同时间时印迹电极对K3Fe(CN)6溶液的响应情况。AMP-PPD/AuE在K3Fe(CN)6溶液中没有出现明显的氧化峰。随洗脱时间的延长,PPD膜中的AMP分子被逐渐洗脱下来,聚合膜中的特异性印迹孔穴的数量增加,K3Fe(CN)6在0.2 V处的氧化峰电流逐渐增大,洗脱10 min后电流值趋于稳定,为保证模板分子洗脱完全,选择15 min作为洗脱时间。
2.3分子印迹膜的表征
AuE、AMP-PPD/AuE和AMP-MIP/AuE在K3Fe(CN)6溶液中的循环伏安响应如图2A所示。K3Fe(CN)6在AuE上有一对可逆的氧化还原峰。当在AuE表面电聚合形成AMP-PPD膜时,由于聚合膜自身的电惰性,K3Fe(CN)6分子不能到达电极表面,因此AMP-PPD/AuE无明显的氧化还原峰。洗脱模板分子后,聚合膜中形成了与AMP分子结构相匹配的印迹孔穴,这些孔穴可以作为传质通道使K3Fe(CN)6分子到达电极表面发生反应,于是在AMP-MIP/AuE上出现了K3Fe(CN)6的氧化还原峰。
AMP-PPD/AuE、AMP-MIP/AuE和nMIP/AuE在K3Fe(CN)6溶液中的方波伏安响应如图2B所示。AMP-MIP/AuE在0.2 V处有1个明显的K3Fe(CN)6氧化峰,而nMIP/AuE和AMP-PPD/AuE均没有出现氧化峰,表明在电聚合过程中,AMP分子嵌入了PPD膜中,当模板分子被洗脱后,聚合膜中形成了AMP的印迹孔穴,K3Fe(CN)6分子可以到达电极表面发生反应,从而产生特征响应峰。


图2 不同电极在5.0 mmol/L K3Fe(CN)6溶液中的CV(A)和SWV(B)图
2.4分子印迹膜的分析特性
2.4.1富集时间
研究了AMP-MIP/AuE在0.1 mmol/L AMP溶液中的富集时间对其在K3Fe(CN)6溶液中响应电流的影响。随富集时间的增加,K3Fe(CN)6的氧化峰电流逐渐减小,当富集90 s时,峰电流趋于稳定,表明AMP-MIP/AuE对AMP分子的吸附量达到稳定,因此,AMP-MIP/AuE在AMP溶液中的最佳富集时间为90 s。
2.4.2选择性
以3.0×10-6mol/L AMP溶液为对照,考察10倍浓度的头孢氨苄、盐酸金霉素、青霉素钾和盐酸强力霉素对测定AMP的干扰情况。结果发现,AMP-MIP/AuE在上述干扰物质溶液中富集后,K3Fe(CN)6的特征峰电流没有明显变化,表明AMP-MIP/AuE对AMP具有良好的选择性。
2.4.3重现性
用同一支AMP-MIP/AuE对3.0×10-6mol/L AMP溶液测定10次,测得K3Fe(CN)6氧化峰电流的相对标准偏差(RSD)为5.1%。用5支金电极,按相同方法制备AMP-MIP/AuE,测定其对AMP溶液的响应情况,K3Fe(CN)6氧化峰电流的RSD为3.4%。结果表明该印迹膜电极具有良好的测试重现性和制作重现性。
2.4.4稳定性
将AMP-MIP/AuE浸入超纯水中,于室温放置保存,每隔一天对3.0×10-6mol/L AMP溶液测试一次,六天后响应电流降至初始电流的90.7%,表明该印迹膜电极具有良好的稳定性。
2.4.5线性范围与检出限
将AMP-MIP/AuE浸入不同浓度的AMP溶液中进行富集,考察富集后K3Fe(CN)6的氧化峰电流与AMP浓度之间的关系(图3)。随AMP浓度的的增加,K3Fe(CN)6的氧化峰电流逐渐减小。以空白溶液为对照,氧化峰电流的变化值与AMP浓度在1.0×10-6~9.0×10-6mol/L范围内呈良好的线性关系,回归方程为:-ΔI=90.65 c+0.866(r=0.993)。基于3倍的信噪比(S/N=3),得到AMP的检出限为6.4×10-7mol/L。

图3 K3Fe(CN)6氧化峰电流变化值与AMP浓度的关系曲线(插图为AMP-MIP/AuE测定不同浓度AMP溶液的SWV图)
2.5实际样品的测定
取购自超市的新鲜脱脂牛奶2种,按照文献[12]方法进行前处理后,使用AMP-MIP/AuE进行方波伏安法测试,结果均未检测出AMP。对其中1种牛奶样品进行加标回收实验,测得加标回收率为90.5%~108.3%,RSD小于5.2%,表明该检测方法准确可靠,可用于实际牛奶样品中AMP含量的测定。
3 结 论
本研究以氨苄青霉素钠为模板分子,采用电聚合邻苯二胺的方法在金电极表面修饰氨苄青霉素钠分子印迹膜,对分子印迹膜的制备条件进行了优化,并对牛奶样品中氨苄青霉素钠残留进行了检测。实验结果表明,该分子印迹传感器对氨苄青霉素钠具有良好的选择性,结果准确可靠,检测速度快,适用于牛奶样品中氨苄青霉素钠的测定。
[1]Tótoli E G, Salgado H R N. Development and Validation of the Quantitative Analysis of Ampicillin Sodium in Powder for Injection by Fourier-transform Infrared Spectroscopy (FT-IR)[J].Phys Chem,2012, 2(6): 103-108.
[2]Dinc E, Baleanu D. A new fractional wavelet approach for the simultaneous determination of ampicillin sodium and sulbactam sodium in a binary mixture[J]. Spectrochim Acta Part A, 2006, 63(3): 631-638.
[3]王宏伟,杨春光,曹冬梅,等. LC-MS-MS法检测牛奶中14种β-内酰胺类兽药的残留量[J].中国乳品工业, 2015, 43(1): 39-43.
[4]Kang M A, Kang J S. Stability Test of Ampicillin Sodium Solutions in the Accufuser Elastomeric Infusion Device Using HPLC: UV Method[J]. Pharmacol Pharm, 2012, 3(4): 462-467.
[5]姜侃,厉永纲,沈泓,等.应用酶联免疫技术建立鲜乳中β-内酰胺酶间接检测方法[J].中国食品卫生杂志, 2013, 25(5): 405-409.
[6]张建群,刘翔,杨扬,等. ELISA法测定氨苄青霉素用多克隆抗体的制备与鉴定[J].中国食品学报,2006,6(2): 11-19.
[7]刘瑾, 张婉洁,王文,等.利用SPR生物传感器检测牛奶中的氨苄青霉素残留[J].化学研究与应用,2013, 25(5): 754-759.
[8]Khalilzadeh M A, Khaleghi F, Gholami F, et al. Electrocatalytic Determination of Ampicillin Using Carbon-Paste Electrode Modified with Ferrocendicarboxylic Acid[J]. Anal Lett, 2009,42(3): 584-599.
[9]Lian W J, Liu S, Yu J H, et al. Electrochemical sensor using neomycin-imprinted film as recognition element based on chitosan-silver nanoparticles/graphene-multiwalled carbon nanotubes composites modified electrode[J]. Biosens Bioelectron, 2013, 44(23): 70-76.
[10]Li J P, Jiang F Y, Li Y P, et al. Fabrication of an oxytetracycline molecular-imprinted sensor based on the competition reaction via a GOD-enzymatic amplifier[J]. Biosens Bioelectron, 2011, 26(5): 2097-2101.
[11]Wei S L, Liu Y, Hua T, et al. Molecularly imprinted electrochemical sensor for the determination of ampicillin based on a gold nanoparticle and multiwalled carbon nanotube-coated pt electrode[J]. J Appl Polym Sci, 2014, 131(16): 318-323.
[12]Jeon M, Kim J, Paeng K J, et al. Biotin-avidin mediated competitive enzyme-linked immunosorbent assay to detect residues of tetracyclines in milk[J]. Microchem J, 2008, 88(1): 26-31.
Development and Application of Ampicillin Sodium Molecularly Imprinted Sensor*
ZHAOXiao-juan1,ZHANGQi-mei1,2,ZENGJing-di1,BAIWei-dong1,CHENHai-guang1
(1 College of Light Industry and Food Science, Zhongkai University of Agriculture and Engineering, Guangdong Guangzhou 510225; 2 Guangzhou Restaurant Group Likofu Food Co., Ltd., Guangdong Guangzhou 511442, China)
Ampicillin sodium was used as template molecule, o-phenylenediamine was used as functional monomer, poly(o-phenylenediamine) film was electropolymerized on the surface of a gold electrode. The ampicillin sodium molecularly imprinted sensor was obtained by eluting template molecules using the mixed solution of 0.5 mol/L NaOH and alcohol (4:1,VNaOH:Valcohol). Ampicillin sodium was determined indirectly based on potassium ferricyanide as electroactive probe. The electrochemical properties of the sensor were investigated using cyclic voltammetry and square wave voltammetry. The peak current changes in SWV had good linear relationship with the concentration of ampicillin sodium in the range of 1.0×10-6~9.0×10-6mol/L. The detection limit was 6.4×10-7mol/L.
molecularly imprinted; electrochemical sensor; electropolymerization; ampicillin sodium; poly(o-phenylenediamine)
国家自然科学基金项目(No: 21005091);广东省自然科学基金项目(No: S2013010013416);广东省高等学校优秀青年教师培养计划资助项目(No: Yq2013097)。
赵晓娟(1980-),女,博士,副教授,主要从事电化学分析与食品安全检测。
白卫东(1967-),男,硕士,教授,主要从事食品化学与食品添加剂。
O657.1
A
1001-9677(2016)012-0001-04

