球形红细菌无机焦磷酸酶的寡聚化及酶活性分析*1
陈果果, 孙梅好
(浙江师范大学化学与生命科学学院,浙江金华 321004)
球形红细菌无机焦磷酸酶的寡聚化及酶活性分析*1
陈果果, 孙梅好
(浙江师范大学化学与生命科学学院,浙江金华321004)
球形红细菌(Rhodobacter sphaeroides)是一种重要的微生物资源,其无机焦磷酸酶(PPase)属于Ⅱ型可溶性焦磷酸酶.通过原核表达和纯化,得到了正常型RsPPase和突变型RsPPasemono,进一步进行了寡聚化和酶活性分析.结果表明:突变型RsPPasemono为单聚体,在钴离子存在条件下会导致谷胱甘肽S-转移酶(glutathione sulfotransferase,GST)标签进行蛋白酶切,且去标签后的RsPPasemono催化效率较高(Kcat/Km(PPi)=12.64 L·μmol-1·min-1),相对于RsPPase-GST提高了12倍;在无钴离子存在条件下仍能进行蛋白酶切,且保持催化效率(Kcat/Km(PPi)=0.34 L·μmol-1·min-1).
球形红细菌;无机焦磷酸酶;寡聚化;钴离子
无机焦磷酸酶(inorganic pyrophosphatase,PPase,EC 3.6.1.1)广泛存在于各种类型的细胞内,是一种必要的、普遍的金属依赖性酶.无机焦磷酸(inorganic pyrophosphate,PPi)是各种生物合成反应中的副产品[1],其浓度影响细胞内生理反应的平衡.PPase能够水解PPi生成2个无机正磷酸(inorganic ortho-phosphate,Pi)[2],并释放PPi中磷酸酐键的能量,促进DNA和RNA聚合反应、辅酶合成、硫酸盐活化、氨基酸和脂肪酸活化等生化反应[3-4].已有研究表明,PPase对生物体的生长具有重要的作用[5].当PPase在植物体内过量表达时,可影响光合成产物的分配,与非转基因植物相比提高了可溶性糖的比例[6].表明PPase具有较大的经济价值和社会应用价值.
无机焦磷酸酶(PPase)可分为4类:膜内在焦磷酸酶(membrane-integral pyrophoshatase,mPPase)[7];可溶性无机焦磷酸酶(soluble inorganic pyrophoshatase,sPPase)3个同源家族,即Ⅰ型(广泛存在于在所有类型的生物体中)、Ⅱ型(迄今局限于细菌和古细菌,数量有限)和Ⅲ型(修饰卤代烷脱卤酶,仅存在于少数细菌中,尚未获得其特性)[8-11].目前研究者们专注于前3个PPase家族的研究,因为它们的酶功能大多或完全致力于PPase催化[12].该焦磷酸酶的第一个晶体结构报道于50多年前[13].这表明对PPase结构与功能的分析研究具有很大的空间及意义.
所有PPase都需要3或4个金属二价阳离子作为辅助因子,不同的家族、pH值、PPi浓度下其催化效果不同[14-15].该催化反应包括基团的去活化和亲核体的产生,但不产生酶-磷酸中间体.表明催化均发生在无机金属-磷酸盐笼(inorganicmetal-phosphate cage)之内,蛋白侧链起辅助作用[16].其中:mPPase催化常数最小(Kcat≈10 s-1);家族Ⅰ型PPase的催化常数比mPPase大一个数量级(Kcat≈200 s-1);家族Ⅱ型PPase的催化常数比家族Ⅰ型PPase的再大一个数量级(Kcat≈2 000 s-1).因此,家族Ⅱ型PPase的催化效率较大,其经济意义和应用前景也更大.
家族Ⅱ型PPase发现于1998年,仅出现在细菌、古细菌谱系(尤其是杆状菌和梭状芽孢杆菌)及一些人类病原体中.家族Ⅱ型PPase具有变构调节(allosteric regulation)作用[17-18],为同源二聚体蛋白质,属于DHH磷酸酯酶超家族(DHH phosphoesterase superfamily),其中DHH是指在N末端结构域的保守序列Asp-His-His与金属特异性结合.家族Ⅱ型PPase的活性位点位于N端的DHH和C端的DHHA2结构域之间[2,5].在过渡金属离子(Mn2+或Co2+作为底物)存在下,家族Ⅱ型PPase与其结合(具有纳摩尔级的亲和力),显示最高的催化活性;而其与Mg2+结合(具有微摩尔级的亲和力)时,其活性降低[17].因为过渡金属倾向于软配位体,如Cys或His.在催化过程中,C末端结构域关闭了N末端结构域,活性金属离子从五配位体变为六配位体,起到协调作用[19].过渡金属容忍这种变化的能力比Mg2+好.
已有研究表明,蛋白质的结构差异主要来自活性中心底物的有无[20].在无底物的情况下,2个结构域呈开放构象(PDB:1K23)[21].而在底物或者产物存在的情况下,2个结构域呈闭合构象(PDB:2HAW)[22].笔者推测:当酶与底物结合时,导致构象闭合;当酶释放产物时,导致构象开放[23].本实验采用Co2+作为催化条件,对PPase进行了相关活性测定,研究了其蛋白构象与催化机理的关系.
球形红细菌(Rhodobacter sphaeroides)作为一种重要的微生物资源,具有解磷解钾、活化土壤中的硅、钙和镁等中量元素、提高或延长肥效、提高作物抗逆性等功能,在工农业生产和生活中具有广泛的应用,其PPase属于家族Ⅱ型.国内对其PPase的研究较少,其活性调控尚没有报道.本研究利用定点突变技术和双标签(6×His标签与GST标签)蛋白纯化体系,原核表达、纯化获得了正常型蛋白RsPPase和突变型蛋白RsPPasemono,并进行了寡聚化和活性分析,为球形红细菌扩大化应用奠定了基础.
1 材料和方法
1.1试剂材料
蛋白纯化试剂DTT,IPTG,溶菌酶、胃蛋白酶抑制剂(Pepstatin A)为Amresco公司产品;胰蛋白酶抑制剂(PMSF)为BBI公司产品;GSH购自Sigma公司;Ni-NTA His·Bind Superflow Resin为Novagen公司产品;PreScission Protease,Glutathione-Sepharose 4 Fast Flow,HiLoad 16/600 Superdex 200 prep grade为GE Healthcare公司产品;PrimeSTAR®HSDNA Polymerase,dNTPMixture为宝生物工程(大连)有限公司产品;Dpn I限制性酶为MBI公司产品.Millipore超滤管;Invitrogen EnzChek®磷酸检测试剂盒;AxyPrep质粒DNA小量试剂盒.常规生化试剂及其耗材均购自国内公司.
感受态细胞E.coli DH5α及BL21(DE3)、由表达载体pGEX-6P-1改造的pSKB4-RsPPase(在PreS-cission Protease编码区和Bam HⅠ识别位点之间加入NdeⅠ识别位点和6×His).
1.2球形红细菌PPase的定点突变
球形红细菌PPase(RsPPase)是同源二聚体,由β折叠PIEITVR(107-113)和相邻单体N端的PIEITVR(107-113)之间的相互作用形成.猜测破坏它们之间的相互作用有利于单聚体形成.因此,本实验将该β折叠PIEITVR突变为RIRDTDR,形成突变蛋白P107R-E109R-I110D-V112D,即RsPPasemono.按照Stratagene的QuikChange®XL Site-Directed Mutagenesis Kit引物设计方法,设计定点突变PCR引物如下:
RsPPasemono-F:5'-gggatcaagaccaagtcccgcatccgcgataccgatcgtccgctggcctgcacc-3'.
RsPPasemono-R:5'-ggtgcaggccagcggacgatcggtatcgcggatgcgggacttggtcttgatccc-3'.
利用定点突变技术,PCR突变pSKB4-RsPPase,程序结束后取5~10μL样品用1.0%琼脂糖凝胶电泳检测.所有突变载体经测序验证后用于原核表达.
1.3球形红细菌PPase及其突变体蛋白的原核表达与纯化
将含有pSKB4-RsPPase和pSKB4-RsPPasemono的表达菌株BL21(DE3)扩大培养,37℃振荡培养至A600达到0.6~0.8.用0.5 mmol·L-1IPTG诱导16 h后离心收集菌体.
用裂解液(50 mmol·L-1Hepes(4-羟乙基哌嗪乙磺酸)缓冲液(pH 8.0),0.4 mol·L-1KCl,290μmol·L-1PMSF(苯甲基磺酰氟),1.5μmol·L-1Pepstatin A,0.1 mg/mL溶菌酶)悬浮菌体后,超声波破碎菌体至菌液澄清,12 000 r/min离心,收集上清液.
利用目的蛋白带有6×His和GST标签,先后过Ni-NTA His·Bind Superflow和Glutathione-Sepharose 2种亲和色谱柱以获得目的融合蛋白,加入PreScission Protease进行酶切,重新上GST柱获得纯净的目的蛋白并透析(25 mmol·L-1Hepes缓冲液(pH 8.0),100 mmol·L-1KCl,1.5 mmol·L-1DTT(二硫苏糖醇),5%甘油),SDS(十二烷基硫酸钠)-PAGE(聚丙烯酰胺凝胶)电泳分析不同纯化阶段的样品纯度.
在无Co2+情况下,得到RsPPase和RsPPasemono;在有Co2+情况下,所有缓冲液中加入0.1mmol·L-1CoCl2,得到RsPPase-GST和RsPPasemono.
1.4酸性蛋白的非变性聚丙烯酰胺凝胶电泳
配制不含有SDS的5×Loading Buffer,并制备不含有SDS的5%浓缩胶和12%分离胶.将电泳槽置于冰中,整个电泳过程处于0~4℃条件下.
1.5分子筛色谱检测
配制缓冲液(50 mmol·L-1Hepes(pH 8.0),50 mmol·L-1KCl),抽滤、脱气处理后备用.清洗、平衡柱和系统后,用2mg/mL蓝色葡聚糖测定外水体积(Vo).将4种标准蛋白(牛血清白蛋白67.5 kD,鸡蛋清白蛋白44 kD,β-乳球蛋白32 kD和α-胰凝乳蛋白酶25 kD)按一定比例混合后低温离心,取上清液上样,测定波长280 nm处的吸光度,分别记录洗脱体积Ve,并利用公式(2)计算Kav.绘制以Kav为横坐标,lg Mr为纵坐标的标准蛋白曲线.测定2种纯化所得蛋白RsPPase和RsPPasemono,根据其流出体积计算相对分子质量.平行实验3次.

式(1)中:r表示柱子半径;l表示柱子长度.
1.6球形红细菌PPase及其突变体蛋白的酶活性测定
利用EnzChek®Phosphate Assay Kit测定焦磷酸酶的活性.依次向反应体系(1×Reaction buffer,0.2 mmol·L-1MESG(2-氨基-6-巯基-7-甲基嘌呤核苷),2 U/mL PNP(嘌呤核苷酸磷酸化酶))中加入磷酸标准溶液0,20,30,40,50,60,70,80μmol·L-1,测定波长360 nm处的吸光度,绘制磷酸盐标准曲线.
保持反应条件和反应体系相同,Co2+-PPase-GST终浓度为0.84μmol·L-1,反应体系中焦磷酸的浓度分别为0,5,10,20,40,80,150和300μmol·L-1;无Co2+的PPase无酶活性;Co2+-PPasemono的终浓度为0.1μmol·L-1,反应体系中焦磷酸的浓度分别为0,5,10,20,40,80,150和300μmol·L-1;无Co2+的PPasemono终浓度为1.4μmol·L-1,反应体系中焦磷酸的浓度分别为0,5,10,20,40,80,150,300和600μmol·L-1,分别记录各反应液吸光度的变化速率.平行实验3次,根据标准曲线计算出磷酸的生成速率,计算出4种焦磷酸酶的最大反应速率(Vm)和米氏常数(Km).
2 结果与分析
2.1球形红细菌PPase的突变PCR
球形红细菌PPase基因大小为918 bp,原核表达载体pSKB4大小约为5 000 bp,故pSKB4-RsPPase约为 5 900 bp.以 pSKB4-RsPPase为模板、突变引物为RsPPasemono-F 和RsPPasemono-R进行PCR扩增,结果见图1,经1%琼脂糖凝胶电泳发现并获得预期大小的DNA片段,经测序验证后用于原核表达.
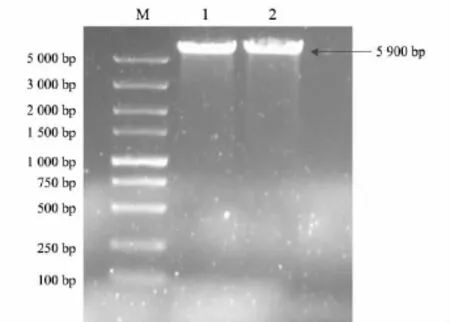
图1 PCR扩增琼脂糖凝胶电泳图
2.2RsPPase及RsPPasemono的诱导表达及纯化
用SDS-PAGE凝胶电泳检测蛋白的表达与纯化效果,结果见图2.目的蛋白RsPPase及RsPPasemono约为33 kD,标签蛋白GST约为28 kD,融合蛋白RsPPase-GST及RsPPasemono-GST约为61 kD.在Co2+存在的条件下,RsPPasemono可酶切除去标签,RsPPase不能去标签;在无Co2+的条件下,RsPPase 和RsPPasemono均能去标签.
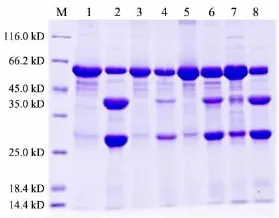
图2 无Co2+和有Co2+条件下RsPPase和RsPPasemono的酶切结果
2.3RsPPase及RsPPasemono的Native-PAGE凝胶电泳
非变性电泳是指在电泳过程中蛋白质处于非变性状态,其迁移率取决于蛋白质的电荷和分子量.正常型RsPPase为二聚体蛋白,故RsPPase-GST的分子量约为122 kD;突变型RsPPasemono预期为单聚体,故RsPPasemono-GST的预期分子量约为61 kD.利用Native-PAGE凝胶电泳可以推测出正常型蛋白RsPPase-GST的分子量大于100 kD,突变型蛋白RsPPasemono-GST的分子量接近66 kD(见图3).
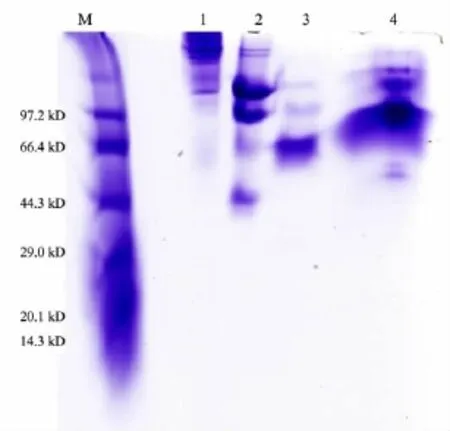
图3 有Co2+条件下RsPPase和RsPPasemono酶切前后的Native-PAGE凝胶电泳图
在有Co2+条件下进行酶切,融合蛋白RsPPase-GST及RsPPasemono-GST均能除去GST标签(28 kD)后得到目的蛋白RsPPase(理论值66 kD)及RsPPasemono(预期值33 kD),但酶切不彻底,且不能准确判断分子量大小.为进一步验证它们的分子量大小,进行了凝胶过滤色谱.
2.4RsPPase及RsPPasemono的分子量测定
本研究中凝胶过滤柱体积(Vc)为120 mL.利用蓝色葡聚糖2000测定外水体积(Vo)为45.13 mL.利用4种标准蛋白绘制葡聚糖凝胶过滤蛋白分子量标准曲线.图4为正常型RsPPase及突变型RsPPasemono的凝胶过滤谱图,具体实验数据及计算结果见表1.

图4 RsPPase及RsPPasemono的凝胶过滤谱图
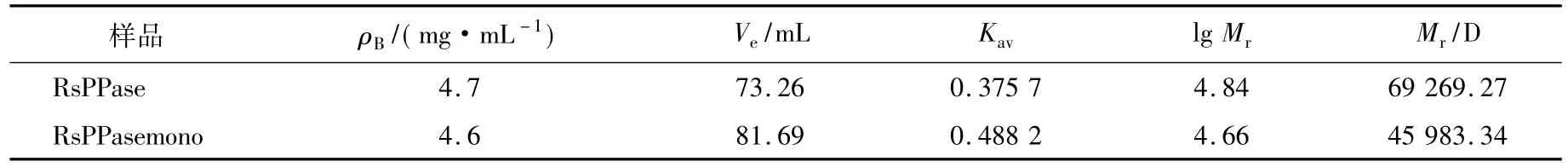
表1 RsPPase及RsPPasemono凝胶色谱洗脱体积及其相应的分子量
球形红细菌PPase为二聚体,其理论分子量为66 kD;RsPPasemono预期为单聚体,故RsPPasemono的预期分子量约为33 kD.通过凝胶色谱测定,RsPPase及RsPPasemono的分子量分别为69.3 kD和46.0 kD.
2.5RsPPase及RsPPasemono的酶活性测定
球形红细菌PPase正常蛋白RsPPase在Co2+存在条件下有活性,在无Co2+条件下RsPPase没有活性,间接证明PPase是一种Co2+依赖性酶.突变型RsPPasemono在Co2+存在条件下的活性较大,在无Co2+条件下仍有活性.利用KaleidaGraph 3.5作图软件对各蛋白进行了米氏方程拟合,所有蛋白的活性参数见表2.

表2 RsPPase及RsPPasemono的活性参数
3 讨论
PPase是广泛存在于自然界中以无机焦磷酸(PPi)为底物的磷酰基转移酶(phosphoryl-transfer enzymes),水解生成无机正磷酸(Pi),调节细胞内的PPi浓度,在脂代谢(包括脂合成与分解)、钙吸收及骨形成和DNA合成等生物化学转化中扮演重要的角色[24],对生物代谢具有重要意义.研究发现,PPase催化过程需要3个二价阳离子(Mg2+,Mn2+,Co2+或Zn2+),其中2个与酶活性中心结合,而第3个形成PPi-X2+复合体[16].其中,钴离子对维持RsPPase的活性具有重要的作用[18].RsPPase属于家族Ⅱ型,为同源二聚体.Celis等[25]的研究结果表明球形红细菌PPase的Km和Kcat分别为0.35 mmol/L和80 s-1.
本研究通过RsPPase结构模拟分析,对RsPPase进行了定点突变,利用亲和色谱技术、原核表达、纯化得到了4种蛋白——Co2+-RsPPase-GST,Co2+-RsPPasemono,RsPPase和RsPPasemono,并对4种蛋白进行了寡聚化和活性分析.
分析SDS-PAGE凝胶电泳图得出:Co2+-RsPPase-GST只有少量能够酶切;Co2+-RsPPasemono-GST,RsPPase-GST和RsPPasemono-GST均能酶切,但均不能完全酶切,其酶切条件优化有待进一步探讨.
同时,本研究发现,SDS-PAGE凝胶电泳图中RsPPase和RsPPasemono酶切后的条带在35 kD和44 kD之间.因此,利用Native-PAGE凝胶电泳和凝胶过滤色谱法进一步测定了RsPPase和RsPPasemono的分子量.分析Native-PAGE凝胶电泳图发现,RsPPase-GST和RsPPasemono-GST的分子量符合预期值.但分子筛结果均略大于预期值,推测是由于操作误差和蛋白浓度等因素造成的.因此RsPPasemono为单聚体.
在闭合构象状态下(Co2+存在条件下),正常型蛋白N端的GST标签受到另一单体C端的影响而导致自由度变小,从而掩盖了蛋白酶的识别位点,导致不能进行酶切.此外,由于其C端结构域不能打开释放产物和结合底物,从而降低了融合蛋白 RsPPase-GST的活性 (Kcat/Km(PPi)=1.11 L·μmol-1·min-1).突变型蛋白为单聚体,其N端的GST标签自由度不受影响,C端结构域也能打开释放产物和结合底物,故能进行蛋白酶切,去标签后的RsPPasemono催化效率较高(Kcat/Km(PPi)=12.64 L·μmol-1·min-1),较前者增大了约12倍.
在开放构象状态下(无Co2+条件下),正常型蛋白N端的GST标签不受另一单体的影响而具有较大的自由度,占据对应单体N端结构域的空间,能够经酶切产生游离的RsPPase,但无钴离子以维持其活性,即无活性.突变型蛋白同理也能进行蛋白酶切得到RSPPasemono,但仍保持较低的催化效率(Kcat/Km(PPi)=0.34 L·μmol-1·min-1).
RsPPase是一种金属钴离子依赖性酶,N端的GST标签和Co2+与活性位点的结合,均通过改变构象影响其活性.本研究通过比较以上4种蛋白的酶切效果和催化效率,为分析钴离子和GST标签影响其酶活的机制奠定了基础.
[1]王异星,李明启.焦磷酸在植物细胞能量代谢中的作用[J].热带亚热带植物学报,1997,5(4):85-90.
[2]Sancha N D L,Coello-Coutiño M P,Valencia-turcotte L G,et al.Characterization of two soluble inorganic pyrophosphatases from Arabidopsis thaliana[J].Plant Science,2007,172(4):796-807.
[3]Hernández-domíguez E E,Valencia-turcotte L G,Rodríguez-sotres R.Changes in expression of soluble inorganic pyrophosphatases of phaseolus vulgaris under phosphate starvation[J].Plant Science,2012,187(3):39-48.
[4]Mohammed SA,Nishio S,Takahashi H,et al.Dynamic behavior of oligomeric inorganic pyrophosphatase explored by quasielastic neutron scattering[J].Journal of Physical Chemistry B,2012,116(33):9917-9921.
[5]Petersburg S,Kajander T,Kellosalo J,et al.Inorganic pyrophosphatases:one substrate,three mechanisms[J].Febs Letters,2013,587(13):1863-1869.
[6]张宁,司怀军,柳娜,等.马铃薯无机焦磷酸酶基因cDNA在大肠杆菌中的表达及蛋白质特征分析[J].分子植物育种,2008,6(6):1107-1110.
[7]Serrano A,Perez-Castiñeira JR,Baltscheffsky H,et al.Proton-pumping inorganic pyrophosphatases in some archaea and other extremophilic prokaryotes[J].Journal of Bioenergetics and Biomembranes,2004,36(1):127-133.
[8]Yan Xufan,Dong Qing,Zheng Minhui,etal.Characterization of a family I-liked alkaline-resistant inorganic pyrophosphatase from the hyperthermophilic archaeon pyrococcus furiosus for rapid determination of sugar nucleotidyltransferase at high temperature[J].Journal of Molecular Catalysis B:Enzymatic,2013,98(9):15-20.
[9]Hoelzle K,Peter S,Sidler M,et al.Inorganic pyrophosphatase in uncultivable hemotrophicmycoplasmas:identification and properties of the enzyme from Mycoplasma suis[J].Bmc Microbiology,2010,10(1):116-127.
[10]Perez-Castineira JR,Hernandez A,Drake R.A plant proton-pumping inorganic pyrophosphatase functionally complements the vacuolar atpase transport activity and confers bafilomycin resistance in yeast[J].Biochemical Journal,2011,437(14):269-278.
[11]Mohammed SA,Nishio S,Takahashi H,et al.Role of vacuolar H+-inorganic pyrophosphatase in tomato fruit development[J].Journal of Experimental Botany,2012,63(15):5613-5621.
[12]姬长合,王靖.酿酒酵母无机焦磷酸酶基因在大肠杆菌中的表达及其意义[J].吉林大学学报:医学版,2012,38(1):70-74.
[13]Klemme J,Klemme B,Gest H.Catalytic properties and regulatory diversity of inorganic pyrophosphatases from photosynthetic bacteria[J]. Journal of Bacteriology,1971,108(12):1122-1128.
[14]Hughes R C,Coates L,Blakeley M P,et al.Inorganic pyrophosphatase crystals from thermococcus thioreducens for X-ray and neutron diffraction[J].Acta Crystallographica Section F Structural Biology and Crystallization Communications,2012,68(12):1482-1487.
[15]苟萍,杨寿钧.酿酒酵母胞内无机焦磷酸酶的分离纯化及性质[J].微生物学报,1998,38(3):229-232.
[16]Harold FM.Inorganic polyphosphates in biology:structure,metabolism,and function[J].Bacteriological Reviews,1966,30(4):772-794.
[17]Merckel M,Fabrichniy I,Salminen A,et al.Crystal structure of streptococcusmutans pyrophosphatase:a new fold for an old mechanism[J]. Structure,2001,9(4):289-297.
[18]Gómez-García M R,Losada M,Serrano A.Comparative biochemical and functional studies of family Isoluble inorganic pyrophosphatases from photosynthetic bacteria[J].Febs Journal,2007,274(15):3948-3959.
[19]Liu Binbin,Bartlam M,Gao R,etal.Crystal structure of the hyperthermophilic inorganic pyrophosphatase from the archaeon pyrococcus horikoshii[J].Biophysical Journal,2004,86(1):420-427.
[20]黄园波,王艳兴,戴梦瑶,等.球形红细菌无机焦磷酸酶的原核表达、纯化及初步分析[J].山西农业科学,2013,41(5):427-433.
[21]Fabrichniy IP,LehtiöL,Salminen A,et al.Structural studies ofmetal ions in family IIpyrophosphatases:the requirement for a Janus ion[J]. Biochemistry,2004,43(45):14403-14411.
[22]Fabrichniy IP,LehtiöL,TammenkoskiM,etal.A trimetal site and substrate distortion in a family IIinorganic pyrophosphatase[J].Journal of Biological Chemistry,2007,282(2):1422-1431.
[23]Ahn S,Milner A J,Fütterer K,et al.The"open"and"closed"structures of the type-C inorganic pyrophosphatases from Bacillus subtilis and Streptococcus gordonii[J].Journal of Molecular Biology,2001,313(4):797-811.
[24]Salminen T,Kaepylae J,Heikinheimo P,et al.Structure and function analysis of Escherichia coli inorganic pyrophosphatase:is a hydroxide ion the key to catalysis?[J].Biochemistry,1995,34(3):782-791.
[25]Celis H,Franco B,Escobedo S,et al.Rhodobacter sphaeroides has a family IIpyrophosphatase:comparison with other species of photosynthetic bacteria[J].Archives of Microbiology,2003,179(5):368-376.
(责任编辑薛荣)
Oligomerization and enzyme activity analysis on inorganic pyrophosphatase from Rhodobacter sphaeroides
CHEN Guoguo, SUN Meihao
(College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua 321004,China)
Inorganic pyrophosphatese from Rhodobacter sphaeroides(RsPPase)is one of the typeⅡ soluble PPase,and divalent cation Co2+is essential for its activity.Regulation of RsPPase activity and oligomerization had not been reported yet.RsPPase and RsPPasemono were prokaryotically expressed and purified.It was found that fusion glutathione sulfotransferase tagged GST-RsPPasemonos were monomers so that they were cleavable by PreScission Protease in presence of Co2+(Kcat/Km(PPi)=12.64 L·μmol-1·min-1)which was increased by 12 times compared to RsPPase-GST and non-Co2+(Kcat/Km(PPi)=0.34 L·μmol-1·min-1).
Rhodobacter sphaeroides;inorganic pyrophosphatase;oligomerization;Co2+
Q556+.5
A
1001-5051(2016)02-0193-07
10.16218/j.issn.1001-5051.2016.02.012
*收文日期:2015-05-06;2015-09-21
国家自然科学基金资助项目(30800019)
陈果果(1991-),女,浙江乐清人,硕士研究生.研究方向:蛋白质结构与功能.
孙梅好.E-mail:mhsun@zjnu.cn

