他莫昔芬对乳腺癌MCF-7细胞侵袭能力、MMP-9活性和表达的影响及机制
陈妍,王婧,徐旖旎,洪端阳,潘迪,沈祥春
(贵州医科大学,贵阳 550025)
他莫昔芬对乳腺癌MCF-7细胞侵袭能力、MMP-9活性和表达的影响及机制
陈妍,王婧,徐旖旎,洪端阳,潘迪,沈祥春
(贵州医科大学,贵阳 550025)
目的观察他莫昔芬(TAM)对乳腺癌MCF-7细胞侵袭能力、基质金属蛋白酶9(MMP-9)活性、MMP-9蛋白表达、MMP-9 mRNA表达的影响,并探讨抑制G蛋白偶联受体30(GPR30)对上述作用的影响。方法 取对数生长期乳腺癌MCF-7细胞,用无血清无酚红高糖DMEM培养基培养24 h耗竭内源性雌激素。将MCF-7细胞接种6孔板,待细胞贴壁后分为对照组、TAM组和TAM+G15(GPR30选择性抑制剂)组。对照组用无血清无酚红高糖DMEM培养基继续培养24 h。TAM组用含1 μmol/L TAM的无血清无酚红高糖DMEM培养基培养24 h,TAM+G15组先用含1 μmol/L的G15的无血清无酚红高糖DMEM培养基培养30 min,然后用含1 μmol/L TAM的无血清无酚红高糖DMEM培养基培养24 h。收集各组细胞,用Transwell侵袭实验检测MCF-7细胞侵袭能力,用明胶酶谱法检测MCF-7细胞培养液上清MMP-9活性,用Western blot法检测MCF-7细胞MMP-9蛋白表达,用实时荧光定量PCR法检测MCF-7细胞MMP-9 mRNA表达。结果 与对照组相比,TAM组MCF-7细胞侵袭能力升高,MMP-9蛋白和mRNA表达增加,培养液上清MMP-9活性升高(P均<0. 05)。与TAM组相比,TAM+G15组上述指标均降低(P均<0. 05)。结论TAM可增强乳腺癌MCF-7细胞的侵袭能力,上调MMP-9的活性及表达水平。用GPR30选择性抑制剂G15抑制GR30通路可以抑制这一作用。
他莫昔芬;乳腺癌;基质金属蛋白酶9;G蛋白偶联受体30
他莫昔芬(TAM)属于雌激素受体调节剂(SERMs),通过与雌激素竞争靶细胞胞质中的雌激素受体(ER)α,抑制ERα功能,发挥拮抗雌激素的作用,是ERα阳性乳腺癌患者内分泌治疗的首选药物。该药能够显著减低ERα阳性乳腺癌患者的病死率,但仅有部分患者能从治疗中获益[1,2]。文献报道,G蛋白偶联受体30(GPR30)与TAM长期使用后复发和转移相关[3]。肿瘤转移是一个复杂的、多步骤的过程,其中细胞侵袭能力增强和细胞外基质降解是其关键步骤。基质金属蛋白酶(MMPs)是促进细胞外基质降解的关键酶[4]。MMPs家族中基质金属蛋白酶9(MMP-9)是肿瘤细胞转移过程中最重要的蛋白水解酶之一[5]。2014年6月~2015年9月,我们以ERα和GPR30阳性的乳腺癌细胞MCF-7为研究对象,观察TAM对MCF-9细胞侵袭能力及MMP-9活性和表达的影响,以及GPR30选择性抑制剂G15对上述作用的影响。现报告如下。
1 材料与方法
1.1材料高糖DMEM培养基、无酚红高糖DMEM培养基、胎牛血清购自Gibco公司;DMSO培养基、TAM、明胶均购自Sigma公司;MMP-9抗体、GAPDH抗体为Bio-world公司产品;BCA试剂盒购自Pierce公司;ECL曝光液为Millipore公司产品;羊抗小鼠或羊抗兔IgG 辣根过氧化物酶(HRP)抗体购自Santa Cruz公司;GPR30特异性拮抗剂G15为Cayman Chemical公司产品;RNA提取试剂盒、逆转录试剂盒以及实时荧光定量PCR试剂盒均购自日本TaKaRa公司。乳腺癌MCF-7细胞购自中国科学院昆明细胞库。仪器中CO2培养箱为Thermo公司产品。制胶、电泳和转印系统,ChemiDoc XRS+凝胶成像系统,CFX Connect实时荧光定量PCR仪均为Bio-Rad公司产品。
1.2细胞培养MCF-7细胞培养采用高糖DMEM培养基(含体积分数为10%的胎牛血清、100 U/mL青霉素及100 μg/mL链霉素),培养条件为37 ℃及体积分数为5%的CO2,待细胞融合率达90%时进行传代培养。
1.3分组及给药方法取对数生长期MCF-7细胞。给药前改用无血清无酚红高糖DMEM培养基培养24 h耗竭细胞内源性雌激素。将MCF-7细胞接种到6孔板中,过夜,待细胞贴壁。设对照组、TAM组和TAM+G15组。对照组用无血清无酚红高糖DMEM培养基继续培养24 h。TAM组用含1 μmol/L TAM的无血清无酚红高糖DMEM培养基培养24 h,TAM+G15组先用含1 μmol/L G15的无血清无酚红高糖DMEM培养基培养30 min,然后用含1 μmol/L TAM的无血清无酚红高糖DMEM培养基培养24 h。每组5个复孔。
1.4MCF-9细胞侵袭能力观察采用Transwell侵袭实验。按照文献[6]操作。各组MCF-7细胞侵袭能力用各组穿过Matrigel 胶微孔滤膜的细胞数与空白对照穿过Matrigel 胶微孔滤膜的细胞数之比表示。
1.5MCF-7细胞MMP-9蛋白表达观察采用Western blot法。收集各组细胞,加入RIPA裂解液裂解,4 ℃、14 000 g离心20 min后取上清液,采用BCA法进行蛋白定量。蛋白变性后按每个泳道30 μg的蛋白总量上样,SDS-PAGE电泳,全湿电转膜仪转膜。用质量浓度为5%的脱脂奶粉于37 ℃ 振摇1 h 进行封闭。分别加入MMP-9或GAPDH一抗,37 ℃ 振摇1 h,4 ℃孵育过夜。HRP标记的二抗37 ℃振摇1 h后,采用ECL曝光液进行曝光。以GAPDH为内参照,采用Image Lab软件分析图像获得各组MMP-9相对表达量。
1.6MCF-7细胞MMP-9 mRNA表达观察采用实时荧光定量PCR法。收集各组细胞。按照RNA提取试剂盒说明书步骤提取细胞总RNA,并用紫外分光光度计检测纯度和浓度,琼脂糖凝胶电泳检查RNA完整性。按照逆转录试剂盒的说明将RNA逆转录为cDNA。依据文献报道设计引物,MMP-9的上游引物为5′-GTGGGGATTTACATGGCACT-3′,下游引物为5′-AAAGCCTATTTCTGCCAGGAC-3′;β-actin上游引物为5′-AGTTGCGTTACACCCTTTC-3′,下游引物为5′-CCTTCACCGTTCCAGTTT-3′。按PCR试剂盒的说明书在荧光定量PCR仪上进行扩增。以β-actin为内参照按照2-ΔΔCt法计算MMP-9 mRNA相对表达量。
1.7MCF-7细胞培养液上清MMP-9活性观察采用明胶酶谱实验。收集各组培养液上清液。将明胶加入SDS-PAGE分离胶液中,使明胶的浓度为0.1%,加入各组培养液上清液后电泳。电泳结束后,将丙烯酰胺凝胶进行复性、孵育染色和洗脱至负染条带清楚。采用凝胶成像系统扫描拍照,并用Image Lab软件分析图像,计算各组MMP-9活性,以各组MMP-9条带与空白对照条带灰度值之比表示MMP-9活性。
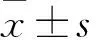
2 结果
2.1各组MCF-7细胞侵袭能力比较对照组、TAM组、TAM+G15组MCF-7细胞侵袭能力分别为100%±0.3%、201.4%±16.7%、125.2%±17.9%,TAM组MCF-7细胞侵袭能力高于对照组和TAM+G15组(P均<0.05),TAM+G15组与对照组相比差异无统计学意义。
2.2各组MCF-7细胞MMP-9蛋白表达比较对照组、TAM组、TAM+G15组MCF-7细胞MMP-9蛋白相对表达量分别为100%±0.1%、232.5%±27.5%、127.5%±12.5%,TAM组MCF-7细胞MMP-9蛋白相对表达量高于对照组和TAM+G15组(P均<0. 05),TAM+G15组与对照组相比差异无统计学意义。
2.3各组MCF-7细胞MMP-9 mRNA表达比较对照组、TAM组、TAM+G15组MCF-7细胞MMP-9 mRNA相对表达量分别为1.0±0.1、1.94±0.08、1.06±0.14,TAM组MCF-7细胞MMP-9 mRNA相对表达量高于对照组和TAM+G15组(P均<0.05),TAM+G15组与对照组相比差异无统计学意义。
2.4各组MCF-7细胞培养液上清MMP-9活性比较对照组、TAM组、TAM+G15组MCF-7细胞培养液上清MMP-9的活性分别为100%±0.2%、253.3%±30.9%、93.0%±12.4%,TAM组MCF-7细胞培养液上清MMP-9活性高于对照组和TAM+G15组(P均<0.05),TAM+G15组与对照组相比差异无统计学意义。
3 讨论
雌激素在乳腺癌的发生和发展中起着重要作用。最初的研究发现,雌激素可通过经典的雌激素受体ERα和ERβ来发挥效应。ERα在雌激素发挥生理作用的各个过程中都有参与,故学者们研发了多种干预ERα的内分泌治疗药物,如ER调节剂TAM和ER拮抗剂氟维司群(ICI)。但是近年来的研究发现,TAM也可发挥类似雌激素的作用。TAM的活性代谢产物4-羟基他莫昔芬(OHT)与雌激素作用类似,能够促进ERα阴性乳腺癌SR-BR-3细胞的增殖[7],并增强子宫内膜癌Ishikawa和KLE细胞的增殖和侵袭能力[8]。本研究结果显示,TAM能够增强ERα阳性乳腺癌MCF-7细胞的侵袭能力,提高其MMP-9蛋白、mRNA的表达和活性。提示仅仅通过抑制ERα功能来治疗乳腺癌可能存在一定的局限性,乳腺癌的治疗还需要寻找和发现新的靶点。
GPR30是近年发现的一种新型雌激素受体,它与经典的ERα没有同源性,效应和作用机制也有所不同,主要介导雌激素快速非基因效应[9]。GPR30与乳腺癌的发生及其生物学行为有一定程度的相关性。在侵袭性乳腺癌组织中GPR30过表达[10],并且GPR30表达与乳腺癌的远处转移呈正相关[11]。在GPR30敲除的自发性乳腺癌MMTV-PyMT小鼠中,乳腺癌转移率显著下降[12]。这些研究表明,GPR30可能是乳腺癌治疗的又一靶点。TAM和ICI虽然能够抑制ERα功能,但却能够激活GPR30。本课题组前期研究发现,OHT能够通过GPR30介导乳腺癌细胞中细胞周期蛋白E(cyclin E)剪切形成小分子片段发挥类似雌激素的作用,而小分子cyclin E的形成提示乳腺癌预后不良[13]。此外,雌激素和ICI都能够通过GPR30促进乳腺癌MCF-7和SK-BR-3细胞与胞外基质黏附以及钙蛋白酶1的激活[14]。提示激活GPR30通路可能是TAM或ICI这类内分泌治疗药物发挥类似雌激素作用的机制之一。
卵巢子宫内膜异位囊肿和上皮性卵巢癌中GPR30和MMP-9的表达呈正相关[15, 16]。雌激素和GPR30选择性激动剂G1能够上调卵巢癌 OVCAR5细胞中MMP-9的表达和水解能力,采用siRNA沉默GPR30的表达或者采用G蛋白的抑制剂百日咳毒素抑制GPR30的活性可阻断雌激素和G1的这一效应[17]。这说明GPR30可能调控MMP-9的活性和表达。在本研究中,采用GPR30的特异性抑制剂G15预处理MCF-7细胞后,TAM增强MCF-7细胞的侵袭能力、上调MMP-9的活性和表达的作用均被抑制,这提示抑制GPR30的作用可能是阻碍TAM发挥类似雌激素效应的途径之一。这也提示在乳腺癌内分泌治疗中除用TAM阻断ERα信号通路以外,可能还需抑制GPR30信号通路。
[1] Jager NG, Linn SC, Schellens JH, et al. Tailored tamoxifen treatment for breast cancer patients: a perspective[J]. Clin Breast Cancer, 2015,15(4):241-244.
[2] Viedma-Rodriguez R, Baiza-Gutman L, Salamanca-Gomez F, et al. Mechanisms associated with resistance to tamoxifen in estrogen receptor-positive breast cancer[J]. Oncol Rep, 2014,32(1):3-15.
[3] Mo Z, Liu M, Yang F, et al. GPR30 as an initiator of tamoxifen resistance in hormone-dependent breast cancer[J]. Breast Cancer Res, 2013,15(6):R114.
[4] Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment[J]. Cell, 2010,141(1):52-67.
[5] Bauvois B. New facets of matrix metalloproteinases MMP-2 and MMP-9 as cell surface transducers: outside-in signaling and relationship to tumor progression [J]. Biochim Biophys Acta,2012,1825(1):29-36.
[6] 卢科莲,喻小兰,夏纪毅,等. 黄芩素对宫颈癌Hela 细胞增殖的抑制作用及机制探讨[J]. 山东医药,2014,54(27):4-7.
[7] Vivacqua A, Romeo E, de Marco P, et al. GPER mediates the Egr-1 expression induced by 17beta-estradiol and 4-hydroxitamoxifen in breast and endometrial cancer cells[J]. Breast Cancer Res Treat, 2012,133(3):1025-1035.
[8] Du GQ, Zhou L, Chen XY,et al. The G protein-coupled receptor GPR30 mediates the proliferative and invasive effects induced by hydroxytamoxifen in endometrial cancer cells[J]. Biochem Biophys Res Commun,2012,420(2):343-349.
[9] Maggiolini M, Picard D. The unfolding stories of GPR30, a new membrane-bound estrogen receptor[J]. J Endocrinol, 2010,204(2):105-114.
[10] Liu Q, Li JG, Zheng XY, et al. Expression of CD133, PAX2, ESA, and GPR30 in invasive ductal breast carcinomas[J]. Chin Med J (Engl), 2009,122(22):2763-2769.
[11] Filardo EJ, Graeber CT, Quinn JA, et al. Distribution of GPR30, a seven membrane-spanning estrogen receptor, in primary breast cancer and its association with clinicopathologic determinants of tumor progression[J]. Clin Cancer Res, 2006,12(21):6359-6366.
[12] Marjon NA, Hu C, Hathaway HJ, et al. G protein-coupled estrogen receptor regulates mammary tumorigenesis and metastasis[J]. Mol Cancer Res, 2014,12(11):1644-1654.
[13] Li Y, Chen Y, Zhu ZX, et al. 4-Hydroxytamoxifen-stimulated processing of cyclin E is mediated via G protein-coupled receptor 30 (GPR30) and accompanied by enhanced migration in MCF-7 breast cancer cells[J]. Toxicology, 2013,30(9):61-65.
[14] Chen Y, Li Z, He Y, et al. Estrogen and pure antiestrogen fulvestrant (ICI 182 780) augment cell-matrigel adhesion of MCF-7 breast cancer cells through a novel G protein coupled estrogen receptor (GPR30)-to-calpain signaling axis[J]. Toxicol Appl Pharmacol, 2014,275(2):176-181.
[15] Long L, Cao Y, Tang LD. Transmembrane estrogen receptor GPR30 is more frequently expressed in malignant than benign ovarian endometriotic cysts and correlates with MMP-9 expression[J]. Int J Gynecol Cancer, 2012,22(4):539-545.
[16] Liu HD, Yan Y, Cao XF, et al. The expression of a novel estrogen receptor, GPR30, in epithelial ovarian carcinoma and its correlation with MMP-9[J]. Acta Physiol Sinica, 2010,62(6):524-528.
[17] Yan Y, Liu H, Wen H, et al. The novel estrogen receptor GPER regulates the migration and invasion of ovarian cancer cells[J]. Mol Cell Biochem, 2013,378(1-2):1-7.
Effects of tamoxifen on invasion, activity and expression of MMP-9 in breast cancer MCF-7 cells
CHENYan,WANGJing,XUYini,HONGDuanyang,PANDi,SHENXiangchun
(GuizhouMedicalUniversity,Guiyang550025,China)
Objective To explore the effects of tamoxifen (TAM) on the invasion, activity and expression of matrix metalloproteinase-9 (MMP-9) in breast cancer MCF-7 cells, meanwhile to discuss the role of inhibiting G-protein-coupled receptor 30 (GPR30) in these effects. Methods MCF-7 cells in the logarithmic phase were pre-cultured for 24 h in phenol red (PR)-free medium without serum to remove endogenous estrogen before the indicated treatments. MCF-7 cells were seeded in the six-well plates and incubated over night to let them adhere on the plate. The control group was continued to cultivate in PR-free medium without serum for 24 h. The TAM group was treated with 1 μmol/L TAM in PR-free medium without serum for 24 h. And the TAM+G15 group was pretreated with G15 (1 μmol/L) for 30 min before treatment with TAM (1 μmol/L) for 24 h in PR-free medium without serum. After treatment, cell invasion was detected by Transwell assay. The activity of MMP-9 in culture medium was tested by Gelatin zymography assay. The MMP-9 protein expression was analyzed by Western blotting. The mRNA expression of MMP-9 was tested by real-time RT-PCR. Results Compared with control group, the cell invasion was increased, the protein and mRNA expression level of MMP-9 was up-regulated, and the activity of MMP-9 in MCF-7 cells was increased in the TAM group (allP<0.05). Furthermore, compared with the TAM group, the above indexes of the TAM+G15 group were all decreased (allP<0.05).Conclusions TAM promotes the cell invasion ability and up-regulates the activity and expression of MMP-9. Meanwhile, the effects may be suppressed by G15 pretreatment.
tamoxifen; breast carcinoma; G-protein-coupled receptor 30; matrix metalloproteinase-9
国家自然科学基金资助项目(81302804);贵州省科学技术基金资助项目(黔科合J字20142007号);贵州省高校优秀科技创新人才支持计划项目(黔教合KY字2015492);贵州省中医药管理局中医药、民族医药科学技术研究课题(20141001)。
陈妍(1985-),女,博士,副教授,主要研究方向为抗肿瘤药物药理。E-mail: s0710189@sina.com
简介:沈祥春(1973-),男,博士,教授,研究方向为中药民族药活性。E-mail: shenxiangchun@126.com
10.3969/j.issn.1002-266X.2016.26.002
R737.9
A
1002-266X(2016)26-0006-04
2016-05-11)

