紫外线照射后生成的微囊泡对成纤维细胞氧化损伤及凋亡的作用
刘 娟 周炳荣 骆 丹 张家安 陶艳玲 苗颖颖 谢淑芬 范 曾 易 飞 吴红巾 栗 丹 王 申
论 著
紫外线照射后生成的微囊泡对成纤维细胞氧化损伤及凋亡的作用
刘娟周炳荣骆丹张家安陶艳玲苗颖颖谢淑芬范曾易飞吴红巾栗丹王申
目的: 明确对UVA及UVB照射后皮肤成纤维细胞生成的微囊泡对成纤维细胞氧化损伤及凋亡的作用。方法:紫外线照射人皮肤成纤维细胞,提取细胞上清液中的微囊泡,利用光散射分析技术鉴定分析微囊泡的大小及数量。将紫外线照射后生成的微囊泡与正常成纤维细胞共孵育,荧光酶标仪定量检测活性氧含量,流式细胞仪检测细胞凋亡率。结果: UVA及UVB照射后皮肤成纤维细胞释放的微囊泡数量及大小明显高于正常成纤维细胞释放的微囊泡。正常纤维细胞、UVA和UVB照射后的成纤维细胞与微囊泡共孵育后活性氧荧光值分别为(52.76±1.4347)、(82.60±4.082)和(85.94± 6.264),凋亡率分别为(3.260±1.732)%,(28.94±2.430)%和(34.48±2.718)%,细胞的氧化损伤和凋亡可被抗氧化剂逆转。结论: 急性中长波紫外线照射可诱导皮肤成纤维细胞释放微囊泡进一步介导细胞的氧化损伤和凋亡。
紫外线? 成纤维细胞? 微囊泡? 氧化损伤? 凋亡
近年来,多个研究显示紫外线诱导的旁观者效应确切存在[1,2]。研究者对此现象发生的机制也进行了研究:Widel等研究认为,活性氧的产生与紫外线诱导的旁效应的产生密切相关[2]?Ghosh等人的研究表明旁效应的产生与受辐射细胞分泌的因子有关,并且观察到旁细胞抗氧化系统的激活[1,3]。我们前期的研究中发现UVB诱导的提前衰老的成纤维细胞上清液可对正常的细胞造成损伤,该上清液含有紫外线辐射细胞释放的可溶性因子,介导了旁效应的发生[4,5]。有关这些活性因子通过何种途径发挥作用,目前并没有得到明确阐述,有研究者发现受到离子辐射的细胞可分泌外泌体(exsomes)及微囊泡(Microvescles,MVs),并通过囊泡的作用进行细胞间的信息传递[6]。囊泡在急性紫外线损伤中是否发挥作用,仍需要进一步的研究。本文通过研究受到急性中波及长波紫外线(UVA/UVB)辐射的人皮肤成纤维细胞(human skin fibroblasts,HSFB),收集、分离并鉴定细胞上清液中的MVs,并分析其对HSFB氧化损伤及凋亡的影响,以进一步揭示紫外线辐射诱导旁效应的发生机制。
1 材料与方法
1.1材料 胰酶购于美国Amresco公司,DMEM培养基购于美国Gibco公司,小牛血清购于杭州四季青生物工程材料有限公司,活性氧检测试剂盒、抗氧化剂N乙酰L半胱氨酸(N acetyl L cysteine,NAC)、线粒体膜电位检测试剂盒(JC-1),hoechs33342t试剂盒购于江苏碧云天生物技术研究所,PKH26荧光染料购于德国sigma公司,细胞凋亡检测试剂盒购自美国BD公司,高速冷冻离心机购于德国eppendorf公司,UVA及UVB照射仪购于上海希格玛高技术有限公司(ss-40,UVA发射波长320~400 nm,波峰365 nm,UVB发射波长280~320 nm,波峰311 nm),荧光酶标仪购自美国Thermo公司。
1.2方法
1.2.1细胞的分离、培养与传代 修剪去除包皮皮下组织,剪成0.5 cm×0.5 cm皮块,碘伏浸泡,0.9%氯化钠溶液冲洗3次,加入0.5%分散酶,4℃消化18~20 h后分离表、真皮。真皮部分以包皮消化液37℃消化5 min后,加入DMEM培养基,吹打、过滤,过滤后将细胞液离心,弃上清,加入含10%胎牛血清、1%青-链霉素双抗的高糖DMEM培养基,混匀并转移至培养皿中,于37℃、5%CO2的条件下培养,待细胞密度约90%时进行传代,将细胞接种于直径10 cm的培养皿中,接种密度为1.0×106个/皿,细胞每天换液1次,取5~10代对数生长期细胞进行实验。
1.2.2无微囊泡血清的制备 胎牛血清在4℃条件下经10 000 g超速离心1 h,吸取上清?重复上述步骤1次,收集上清?收集的血清上清过0.22微米滤膜,除菌。配置成含10%血清的培养基,不加青链霉素。
1.2.3中长波紫外线照射 实验分为3组。未辐射组:未经紫外线辐射,正常培养的HSFB?UVA辐射组(20 J/cm2):UVA直接单次照射?UVB辐射组(60 mJ/cm2):UVB直接单次照射。待细胞处于对数生长期后,密度约80%,开始进行紫外线照射。用UVA/UVB探测仪标定UVA/UVB照射仪的照射度,UVA/UVB剂量=UVA/UVB照射度×时间(s),培养皿距灯管距离15 cm,分别按照上述剂量一次性照射。每次照光前,每组用磷酸盐缓冲液(PBS)洗涤3次,洗净培养基,照光时用PBS替换培养基,照射后换经步骤2处理过后的含10%无MVs血清的培养基,于37℃、5%CO2饱和湿度的细胞培养箱中培养。
1.2.4培养基中微囊泡的提取及鉴定 吸取各组处理细胞培养24 h的上清液,先于4℃经2000 g离心20 min去除杂质及细胞碎片,再于4℃经10 000 g超速离心2 h,MVs可在离心管底壁沉集,用PBS仔细洗净培养基后以PBS重悬(提取MVs的量设定为1 mL细胞上清液提取10μL MV,标记为CMVs=10 μL/mL),置于-80℃冰箱备用。提取的MVs分组为:未辐射组,UVA辐射组,UVB辐射组。采用光散射分析技术对提取的MVs进行分析鉴定,包括MVs的大小分布及数量的分析。
1.2.5细胞对微囊泡摄取的动态观察 使用PKH26荧光染料对每组提取的MVs进行标记(染色标记方法按照说明书进行),hoechest33342t标记细胞核,使用共聚焦显微镜观察不同时间点(30 min,3 h,24 h,48 h)成纤维细胞对MVs摄取的情况。并用荧光酶标仪于激发波551 nm,发射波557下行荧光值的检测。
1.2.6活性氧检测
1.2.6.1荧光显微镜观察 将密度约为2×105/mL细胞接种于3.5 cm小皿中,次日细胞贴壁后进行细胞处理,将细胞随机分组为对照组,未辐射组(加入未辐射组MVs孵育),UVA辐射组(加入UVA辐射组MVs孵育),UVA+NAC组(另加入抗氧化剂NAC),UVB组(加入UVB辐射组MVs孵育),UVB+NAC组(另加入抗氧化剂NAC)。抗氧化剂NAC的孵育浓度为1 mmol/L,每组加入的MVs量为60μL。孵育48 h后进行实验。采用原位装载探针的方法,以1∶1000比例稀释相应探针,每皿加入1 mL稀释液,37℃避光孵育20 min后PBS洗涤细胞3次,荧光显微镜下观察并拍照。
1.2.6.2荧光酶标仪定量检测 将HSFB以2000个/ 100μL接种于96孔板,置于5%CO2、37℃饱和湿度下培养?次日贴壁后同上处理,每孔加入10μLMVs。装载探针后通过荧光酶标仪于激发波485 nm,发射波525 nm下行荧光值的检测。
1.2.7细胞凋亡的检测
1.2.7.1JC-1染色观察线粒体膜电位的变化 将细胞制成1×105/mL细胞悬液接种于3.5 cm培养皿中培养。次日细胞贴壁后,对细胞进行处理,依据加入不同上清中提取的MVs将其分组为:未辐射组,UVA辐射组,UVA+NAC组,UVB组,UVB+NAC组,并设置对照组(仅使用新鲜培养基孵育的HSFB)。随机选用两组加入1 mmol/L的NAC孵育30 min。每组加入步骤4收集的相应MVs,加入的MVs量为60μL/皿,孵育48 h后换液1次,再加入步骤4收集的MVs 60μL,继续孵育48 h后进行试验。弃去原培养液,加入PBS洗3遍,按试剂说明书进行染色,染色后即刻荧光显微镜下观察并拍照。
1.2.7.2流式细胞仪膜联蛋白V(Annexin V)/碘化丙啶(PI)双染法检测细胞凋亡分组及处理同上,将各组细胞制成1×105/mL细胞悬液,接种于3.5 cm培养皿中培养并处理后,离心收集至10 mL离心管中,PBS清洗3次,用100μL的标记溶液重悬细胞,室温下避光孵育15 min,离心收集细胞并去上清。加入荧光(SA-FLOUS)溶液4℃下孵育20 min,避光并不停振动,上机检测细胞凋亡率。
1.3统计学方法 用SPSS 13.0软件进行分析,两组间比较用成组t检验,多组间行单因素方差分析,P< 0.05为差异有统计学意义。
2 结果
2.1UVA/UVA辐射后HSFB分泌的MVs含量变化及大小分布范围 HSFB可分泌一定量的MVs至上清液中,经过UVA/UVB辐射过后的细胞,其分泌更多量的MVs,用PBS将收集的MVs重悬后采用光散射分析技术对其进行分析,依据布朗运动原理,所有的粒子均被逐个分析,由此可区分外泌体及MVs,外泌体的直径多在30~100 nm,MVs的直径约在100~500 nm。分析表明我们收集的囊泡以MVs为主,正常细胞分泌的MVs直径多在120~200 nm,而受到紫外线辐射后的细胞生成的MVs的直径聚集在150~300 nm,且辐射细胞分泌的MVs的量明显高于正常细胞所分泌的含量(图1)。

图1 正常HSFB及急性中长波紫外线辐射后HSFB培养上清液中收集、分离、提取的微囊泡含量,大小及分布范围(蓝色:对照组?紫色:UVA辐射组?青色:UVB辐射组)
2.2成纤维细胞摄取MVs的观察 加入MVs后30 min监测即可见细胞开始对其进行摄取,细胞核的周边可见散在经PKH26标记呈现红色荧光的MVs,随着时间的推移,细胞对MVs的摄取逐渐增多,细胞核周边可见较多量的MVs聚集,尤其以紫外线辐射组为著。30 min荧光酶标仪定量红色荧光未辐射组(0.044±0.017)与UVA组(0.093±0.025)对比无明显差异,但与UVB组的荧光值(0.182±0.064)对比差异有统计学意义?3 h,24 h,48 h红色荧光定量未辐射组(0.070±0.017,0.685±0.138,0.973±0.319)与同时刻UVA组(0.438±0.170,4.01±0.552,6.732±0.822)及UVB组(1.271±0.244,8.088±0.837,11.853±1.553)对比差异均有统计学意义(P<0.05)?而同时刻的UVA组及UVB组荧光值对比差异均无统计学意义(P> 0.05)见图2。
2.3细胞内活性氧含量变化 共聚焦显微镜下观察,UVA辐射组及UVB辐射组细胞活性氧荧光强度明显高于对照组及未辐射组。荧光酶标仪检测荧光值,紫外线辐射组均高于未辐射组及对照组,差异有统计学意义(P<0.05)?对照组与未辐射组相比,差异无统计学意义(P>0.05),见图3,表1。

表1 荧光酶标仪检测各组MVs作用48 h对HSFB活性氧含量的影响及各组MVs作用96 h对HSFB凋亡率的影响(¯x±s,n=5)
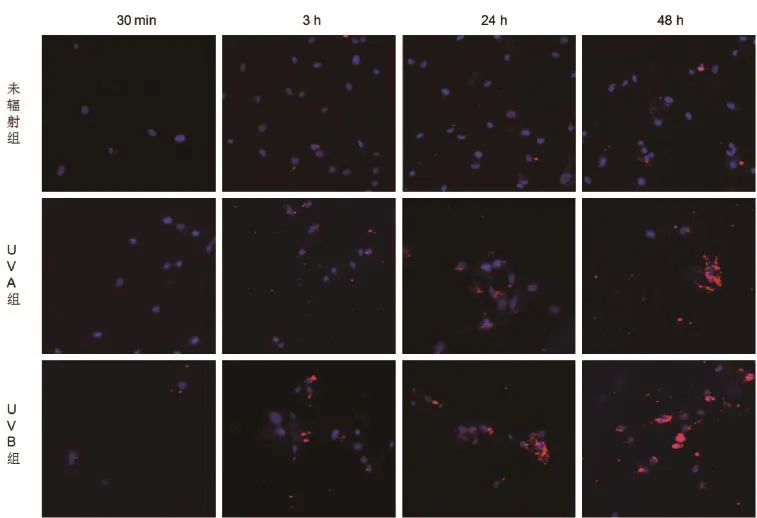
图2 成纤维细胞在不同时间点摄取正常成纤维细胞,UVA及UVB辐射后成纤维细胞诱导生成的MVs的荧光图(激光共聚焦显微镜 ×200) 蓝色为hoechest33342标记的细胞核,红色为PKH26标记的MVs,细胞核周围可见大量的MVs聚集,尤以紫外线辐射组为著
2.4细胞凋亡的检测
2.4.1JC-1染色观察线粒体膜电位的变化 线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。线粒体膜电位检测试剂盒(JC-1)可快速灵敏检测细胞的线粒体膜电位变化,用于早期的细胞凋亡检测。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物(J-aggregates),可以产生红色荧光?在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光。从而通过荧光颜色的转变来检测线粒体膜电位的变化,作为细胞凋亡早期的一个检测指标。对照组及加入未辐射组MVs组的细胞表现为红色荧光,加入UVA及UVB辐射组MVs的HSFB表现为出现较多的细胞碎片,并出现较多绿色荧光,表明细胞出现早期凋亡。而两组实验组在加入抗氧化剂NAC后,细胞形态较完整,且产生红色荧光为主(图4)。
2.4.2流式细胞仪膜联蛋白V(Annexin V)/碘化丙啶(PI)双染法检测细胞凋亡 通过流式细胞仪定量检测,加入UVA及UVB辐射组MVs的HSFB表现出凋亡率明显升高,与对照组及未辐射组比较差异有统计学意义(P<0.05),而两组实验组在加入抗氧化剂NAC后凋亡率出现逆转,与对照组及未辐射组对比,差异无统计学意义(P>0.05)见表1。
3 讨论
紫外线诱发旁效应的机制仍不明确。近年来,学者提出氧化应激在紫外线辐射旁效应中的重要作用,研究者认为ROS、MDA等氧化产物均是小分子物质,可以在细胞内和细胞间扩散,从而导致旁观者细胞的氧化损伤[7]。但是Mikula-Pietrasik等认为体内环境中存在一定的抗氧化物质,由紫外线辐射生成的多种氧化物质难以长期存在于细胞间隙,故亦难以发挥介导旁效应的功能[8]。研究表明,细胞可释放MVs,其中包裹蛋白质,脂质及RNAs等信息分子,可避免在细胞间的运输过程中多种酶类对MVs中信息物质的降解,从而实现细胞之间的信息交流及活性物质的转移[9]。

图3 各组MVs对HSFB活性氧含量的影响(荧光显微镜随机拍摄 ×100)

图4 各组MVs对HSFB线粒体膜电位的影响(荧光显微镜随机拍摄 ×100)
MVs的释放是一个高度保守的过程,其中所包含的信息物质依据其来源的不同而不同[10]。正常的细胞可分泌MVs,而受到损伤后的细胞,如肿瘤细胞,电离辐射后的细胞会分泌更多的MVs[11,12]。我们的研究也证明受到UVA及UVB急性损伤的细胞会分泌更多量的MVs,且辐射后细胞所分泌的MVs的大小发生变化,表明MVs的性质可能发生改变。为何损伤后的细胞会分泌更多的MVs,有研究表明缺氧状态可促进MVs合成,可能与低氧诱导因子(hypoxia inducible factor,HIF)信号通路的激活有关[11,13]。在紫外线急性损伤的细胞中是否存在该信号通路的激活,尚需进一步的研究。亦有研究表明细胞可通过出芽的方式分泌MVs,而损伤细胞产生更多的活性物质,细胞则通过出芽或内吞的方式产生更大量的囊泡以包裹和运输信息物质[10]。
多种细胞均可摄取MVs,MVs可通过与受体细胞直接对接,与细胞膜融合或者通过细胞的胞吞作用进入胞内,一旦被细胞摄取,囊泡中的信息物质即被释放[10]。本研究中提取的紫外线辐射的细胞所分泌的MVs,在加入受体细胞中,在30 min时即被受体细胞所摄取,随时间推移细胞核周边的MVs逐渐增多,呈现时间依赖性,MVs进入细胞后,并没有被细胞器所降解,而是将其中的信息物质释放出,介导了细胞间的信号交流。我们的研究显示正常细胞分泌的MVs对细胞的生长及增殖没有明显影响,而辐射细胞分泌的MVs却可诱导细胞的增殖率下降,氧化损伤的加剧及凋亡的发生。由此可知,MVs介导的信息传递很可能参与了紫外线诱导的旁效应的发生。
急性紫外线辐射后可造成直接受辐射细胞出现氧化损伤和细胞凋亡,已被广泛验证[14,15]。我们在前期的研究发现,收集辐射细胞的上清液培养正常的细胞,旁细胞中出现了氧化损伤及细胞的凋亡[4],Widel等[2]采用共培养的方法,同样在未直接受到辐射的细胞中发现了以上现象。但是有关上清液中何种物质介导了旁效应的发生,却没有进一步阐释。本研究中我们仅提取了辐射细胞上清液中的MVs,发现同样介导了旁观者效应,说明了MVs介导的细胞间信息传递是导致旁效应的重要途径之一。而此类的氧化损伤及凋亡可被抗氧化剂部分逆转,说明氧化应激损伤在旁效应中有重要作用。以上研究结果揭示了紫外线辐射诱导的旁观者效应中氧化应激的重要地位,损伤细胞释放的MVs,其中包含有介导氧化损伤的信号分子,当MVs被受体细胞摄取后,信息物质即可释放,引发受体细胞的生物学效应。
综上所述,通过本研究,我们发现中长波紫外线可诱导成纤维细胞生成MVs,且紫外线诱导生成的MVs可以被受体细胞摄取,介导受体细胞的氧化损伤及凋亡。但是MVs中的何种物质以及通过何种分子机制途径介导了紫外线的旁观者效应尚需进一步的研究。
[1]Wu S,Jin C,Lu X,et al.Bystander effect induced by UVC radiation in Chinese hamster V79 cells[J].Photochem Photobiol,2014,90(4):837-844.
[2]Widel M,Krzywon A,Gajda K,et al.Induction of bystander effects by UVA,UVB,and UVC radiation in human fibroblasts and the implication of reactive oxygen species[J].Free Radic Biol Med,2014,68:278-287.
[3]Ghosh R,Guha D,Bhowmik S,et al.Some UV-bystander effects are mediated through induction of antioxidant defense in mammalian cells[J].Indian JBiochem Biophys,2012,49(5):371-383.
[4]王申,周炳荣,刘娟,等.中波紫外线诱导的提前衰老成纤维细胞培养液对正常人真皮成纤维细胞的氧化损害[J].中国中西医结合皮肤性病学杂志,2014,13(5):279-282.
[5]王申,周炳荣,骆丹,等.中波紫外线诱导的提前衰老成纤维细胞上清液对人真皮成纤维细胞增殖、老化及自噬的影响[J].中国皮肤性病学杂志,2015,48(7):485-489.
[6]Jella KK,Rani S,O'Driscoll L,et al.Exosomes are involved inmediating radiation induced bystander signaling in human keratinocyte cells[J].Radiat Res,2014,181(2):138-145.
[7]Shorrocks J,Paul ND,McMillan TJ.The dose rate of UVA treatment influences the cellular response of HaCaT keratinocytes[J].J Invest Dermatol,2008,128(3):685-693.
[8]Mikula-Pietrasik J,Sosinska P,Janus J,et al.Bystander senescence in human peritoneal mesothelium and fibroblasts is related to thrombospondin-1-dependentactivation of transforming growth factor-beta1[J].Int J Biochem Cell Biol,2013,45(9):2087-2096.
[9]Chahar HS,Bao X,Casola A.Exosomes and Their Role in the Life Cycle and Pathogenesis of RNA Viruses[J].Viruses,2015,7(6):3204-3225.
[10]Lo Cicero A,Stahl PD,Raposo G.Extracellular vesicles shuffling intercellular messages:for good or for bad[J]. Curr Opin Cell Biol,2015,35:69-77.
[11]King HW,Michael MZ,Gleadle JM.Hypoxic enhancement of exosome release by breast cancer cells[J].BMCCancer,2012,12:421.
[12]Arscott WT,Tand le AT,Zhao S,et al.Ionizing radiation and glioblastoma exosomes:implications in tumor biology and cellmigration[J].Transl Oncol,2013,6(6):638-648.
[13]Park JE,Tan HS,Datta A,et al.Hypoxic tumor cellmodulates itsmicroenvironment to enhance angiogenic and metastatic potential by secretion of proteins and exosomes[J]. Mol Cell Proteomics,2010,9(6):1085-1099.
[14]Williams JD,Bermudez Y,Park SL,et al.Malondialdehyde-derived epitopes in human skin result from acute exposure to solar UV and occur in nonmelanoma skin cancer tissue[J].JPhotochem Photobiol B,2014,132:56-65.
[15]Wondrak GT,Roberts MJ,Cervantes-Laurean D,et al. Proteins of the extracellularmatrix are sensitizers of photooxidative stress in human skin cells[J].J Invest Dermatol,2003,121(3):578-586.
(收稿:2015-09-02 修回:2015-09-28)
Effects of m icrovesicles on oxidative damage and apoptosis of fibroblasts induced by ultraviolet ir radiation
LIU Juan,ZHOU Bingrong,LUO Dan,ZHANG Jiaan,TAO Yanling,MIAO Yingying,XIE Shufen,FAN Zeng,YIFei,WU Hongjin,LIDan,WANG Shen.
Department of Dermatology,First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
Corresponding authors:ZHOU Bingrong,E-mail:bingrong.2002@163.com
LUO Dan,E-mail:daniluo2013@njmu.edu.cn
Objective:To determine the effects ofmicrovesicles induced by UVA and UVB irradiation on oxidative damage and apoptosis skin fibroblasts.M ethods:Cultured skin fibroblastswere irradiated with UVA and UVB.Microvesicleswere extracted from supernatant of cultured fibroblasts.The size and the number of microvesicleswere detected by light scattering analysis technology.Themicrovesicles were co-incubated with normal fibroblasts.The active oxygen contentwas detected by reactive oxygen species(ROS)kit and apoptosis rate was detected by flow cytometry.Results:The size and themumber ofmicrovesicles abstracted from fibroblasts after UVA and UVB radiation was significantlymore than those in normal fibroblasts.The active oxygen content in fibroblasts irradiated by UVA and UVB and normal fibroblasts after co-incubated withm icrovesicles was(52.76±1.4347),(82.60±4.082)and(85.94±6.264),and the apoptosis rateswere(3.260±1.732)%,(28.94±2.430)%and(34.48±2.718)%.The cell oxidative damage and apoptosis rate can be reversed by the antioxidant.Conclusion:UVA/UVB radiation can induce skin fibroblasts to releasemicrovesicles,which can stimulate oxidative damage and apoptosis of the cells.
ultraviolet rays?fibroblasts?m icrovesicles?oxidative damage?apoptosis
国家自然科学基金(编号:81371757 81573072)
南京医科大学第一附属医院皮肤性病科,南京,210029
周炳荣,E-mail:bingrong.2002@163.com
骆丹,E-mail:daniluo2013@njmu.edu.cn

