猪肺炎支原体CJ株膜蛋白的电泳分析和免疫印迹检测
王 钢,贺 笋,侯 凤,李新萍,李延涛
(新疆天康畜牧生物技术股份有限公司,新疆乌鲁木齐830000)
猪肺炎支原体CJ株膜蛋白的电泳分析和免疫印迹检测
王钢,贺笋,侯凤,李新萍,李延涛
(新疆天康畜牧生物技术股份有限公司,新疆乌鲁木齐830000)
以在新疆昌吉某猪场分离的一株猪肺炎支原体(CJ)为试验材料,采用SDS-PAGE和Western-Blot印迹对该菌的膜蛋白进行了分析.该猪肺炎支原体(CJ)经过Friis改良液体培养基培养,以12 000 r/min离心收集菌体,低温反复冻融获得膜蛋白后,应用12%分离胶,4%浓缩胶进行SDS-PAGE分离,在电泳图谱上呈现大概26条蛋白条带,分子量在10 kD~200 kD.再以膜蛋白做免疫印迹检测,其Western-Blot膜上有14种反应条带,其中p36、p38、p40、p52、p65,p70、p114、p200条带颜色较深.
猪肺炎支原体;膜蛋白;SDS-聚丙烯酰胺凝胶蛋白电泳;蛋白免疫印迹
猪肺炎支原体(Mycoplasma hyopneumoniae,Mph)引起的猪支原体肺炎遍布世界各地,并且在猪呼吸道疾病综合征(PRDC)的发生中起到重要的作用[1].已有很多研究报道证明,猪肺炎支原体致病因子和主要抗原位于细胞膜上,而不是在细胞质[2].本研究以新分离的猪肺炎支原体CJ株为试验材料,采用SDS-PAGE和Western-Blot印迹法对该菌膜蛋白进行了分析,为下一步对动物的免疫原性和致病性研究提供依据.
1 材料与方法
1.1材料菌种:猪肺炎支原体CJ株,由新疆天康畜牧生物技术股份有限公司保存.Friis改良液体培养基:Hanks A,Hanks B,酵母浸出液,PPLO和BHI粉末,猪血清,5%酚红,抗生素(杆菌肽、甲氧西林),pH值在7.38~7.40.低分子量标准蛋白质MARKER,购自赛默飞科技有限公司.4x Pro⁃tein SDS-PAGE Loading Buffer,购自TaKaRa公司.猪阳性血清:新疆天康畜牧生物技术股份有限公司保存.羊抗猪IgG酶标抗体:BETHHYL公司生产,Cat:A100-105 P;Lot:A100-105P-22.高速冷冻离心机:日本日立.电泳仪以及电泳槽:购自伯乐公司.
1.2猪肺炎支原体的培养、收集及膜的制备猪肺炎支原体CJ菌株按1∶10接种量加入培养基中,37℃摇床(50 r/min)培养并传代,培养液颜色变黄,pH值大约为6.7时,取10 mL菌液12 000 r/min离心30 min,收获菌体细胞,并用PBS(pH值7.2)洗涤几次,最后用1 mL PBS溶解.然后采用-20℃低温反复冻融3~4次,即制得膜蛋白(测膜蛋白量大约为5.68 mg/mL),-20℃保存备用.
1.3SDS-PAGE分离猪肺炎支原体膜蛋白采用垂直板型不连续凝胶电泳系统,分离胶为12%,浓缩胶为4%制备凝胶.膜蛋白样品与4XSDS混合,煮沸5分钟,每孔20 μL量加入;低分子量标准蛋白按10 μL量加入.连接电源,电压为150 V,待指示染料迁移距下沿约为1 cm时,停止电泳.取出部分进行考马斯亮蓝R250染色检测,其余未染色凝胶进行转膜.
1.4膜的转移将裁剪好的NC膜依次通过甲醇、去离子水、电转液进行激活,并将未染色的凝胶一起浸泡与电转液中,装配成"凝胶三明治",插入电泳转移槽.NC膜接正极,凝胶接负极,连接电泳仪,调节电流为0.35 mA,电泳50 min,转移完毕,取出膜.
1.5Western-Blot印迹将转移电泳后的NC膜置PBST(含0.05%Tween-20)中,每次3 min,洗3次.置于封闭液内,在37℃摇床中保温1 h,PBST再洗3次.加入1∶40稀释的一抗,在37℃摇床中保温1 h,取出PBST洗3次.再加入1∶5 000稀释的羊抗猪IgG酶标抗体,37℃保温1 h,取出PBST洗3次.最后用DAB显色,暗处反应大概1~3 min,出现显色条带,终止反应,避光晾干,拍照.
2 结果
2.1SDS-PAGE结果猪肺炎支原体膜蛋白经SDSPAGE分离后,电泳图谱上呈现约26条带.相对分子量质量范围在10~200 kD,电泳图谱见图1.
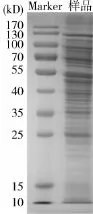
图1 猪肺炎支原体SDS-PAGE
2.2Western-Blot印迹结果样品经免疫印迹检测发现,在26条膜蛋白中出现了14条显色条带,其中包括了p36、p38、p40、p41、p52、p65,p70、p97、p114、p200等主要蛋白.结果见图2
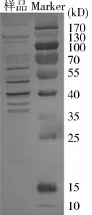
图2 猪肺炎支原体Western-Blot
3 讨论
3.1猪肺炎支原体膜蛋白的电泳分离分析通过SDS-PAGE和Western-Blot技术分析微生物的蛋白和抗原组成是目前最常用的方法. Young[4]通过SDS-PAGE分析MPH J株,获得15-20条谱带.Geary[2]通过此方法检测到猪肺炎支原体VPP11膜制剂得23条带.邵国青[4]等通过SDSPAGE分析猪肺炎支原体168株,得到15条带.张映[5]用12.5%凝胶对膜蛋白进行SDS-PAGE分离,在电泳图谱上呈现36条蛋白条带.本试验通过SDS-PAGE方法获得了26条谱带,分子量在10 kD~200 kD之间,与文献报道有些差异,可能与膜制剂的制备和菌种不同有关.
3.2猪肺炎支原体膜蛋白的免疫印迹检测WISE等[6]用免疫印迹方法检测MPh J(ATCC25934)膜蛋白,结果表明,p70、p65、p50和p44这4种蛋白具有抗原性,并且证明这4种蛋白为膜完整蛋白. Scarman[8]通过用MPh猪高免血清做免疫印迹检测,证明主要Mph抗原蛋白分子量大约为:36、43、48、52、76、78、80、82、94、106、114、200 kD.邵国青[4]通过对猪肺炎支原体168株免疫印迹分析,分子量约为36、41、50、64 kD的条带较为明显.张映[7]分析猪肺炎支原体Z株,其中p34、p47、p52、p54的酶染色带颜色较深.本试验Western-Blot结果中,分子量为p36、p38、p40、p41、p52、p65,p70、p114、p200条带反应明显,可以说明猪肺炎支原体CJ株具有免疫反应的蛋白条带较多,是潜在的候选免疫抗原.
[1]赵德明,张仲秋,沈建忠,主译.猪病学[M].9版.北京:中国农业大学出版社,2008:795-799.
[2]Geary S J,Walczak E M.Isolation of a cytopthic factor from My⁃coplasma hyopneumoniae[J].Infect Immun,1985,48:576-578.
[3]Young T F,Ross R F.Assessment of antibody response of swine infected with Mycoplasma hyopneumoniae by immunoblotting[J]. AmJ Vet Res,1987,48(4):651-656.
[4]邵国青.猪肺炎支原体168菌株蛋白SDS-PAGE谱带和染色体DNA PFGE图谱比较[J].江苏农业学报,1999,15(4):247-249.
[5]张映,王肇悦,舜向庭.猪肺炎支原体膜蛋白的电泳分析及免疫印迹检测[J].畜牧兽医,2003,35(5):6-8.
[6]Wise K S.Major membrane surface proteins of mycoplasma hyo⁃pneumoniae selectively modified by covalently bound lipid[J].Bac⁃teriol,1987,169:5546-5555.
[7]Scarmam A L,Chin J C,Eamens G J,et al.Identification of nov⁃el species-specific antigens of Mycoplasma hyopneumoniae by preparative SDS-PA GE ELISA profiling[J].Microbiology,1997,143:663-673.
S858.28
A
0529-6005(2016)06-0041-02
2013-09-16
王钢(1986-),男,硕士,主要从事兽用生物制品研究,E-mail:ganggang6666666@163.com

