玉米赤霉烯酮一步ELISA法的建立及应用
王文珺,刘怡菲,韩 霄,王照鹏,苏丽芳,敖海阔,吴雨洋
(1.北京维德维康生物技术有限公司,北京 100095;2.河北兽药监察所,河北石家庄 050035;3.北京交通大学理学院,北京 100044)
玉米赤霉烯酮一步ELISA法的建立及应用
王文珺1,刘怡菲2,韩霄3,王照鹏1,苏丽芳1,敖海阔1,吴雨洋1
(1.北京维德维康生物技术有限公司,北京 100095;2.河北兽药监察所,河北石家庄 050035;3.北京交通大学理学院,北京 100044)
为了建立一种快速、准确的检测饲料及其原料中玉米赤霉烯酮的酶联免疫一步法。在制备玉米赤酶烯酮半抗原、免疫原及单克隆抗体的基础上,运用方阵法确定包被抗原、抗体的浓度,筛选稳定的ELISA检测体系,并在此基础上考察了抗体的特异性。建立了检测饲料及其原料中玉米赤霉烯酮的方法,猪饲料、牛饲料、玉米渣和麦麸的检测限分别为96.2、92.7、80.5和86.7 μg/kg。在饲料及原料中定量添加玉米赤霉烯酮,酶联免疫的回收率为79.4%~104.9%,开发的酶联免疫试剂盒与德国拜发试剂盒对实际样本进行检测,两种试剂盒对样本阴阳性判定一致。本研究为饲料及其原料中玉米赤酶烯酮的监管提供了技术支撑。
玉米赤霉烯酮,半抗原,单克隆抗体,酶联免疫吸附分析法(ELISA),饲料及其原料
由饲料污染导致的食品质量安全问题引发越来越多的关注,真菌毒素是饲料污染的重要原因。据统计,每年全世界的农产品和工业原料因真菌毒素污染引起的损失达数百亿美元[1]。玉米赤霉烯酮(zearalenone,ZEN)是一种常见的真菌毒素,最初从患赤霉病的玉米中分离得到,其主要污染玉米和小麦等粮食。ZEN引起的污染相当广泛[2],中国、美国、加拿大、英国等国家相继报告了由ZEN污染粮食引起的猪中毒事件。李荣涛[3]曾从全国各地采集玉米、小麦样本进行分析,发现样本中ZEN阳性率为100%,浓度范围为0.014~0.73 mg/kg。被ZEN污染的饲料一旦被动物食用,可引起动物中枢神经中毒,对于妊娠期的动物,可能会引起流产、死胎、畸胎等[4]。ZEN会通过食物链传递给人体,危害人类的健康。ZEN的存在日益引起人们的关注[5],近年来,人们着手研究建立了多种检测ZEN的方法。ZEN仪器分析方法主要有液质联用(LC-MS/MS)和高效液相色谱(HPLC)等[6-9],可同时定量检测ZEN及其代谢物α-玉米赤霉烯醇、β-玉米赤霉烯醇等[10-11],但仪器分析需要昂贵的仪器,检测周期长,不适合快速对大量样本的检测,常被用来作为确证的方法。因此,急需开发出一种灵敏度高、准确的ZEN快检方法,以满足社会对ZEN污染情况的监控。ELISA具有高灵敏度、高通量、操作简便等优点,可实现短时间内对大量样本的筛查。美国分析化学家协会(AOAC)率先将ELISA应用于检测谷物、小麦、猪饲料中的ZEN[12]。我国GB/T13078.2-2006规定饲料中ZEN限量标准为500 μg/kg[13],检测饲料中ZEN的国标方法包括薄层色谱法、ELISA以及免疫亲和柱—高效液相色谱联用技术等[14-15]。目前,人们已逐步将免疫分析技术应用于真菌毒素检测的研究[16-19]。ZEN标准品的稳定性直接影响ELISA方法的产业化,但很少有文献报道涉及这方面的研究。
本研究系统阐述了ZEN抗原抗体制备、检测体系建立、样本分析,建立了饲料及其原料中ZEN的检测方法(检测限100 μg/kg),探讨了保持标准品稳定性的思路及方法,以期为真菌毒素类ELISA方法的应用提供技术依据。
1 材料与方法
1.1材料与仪器
玉米赤霉烯酮、玉米赤霉酮、α-玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇中国兽药监察所;Proclin 300、明胶、酶稳定剂、牛血清白蛋白(BSA)、卵清蛋白(OVA)、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、弗氏完全佐剂、弗氏不完全佐剂等Sigma公司;羊抗鼠IgG-HRP美国Jackson公司;ELISA酶标板厦门云鹏;新生牛血清民海生物;吡啶、甲醇等分析纯化合物北京国药集团;ELISA所用的缓冲液包被液:碳酸盐缓冲液0.05 mol/L,pH9.6;磷酸盐缓冲液(0.02 mol/L,PBS):PB缓冲液中加入0.15 mol/L NaC1,pH7.4;洗涤液:1000 mL PBS加1 mL Tween-20;酶稀缓冲液:2 mL Tween-20、1 g明胶、200 mL新生牛血清、0.2 g酶稳定剂和300 μL ProClin 300,加入到0.02 mol/L PBS中,定容到1000 mL;封闭液:1000 mL PBS加入5 g明胶、2%蔗糖和500 μL ProClin 300;专用标准品缓冲液:0.02 mol/L磷酸氢二钠-柠檬酸缓冲液,pH6.0;A/B双组份显色底物液:北京维德维康生物技术有限公司自制;终止液:1 mol/L H2SO4。
MK3酶标仪美国,Thermo fisher科技;TDL-40C离心机上海安亭科学仪器厂;HQ-60型涡动仪北京方正生物科技发展有限公司;Milli-Q型超纯水仪美国,Milli-Q公司;微量移液器德国,Eppendorf;90-3 型磁力搅拌器上海青浦沪西仪器厂;电子天平德国,赛多利斯科学仪器公司。
1.2实验方法
1.2.1ZEN半抗原(玉米赤霉烯酮-6′-羧甲氧肟)的合成由于ZEN本身没有活性基团,无法直接偶联蛋白,需要先合成半抗原,参考Liu的方法[20]略有改动。ZEN(10 mg)溶于6 mL吡啶中,加入8.0 mg O-羧甲基羟胺半盐酸盐,搅拌反应24 h,真空干燥后的残留物溶于5 mL蒸馏水中,用Na2CO3将pH调到8.0,用乙酸乙酯从水相中除去未反应的ZEN。水相的pH用HCl调到3.0,沉淀反应产物,并用10 mL乙酸乙醋提取四次,提取物用无水Na2SO4干燥,减压浓缩得半抗原ZEN-CMO。
1.2.2活性酯法制备ZEN人工抗原人工抗原制备参考王照鹏的方法[21],略有改进。将5.19 mg ZEN-CMO溶于2 mL 二甲基甲酰胺(DMF)中,加入5.0 mg NHS 和6.0 mg EDC中,室温搅拌反应2 h,得到活化的A液;称取67 mg BSA溶于5.0 mL 0.02 mol/L(pH7.4)的PBS中,得到B液;在4 ℃条件下,边搅拌边在B液中缓慢的加入A液,然后室温搅拌24 h;将反应产物装入干净的透析袋(15 cm)中,用0.01 mol/L PBS(pH7.4)在4 ℃下搅拌透析3 d,每天更换透析液3次,透析产物(免疫原:ZEN-CMO-BSA)在4500 r/min离心6 min,0.5 mL/管分装,将抗原编号,-20 ℃保存备用。ZEN-CMO-BSA制备方法见图1。同法合成包被原ZEN-CMO-OVA。
1.2.3ZEN单克隆抗体制备制备单克隆抗体(单抗)的流程参考王文珺描述的方法[22]:免疫Balb/C小鼠,待效价大于5000后,取小鼠脾脏与骨髓瘤细胞融合,用选择培养基筛选杂交瘤细胞,经五次克隆后,筛出稳定分泌ZEN抗体的细胞,细胞培养上清或注射小鼠体内产生的腹水含有大量的ZEN单克隆抗体。经进一步纯化后可用于ZEN试剂盒研发。
1.2.4ZEN标准抑制曲线的建立首先,方阵法筛选抗原、抗体的工作浓度,建立间接竞争性ELISA(icELISA)的标准曲线[23]:a.包被:以确定的抗原浓度包被酶标板,4 ℃过夜,弃包被液,洗涤一次;b.封闭:加入封闭液(150 μL/孔),室温下封闭2 h,弃封闭液,拍干;c.加样:取50 μL不同浓度的标准品(0、0.1、0.2、0.4、0.8、2.4 ng/mL)分别加入各平行孔中,再按顺序加入50 μL IgG-HRP工作液、50 μL ZEN单抗,避光反应30 min,洗涤四次;d.显色:加入新鲜配制的底物液100 μL,避光孵育10~15 min;e.终止:加入50 μL终止液,在450 nm/630 nm 双波长下读出数据。
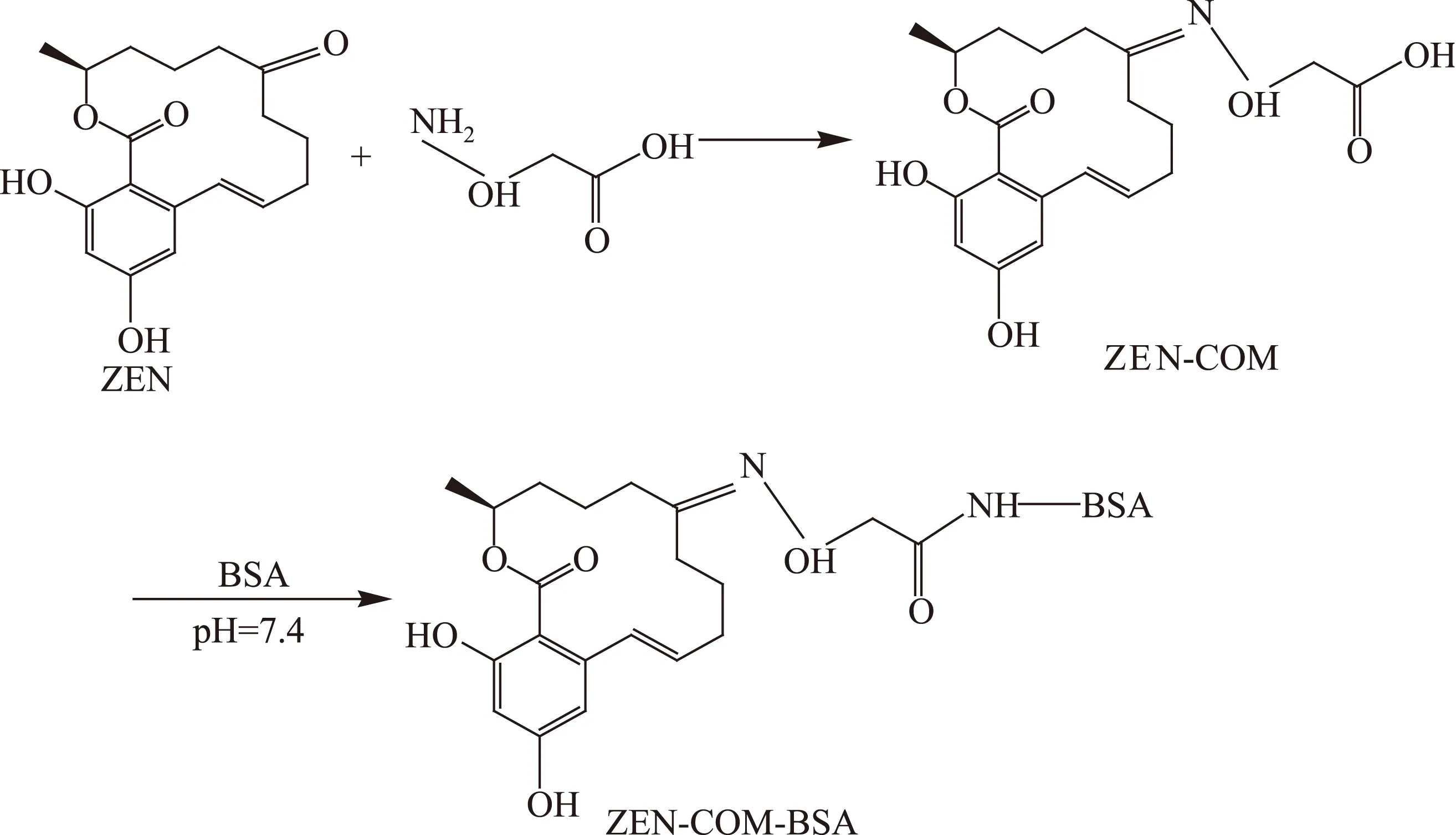
图1 ZEN半抗原合成和偶联物制备反应图Fig.1 Reactions used to synthesize the hapten(ZEN-CMO)and conjugates(ZEN-CMO-BSA)
ZEN标准品浓度的对数为横坐标,结合率(B/B0)为纵坐标。用软件Origin 8.0绘制标准曲线,建立四参数回归方程[24]:
其中:Y为结合率;A1代表零标准品的OD值;A2是最高浓度标准品的OD值;P为曲线拐点的斜率;X0为IC50所代表的药物浓度。
1.2.5ZEN抗体的特异性考察ZEN单抗与其结构类似物的交叉反应,分别建立标准抑制曲线,计算各自的IC50,按下式计算交叉反应率:
交叉反应率(CR%)=IC50(ZEN)/IC50(结构类似物)×100
1.2.6标准品稳定性考评三种标准品缓冲液(标缓)配制标准品:0.02 mol/L磷酸盐缓冲液(pH=7.4)、0.02 mol/L磷酸盐缓冲液(pH=7.4)+20%甲醇、专用标准品缓冲液(见1.1)。考察不同标缓中标准品在4、37 ℃放置0、3、6、9 d的情况,通过考评IC50值、零孔OD值选择合适的标缓。
1.2.7样品的测定
1.2.7.1添加实验称取粉碎后的待测样品1.0 g于50 mL离心管中,样品包括:猪饲料(幼仔)、牛饲料(肉牛)、玉米渣、麸皮,每种样品称量4份,样品分别按100、200、500 ng/g浓度添加ZEN,同时设置未添加ZEN的试样平行处理做空白。然后加入6 mL样品稀释液(20%甲醇+0.02 mol/mL PBS),高速涡动2 min后4000×g离心10 min;取20 μL上清液用380 μL样品稀释液,充分混匀后,取50 μL用于ELISA分析。
1.2.7.2实际样本分析用本研究开发的试剂盒(WDWK)和德国拜发(RIDA)试剂盒对20个实际样本进行分析,通过检测结果的比对,确定该检测方法的准确性。
2 结果与讨论
2.1ZEN人工抗原及单抗制备
ZEN是一种小分子物质(MW=318.6),需要与大的载体蛋白(如BSA、OVA、KLH等)偶联才具有免疫原性。本研究在保持ZEN基本空间构型的前提下,合成具有羧基长链的半抗原,通过羧基与载体蛋白BSA偶联制备免疫原。根据紫外扫描确定ZEN与BSA的偶联比为12.8∶1(见图2)。一般来说,偶联比在8∶1~25∶1范围内,免疫效果较好。免疫小鼠制备单克隆抗体,经过四次克隆,获得一株能稳定分泌抗体,编号为4C-1H-5F-3D细胞株。

图2 偶联物的紫外图谱Fig.2 UV spectrum of conjugates
2.2ZEN 标准抑制曲线
在优化条件下,建立ZEN的标准抑制曲线(图3),IC50=0.35 ng/mL,低于文献报道中的IC50=(1.13±0.16) μg/L及线性范围为1~50 ng/mL的检测结果[16,20]。本研究采用一步法,即抗原、抗体和酶标二抗的反应一步完成,如果采用传统的两步法,IC50值更低(IC50=0.19 ng/mL)。但这样会增加检测步骤,延长检测时间,不符合快检产品的要求。在保证检测限满足国标的情况下,本文优先考虑一步法。

图3 ZEN标准抑制曲线Fig.3 The standard inhibition curve of ZEN determined by icELISA
2.3抗体特异性
ZEN单抗的特异性用其与ZEN结构类似物的交叉反应来表示。由表1可知,ZEN单抗与欧盟及农业部“235”号公告[25]禁用药物玉米赤霉醇有很大的交叉,因此该抗体也可用来开发玉米赤霉醇的检测试剂盒。抗体与其结构类似物的交叉反应越大,说明该结构类似物具有与待测物相同或相近结构,即相同的抗原决定簇。在免疫检测中,交叉反应的存在常被利用检测一类物质,如磺胺总量的检测。

表1 ZEN抗体的交叉反应Table 1 Cross-reaction of ZEN and structurally related compounds

表2 标准品的稳定性考评Table 2 Evaluation for stability of standard
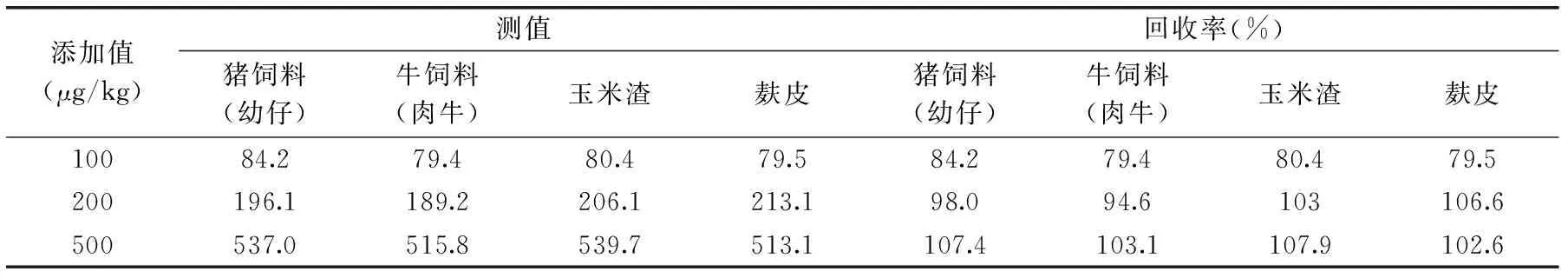
表3 饲料及其原料*中添加ZEN回收实验Table 3 Recovery for ZEN from Feed and feedstuffs* by icELISA
注:*:饲料及原料阴性样本来自农业部饲料工业中心。
2.4稳定性考评
标准品的稳定性是ELISA试剂盒质量控制的一个重要指标[26-28]。ZEN属于内酯类化合物,如选择的标缓不合适,会引起ZEN的空间构型发生改变,影响抗原-抗体的特异性结合,即破坏了ZEN标准品的稳定性。关于ZEN ELISA的研究报告,很少涉及标准品的稳定性的研究[17,29-30]。事实上,真菌毒素类标准品的稳定性是制约其产品稳定的关键因素。
根据阿伦尼乌斯公式[31],试剂在37 ℃条件下(热加速实验)放置1 d,相当于4 ℃条件下保存1.6个月,9 d热加速实验相当于4 ℃保存一年两个月。在试剂研发过程中,常用热加速实验考察试剂的稳定性。本研究工作重点考察了不同缓冲液配制的标准品在4 ℃和热加速实验条件下参数的变化情况,不同考评天数之间的数值,最大允许存在40%以内的差异,不同处理方法之间的差异不应该超过20%(以4 ℃为对照),对稀释倍数较大的前处理方法,这种差异应该控制在10%之内。由表2 OD值和IC50可以看出,使用专用标缓可以很好地维持标准品的稳定性。
2.5样本分析
2.5.1添加实验在阴性样本中添加不同浓度ZEN,添加回收率范围在79.4%~107.9%之间(见表3),结果表明,样本前处理方法准确,可满足市场需求。
同时,通过对大量阴性样本的筛查,得到猪饲料(幼仔)、牛饲料(肉牛)、玉米渣、麸皮的检测限分别为96.2、92.7、80.5、86.7 μg/kg。
2.5.2实际样本分析通过Wdwk和RIDA试剂盒对20个实际样本的分析(结果见表4),经单因素方差分析,两种方法的分析方法结果无显著差异(p>0.05)。检测样本中没有ZEN浓度≥500 μg/kg的样本。

表4 WDWK试剂盒与RIDA试剂盒检测结果的比较Table 4 Comparision of results determinedly by WDWK kits and RIDA kits
3 结论
本研究在制备高灵敏度抗体的前提下,采用一步ELISA法,开发出具有反应时间短、操作简单、结果稳定的ELISA试剂盒,满足市场对快检免疫试剂的要求。本研究工作的重点是解决了ELISA试剂盒中ZEN标准品稳定性问题,采用了专用缓冲液,标准品可稳定保存12个月。在样本添加实验中,回收率在79.4%~107.9%之间,实际样本分析表明本研究开发的试剂盒与德国拜发试剂盒的检测结果非常接近,进一步证明了本研究工作的可靠性及可行性。
[1]贺筱蓉. 食品安全概论[M]. 江西:科学技术出版社,2005:7-11.
[2]吴艳萍,靳慧霞. 植物产品中真菌毒素的危害及其检测方法[J]. 粮食与饲料工业,2001(7):43-47.
[3]李荣涛,谢刚,付鹏程. 小麦和玉米中玉米赤霉烯酮污染情况初探[J]. 粮食储藏,2004,32(5):36-39.
[4]ABDELLAH Z,JOSE MIGUEL S,JUAN C. Review on the Toxicity,Occurrence,Metabolism,Detoxification,Regulations and intake of Zearalenone:An Oestrogenic Mycotoxin[J]. Food and Chemical Toxicology,2007,45:1-18. doi:10.1016/j. fct.2006.07.030.
[5]Shephard G S,Berthiller F,Dorner J,et al. Developments in Mycotoxin Analysis:an Update for 2008-2009[J]. World Mycotoxin Journal,2010,3(1):3-23.
[6]RASMUSSEN R R,STORM I M L D,RASMUSSEN P H,et al. Multi-Mycotoxin Analysis of Maize Silage by LC-MS/MS[J]. Analytical and Bioanalytical Chemistry,2010,397(2):765-776.
[7]ÅBERG A T,SOLYAKOV A,BONDESSON U. Development and in-House Validation of an LC-MS/MS Method for the Quantification of the Mycotoxins Deoxynivalenol,Zearalenone,T-2 and HT-2 Toxin,Ochratoxin A and Fumonisin B1 and B2 in Vegetable Animal Feed[J]. Food Additives and Contaminants Part A,2013,30(3):541-549.
[8]KONG Weijun,SHEN Honghong,ZHANG Xiaofei,et al. Analysis of Zearalenone andα-Zearalenol in 100 Foods and Medicinal Plants Determined by HPLC-FLD and positive Confirmation by LC-MS-MS[J]. Journal of the Science of Food and Agriculture,2013,93(7):1584-1590.
[9]张继斌,汪咏曾,王昕,等. 免疫亲和柱同时净化-HPLC法测定高粱中黄曲霉毒素和玉米赤霉烯酮[J]. 粮食科技与经济,2013,38(6):231-236.
[10]SAMBUU R,TAKAGI M,SHIGA S,et al. Detection of Zearalenone and Its Metabolites in Naturally Contaminated Porcine Follicular Fluid by Using Liquid Chromatography-Tandem Mass Spectrometry[J]. Journal of Reproduction and Development,2011,57(2):303-306.
[11]DUSI G,BOZZONI E,ASSINI W,et al. Confirmatory Method for the Determination of Resorcylic Acid Lactones in Urine Sample Using Immunoaffinity Cleanup and Liquid Chromatography-Tandem Mass Spectrometry[J]. Analytica Chimica Acta,2009,637:47-54.
[12]BENNETT G A,NELSEN T C,MILLER B M,et al. Enzyme-linked Immunosorbent Assay for Detection of Zearalenone in Corn,Wheat,and Pig Feed:Collaborative Study[J]. Journal of AOAC International,1994,77(6):1500-1509.
[13]中华人民共和国国家质量监督检验检疫总局. GB/T 13078.2-2006:饲料卫生标准饲料中赭曲霉毒素A和玉米赤霉烯酮的允许量[S]. 北京:中国标准出版社,2007.
[14]中华人民共和国国家质量监督检验检疫总局. GB/T 19540-2004:饲料中玉米赤霉烯酮的测定[S]. 北京:国家标准出版,2004.
[15]中华人民共和国国家质量监督检验检疫总局. GB/T 28716-2012:饲料中玉米赤霉烯酮的测定免疫亲和柱净化-高效液相色谱法[S]. 北京:中国标准出版社,2012.
[16]THONGRUSSAMEE T,KUZMINA N S,SHIM W B,et al. Monoclonal-based Enzyme-Linked Immunosorbent Assay for the Detection of Zearalenone in Cereals[J]. Food Additives and Contaminants Part A,2008,25:997-1006.
[17]王雄,荣钊,蒙海超. 抗玉米赤霉烯酮单克隆抗体的制备及ELISA检测试剂盒的研制[J]. 饲料检测,2010,11:39-43.
[18]JIANG Haiyang,WANG Wenjun,ZHU Jinhui,et al. Determination of Zeranol and its Metabolites in Bovine Muscle and Liver by a Chemiluminescence Enzyme Immunoassay:Compared to an Ultraperformance Liquid Chromatography Tandem Mass Spectroscopy Method[J]. Luminescence,2014,29:393-400.
[19]GUTZWILLER A,GAFNER J L,SILACCI P. Urinary Zearalenone Measured with ELISA as a Biomarker of Zearalenone Exposure in Pigs[J].Mycotoxin Research,2014,30:187-190.
[20]LIU M,BHANU P,PATRICK L,et al. Indirect Enzyme-Linked Immunosorbent Assay for the Mycotoxin Zearalenone[J]. Applied and Environmental Microbiology,1985,50(2):332-336.
[21]王照鹏,李向梅,徐飞,等. 大观霉素人工抗原的合成及其多克隆抗体制备[J]. 中国畜牧兽医,2014,41(2):54-57.
[22]王文珺,许艇,高宏斌,等. 人工雌性激素己烯雌酚单克
隆抗体的制备及表征[J]. 核农学报,2007,21(1):79-82.
[23]Shen Jianzhong,Wang Wenjun,Xia Xi,et al. Determination of Four Nitrofuran Metabolites and Chloramphenicol in Biological Samples Using Enzyme-Linked Immunosorbent Assay[J]. Analytical Letters,2013,46:1404-1418. doi:10.1002/bio.2544.
[24]Xu Fei,Wang Wenjun,Jiang Haiyang,et al. Indirect Competitive Enzyme-Linked Immunosorbent Assay for the Detection of Dibutyl Phthalate in White Wine,Compared With GC-MS[J]. Food Analytical Methods,2014,7:1619-1626.
[25]中华人民共和国农业部.农业部235号公告:动物性食品中兽药残留最高限量[EB/OL]. http://www.moa.gov.cn/zwllm/tzgg/gg/2002-12-24.
[26]韩春卉,江涛,李燕俊,等. 黄曲霉毒素B1酶联免疫分析试剂盒稳定性研究[J]. 食品科学,2013,34(14):315-318.
[27]吴瑜燕,高源,邵祝军. 检测百日咳抗毒素免疫球蛋白G的酶联免疫吸附实验试剂盒的稳定性评价[J]. 中国疫苗和免疫,2013,20(4):17-21.
[28]谢芳,赖卫华,史爱武,等. 免疫磁珠富集结合酶联免疫吸附法检测酱油中黄曲霉毒素B1[J].食品科学,2013,34(18):165-169.
[29]Maragos C M,Kim E K. Detection of Zearalenone and Related Metabolites by Fluorescence Polarization Immunoassay[J]. Journal Food Protection,2004,67(5):1039-1043.
[30]Aksoy A,Yavuz O,Das K,et al. Occurence of Aflatoxin B1,T-2 Toxin and Zearalenone in Compound Animal Feed[J]. Journal of Animal and Veterinary Advances,2009,8(3):403-407.
[31]杨梅,刘君君,牟晓然,等. 阿伦尼乌斯方程在体外诊断试剂有效期预测中的应用[J].国际检验医学杂志,2013,34(12):1586-1590.
Development and application of one-step enzyme-linked immunosorbent assays for zearalenone
WANG Wen-jun1,LIU Yi-fei2,HAN Xiao3,WANG Zhao-peng1,SU Li-fang1,AO Hai-kuo1,WU Yu-yang1
(1.Beijing WDWK Biotechnology Co.,Ltd.,Beijing 100095,China;2.Hebei Institute of Veterinary Drug Control,Shijiazhuang 050035,China;3.College of Science,Beijing Jiaotong University,Beijing 100044,China)
With aim of developing a speed,accurate,one-step enzyme-linked immunosorbent assay(ELISA)for the detection of zearalenone in feed and feed stuffs was set. Hapten was synthesized firstly,conjugated then to carrier proteins for complete antigen,which was used as antigen in mice for monoclonal antibody. Concentrations of coating antigen and antibody were determined with chessboard format. A stable analytical system was established and the specificity of monoclonal antibody was evaluated. The results showed that the detection of limit of this developed ELISA for zearalenone in pig feed、cow feed、maize pulp and wheat bran was 96.2,92.7,80.5 and 86.7 μg/kg,respectively. Feed samples were spiked with zearalenone and the recoveries of ELISA were 79.4%~104.9%. There was no distinct difference between the results of WDWK and RIDA kits. This study could bring a technical basis for the monitor of zearalenone.
zearalenone;hapten;monoclonal antibody;enzyme-linked immunosorbent assays(ELISA);feed and feed stuffs
2015-11-24
王文珺(1975-),女,博士,副研究员,研究方向:农业及环境毒物检测研究,E-mail:wwj107@163.com。
河北省科技计划项目(15277107D)。
TS207.3
A
1002-0306(2016)14-0078-06
10.13386/j.issn1002-0306.2016.14.007

