产β-葡萄糖苷酶酿酒酵母菌株的化学诱变选育及产酶条件优化
王 婧,张 莉,张宏海,韩舜愈,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州 730070;3.甘肃省葡萄酒产业技术研发中心,甘肃兰州 730070)
产β-葡萄糖苷酶酿酒酵母菌株的化学诱变选育及产酶条件优化
王婧1,2,3,张莉1,2,3,张宏海1,2,3,韩舜愈1,2,3,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃兰州 730070;3.甘肃省葡萄酒产业技术研发中心,甘肃兰州 730070)
以实验室保存的一株酿酒酵母菌株UV-45为出发菌株,通过硫酸二乙酯(DES)诱变筛选及致死率测定,得到一株产β-葡萄糖苷酶稳定,酶活为74.26 U/mL的突变菌株UV-E-16,与出发菌株相比,其酶活提高了22.74%;通过Plackett-Burman方法对该菌株发酵产酶的相关因素进行分析,得出初始pH、培养温度和接种量为显著影响因子;利用Box-Behnken实验设计和响应曲面法获得其最佳产酶条件为初始pH5.62、培养温度29.5 ℃、接种量6.12%,该条件下,菌株UV-E-16产β-葡萄糖苷酶酶活为90.91 U/mL。经化学诱变及响应面优化产酶条件,出发菌株UV-45产β-葡萄糖苷酶酶活力提高了50.24%,具有工业化应用的潜力。
β-葡萄糖苷酶,硫酸二乙酯,化学诱变,产酶条件
β-葡萄糖苷酶(β-glucosidase,BGL,EC 3.2.1.21),是键合态香气释放的关键酶,首次于 1837 年在苦杏仁中由Liebig和Wohler发现[1-2]。它能催化烷基糖苷、芳基糖苷等结合于糖链末端非还原性的β-D-葡萄糖苷键[3-4]水解使其释放出游离的具有香气的糖苷配体[5-7],能够改善和增强果酒的香气[8],且在食品方面有广泛应用。
微生物是β-葡萄糖苷酶的主要来源,主要集中在酵母、黑曲霉及一些细菌上。目前对微生物来源的β-葡萄糖苷酶研究较多的是丝状真菌,主要是曲霉以及木霉;在众多的产酶微生物菌种中,黑曲霉为产β-葡萄糖苷酶的优势菌,研究也较多,但是黑曲霉存在一定的食品安全隐患,在食品加工中的应用受到了很大程度的限制[9]。因此,酵母以及乳酸菌成为了与食品相关的产β-葡萄糖苷酶菌株的研究重点。
在实际应用中,酵母释放的β-葡萄糖苷酶活性较低,产酶条件不明,因此,探明酵母菌株的产酶条件并提高β-葡萄糖苷酶活力对提高果酒香气以及食品方面应用具有重要意义。
诱变育种是指利用物理或化学诱变剂处理微生物菌株使其发生基因突变,再通过简便、快速和高效的筛选方法,从中挑选出目标突变菌株的过程[10]。据文献报道,化学诱变手段主要是利用化学试剂使菌株发生突变,常用的化学诱变试剂有硫酸二乙酯(DES)、甲基磺酸乙酯(EMS)、亚硝基胍(NTG)等。其诱变机理是化学试剂能改变DNA结构,并引起DNA变异,许多化学诱变试剂产生的DNA畸变几率较低,其具有位点特异性,且产生突变的比例较高、范围较大,可以引起染色体断裂和生物学损伤。该方法操作不需要特殊设备,且操作过程较为简单。因此可以低浓度处理较长时间而获得较高的诱变效果[11]。
2004年,王宜林[12]用盐酸羟胺和5-溴尿嘧啶复合诱导酵母使产超氧化物歧化酶SOD能力提高。2009年,刘海洲[13]通过紫外诱变、硫酸二乙酯诱变及复合诱变,对南极假丝酵母菌种进行了选育,筛选出一株高产菌株UDAan-I,其酶活达到42.7 U/mL,为原始茵株的1.8倍。2013年Ruchi[14]等人利用化学与物理诱变复合技术处理枯草芽孢杆菌,使其产β-葡萄糖苷酶活性提高1.2倍。但是,系统研究化学诱变方法在提高酵母产β-葡萄糖苷酶方面的报道较少。
实验以一株能够产生β-葡萄糖苷酶的酿酒酵母菌株为出发菌株,分析化学诱变处理的条件参数,旨在选育出高产β-葡萄糖苷酶的突变菌株并明确其产酶最优条件,以期为实际生产提供优良的菌株。
1 材料与方法
1.1材料与仪器
酿酒酵母菌株(Saccharomycescerevisiae)UV-45由甘肃省葡萄与葡萄酒工程学重点实验室紫外诱变选育保存。
p-NPGSigma公司;对硝基苯酚天津市凯信化学工业有限公司;硫酸二乙酯、硫代硫酸钠、酵母膏、蛋白胨、葡萄糖、琼脂等均为国产分析纯。
湘仪高速冷冻离心机长沙湘仪离心机仪器有限公司;紫外-可见分光光度计Thermo Fisher scientific公司;SW-CJ-2FD型超净工作台苏州安泰空气技术有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器上海申安医疗器械厂。
1.2培养基与试剂配制
YPD液体培养基酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,自然pH,121 ℃灭菌 20 min。
YEPD固体培养基酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,琼脂2.0%,自然pH,121 ℃灭菌 20 min。温度降至70 ℃左右,加入60 μg/mL链霉素。
发酵培养基[15]酵母浸膏1.0%,蛋白胨2.0%,葡萄糖2.0%,NH4NO30.3%、KH2PO40.4%,自然pH
初筛培养基[16]马铃薯20 g/L,葡萄糖20 g/L,琼脂 20 g/L,自然pH,将200 g马铃薯去皮切碎,煮烂后取得马铃薯汁,加入葡萄糖与琼脂并加水至1000 mL,121 ℃灭菌 20 min,在温度降到60~70 ℃左右加入1 g/L p-NPG。
DES诱变剂DES与无水乙醇按相应体积比混合,制备不同浓度DES诱变剂。
25%硫代硫酸钠25 g硫代硫酸钠溶于100 mL蒸馏水中。
1.3实验方法
1.3.1原菌株活化培养将出发菌株UV-45接种一环于YEPD斜面培养基上,28 ℃培养24 h后,接入50 mL YPD液体培养基中28 ℃,180 r/min培养48 h。将活化好的酵母菌按5%的接种量转入20 mL YPD液体培养基中,28 ℃,180 r/min振荡培养48 h。
1.3.2生长曲线绘制取15个50 mL三角瓶,分别装入20 mL YPD液体培养基灭菌备用。将菌株UV-45扩增培养液按5%接种量分别接入,并于28 ℃,180 r/min培养,每隔4 h取样。以不接菌的YPD液体培养基为空白对照,在600 nm下测吸光度值,绘制菌株生长曲线[17]。
1.3.3菌株化学诱变及筛选
1.3.3.1菌悬液制备取对数生长期的培养液,8000 r/min离心10 min收集酵母菌体,并以适量无菌生理盐水洗涤2次。将酵母菌体悬浮于无菌生理盐水中,并以无菌生理盐水进行10倍系列逐级稀释,然后配成106~108cfu/mL的菌悬液。
1.3.3.2化学诱变最佳诱变剂浓度:分别取5 mL制备好的菌悬液,加入同体积DES溶液,DES浓度分别为0.5%、1%、1.5%、2%、2.5%、3%。于28 ℃下以180 r/min的转速恒温振动处理35 min后立即加入过量25% Na2S2O3终止反应。分别取不同处理时间的菌液进行梯度稀释,并取稀释液10-4、10-5、10-6涂布于YPD固体培养基上,30 ℃培养48 h,取未做DES处理的菌液稀释平板作为对照,计算菌落数及DES诱变致死率[14]。
最佳诱变时间:取5 mL制备好的菌悬液,分别加入同体积1% DES溶液,分别于28 ℃下以180 r/min的转速恒温振动处理。分别处理0、5、10、15、20、25、30、35、40、45、50、55、60 min之后立即加入过量25% Na2S2O3终止反应。分别取不同处理时间的菌液梯度稀释,取10-4、10-5、10-6涂布于YPD固体培养基上,30 ℃培养48 h,取未做DES处理的菌液稀释平板作为对照,计算菌落数及DES诱变致死率[14]。
致死率计算公式如下:
致死率(%)=(对照每0.1 mL菌落数-处理后每0.1 mL菌落数)/对照每0.1 mL菌落数
1.3.3.3突变菌株筛选初筛:将最佳诱变条件下的单菌落,挑入以p-NPG为底物的96孔板初筛培养基上,培养3 d后,喷洒1 mol/L Na2CO3,观察显色情况,并挑选明显呈黄色的菌落作为高产菌株进行复筛。
复筛:将初筛显色明显的突变菌株接种至发酵培养基中培养72 h,将发酵液于8000 r/min离心10 min后,收集上清液,即粗酶液,用于测定酶活力,筛选出酶活较高的菌株。
1.3.4酶活测定
1.3.4.1标准曲线绘制称取对硝基苯酚139.0 mg,蒸馏水定容至1000 mL,分别吸取1.0、2.0、3.0、4.0、5.0、6.0 mL于100 mL容量瓶中,用1 mol/L Na2CO3溶液定容后混匀。以蒸馏水作为空白,于400 nm处测其吸光值。以对硝基苯酚浓度为横坐标,吸光值为纵坐标,绘制标准曲线[15]。
1.3.4.2酶活测定参照马腾臻的酶活测定方法[18],β-葡萄糖苷酶酶活力单位(U)定义为,在上述反应条件下,1 min内以p-NPG为底物释放出1 μmol的p-NP所需要的酶量[18]。
1.3.5诱变菌株产酶稳定性验证对复筛获得的高产β-葡萄糖苷酶突变菌株进行传代培养,连续传代10次,测其β-葡萄糖苷酶酶活,获得产酶稳定性高的菌株[14]。
随机响应动力学分析以电机与车轴的垂向相对动态位移为输出结果,并取统计学中的3倍标准差,即3 σ作为边界值,各工况计算结果汇总如表3~4所示。
1.4产酶培养条件优化
1.4.1最佳碳源选择发酵基础培养基中分别添加2%淀粉、玉米芯、蔗糖、微晶纤维素、麸皮、葡萄糖为唯一碳源,其它成分不变,28 ℃,180 r/min培养72 h后测定β-葡萄糖苷酶活性[19],每组实验3个平行。
1.4.2最佳氮源选择发酵基础培养基中去掉氮源,分别加入1%牛肉膏、尿素、硫酸铵、硝酸铵、酵母膏为唯一氮源,其他成分保持不变,28 ℃,180 r/min培养72 h后测定β-葡萄糖苷酶活性[19],每组实验3个平行。
1.4.3响应面法优化产酶条件
1.4.3.1Plackett-Burman设计筛选影响产酶的主效因子根据已经确定好的碳源和氮源,以初始pH、培养温度、培养时间、转速、接种量、装液量及培养基碳源、氮源添加量等8个因素作为研究对象,考察各个因子对UV-E-16菌株产酶的影响。实验采用Plackett-Burman设计,每个因子取高(+1)低(-1)两个水平。根据单因素实验结果(数据未给出)设计实验因素,设计水平见表1(N=12)[20]。
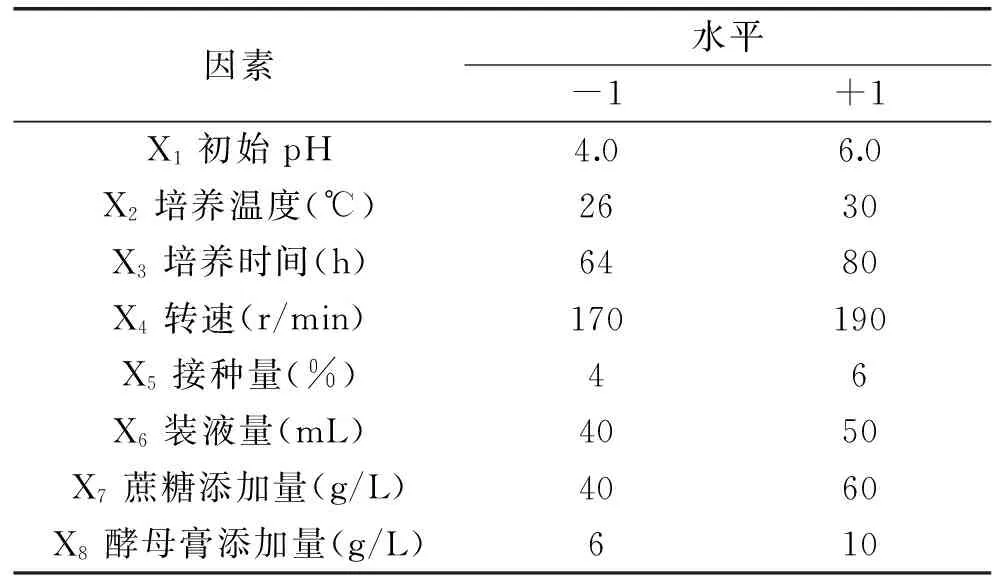
表1 Plackett-Burnman实验因素水平编码Table 1 Factors levels and code of Plackett-Burnman
1.4.3.2最陡爬坡实验设计(Steepest ascent design)由Plackett-Burnman实验选出对酵母产β-葡萄糖苷酶酶活影响显著的因素进行最陡爬坡实验,设计显著影响因素的最陡爬坡路径,以实验值变化的梯度方向为爬坡方向。
1.4.3.3Box-Behnken实验设计参考文献[21]根据Plackett-Burman设计结果分析,为确定显著因子的最优水平,利用响应曲面法(Box-Behnken 设计)对影响菌株UV-E-16产β-葡萄糖苷酶活性的显著因子进一步优化。以酶活力为响应值,主效因子的水平为自变量,使用Design-Expert进行Box-Behnken实验设计,设计方案见表2。
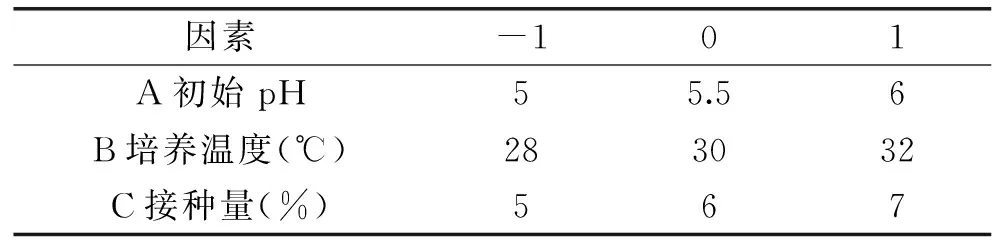
表2 中心组合实验的自变量及其水平Table 2 Factors and levels of center combination test design
1.5数据分析
采用Design-Expert 8.0 统计软件分析数据。
2 结果与分析
2.1对硝基苯酚溶液标准曲线
对硝基苯酚在碱性条件下显黄色,在一定范围内,其浓度与吸光值成正比。如图1,对硝基苯酚标准曲线回归方程为:Y=19.957x-0.0087,相关系数R2=0.9970,吸光度与对硝基苯酚含量成线性关系。
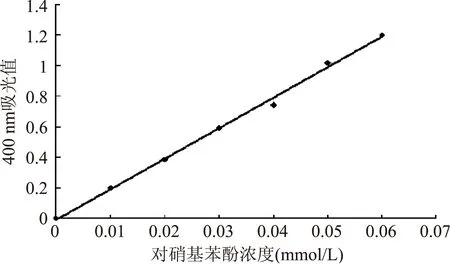
图1 对硝基苯酚溶液标准曲线Fig.1 Standard curve of p-nitrophenol solution
2.2菌株UV-45生长曲线
菌株UV-45的生长曲线如图2,4~28 h为酵母菌株UV-45的对数生长期,4 h以后酵母进入对数生长期,28 h后为稳定期,菌体浓度基本保持不变,由于采用OD值法测菌体浓度,因此,细胞衰亡期趋势未能体现,因此未出现衰亡期。由于对数生长期的细胞为生理活性一致的活细胞,突变率高,重现性好[21],因此本实验选择对数生长中期的菌体进行化学诱变,即选择培养16 h的菌体进行DES诱变处理。
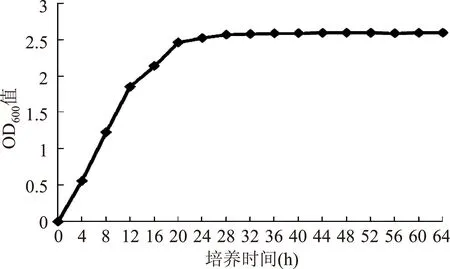
图2 酵母菌株UV-45生长曲线Fig.2 Growth curves of yeast strain UV-45
2.3DES诱变条件优化
2.3.1最佳诱变浓度选择出发菌株UV-45由不同浓度DES诱变处理,DES浓度与致死率的关系如图3所示,UV-45菌株对DES试剂非常敏感,DES试剂浓度为0.5%时,致死率达到50%;随着浓度增大,菌株致死率呈上升趋势;浓度为2%时,致死率达到92%。由于高致死率容易产生突变株,但负突变较多;低致死率不易产生突变,但正突变比例较高[11],据文献报道,诱变的致死率在75%~85%之间时,正突变率相对较高[11],获得优良性能菌株的可能性更大。因此选择77.53%的致死率,即DES浓度为1%。
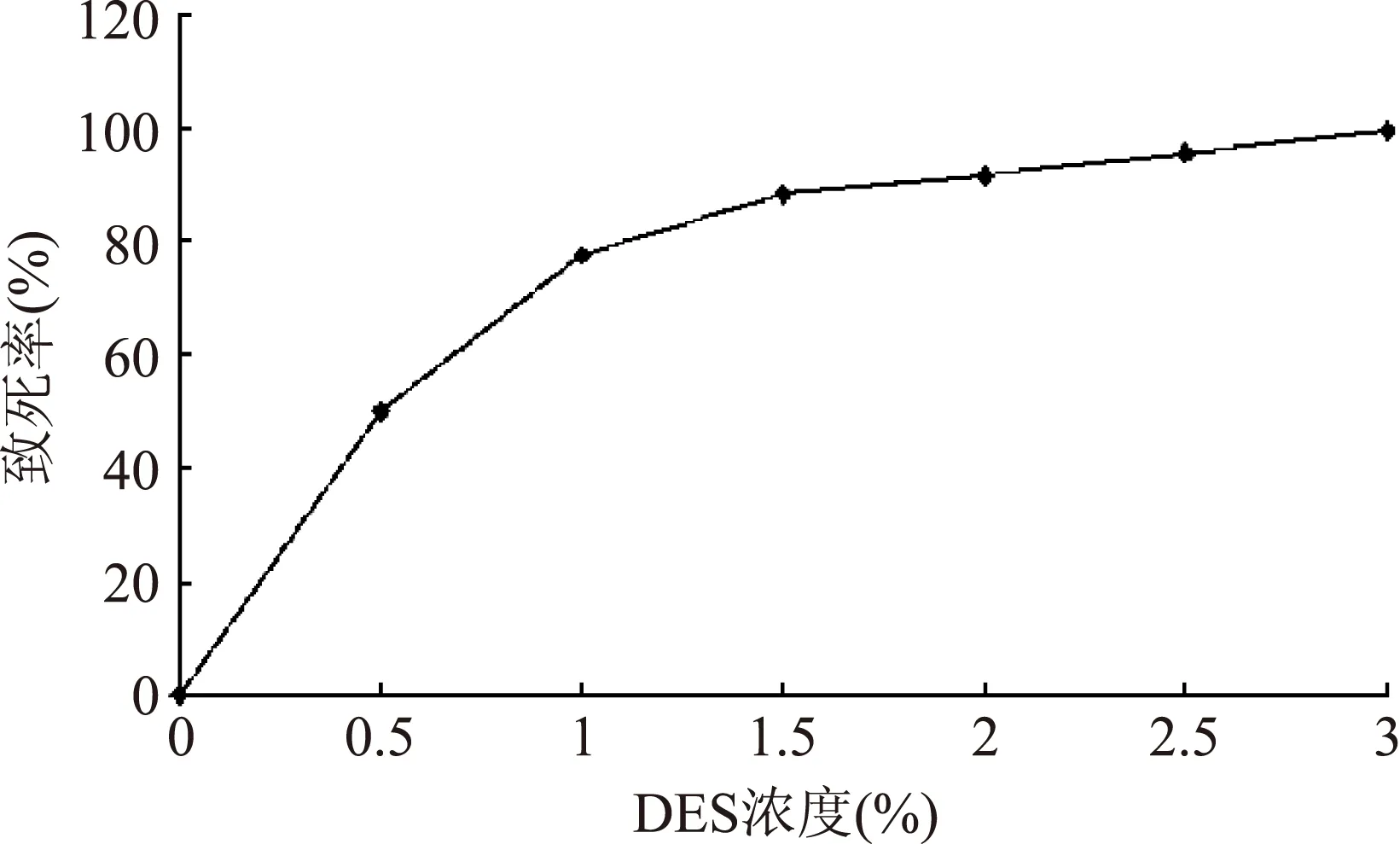
图3 DES浓度对菌株致死率的影响Fig.3 Effects of radiation DES concentration on death rate of strain
2.3.2最佳诱变时间选择DES处理时间与致死率的关系如图4所示,UV-45在浓度为1%的DES处理下,随着处理时间增长,菌株致死率呈上升趋势;在处理60 min时,酵母菌株UV-45的致死率达到100%,因此,选择1% DES处理酵母菌40 min,此时致死率为82.02%。
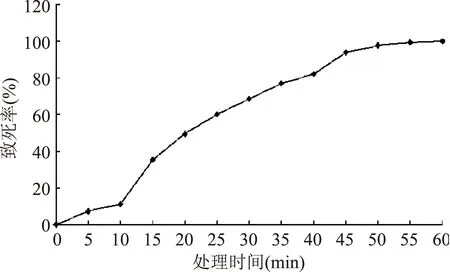
图4 DES诱变处理时间对菌株致死率的影响Fig.4 Effects of radiation DES time on death rate of strain
2.4突变菌株筛选
由于p-NPG经β-葡萄糖苷酶水解后的产物p-NP在碱性条件下显黄色[15],因此将其作为反应底物,利用96孔板培养进行菌株初筛,根据颜色深浅据此来初步判断酶活高低,以筛选出酶活较高的11株菌株分别是UV-E-5、UV-E-8、UV-E-9、UV-E-12、UV-E-16、UV-E-17、UV-E-19、UV-E-23、UV-E-25、UV-E-29、UV-E-33。
通过对这11株菌摇瓶发酵复筛,所得结果见图5。对11株菌复筛所得的酶活力数据进行方差分析,根据显著性分析,UV-E-9、UV-E-16、UV-E-23、UV-E-25,这4株突变体与出发菌株UV-E-45酶活力差异极显著(p<0.01),分别比出发菌株提高了51.75%、48.24%、45.68%、40.19%,说明菌株UV-E-9、UV-E-16、UV-E-23、UV-E-25所产β-葡萄糖苷酶活力比原菌株有明显提高。因此选择这四株突变体进行进一步实验。
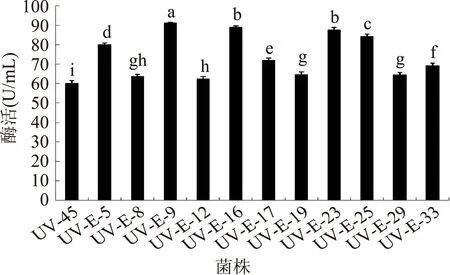
图5 突变体β-葡萄糖苷酶酶活Fig.5 β-glucosidase activity of Mutant
2.5突变菌株产酶稳定性研究
将复筛得到的突变菌株UV-E-9、UV-E-16、UV-E-23、UV-E-25经过多次传代后测酶活,结果如图6所示,只有菌株UV-E-16传代10次后β-葡萄糖苷酶酶活仍保持了83.3%的酶活力,说明突变菌株UV-E-16性状相对稳定,因此选择UV-E-16为目标菌株做进一步研究。

图6 突变体产酶稳定性Fig.6 Produce enzyme stability of Mutant
2.6突变菌株产酶培养条件优化
2.6.1最佳碳源、氮源选择由图7可知,蔗糖作为突变菌株UV-E-16产酶培养的碳源时,最有利于产酶;其次是葡萄糖和微晶纤维素。当选择蔗糖为最佳碳源,其酶活为84.91 U/mL。

图7 不同碳源对产酶的影响Fig.7 The influence of different carbon sources on the enzyme production
如图8所示,突变菌株UV-E-16产酶培养的最适氮源为酵母膏,其次是尿素,而硫酸铵和硝酸铵作为唯一氮源不能满足大量产酶的需求,因此选择酵母膏为最佳氮源。
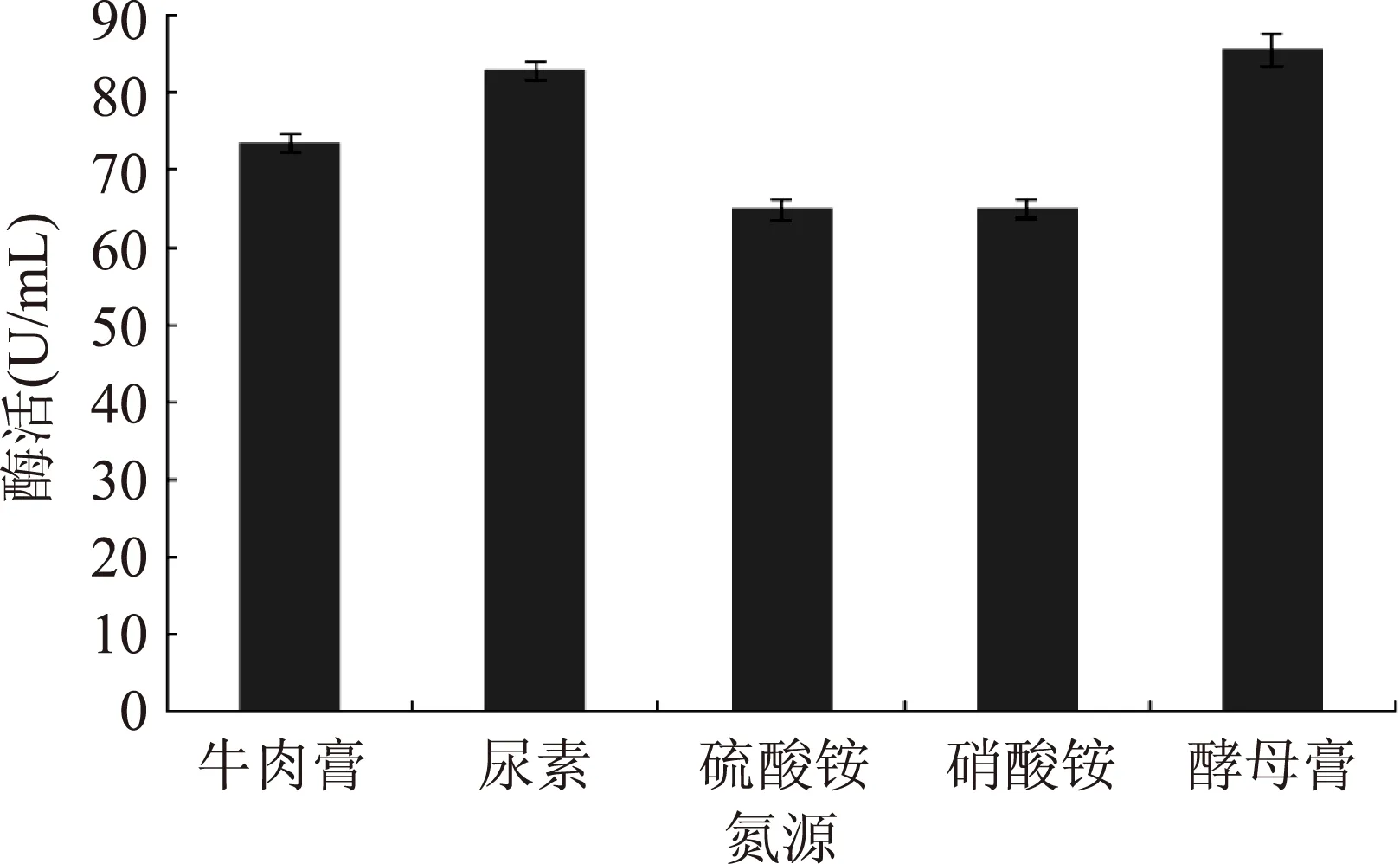
图8 不同氮源对产酶的影响Fig.8 The influence of different nitrogen source on the enzyme production
2.6.2响应面法优化β-葡萄糖苷酶产酶条件
2.6.2.1Plackett-Burman设计筛选影响产酶的主效因子运用Design-Expert 8.05进行设计与分析,实验结果及主效应分析结果分别见表3、表4。
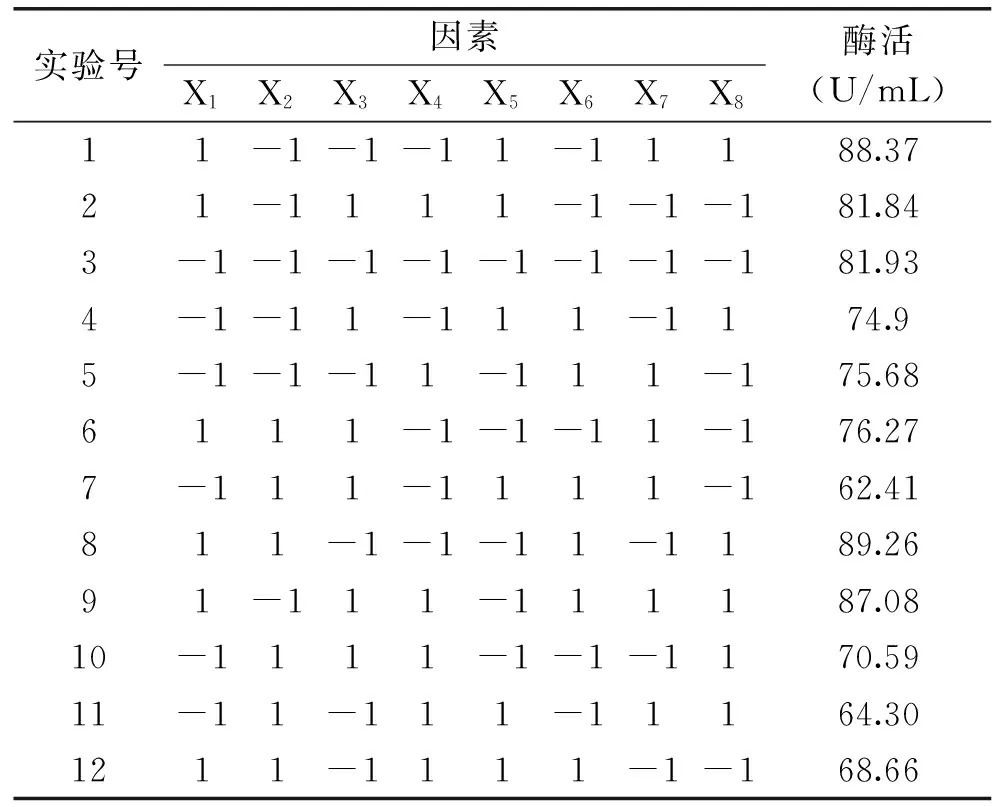
表3 Plackett-Burman 实验设计及结果Table 3 Design and results of Plackett-Burnman
由表4可知,对突变菌株UV-E-16产β-葡萄糖苷酶酶活有显著影响的因素为初始pH(X1)、培养温度(X2)、接种量(X5),其他因素对产酶活性没有显著影响,根据效应判断,选择条件即培养时间(X3)为64 h,转速(X4)为170 r/min,装液量(X6)为40 mL,蔗糖添加量(X7)为40 g/L,酵母膏添加量(X8)为10 g/L。因此,最陡爬坡实验选择初始pH、培养温度和接种量为研究对象。
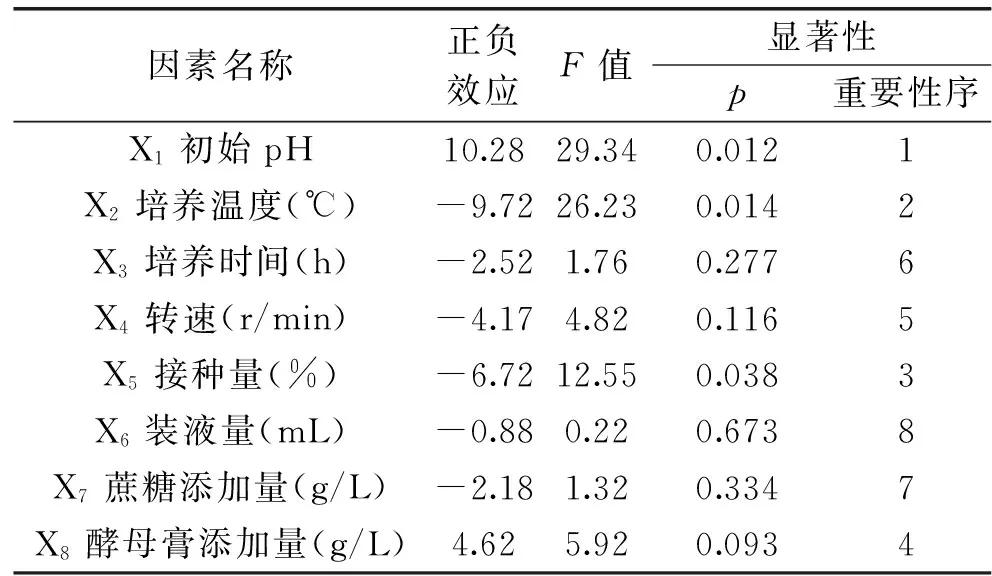
表4 Plackett-Burman实验各因素主效应分析Table 4 Main effect factors analysis of Plackett-Burnman
2.6.2.2最陡爬坡实验设计根据2.6.2.1筛选所得的3个显著因素及其效应,设定最陡爬坡实验步长及爬坡方向。实验设计及结果分析见表5。
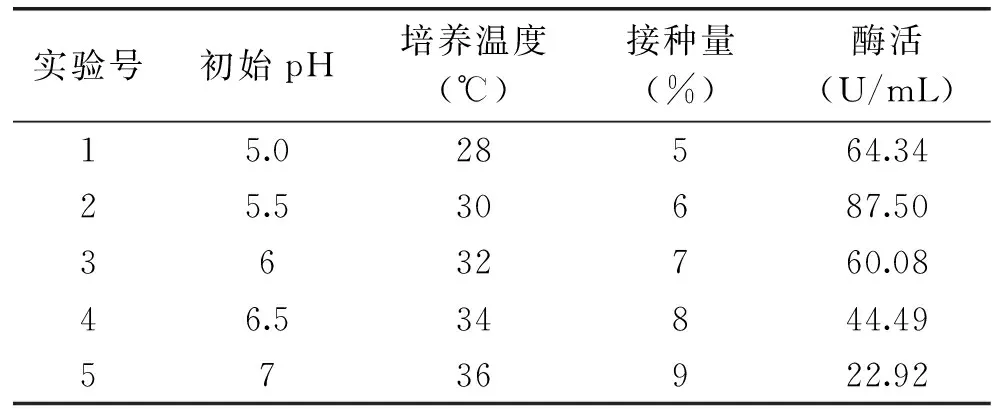
表5 最陡爬坡实验设计及结果Table 5 Design and results of steepest garde test
由表5知,2号实验条件下酵母产β-葡萄糖苷酶酶活最高为87.5 U/mL,即培养基初始pH为5.5、培养温度为30 ℃、接种量为6% 的培养条件。因此,将2号实验条件作为响应面实验因素水平的中心点。
2.6.2.3Box-Behnken 实验设计及结果根据2.6.2.1与2.6.2.2结果分析,对产β-葡萄糖苷酶产量影响显著的因素为初始pH、培养温度以及接种量。为了确定显著因子的最佳水平,利用响应曲面法(Box-Behnken设计)对影响突变菌株UV-E-16产酶活性的显著因子进行进一步优化。以酶活力为响应值,显著因子的水平为自变量,借助实验设计软件Design-Expert进行Box-Behnken实验设计,设计及结果见表6。
利用Design Expert 8.0软件对表6的数据进行二次多项回归拟合,获得酶活(Y)对A-初始pH(X1)、B-培养温度(X2)、C-接种量(X5)的二次多项回归方程:
Y=89.67+7.42A-5.17B+1.65C+10.09AB+10.24AC-6.35BC-16.01A2-17.65B2-19.63C2
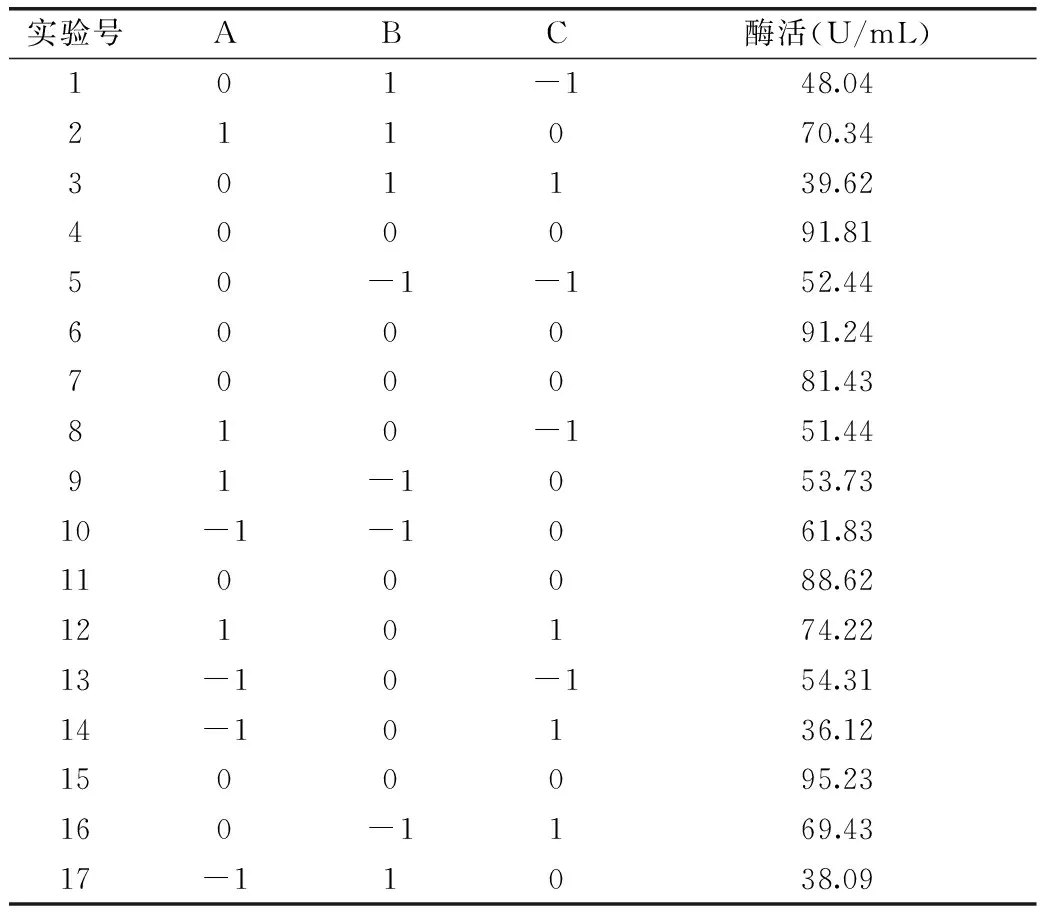
表6 Box-Behnken组合实验设计及结果Table 6 Design and results of Box-Behnkencombination test
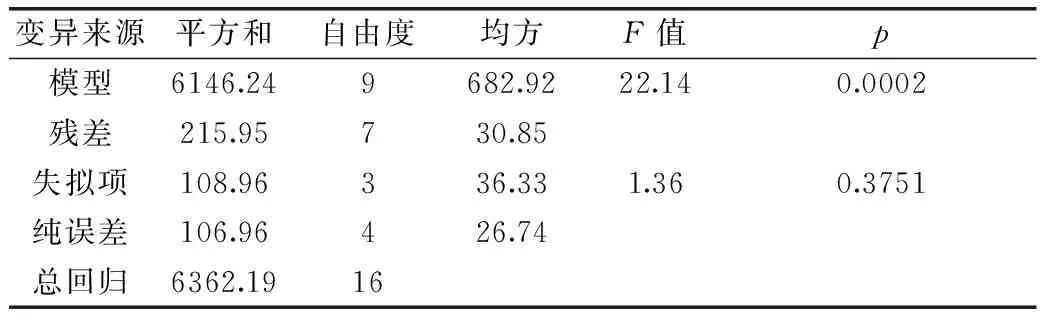
表7 Box-Behnken实验回归模型方差分析Table 7 Analysis of Box-Behnken combination test regression model variance
用Design Expert 8.0软件对数据进行多元回归分析,其方差分析见表7、表8。从表中可以看出,该模型在α=0.01的水平上高度显著,说明模型的预测值和实际值非常吻合,模型成立。各因素中一次项 A,交互项AB,AC及二次项A2、B2、C2对菌株产酶的影响极显著(p<0.01);一次项 B 对产酶量影响显著(p<0.05);而C、BC的影响差异不显著。同时回归方程相关系数R2=0.9661,模型F=22.14,说明响应值的变化有96.61%来源于所选变量,即初始pH、培养温度、接种量等三个因素的变化是造成菌株UV-E-16β-葡萄糖苷酶产量不同的原因。
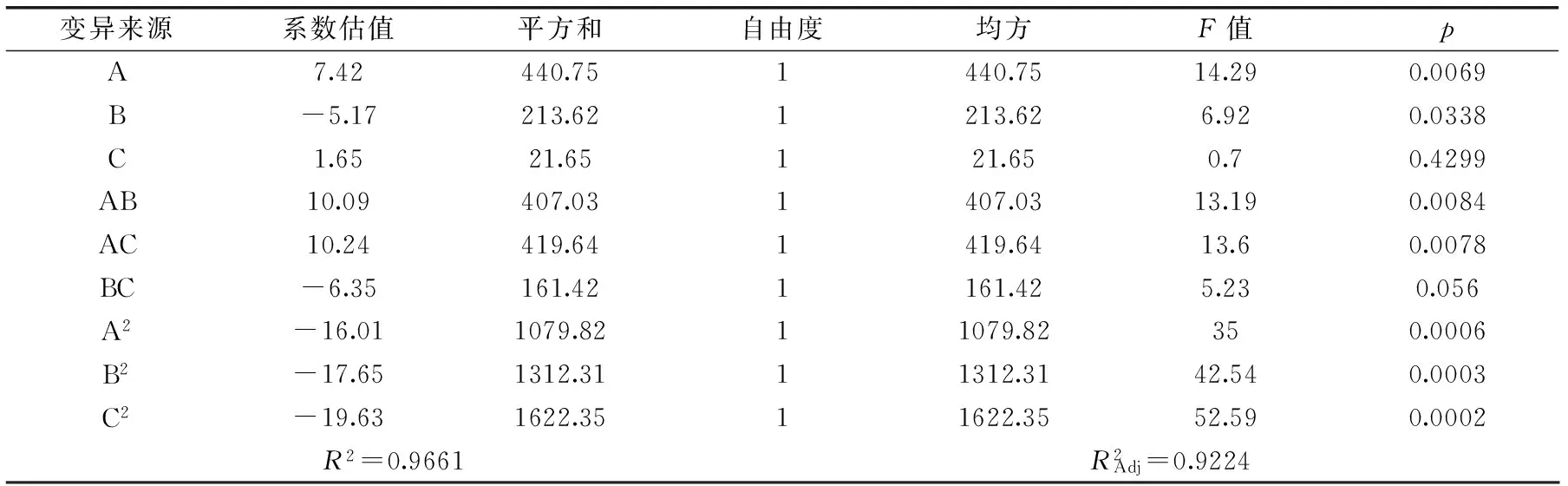
表8 二次多项回归方程系数的显著性检验Table 8 The regression coefficients of the quadratic multinomial significance test
回归方程失拟检验p>0.05,F=1.36,说明未知因素对实验结果干扰很小。因此,该回归方程可以较好地描述各因素与响应值之间的真实关系,可以用其确定最佳产酶条件。根据表7、表8中各因素对于菌株酶产量影响的F值,可以看出初始pH对菌株产酶量影响最大,培养温度次之,接种量影响最小。
2.6.2.4响应面优化结果的分析对初始pH(A)、培养温度(B)、接种量(C)3个因素,两两交互作用分析,做出响应面曲面,如图9。RSM方法的图形是特定的响应面(Y)与对应的因素A、B、C构成的一个三维空间在二维平面上的等高图,每个响应面对其中两个因素进行分析,另外两个因素固定在零水平。从中可以直观地反映各因素对响应值的影响,从实验所得的响应面分析图上可以找到它们在提取过程中的相互作用,并通过等高线图得最优条件下各实验因子的取值。对初始pH(A)、培养温度(B)、接种量(C)3个因素,两两交互作用分析,做出相应的响应面曲面。如图9A,培养温度与培养基初始pH的响应面图及培养基初始pH与接种量的响应面图(图9B)可知,响应曲面坡度陡峭并且等高线扁而十分密集,说明UV-E-16菌株发酵产酶受到培养温度与培养基初始pH两因素间的交互作用趋势较明显,而从培养温度与接种量的相面图(图9C)可以看出,相应曲面坡度陡峭度降低,等高线密度降低,说明菌株发酵产酶量受该两组因素间的交互作用不显著。该结果与表8、表9的方差分析结果一致。图9D表示实际值与预测值的拟合度较高,实验真实性可靠。
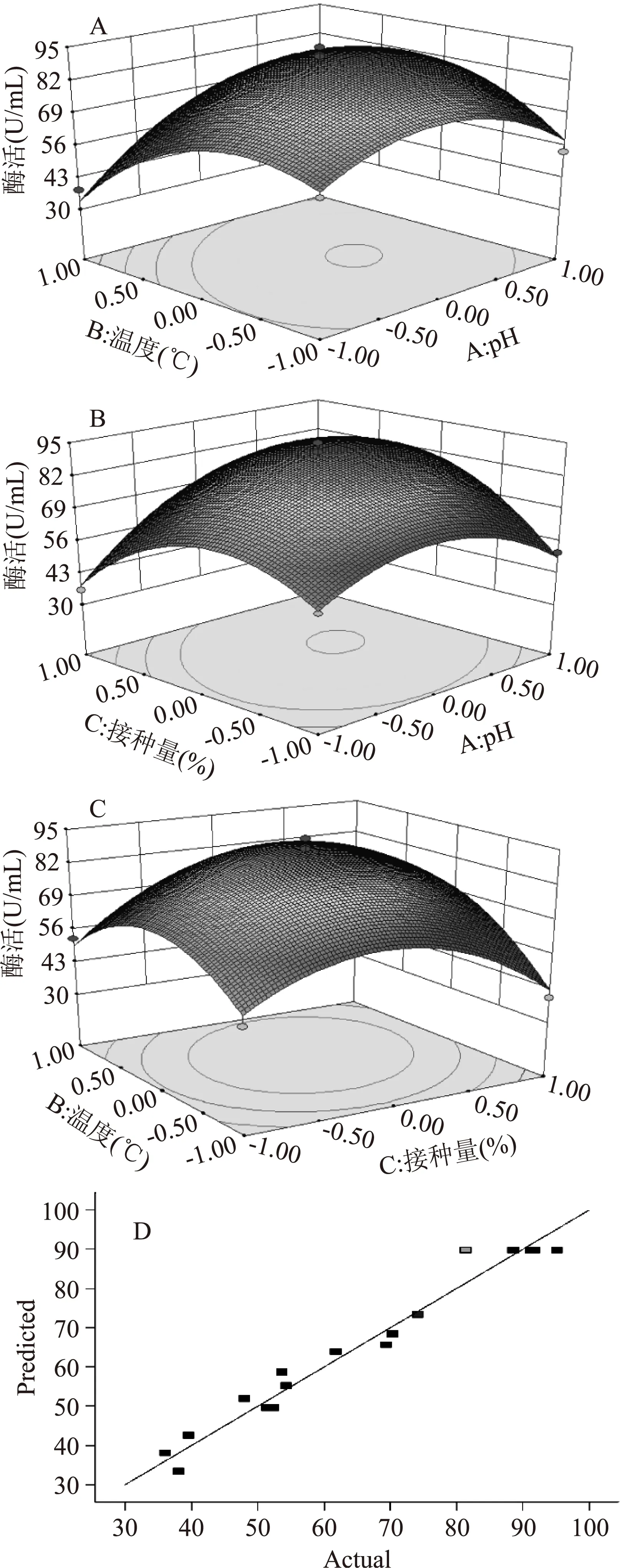
图9 响应面分析交互作用对β-葡萄糖苷酶产量的 影响及实际值与预测值的拟合性Fig.9 Response surface analysis of interactions on beta glycosidase enzymes yield and the influence of the fitting of the actual values and predicted values
2.7验证实验
为了进一步验证该模型的可靠性,初始pH5.62、培养温度29.8 ℃、培养时间为64 h、转速为170 r/min、接种量6.12%、装液量为40 mL、蔗糖添加量为40 g/L、酵母膏添加量为10 g/L的条件下测定酵母产β-葡萄糖苷酶酶活,实际测得值为90.91 U/mL,预测值为95.23 U/mL,相对误差为4.54%。因此,该模型设计合理且结果有效,得到的最佳培养条件准确可靠。
3 结论
本文以本实验室选育保存的一株酿酒酵母UV-45为出发菌株,以硫酸二乙酯(DES)对其对数生长期的菌体进行诱变,经显色反应初筛和比色法复筛,得到了突变体UV-E-9、UV-E-16、UV-E-23、UV-E-25,这4株突变体的β-葡萄糖苷酶的酶活较出发菌株有明显提高,并根据产酶稳定性确定UV-E-16为最优突变菌株。
对突变菌株UV-E-16发酵产β-葡萄糖苷酶的条件进行优化。首先确定最优碳源为蔗糖、最优氮源为酵母膏。其次通过Plackett-Burman 实验设计对培养条件初始pH、培养温度、培养时间、转速、接种量、装液量以及培养基碳源、氮源浓度等8个相关因素进行筛选,初始pH、培养温度和接种量对产酶菌株UV-E-16β-葡萄糖苷酶产量有显著影响,其他因素对产酶活性没有显著影响。通过Box-Behnken实验设计和响应面法分析对菌株UV-E-16产酶活性有显著影响的3个因素进行优化组合,获得最佳产酶条件为:初始pH 5.62、培养温度29.8 ℃、培养时间为64 h、转速为170 r/min、接种量6.12%、装液量为40 mL、蔗糖添加量为40 g/L、酵母膏添加量为10 g/L。;该条件下,菌株UV-E-16产β-葡萄糖苷酶酶活为90.91 U/mL,比出发菌株UV-45的酶活提高了50.24%,具有工业化应用的潜力。
[1]Liebig J,Wohler F.The composition of bitter almonds[J].Annalen,1837,22(1):1-24.
[2]Feldwisch J,Vente A,Zettl R,et al.Characterization of two membrane-associatedβ-glucosidases from maize(Zea mays L.)coleoptiles[J].Biochemical Journal,1994,302(1):15.
[3]Chen HL,Chen YC.A highly efficient beta-glucosidase from a buffalo rumenfungus Neocallimastix patriciarum W5[J]. Biotechnol Biofuels,2012,25:24.
[4]Mathew GM,Sukumaram RK.A Progress in research on fungal cellulases for lignocellulose degradation[J].Journal of Scientific Industrial Research,2008,67:898-907.
[5]Arevalo villena M,Ubeda iranzo JF,Gundllapalli SB,et al.Characterization of an Exocellularβ-glucosidase from Debaromyces pseudopolymorphus[J].Enzyme Microb Technol,2006,39:22-34.
[6]Baffi M A,Tobal T,Henrioue J,et al.A Novelβ-glucosidase from Sporidiobolus pararoseus:Characterization and Application in Winemaking[J].Journal of food science,2011,76:997-1002.
[7]葛有辉,王德良,曹建.富含β-葡萄糖苷酶的酒香酵母在酿酒领域中的应用[J].酿酒科技,2011,2:96-99.
[8]郭慧女.β-葡萄糖苷酶生产菌的选育及其对葡萄酒中结合态香气的影响[D].无锡:江南大学.2010.
[9]梁华正,刘富梁,彭玲西,等.京尼平苷为底物测定β-葡萄糖苷酶活力的方法[J].食品科学,2006,27(4):182-185.
[10]张顺涛.高生物通量富硒酵母的选育及富硒保健酒的研制[D].青岛:中国海洋大学.2009.
[11]熊建春.甘蔗威士忌酯香酵母菌的选育及发酵工艺研究[D].广州:华南理工大学.2010.
[12]王宜林.化学诱变剂对酵母SOD活性的影响[J].食品科技,2004,5:8-13.
[13]刘海洲,刘均洪.南极假丝酵母诱变育种及产脂肪酶条件优化[J].青岛科技大学,2009,30(3):226-237.
[14]Ruchi Agrawal,Alok Satlewal,Ashok kumar Vevma.Development of aβ-glucosidase hyperproducing mutant by combined chemical and UV mutagenesis[J].Original article 3 Biotech,2013,3:381-388.
[15]李庆华.高产β-葡萄糖苷酶酿酒酵母的筛选及其发酵特性的研究[D].西安:西北农林科技大学.2009.
[16]侯晓瑞,王婧.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[17]李新社,陆步诗.紫外诱变皮状丝孢酵母选育高产油脂菌株[J].中南大学学报,2011,42(3):617-622.
[18]马腾臻,杨学山,张莉.红佳酿酵母β-葡萄糖苷酶活性测定及产酶特性[J].食品与发酵工业,2014,10(322):47-52.
[19]先天敏.黑曲霉C112产β-葡萄糖苷酶的条件优化及酶学性质研究[D].长沙:中南林业科技大学.2013.
[20]Kai Cai,Huinan Zhao.Enzymatic hydrolysis followed by gas chromatography-mass spectroscopy for determination of glycosides in tobacco and method optimization by response surface methodology[J].Analytical Methods,2014,6:7006-7014.
[21]周德庆.微生物实验教程[M].北京:高等教育出版社,2006:216.
Chemical mutation of strain and optimization of productionβ-Glucosidase fromSaccharomycescerevisiae
WANG Jing1,2,3,ZHANG Li1,2,3,ZHANG Hong-hai1,2,3,HAN Shun-yu1,2,3,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Key Laboratory of Viticulture and Enology in Gansu Province,Lanzhou 730070,China;3.Research and Development Center of Wine Industry Technology in Gansu Province,Lanzhou 730070,China)
By the screening of diethyl sulfate(DES)mutation and death rate determination,a mutant strain UV-E-16,which characterized by stableβ-glucosidase producing capability and enzyme activity of 74.26 U/mL,was obtained from a laboratory savedSaccharomycescerevisiaeUV-45.Compared with the original strain,enzyme activity of UV-E-16 was improved by 22.74%.Initial pH,temperature,and inoculation dose were selected as the significant impact factors affecting on enzyme production according to Plackett-Burman design.Further optimizing was conducted by Box-Behnken design and response surface methodology.Related results showed that the optimized conditions were initial fermentation pH of 5.62,culture temperature of 29.5 ℃ and inoculum 6.12%,and theβ-glucosidase producing activity of UV-E-16 was 90.91 U/mL under the conditions.The activity ofβ-Glucosidase synthesis was improved by 50.24% in comparison with UV-45,UV-E-16 can be regarded as a promising strain with industrial application properties.
β-glucosidase;diethyl sulfate;chemistry mutagenic;optimized conditions
2015-03-23
王婧(1969- ),女,博士,副教授,硕士生导师,研究方向:微生物学,E-mail:wangjing@gsau.edu.cn。
韩舜愈(1963- ),男,博士,教授,研究方向:果蔬加工及葡萄酒酿造,E-mail:gsndhsy@163.com。
国家自然科学基金资助项目(31160310);甘肃省农业生物技术专项(GNSW-2013-16)。
TS261.2
A
1002-0306(2016)09-0139-08
10.13386/j.issn1002-0306.2016.09.019

