高分子聚合物γ-PGA对长双歧杆菌的冻干保护作用
宋玉萍,梁金钟,王风青,梅剑秋
(哈尔滨商业大学食品工程学院,黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
高分子聚合物γ-PGA对长双歧杆菌的冻干保护作用
宋玉萍,梁金钟*,王风青,梅剑秋
(哈尔滨商业大学食品工程学院,黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
以长双歧杆菌为实验菌株,以高分子聚合物γ-PGA为主要保护剂进行冻干实验。通过对冻干菌粉的存活率、发酵产酸能力,冻干菌粉和反复冻融3次后菌体形态的微观变化进行研究。结果表明:用10%脱脂乳粉作为保护剂菌体存活率为47.3%,以2.5%γ-PGA为保护剂菌体存活率为54.8%。以10%脱脂乳粉和1.5%γ-PGA作为保护剂其存活率为79.8%,复合保护剂比10%脱脂乳粉单一保护剂存活率高25.0%左右。电镜观察采用复合保护剂菌体外层形态呈致密包裹结构,冻融3次后菌体形态完整,细胞结构未见严重损伤和变形,复水后作为菌种进行发酵,18 h时的酸度达到65.5°T,室温贮藏90 d存活率仍能达到48.7%。
γ-PGA,冷冻干燥,长双歧杆菌,冻干保护剂
γ-PGA(poly-γ-glutamic acid,γ-聚谷氨酸)是一种由微生物发酵合成的氨基酸高分子线型均聚物,由D-谷氨酸和L-谷氨酸通过α-氨基和γ-羧基聚合而成[1],γ-PGA主链由酰胺键链接,且存在大量游离的亲水性羧基[2],在分子内部或分子之间可形成大量氢键。由于γ-PGA特殊的分子结构赋予其具有极佳的成膜性、成纤维性、阻氧性、粘结性、悬浮性、增粘性、保湿性、极强吸水性、可食用性和可生物降解性[3],且具有极佳的抗冷冻性能[4]。双歧杆菌是人类的肠道益生菌,具有多种生物学功能,能通过糖酵解产生大量有机酸,降低肠道环境的pH,可有效抑制肠道中腐败菌和有害菌的生长繁殖[5],对人体健康有利。因此,近年来益生菌产品广受人们青睐,但双歧杆菌在冻干生产中细胞极易损伤而失活,在贮存期间其活性保持也较困难[6]。为提高益生菌冻干菌粉的存活率,需添加适当的冻干保护剂使菌体细胞免受冻干的损害。本文的目的就是研究不同浓度的γ-PGA及γ-PGA与脱脂乳粉作为复合冻干保护剂,研究γ-PGA在冷冻干燥过程中对双歧杆菌存活率的影响,并对其作用机理进行分析探讨。目前γ-PGA尚未被用于益生菌的冻干保护。
1 材料与方法
1.1材料与仪器
PBS缓冲溶液:准确称取NaCl 8.00 g、KCl 0.20 g、KH2PO40.24 g、Na2HPO4·12H2O 0.3628 g溶于800 mL蒸馏水中,用盐酸调节pH为7.4,然后用蒸馏水定容至1000 mL,高压灭菌后室温保存。
混合盐溶液:CaCl20.20 g/L、KH2PO41.00 g/L、K2HPO41.00 g/L、MgSO40.48 g/L、NaHCO310.00 g/L、NaCl 2.00 g/L。
γ-PGA纯品由哈尔滨商业大学发酵自制;脱脂乳粉完达山乳业有限公司;半胱氨酸(L-Cysteine)(分析纯)美国Amresco公司。
长双歧杆菌(Bifidobacteriumlongum)由哈尔滨商业大学发酵学科组耐氧驯化培养得到。
菌体的活化、培养及保藏培养基(TPY培养基):酪蛋白胨12.0 g/L、胰蛋白胨3.0 g/L、大豆蛋白胨3.0 g/L、葡萄糖5.0 g/L、酵母浸粉5.0 g/L、吐温80 1.0 g/L、半胱氨酸0.5 g/L、混合盐溶液10.0 mL/L。500 mL三角瓶装液量300 mL,121 ℃高压灭菌20 min。
L535-1低速离心机湖南湘仪实验仪器开发有限公司;FD5系列冻干机SIM西蒙国际仪器有限公司;DHP-9162电热恒温培养箱上海一恒科技有限公司;超低温保存箱Haier BIO-MEDICAL;SW-CJ-IFD型单人单面净化工作台苏州净化设备有限公司;BS224S电子台秤赛多利斯科学仪器(北京)有限公司。
1.2实验方法
1.2.1活菌粉的制备工艺活化菌种→液体培养→菌体收集→PBS洗涤→离心收集→细胞悬浮液(添加冻干保护溶液)→布盘→冷冻干燥→冻干菌粉
1.2.2菌体的培养、收集以及细胞悬浮液的制备将活化的长双歧杆菌以2%的接种量接种于5000 mL TPY液体培养基,37 ℃静止培养36 h,3500 r/min离心20 min弃上清,将得到的菌体沉淀用PBS缓冲溶液洗涤2次。将离心得到的菌泥悬浮于100 mL的PBS缓冲溶液中。冻干前先进行厌氧活菌计数。
冷冻干燥:取10 mL的菌悬液于大平皿中,分别加入不同配方的保护剂溶液,用PBS定容至60 mL,使大平皿中保护剂的浓度为目标配方最终浓度。将样品放置于4 ℃冰箱中预冷2 h,然后放入-70 ℃冰箱中冷冻24 h,最后在真空度为3~15 mb的条件下干燥约48 h左右,待样品恢复至室温取出。
储存:将制得的菌粉立即转入塑封袋中,抽真空塑封以隔绝空气并防止水分变化,室温放置每隔一段时间取出测活菌数。
1.2.3存活率的计算细胞悬浮液活菌数测定:每个厌氧管中加入5 mL的TPY固体培养基后充入氮气封装,121 ℃高压灭菌20 min,在水浴锅中维持温度在65 ℃,注入0.5 mL稀释适当倍数的菌液,在冰水浴中滚管,使固体培养基均匀凝固在厌氧管管壁上。37 ℃培养72 h,计厌氧管壁的菌落数。
冻干菌粉活菌数的测定:将制得的冻干菌粉加入含玻璃珠的100 mL无菌的PBS缓冲溶液中复水2 h后摇匀进行厌氧活菌数的测定。

式中:n1为10 mL原有长双歧杆菌菌悬液的活菌数;n2为菌粉复水后活菌数。
1.2.4电镜样品的制备将复水菌悬液离心得到菌泥,加入2.5% pH7.2戊二醛并置于4 ℃冰箱中固定1.5 h,用磷酸缓冲溶液冲洗2次后用50%、70%、90%乙醇脱水各一次,100%乙醇脱水2次,100%乙醇与叔丁醇1∶1、纯叔丁醇各置换一次,每个操作间隔15 min。然后将样品放入-20 ℃冰箱中冷冻30 min再放入冻干机中干燥,大约4 h。将得到的干粉用导电胶带粘在样品台上,溅射镀上金属膜。
1.2.5酸度滴定将前述菌悬液无菌稀释至100 mL,作为未冻干处理的菌悬液。取未冻干处理的菌悬液和复水后的各种菌粉溶液2 mL分别接种于100 mL TPY培养基中,37 ℃静置培养18 h。将得到的发酵液按GB5409-89[7]方法进行酸度测定。
2 结果与分析
2.1 不同类型保护剂对长双歧杆菌的冻干保护
以10%脱脂乳粉和2%的蔗糖、海藻糖、γ-PGA、甘露醇、谷氨酸为保护剂,以冻干菌粉的菌体存活率为依据,选取最佳的保护剂种类。实验结果见图1。

图1 不同类型保护剂长双歧杆菌冻干菌粉存活率的影响Fig.1 Effect of different cryoprotectants on the survival rate of Bifidobacterium longum after lyophilization
从图1可以看出,脱脂乳粉、蔗糖、海藻糖和γ-PGA的保护效果比较好,这四种保护剂的保护效果大小为:γ-PGA>海藻糖>脱脂乳粉>蔗糖。其中2%γ-PGA的菌体存活率最高为54.8%。
γ-PGA具有极好的抗冷冻性、成膜性以及持水性,可能在冻干过程中能稳定细胞膜和蛋白质结构,γ-PGA分子的大量羧基与菌体蛋白的羟基形成氢键[8],使蛋白质表面形成水化膜,稳定蛋白质的高级结构,冻干过程中的冰晶不易损伤细胞。
2.2不同浓度γ-PGA对长双歧杆菌的冻干保护
实验以不同浓度的γ-PGA作为保护剂,通过对长双歧杆菌冻干菌粉存活率的考察,确定γ-PGA作为冻干保护剂的最佳浓度。实验结果见图2。

图2 γ-PGA浓度对长双歧杆菌冻干菌粉存活率的影响Fig.2 Effect of γ-PGA concentration on the survival rate of Bifidobacterium longum after lyophilization
从图2可以看出,γ-PGA的添加明显提高了长双歧杆菌冻干菌粉的存活率,其中添加量为1%时菌体存活率提高效果显著,添加量4%处达到最大,继续增大γ-PGA添加量,影响效果逐渐减少。由于γ-PGA分子易附着于细胞表面[9],在冻干过程中细胞中的水分子缓慢向细胞表面迁移并和γ-PGA的亲水基团结合,极大的减少游离水的含量进而减缓冰晶的生长,因而减轻了细胞的损伤。但实验过程中发现随着γ-PGA添加量的增加,菌粉的吸潮也越来越加重,而且γ-PGA价格比较高[10],综合考虑将γ-PGA的添加量确定在2.5%以内。
2.3γ-PGA与脱脂乳粉复配对长双歧杆菌的冻干保护
用浓度0.5%、1.0%、1.5%、2.0%、2.5%γ-PGA分别与10%脱脂乳粉复配,以长双歧杆菌冻干菌粉中菌体存活率为指标,确定最佳的保护剂配方浓度。不同配方的保护剂对长双歧杆菌冻干菌粉中菌体的存活率影响见图3。

图3 不同配方保护剂对长双歧杆菌冻干存活率的影响Fig.3 Effect of different cryoprotectants on survival rate of Bifidobacterium longum after lyophilization
从图3可以看出,10%脱脂乳粉添加γ-PGA的保护剂较单一脱脂乳粉的保护效果明显提高,在γ-PGA浓度1.5%左右达到最高,之后随着γ-PGA浓度的增大,冻干菌粉的存活率几乎不再增大。而且添加脱脂乳粉后,样品吸潮有所缓解,基于保存条件和成本效益的综合考虑,确定采用10%脱脂乳粉和1.5%γ-PGA的复合保护剂,菌体存活率达到79.8%。
2.4添加保护剂冻干菌体微观形态的电镜观察
为了从微观探讨保护剂的作用,选择未添加保护剂的对照样、添加2.5%γ-PGA的冻干样、添加脱脂乳粉的对照样与1.5%γ-PGA和10%脱脂乳粉的复配冻干样品四种冻干菌粉进行扫描电镜观察,结果如图4。

图4 长双歧杆菌冻干菌粉的扫描电镜照片Fig.4 Picture of different cryoprotectants on structure of bacterial powder after lyophilization注:A:未添加保护剂的空白样;B:2.5% γ-PGA冻干样; C:10%脱脂乳粉冻干样; D:10%脱脂乳粉+1.5%γ-PGA冻干样。
冷冻干燥中,当细胞的生理条件和胞外环境相同时,菌体死亡的可能性表达为:P=cS(P为菌体死亡的可能性,c为常数,S为暴露在介质中的区域)[11],说明菌体死亡的可能性与暴露在外部的区域面积有很大的关系。从图4中可以看出,B中菌体被保护剂均匀包裹,而且分散性良好,菌体与保护剂呈沙琪玛状态分布;C中保护剂与菌体呈海绵状,虽然保护剂将长双歧杆菌包裹的很致密,但仍有部分菌体暴露在空气和介质中;D中保护剂与菌体呈现墙体结构,保护剂对长双歧杆菌的包裹不仅致密而且几乎没有菌体露在表面,包裹的涂层均匀且致密。说明10%脱脂乳粉中添加1.5%γ-PGA能提供良好的物理屏障来抵御恶劣的外界环境,极大的减少了菌体暴露在介质中的面积,有效地保护细胞免受冷冻伤害。
2.5反复冻融后的菌体形态
将制得的冻干菌粉反复冻干复水,即将得到的菌粉进行复水洗涤去保护剂,离心得菌体后制成菌悬液,重新加入相对应的保护剂进行布盘冻干,如此反复2次,将得到的菌粉再进行复水洗涤去掉保护剂,离心得到菌体后,进行扫描电镜观察,结果如图5。

图5 反复冻干复水的长双歧杆菌扫描电镜照片Fig.5 Picture of different cryoprotectants on the structure of Bifidobacterium longum after repeat lyophilization and hydration注:A:未添加保护剂的空白样;B:2.5% γ-PGA冻干样; C:10%脱脂乳粉冻干样; D:10%脱脂乳粉+1.5% γ-PGA冻干样。
为了能够直观的观察保护剂对菌体的保护作用,验证不同配方保护剂缓解冻干过程对菌体的损伤,将制得的冻干菌粉反复冻融。菌体反复冻干复水后对菌体的损伤主要有冰晶机械应力[12]和冷冻脱水导致细胞的膜结构向非层状结构相变,导致复水时膜蛋白分离引起细胞内溶物泄露甚至细胞破碎[13]。从图5可以看出,不加任何保护剂的对照样品A受到了极大的损伤,出现了大量的细胞碎片;添加2.5%γ-PGA作为保护剂的B样品虽然也受到了损伤,但是未出现细胞碎片,菌体细胞表面有泡状的突出部分,应该是内溶物轻微的泄露所导致;以10%脱脂乳粉为保护剂的C样品虽然未出现细胞碎片,但是菌体变形得较为严重。10%脱脂乳粉与1.5%γ-PGA复配保护的样品D细胞饱满、形态完整、分散性好,未见细胞变形或粘连。电镜结果进一步验证了在冻干过程中γ-PGA能有效的保持细胞的结构完整和细胞膜的渗透屏障,有效的防止冻干损伤。
2.6菌体的产酸能力
将前述菌悬液无菌稀释至100 mL,作为未冻干处理的菌悬液。取未冻干处理的菌悬液和复水后的各种菌粉溶液2 mL分别接种于100 mL TPY培养基中,37 ℃静置培养18 h。酸度测定的结果见图6。

图6 不同配方保护剂对长双歧杆菌发酵产酸活力的影响Fig.6 Effect of different cryoprotectants on acidogenic of Bifidobacterium longum after lyophilization
长双歧杆菌冻干时易导致部分菌体的损伤、某些酶的钝化影响菌体的正常代谢[14],进而使菌体的迟滞期明显延长、对数生长期的产酸能力下降[15],所以通过酸度的测定可以表征菌体的活性。酸度的大小是菌体代谢的结果,亦是菌体活性的直观反映。从图6可以看出,10%脱脂乳粉与1.5%γ-PGA复配的保护剂保护的菌体与未进行冻干的菌体产酸能力相差最小,说明复配的保护剂优于10%脱脂乳粉的保护剂。虽然2.5%γ-PGA作为保护剂的样品产酸能力不如10%脱脂乳粉作为保护剂的样品,但也相差不是很大,综合前述实验结果可以看出γ-PGA可以很好的维持菌体的活性、快速的恢复活力,降低冻干过程带来的代谢损伤,这应该与γ-PGA分子结构有关。另外,γ-PGA具有很好的成膜性以及阻氧性,能有效的创造一个低氧的环境,保持长双歧杆菌的代谢活性。
2.7冻干菌粉的贮存实验
将经10%脱脂乳粉与1.5%γ-PGA复合保护的长双歧杆菌冻干菌粉,抽真空塑封置于室温贮藏,每隔15 d进行一次计数,具体结果见图7。
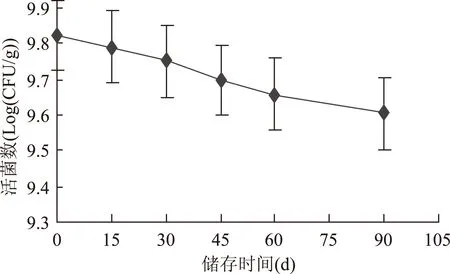
图7 贮存过程中冻干菌粉活菌数Fig.7 The survival number of Bifidobacterium longum after lyophilization
将长双歧杆菌制成菌粉的主要目的就是提高双歧杆菌类产品的货架期,将制得的冻干菌粉进行贮存实验进一步验证保护剂的实用效果,具体实验结果见图7。从图7可以看出复配保护剂在储存90 d时活菌数为9.6 log(CFU/g)即4.02×109CFU/g,仍然保持在109CFU/g的水平,此时冻干菌粉的菌体存活率为48.3%,远远高于国际标准化委员会的规定[16]。
3 结论与讨论
实验得出,用10.0%脱脂乳粉作冻干保护剂菌体存活率为47.3%,而2.0%γ-PGA的菌体存活率可达到51.0%,与海藻糖效果相当。在不同浓度γ-PGA与脱脂乳粉复配的实验中,添加γ-PGA的样品活菌率要明显高于单一脱脂乳粉的样品,其中10.0%与1.5%γ-PGA复合保护长双歧杆菌效果最为显著,菌体的存活率达到79.8%。电镜观察经保护剂包埋后的菌体形态呈墙体结构将菌体致密的包裹,冻融3次后菌体形态依然饱满、完整、未见细胞变形或粘连,复水后作为发酵菌种18 h时的酸度为65.5 °T,贮藏90 d存活率为48.3%。
当前,γ-PGA用作冻干保护剂还少有研究,它保护菌体的机理可能源于以下几点:γ-PGA是谷氨酸聚合而成的同聚肽,分子链上有大量的羧基,能够与菌体表面上的活性基团结合,使菌体包裹的更严实,还可以与菌体表面的蛋白以氢键结合,保证了蛋白质的稳定性;而且γ-PGA的持水性好,易与水分子结合,能够极大的减少游离水的含量进而减缓冰晶的生长,使形成的冰晶细小,达到理想的保护效果;另外随着冻干过程中水分的升华,γ-PGA的浓度不断增大,粘度也极度上升,因而分子扩散系数降低,有效的避免了细胞内溶物的泄露。γ-PGA属于非渗透性的保护剂,虽然分子量比较大不能渗透进入细胞,但分布在一定的范围内,能在细胞表面形成更密封的保护层来阻止冷冻损伤,且它的成膜性以及阻氧性能使双歧杆菌免受氧气的毒害,保护内部酶的活性,而且低氧环境还可降低细胞膜上脂类物质的过氧化作用。另外,γ-PGA在水中的溶解速度比较慢,可以减缓溶液进入冻干菌体中的速度,起到一个渗透缓冲作用,如果没有这个缓冲作用,水很快就会进入细胞,造成活细胞的暂时渗透压休克、受损细胞的破裂死亡。
γ-PGA在中性环境中是无规则卷曲状态,在酸性溶液中以平行的β-片层结构为主[17],如果将它应用于微胶囊,具有潜在的保护能力,使长双歧杆菌有效的抵御体系中有害成分的破坏,尤其是在酸性和液体食品体系中。而且能使长双歧杆菌在通过胃消化时对抗较强的酸环境,使益生菌高存活并有效的到达肠道的靶位点,这将对人体微生态十分有益。
[1]梁金钟,王风青,张露露.产γ-PGA发酵动力学模型的建立[J].食品工业科技:生物工程,2013(16):174-177.
[2]范洪臣,李艳华,梁金钟,等.响应面法优化枯草芽孢杆菌产γ-PGA的条件[J].生物加工过程,2008,6(3):17-23.
[3]梁金钟,张露露,王风青.γ-PGA发酵液预处理的研究[J].食品科学:生物过程,2013,21(34):168-171.
[4]彭云英.γ-聚谷氨酸生产、合成机制和抗冷冻性的研究
[D].无锡:江南大学.
[5]吕志勇,吕志刚.双歧杆菌的保健功能及其产品研发[J].食品工业科技,2006,34(19):5031-5032.
[6]陈葙南.双歧杆菌的生理功效及应用研究进展[J].科技创新导报,2010,11:2-3.
[7]中国预防医学科学院标准.GB 5409-89[S].食品卫生国家标准汇编.北京:中国标准出版社,1988.
[8]庄华红,王淑芳,高靖辰,等.γ-聚谷氨酸水凝胶的制备、性能及应用[J].应用化学,2014,31(3):245-255.
[9]施庆珊.γ-聚谷氨酸的微生物合成与应用[J].精细与专用化学品,2004,11(12):20-23.
[10]梁金钟,王风青.微生物发酵法合成高分子聚合物γ-PGA的研究[J].北京工商大学学报:自然科学版,2011,29(1):24-29.
[11]曹永梅,张灏,许时婴,等.保护剂在冷冻干燥双歧杆菌中的作用[J].食品与发酵工业,1999,26(2):40-45.
[12]杨戈尔.低温冷冻过程中胞内冰晶生长机制与应用研究[D].上海:上海交通大学.
[13]苏萍,董英,程新,等.植物乳杆菌冻干保护剂的优化及其保护机制[J].中国食品学报,2014,14(11):56-63.
[14]Han B,Bischof JC.Direct cell injure associated with eutectic crystallization during freezing[J].Cryobiology,2004,48(1):8-21.
[15]刘丽凤,孟祥晨.双歧杆菌的冻干损伤及保护[J].中国乳品工业,2006,1(34):39-43.
[16]杨剀舟,刘云,杨立芳,等.长双歧杆菌BBMN68微胶囊的制备及其应用性评价[J].食品科学,2015,3(9):71-77.
[17]D.ZANUY,A.M.NAMBAL,S.LEO′N,et al.On the structure of the phase A of comb-like poly(a-alkyl-b,l-aspartate)s:a molecular modelling study[J].Polymer,2001,42:281-287.
Effect of polymerγ-PGA on freeze-dried protection ofBifidobacteriumlongum
SONG Yu-ping,LIANG Jin-zhong*,WANG Feng-qing,MEI Jian-qiu
(Key Laboratory of Food Science and Engineering,School of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
WithBifidobacteriumlongumas experimental strain,in polymerγ-PGA as main protective agent,freeze-drying experiment was carried out.The optimal formulation of protective agent was studied by survival rate,the ability of producing acid,the morphology of the protective agent and the cell morphology that was repeated freezing and thawing after 3 times.The results showed that using 10% dried skim milk as a protectant cell survival rate was 47.3%,with 2.5%γ-PGA as a protectant cell survival rate was 54.8%.The survival rate of compound that 1.5%γ-PGA mixed with 10% Skim Milk Power was up to 79.8%,which was about 25.0% higher than using the single dried skim milk protectant at 10%.Electron microscope results showed that,with composite protective agent bacteria surface form a dense structure.After repeat freezing and thawing 3 times,there was no serious damage on bacteria.With strains that freeze-dried bacteria powder watered 2 h for fermentation,the fermentation acidity was 65.5 °T after 18 h.The survival rate stored 90 d at room temperature could reach 48.7%.
poly-γ-glutamic acid;lyophilization;Bifidobacteriumlongum;cryoprotectants
2015-11-19
宋玉萍(1990-),女,硕士,研究方向:食品科学,E-mail:846718795@qq.com。
梁金钟(1957-),男,本科,教授,研究方向:微生物学与发酵工程,E-mail:Ljz2050@126.com。
“十二五”国家科技支撑计划项目(2012BAD32B08)。
TS201.3
A
1002-0306(2016)09-0185-05
10.13386/j.issn1002-0306.2016.09.028

