一种深海微生物脂肪酶在非水介质中催化合成乙酸肉桂酯的应用研究
王召贺,张 云,孙爱君,杨再昌,胡云峰,*
(1.贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.中国科学院南海海洋研究所,热带海洋生物资源与生态重点实验室,广东广州 510301;3.中国科学院南海海洋研究所,广东省海洋药物重点实验室,广东广州 510301)
一种深海微生物脂肪酶在非水介质中催化合成乙酸肉桂酯的应用研究
王召贺1,张云2,3,孙爱君2,3,杨再昌1,胡云峰2,3,*
(1.贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.中国科学院南海海洋研究所,热带海洋生物资源与生态重点实验室,广东广州 510301;3.中国科学院南海海洋研究所,广东省海洋药物重点实验室,广东广州 510301)
从一株深海来源微生物Streptomycessp.SCSIO 13580的基因组中克隆了1个序列新颖的脂肪酶编码基因,含有1005个碱基,编码334个氨基酸,与最相近的蛋白有51%相似。在大肠杆菌中异源表达了这个脂肪酶,发现其具有在非水介质中催化合成乙酸肉桂酯的活性。在单因素实验的基础上,考察了酰基供体、溶剂、肉桂醇/乙酸乙烯酯摩尔浓度之比、温度等因素对该酶合成乙酸肉桂酯的活性的影响,得到的最佳反应条件是:以乙酸乙烯酯为酰基供体,以正己烷为溶剂,肉桂醇/乙酸乙烯酯的摩尔浓度之比为1∶6,反应温度为40 ℃,优化后的转化率达到48.3%,酶粉的酶活力为5.59 U/g。
脂肪酶,转酯反应,乙酸肉桂酯,肉桂醇,乙酸乙烯酯
乙酸肉桂酯是我国规定可使用的香料之一,可从肉桂精油中提取,是一种重要的食用香料,可用于配制果味香精[1]。目前乙酸肉桂酯可从天然植物中提取,由化学法通过酯化或转酯反应合成[2]以及生物催化法合成[3]。但从天然植物中提取的量极少,不能满足需要;化学法的副反应复杂,反应条件剧烈,后续提取工艺繁琐,对设备要求高,环境污染大[4]。生物催化法的反应条件温和、效率高、专一性强、对环境友好,可以克服化学法的上述缺点[5]。

表1 PCR扩增体系Table 1 PCR amplification system
脂肪酶(EC 3.1.1.3)又称甘油酯水解酶,是一类特殊的酯键水解酶,能够催化酯化、酯水解、醇解、转酯等多种反应[6],在油水界面可催化脂肪分解为甘油和脂肪酸,在非水介质中则催化甘油和脂肪酸合成脂肪[7]。脂肪酶具有界面活化现象,在油水界面的催化活性会得到显著提高[8]。1984年,Zaks发现酶在有机相中也具有催化活性,改变了“酶只能在水相中进行催化”的传统观念,开启了非水相酶学的时代,酶的应用范围也得到了极大扩展[9]。
本研究用基因工程手段克隆出来自深海链霉菌Streptomycessp.13580基因组中的脂肪酶L-1基因,并实现了该酶在大肠杆菌中的异源表达。利用脂肪酶L-1的酶粉在非水介质中合成乙酸肉桂酯,并对非水介质中合成乙酸肉桂酯的反应条件进行优化。使用深海微生物来源的脂肪酶催化制备香料产品乙酸肉桂酯是绿色的生产过程,具有反应条件温和、对环境污染小、产品质量高等优势。本研究为采用深海微生物脂肪酶进一步催化制备乙酸肉桂酯等重要工业香料的应用奠定了较好的工作基础,为有效利用海洋微生物酶资源提供参考依据。
1 材料与方法
1.1材料与仪器
菌株Streptomyces sp.SCSIO 13580由中国科学院南海海洋研究所实验船从南海采集;基因组测序由上海美吉生物科技有限公司完成。
LB发酵培养基含有10% NaCl、10%胰蛋白胨、5%酵母提取粉;固体培养基除上述成分外,还有15%的琼脂,两种培养基在使用前均在高温灭菌锅中121 ℃下灭菌20 min。
胰蛋白胨、酵母提取粉广州环凯微生物科技有限公司;正己烷、乙醇、乙酸、乙酸乙酯、乙腈、NaCl广州化学试剂厂;DMSO(二甲基亚砜)天津市大茂化学试剂厂;丙酮、甲苯成都市科龙化工试剂厂;乙酸仲丁酯、肉桂醇北京百灵威科技有限公司;乙酸乙烯酯、环己烷、十二烷上海阿拉丁生化科技有限公司;PCR所用试剂上海捷瑞生物工程有限公司;镍柱、脱盐柱GE医疗集团。
Aeris型PCR仪新加坡ESCO公司;超低温冰箱SANYO公司;SCIENTZ-IID型超声破碎仪;SCIENTZ-10N型冷冻干燥机宁波新芝生物公司;GC-MS-QP2010 Ultra型GC-MS(气相色谱质谱联用仪)岛津公司;Allegra X-30R Centrifuge型低温离心机Beckman公司;Microfuge 16型微型离心机Beckman公司;MLS-3781L-PC型高压灭菌锅SANYO公司;DJS-2012R型摇床上海世平实验设备公司。
1.2实验方法
1.2.1目的基因的扩增和连接菌株的总DNA测序完成后,用生物信息学方法对其中一种脂肪酶L-1编码基因进行边界确定和引物设计,引物序列为:
F:5′-CACGGATCCATGAGGATCGATCCGCCCG-3′(下划线为BamH I酶切位点)
R:5′-CATCTCGAGTTAGGCGGGCTGTGGGGTC-3′(下划线为XhoI酶切位点)
由上海生工生物技术有限公司来合成所需引物,用合成的引物进行PCR扩增。PCR扩增体系如表1所示:
PCR扩增程序为:①95 ℃变性5 min;②95 ℃变性30 s;③65 ℃退火30 s;④72 ℃延伸2 min,②到④循环30次;⑤72 ℃延伸10 min;⑥降温至18 ℃。将PCR产物在1%琼脂糖凝胶中用120 V电压进行电泳20 min,用凝胶成像系统观察扩增情况,切胶回收1000 bp左右的片段。
用BamH I和XhoI酶切回收产物和pET-28a(+)载体,按5∶1的比例用T4连接酶催化连接20 min后,转入DH5α感受态细胞中,冰上放置30 min,42 ℃水浴热激50 s,冰上放置2 min,加入300 μL液体培养基,37 ℃ 200 r/min条件下培养1 h。4000 r/min离心1 min,弃去大部分上清液,保留100 μL左右,混合均匀,涂布于含有50 μg/mL卡那霉素的LB平板上。37 ℃培养16 h后挑取单菌落,经酶切和测序验证无误则表明连接成功[10]。
1.2.2目的蛋白的表达和酶粉的制备将1 μL连接好的重组质粒转入BL21感受态细胞中,转入方法与转入DH5α感受态细胞的方法相同。将平板上的单菌落接种到试管中,37 ℃培养,待OD600值达到0.5左右时,加入终浓度为0.2 mmol/L的IPTG(异丙基-β-D-硫代半乳糖苷)诱导其表达,25 ℃培养16 h,4 ℃ 4000 r/min离心1 min,收集菌体,加入100 μL非变性蛋白裂解液裂解细胞,用SDS-PAGE凝胶检验蛋白表达情况[11]。
验证表达成功后,将菌种接种到300 mL液体培养基中,用同样的方法培养并诱导其表达,4 ℃ 8000 r/min离心15 min,收集菌体,用20 mLPBS缓冲液(20 mmol/L,pH7.4)悬浮菌体,超声破碎15 min,4 ℃ 4000 r/min离心15 min,收集上清液,将一部分上清液冷冻于-80 ℃冰箱中,24 h后冻干制成酶粉[12]。
1.2.3目的蛋白的纯化用1.2.2的方法将菌体破碎,收集上清液,加入10 mL至镍柱中,镍柱上清液与镍柱结合后,先用20 mmol/L咪唑洗脱杂蛋白,再用5 mL 500 mmol/L咪唑洗脱目的蛋白[13],收集中间的3 mL洗脱液,用脱盐柱SephadexG25按厂家说明书的方法脱盐。用SDS-PAGE凝胶电泳检验蛋白纯化和脱盐情况。
1.2.4乙酸肉桂酯的合成反应在20 mL反应瓶中进行,将0.1 mol/L的肉桂醇和0.2 mol/L的乙酸乙烯酯溶解到5 mL正己烷中,加入30 mg脂肪酶L-1酶粉,在摇床上以200 r/min转速,37 ℃反应24 h后取出部分样品进行检测[14]。肉桂醇与乙酸乙烯酯的转酯反应的反应式如下:

图1 脂肪酶催化合成乙酸肉桂酯Fig.1 Lipase-catalyzed synthesis of cinnamyl acetate
1.2.5产物的检测反应后的液体取出1 mL左右,12000 r/min离心1 min除去酶粉,加入0.1 mmol/L的十二烷作为内标物,混合均匀后,加入无水硫酸钠除去水分,取出600 μL用于GC-MS检测[15]。色谱柱RXI-5MS,进样口温度220 ℃,进样方式:分流,柱流量:1.20 mL/min,离子源温度200 ℃,接口温度280 ℃。柱箱温度50 ℃,恒温保持1 min,以12 ℃/min的速率上升到150 ℃,再以20 ℃/min的速率上升到300 ℃,恒温保持1 min。底物肉桂醇和产物乙酸肉桂酯的出峰时间分别为8.250 min、9.600 min。
1.2.6转化率的测定采用十二烷为内标物进行定量计算。反应完成后,加入0.1 mol/L的十二烷,转化率(%)=肉桂醇的消耗量/肉桂醇的起始物质的量×100[16]。定义每分钟转化1 μmol的底物所需要的酶量为1个酶活单位。
1.2.7酰基供体的选择分别用乙酸、乙酸乙酯、乙酸乙烯酯、乙酸仲丁酯作为酰基供体进行反应,其他条件与1.2.4相同。24 h后,用1.2.5的方法检测反应产物,用肉桂醇转化率最高的酰基供体进行后续实验。
1.2.8溶剂的选择分别以正己烷、正庚烷、环己烷、甲苯、丙酮、DMSO、乙酸乙烯酯为溶剂,用1.2.7中选择的酰基供体进行反应,其他条件与1.2.7相同。24 h后,用1.2.5的方法检测反应产物,用肉桂醇转化率最高的有机溶剂进行后续实验。
1.2.9底物浓度比例对转化率的影响用1.2.8中选择的有机溶剂为溶剂,分别以肉桂醇与酰基供体摩尔浓度比为1∶1、1∶2、1∶4、1∶6、1∶8、1∶10、1∶12的比例溶解于溶剂中,其他条件与1.2.8相同。24 h后,用1.2.5的方法检测反应产物,考察底物浓度比例对肉桂醇转化率的影响,选择适当的比例。
1.2.10温度对转化率的影响用1.2.9中选择的底物浓度比例,分别在25、30、35、40、45、50、55 ℃环境下反应,其他条件与1.2.9相同。24 h后,用1.2.5的方法检测反应产物,以肉桂醇转化率最高的温度为最优温度。
2 结果与讨论
2.1目的蛋白的表达和纯化
脂肪酶来源广泛,在微生物中就有65个属可用于脂肪酶的生产。但对于特定催化反应而言,可用的脂肪酶就很有限,新型脂肪酶的挖掘就成为许多学者研究的热点[17]。海洋面积辽阔,具有高压、高盐、低温等多种生态环境,蕴藏着丰富的微生物资源,海洋微生物也成为结构、功能新颖的脂肪酶的重要来源[18]。将脂肪酶L-1的氨基酸序列在NCBI的GenBank数据库中进行对比,发现其与数据库中的蛋白质的最大相似度为51%,序列较为新颖。生物信息学方法预测,脂肪酶L-1编码基因由1005个碱基组成,对应着蛋白序列含有334个氨基酸残基,理论分子量为35.24 ku,pI为5.07。SDS-PAGE凝胶检测结果如图2。镍柱纯化、脱盐柱脱盐得到的单一条带与重组蛋白大小一致,条带清晰,表明脂肪酶L-1具有可溶性,带有的组氨酸标记能够与镍柱特异性结合,可以用亲和层析的方法得到纯酶[19]。

图2 脂肪酶L-1纯化、 脱盐的SDS-PAGE凝胶Fig 2 SDS-PAGE gel of purification and desalination of lipase L-1注:1-蛋白分子量标记;2-IPTG诱导前的总蛋白对照; 3-IPTG诱导后的总蛋白对照;4-IPTG诱导后的细胞上清液; 5-镍柱穿透液;6-镍柱纯化蛋白;7-脱盐蛋白。
2.2脂肪酶L-1催化合成乙酸肉桂酯
图3为反应产物的GC-MS检测的气相色谱图,其初步转化率为23.7%。为获得更高的转化率,需对该反应的条件进行优化,提高乙酸肉桂酯的产率。姚侠等[20]用Novozyme435催化合成乙酸肉桂酯,转化率达到90%以上;Yadav等[3]用同样的酶催化,也得到了较高的转化率;刘昱杉等[4]用固定化的荧光假单胞菌脂肪酶催化转酯反应,也得到了较高的产率。目前的用生物催化的方法制备乙酸肉桂酯具有较好的可行性。
2.3酰基供体的选择
不同的酰基供体与肉桂醇反应的速率不同,因此酰基供体的选择对产物乙酸肉桂酯的合成效率有重要影响。耿博[5]以脂肪酶为催化剂,乙酸、乙酸乙酯为酰基供体,刘昱杉等[4]以固定化的脂肪酶为催化剂,乙酸乙烯酯为酰基供体,均得到较高的产率。Wang等[21]用化学法以乙酸仲丁酯为酰基供体,与甲醇通过转酯反应制备仲丁醇。因此,选择不同的酰基供体是酶法和化学法通过转酯反应制备酯类化工产品的重要因素。本研究中,用乙酸、乙酸乙酯、乙酸乙烯酯、乙酸仲丁酯作为酰基供体分别和肉桂醇反应,肉桂醇浓度为0.1 mol/L,酰基供体浓度为0.2 mol/L,以正己烷为溶剂,反应24 h后,用GC-MS检测反应产物,选用转化率最高的作为酰基供体。结果如图4所示,用乙酸乙烯酯作为酰基供体时,肉桂醇的转化率为23.9%,明显高于其他酰基供体。乙酸仲丁酯可能是由于烷氧基的空间效应而不被催化。姚侠等[20]用脂肪酶催化合成乙酸肉桂酯时同样发现,以乙酸乙烯酯作为酰基供体时,肉桂醇的转化率最高,并且推测这可能是由于乙酸乙烯酯的产物乙醛是气体,能够及时分离出反应体系,促使反应向正反应方向进行。

表2 有机溶剂及其LogP值Table 2 Organic solvents and their LogPs
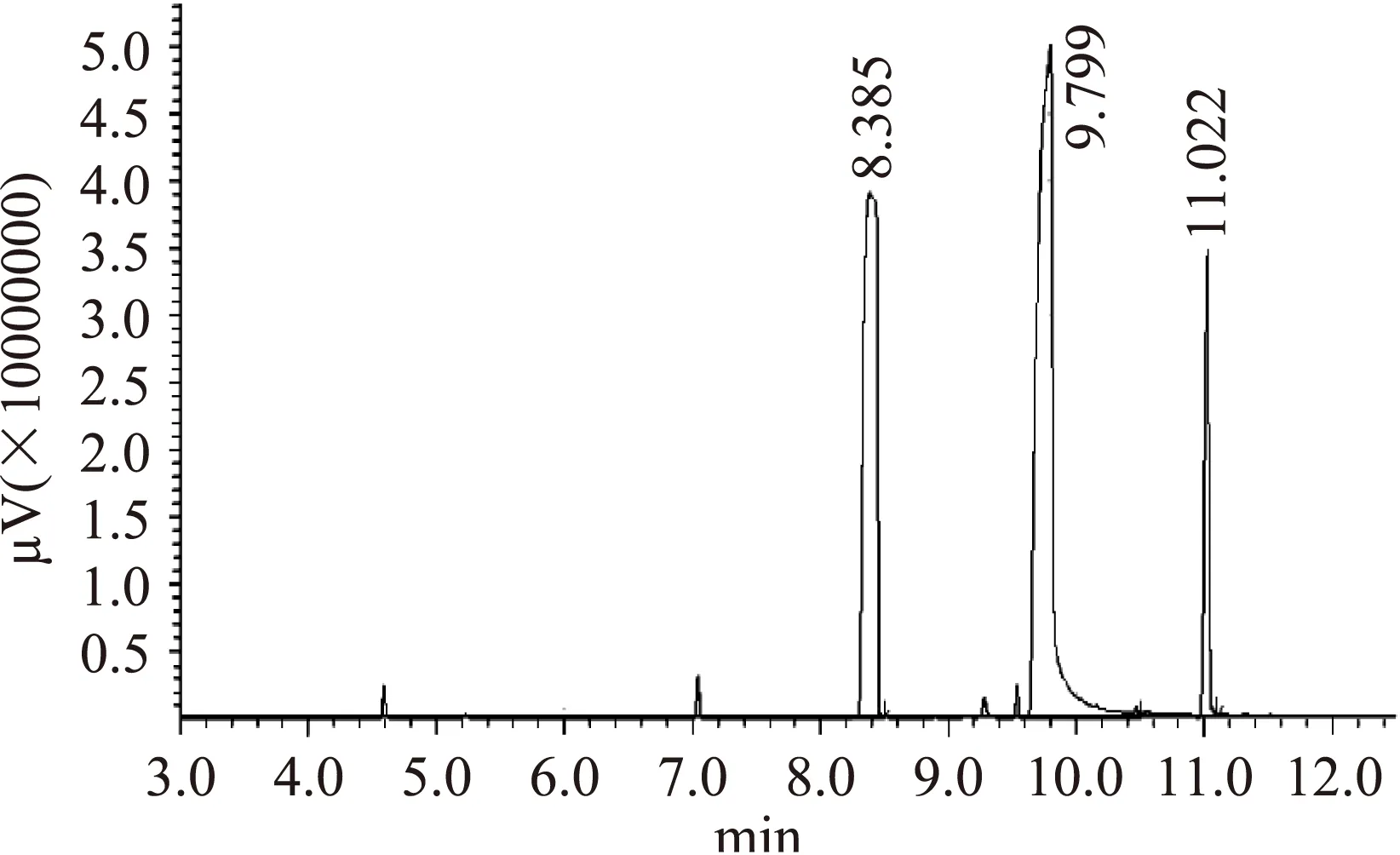
图3 转酯反应产物的气相色谱图Fig.3 Gas chromatogram of trans-esterification reaction product 注:十二烷,保留时间:8.385 min;肉桂醇,保留时间: 9.799 min;乙酸肉桂酯,保留时间:11.022 min。

图4 不同酰基供体对转化率的影响Fig.4 Effects of aclyl donors on the synthesis of cinnamyl acetate
2.4溶剂的选择
作为酶促反应的介质,有机溶剂对酶的催化活性和稳定性有重要影响。在有机相中,酶的催化活性与溶剂的疏水性(LogP)有很大关系,亲水性溶剂易于夺取酶分子表面的水分子,影响酶的活性,而疏水性强的溶剂则相反,对酶活性的影响要小[22]。以乙酸乙烯酯为酰基供体,分别以正己烷、正庚烷、环己烷、甲苯、丙酮、DMSO、乙酸乙烯酯为溶剂进行比较,它们的疏水性如表2所示,LogP值越高,疏水性越高。从表中可以看出,正己烷、正庚烷等烃类的疏水性要高于丙酮、DMSO和乙酸乙烯酯。每种有机溶剂中的转化率如图5所示,以正己烷为溶剂时,肉桂醇转化率达到31.1%,高于其他溶剂。从结果上看,疏水性较高的几个溶剂的转化率均比疏水性较低的丙酮和DMSO要高;推测乙酸乙烯酯对该脂肪酶有底物抑制效应,所以用乙酸乙烯酯作为溶剂时的转化率偏低[23]。
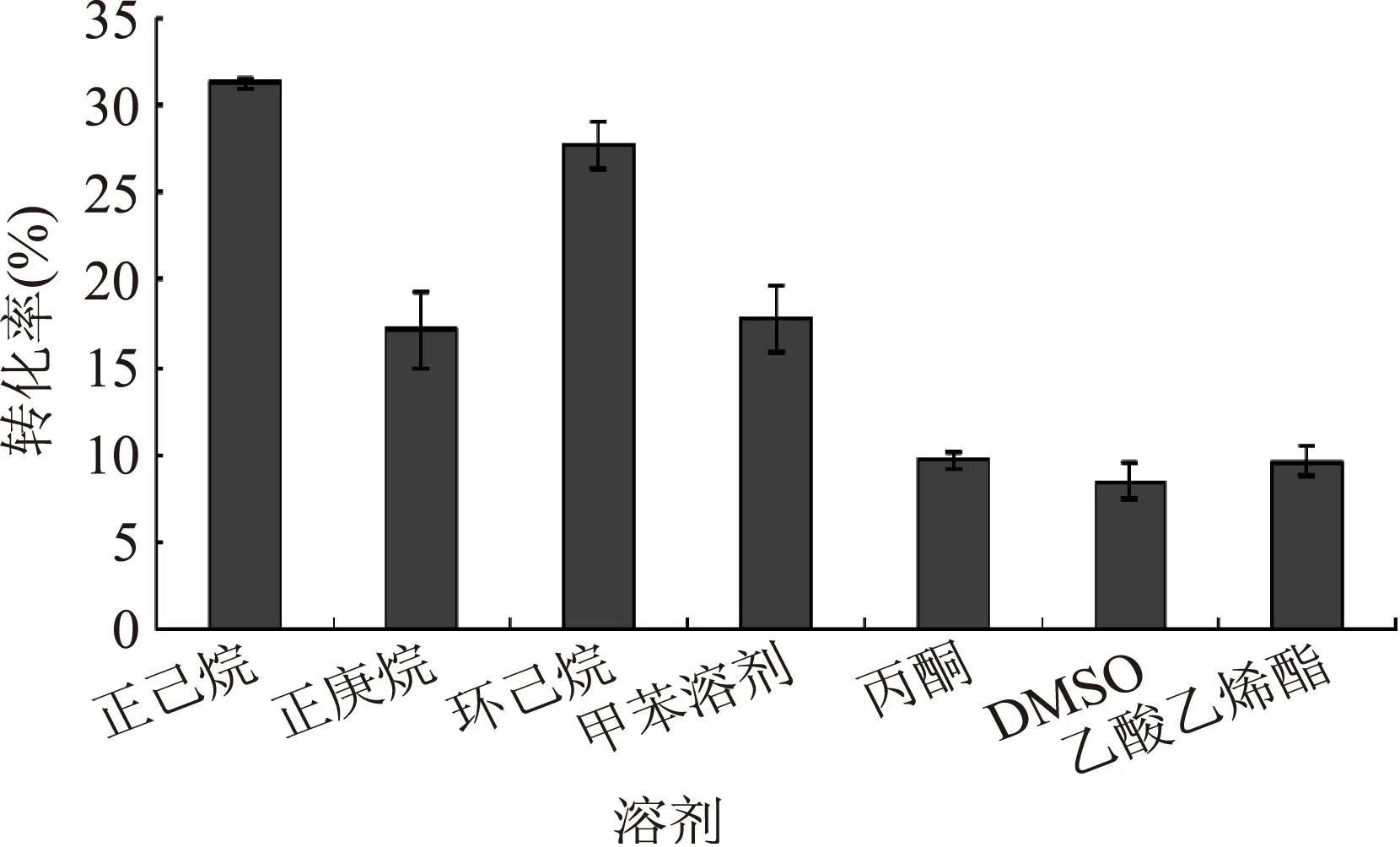
图5 溶剂对转化率的影响Fig.5 Effects of solvent on the synthesis of cinnamyl acetate
2.5底物浓度比例对转化率的影响
底物的浓度比例会影响反应进行的速率和方向,高浓度的乙酸乙烯酯将提高底物与底物之间、底物与酶之间的接触面积,增加分子碰撞的几率;但另一方面,肉桂醇浓度减少使反应体系的粘度增加,酶的活性中心被覆盖,阻碍反应的进行,同时会增加后续提取产物的难度[24],因此有必要通过比较来确定最佳底物摩尔浓度比例。用不同底物浓度比例反应的结果如图6所示,随着比例的增加,转化率提高,当肉桂醇与乙酸乙烯酯的摩尔浓度比为1∶6时,肉桂醇的转化率达到26.4%,提高乙酸乙烯酯的浓度,肉桂醇转化率增长较小,为了便于后期分离纯化,避免不必要的浪费,选用1∶6的比例进行后面的实验。

图6 肉桂醇/乙酸乙烯酯摩尔浓度比对转化率的影响Fig.6 Effects of cinnamyl alcohol/vinyl acetate ratio on the synthesis of cinnamyl acetate
2.6温度对转化率的影响
温度是影响反应速率和反应方向的重要因素,适当提高反应温度能够提高分子的热运动,增加底物之间相互反应的机会,降低体系的粘度,提高反应速率,进而提高底物转化率;但过高的温度会破坏酶的三级结构,降低酶活性,甚至使酶完全失活,又会降低反应速率和底物转化率[25],所以反应温度的选择就显得十分必要。用不同温度进行反应的结果如图7所示,40 ℃时,肉桂醇转化率达到48.3%,高于其他温度,高于40 ℃时,转化率降低,但趋于稳定。

图7 温度对转化率的影响Fig.7 Effects of temperature on the synthesis of cinnamyl acetate
3 结论
深海微生物是新颖优异脂肪酶的重要来源,对海洋微生物资源的利用已引起了越来越多的重视。本研究从深海微生物的基因组出发,用基因工程手段,克隆并异源表达了一个新颖的脂肪酶基因L-1,用酶粉在有机相中催化转酯合成乙酸肉桂酯。使用单因素实验方法对脂肪酶L-1催化合成乙酸肉桂酯的反应条件进行优化。从GC-MS检测的结果来看,使用脂肪酶L-1催化制备乙酸肉桂酯香料的最优反应条件为:以正己烷为溶剂,乙酸乙烯酯为酰基供体,肉桂醇与乙酸乙烯酯的摩尔浓度比为1∶6,反应温度为40 ℃,肉桂醇的转化率达到48.3%。脂肪酶L-1序列新颖,有很大的潜力可对其通过定向进化等手段进行改造,或通过对其发酵条件、反应条件的进一步优化来提高其转化率,使其更适应工业要求。采用深海微生物来源的脂肪酶催化制备乙酸肉桂酯产品是绿色环保的生产工艺,反应条件温和,制备的乙酸肉桂酯产品质量较高,所采用的深海微生物脂肪酶催化高效制造乙酸肉桂酯等香料产品,有希望替代现有的化学合成工艺,具有较好的工业应用前景,希望能够为更好地利用海洋微生物酶资源提供一种方法和思路。
[1]陈海燕,何春茂.肉桂油的深加工产品及其应用[J].广西林业科学,2009,38(3):179-182.
[2]Tomke P,Rathod V.Ultrasound assisted lipase catalyzed synthesis of cinnamyl acetate via transesterification reaction in a solvent free medium[J].Ultrasonics Sonochemistry,2015(27):241-246.
[3]Yadav G D,Devendran S.Lipase catalyzed synthesis of cinnamyl acetate via transesterification in non-aqueous medium[J].Process Biochemistry,2012,47(3):496-502.
[4]刘昱杉,胡兴超,丛方地,等.荧光假单胞菌脂肪酶(PFL)的固定化及催化合成乙酸肉桂酯[J].中国食品添加剂,2015(6):140-144.
[5]耿博.脂肪酶催化合成乙酸肉桂酯的应用研究[D].天津:天津大学,2012:1-64.
[6]Kretza E,Papaneophytou C,Papi R,et al.Lipase Activity in Thermus thermophilus HB8:Purification and Characterization of the Extracellular Enzyme[J].Biotechnology and Bioprocess Engineering,2012(17):512-525.
[7]Kim S,Song J,Kin H.Cell surface display of Staphylococcus haemolyticus L62 lipase in Escherichia coli and its application as a whole cell biocatalyst for biodiesel production[J].Journal of Molecular Catalysis B:Enzymatic,2013(97):54-61.
[8]何文龙. 脂肪酶工程菌优化表达[D].长春:吉林大学,2010:1-50.
[9]Zaks A,Klibanov A M.Enzyme catalyzed processes in organic media at 100 ℃[J].Abstracts of Papers of the American Chemical Society,1984(188):1249-1251.
[10]Mirkalantari S,Amirmozafari N,Kazemi B,et al.Molecular cloning of virB12 gene of Brucella melitensis 16M strain in pET28a vector[J].Asian Pacific Journal of Tropical Medicine,2012,5(7):511-513.
[11]季爱加,宁喜斌.原核表达载体pET28a-EGFP的构建与表达[J].微生物学杂志,2011,31(04):69-73.
[12]Castillo B,Delgado Y,Barletta G,et al.Enantioselective transesterification catalysis by nanosized serine protease subtilisin Carlsberg particles in tetrahydrofuran[J].Tetrahedron,2010,66:2175-2180.
[13]刘羽,王能飞,黄亦钧,等.低温脂肪酶基因在毕赤酵母中的表达研究[J].海洋科学进展,2012,01:155-162.
[14]刘雄民,郭辰,沈芳,等.脂肪酶干燥方法对环十五内酯合成的影响[J].广西大学学报:自然科学版,2007,02:130-133.
[15]蔡君,谭群,晏家瑛,等.不同提取工艺下蜂胶醇提物的GC-MS分析[J].现代食品科技,2010,26(5):544-550.
[16]Wu Z J,Qi W,Wang M F,et al.Lipase immobilized on novel ceramic supporter with Ni activation for efficient cinnamyl acetate synthesis[J].Journal of Molecular Catalysis.B,Enzymatic,2014,110:32-38.
[17]刘虹蕾,缪铭,江波,等.微生物脂肪酶的研究与应用[J].食品工业科技,2012,12:376-381.
[18]史翠娟,闫培生,赵瑞希,等.海洋微生物酶研究进展[J].生物技术进展,2015,5(3):185-190.
[19]黄振蓉,吴海丽,张三军,等.E.coliRecQ解旋酶克隆表达纯化及生物学活性检测[J].中国生物工程杂志,2013,03:21-27.
[20]姚侠,郑建永,应向贤,等.有机相脂肪酶催化合成乙酸肉桂酯[J].生物加工过程,2012,10(3):12-16.
[21]Wang H X,Wu C M,Bu X W,et al.A benign preparation of sec-butanol via transesterification from sec-butyl acetate using the acidic Imidazolium ionic liquids as catalysts[J].Chemical Engineering Journal,2014,246:366-372.
[22]肖素静,曹艳,孙磊,等.耐有机溶剂脂肪酶产生菌的筛选及其酶学性质[J].食品与生物技术学报,2009,06:816-821.
[23]李超.非水相中酶催化酯化反应动力学的研究[D].保定:河北大学,2014:1-34.
[24]Gharat N,Rathod V K.Ultrasound assisted enzyme catalyzed transesterification of waste cooking oil with dimethyl carbonate[J].Ultrasonics-Sonochemistry,2012,20:900-905.
[25]Romero M D,Calvo L,Alba C,et al.Enzymatic synthesis of isoamyl acetate with immobilized Candida antarctica lipase in n-hexane[J].Enzyme and Microbial Technology,2005,371:42-48.
Synthesis of cinnamyl acetate by lipase-catalyzed trans-esterification
WANG Zhao-he1,ZHANG Yun2,3,SUN Ai-jun2,3,YANG Zai-chang1,HU Yun-feng2,3,*
(1.Key Laboratory of Fermentation Engineering and Biopharmacy of Guizhou Province,School of Fermentation and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of tropical marine bio-resources and ecology,South China Sea Institute of Oceanology,Chinese Academy of Sciences,Guangzhou 510301,China;3.Guangdong Key Laboratory of Marine Materia Medica,South China Sea Institute of Oceanology,Guangzhou 510301,China)
One novel gene encoding a lipase L-1 was cloned from the genome ofStreptomycessp.SCSIO 13580 identified from the deep sea of the South China Sea.L-1 contains 1005 bp and encodes a putative lipase that harbors 334 amino acids and exhibits the highest similarity of 51% with other lipases.The lipase was heterologously expressed inE.coli. The lipase could catalyze the trans-esterification reaction of vinyl acetate and cinnamyl alcohol in non-aqueous medium.The effects including cinnamyl alcohol/vinyl acetate ratio(mol/mol),temperature,solvents and aclyl donors,on the catalytic activities were further investigated.The optimum enzymatic working conditions were obtained as follows:vinyl acetate as the acyl donor,n-hexane as the solvent,ratio of cinnamyl alcohol/vinyl acetate 1∶6,reaction temperature of 40 ℃,the maximum conversion rate could reach 48.3%,the activity of enzyme powder was 5.59 U/g.
lipase;trans-esterification reaction;cinnamyl acetate;cinnamyl alcohol;vinyl acetate
2015-10-16
王召贺(1992-),男,硕士研究生,研究方向:发酵工程,E-mail:wzhaohe@foxmail.com。
胡云峰(1980-),男,博士,从事生物酶催化方面的研究,E-mail:yunfeng.hu@hotmail.com。
国家自然科学基金青年科学基金项目(21302199),中国科学院战略性先导科技专项(XDA11030404),中国科学院重点部署项目(KGZD-EW-606),广州市科技计划项目(201510010012)。
TS264.3
B
1002-0306(2016)09-0202-06
10.13386/j.issn1002-0306.2016.09.031

