丙酸杆菌素的发酵及其分离纯化的初步探究
邢胜杰,贾彩凤,杨雪霞,何新舟,刘晓霞,高红亮,*,常忠义,金明飞
(1.华东师范大学生命科学学院,上海 200241;2.东华大学 化学化工与生物工程学院,上海 201620)
丙酸杆菌素的发酵及其分离纯化的初步探究
邢胜杰1,贾彩凤1,杨雪霞2,何新舟1,刘晓霞1,高红亮1,*,常忠义1,金明飞1
(1.华东师范大学生命科学学院,上海 200241;2.东华大学 化学化工与生物工程学院,上海 201620)
本文以薛氏丙酸杆菌(Propionibacterium shermanii)发酵液为原料,以抑菌活性为指标,利用分离纯化技术提取发酵液中小分子丙酸杆菌素。丙酸杆菌素初步分离纯化确定的最佳脱盐条件为:上样量5 mL,流速0.5 mL/min,收集方式为手动收集,电导率达到1.5 ms/cm时停止收集;Superdex peptide最佳凝胶过滤条件为:上样量500 μL,流速0.5 mL/min,深孔板固定体积收集,每孔收集体积200 μL。最终得到一种分子量为698.9556 u的丙酸杆菌素,其单位抑菌活性为初始的6.8倍,抑菌活性得率为10.9%。酶解实验表明纯化后的丙酸杆菌素仍保留抑菌活性,且对胃蛋白酶敏感。
丙酸杆菌素,分离纯化,薛氏丙酸杆菌
细菌素是一类重要的食品生物防腐剂[1-3],目前人们研究比较清楚的是乳酸链球菌素(Nisin)[4],它对引起食品腐败变质的革兰氏阳性菌具有良好的抑制作用,但不能抑制革兰氏阴性菌和霉菌等的生长[5]。研究发现丙酸杆菌素不但能够抑制部分革兰氏阳性菌,而且对绝大多数革兰氏阴性菌和霉菌具有良好的抑制和杀灭作用。
目前国内外报道过的丙酸杆菌素主要有5种[6],即丙酸杆菌素PLG-1、丙酸杆菌素T1、丙酸杆菌素JenseniiG、丙酸杆菌素SM1和丙酸杆菌素MicrogardTM。其中Microgard最初由法国罗地亚公司研发生产,它是由薛氏丙酸杆菌发酵制备得到的一种丙酸杆菌素,虽然它的主要抑菌成分进入人体后能被胃蛋白酶消化分解,但它是一种混合物,里面还含有丙酸、乙酸及无机盐等小分子物质[7]。目前国内对于丙酸杆菌素的研究主要集中在丙酸杆菌素发酵培养基的优化方面[3,7-9]。最新的研究成果潘淼等人[10]也只是研究了玉米浆和大豆蛋白胨作为替代氮源对薛氏丙酸杆菌产生丙酸杆菌素的影响,对于薛氏丙酸杆菌素的分离纯化还未见报道,因此本文在发酵罐制备丙酸杆菌素粗提物的基础上通过初步分离纯化技术制备出一种小分子丙酸杆菌素,并对它的相对分子量和胃蛋白酶敏感性做了初步的分析。既为薛氏丙酸杆菌代谢物的工业化生产提供了参考,又建立了一种小分子细菌素的分离纯化方法。
1 材料与方法
1.1材料与设备
1.1.1菌种薛氏丙酸杆菌(Propionibacterium shermanii)为发酵菌株由华东师范大学生命科学院微生物实验室分离并保存;
恶臭假单胞菌(Pseudomonas putiu)为抑菌活性测定中指示菌株由上海疾病控制中心提供。
1.1.2培养基恶臭假单胞菌培养基,LB培养基;丙酸杆菌种子培养基,SLB培养基[3]:胰蛋白胨10 g,酵母粉10 g,60%乳酸钠16.7 mL,KH2PO40.25 g,MnSO40.005 g,蒸馏水溶解定容至1 L,pH7.0;发酵培养基为葡萄糖培养基,用1.5%葡萄糖取代SLB中的乳酸钠,其它成分不变。
1.1.3仪器BIOF-6000B型10L国产发酵罐上海高机生物工程公司;Sorvall RC-6 plus 冷冻离心机Thermo公司;GLZY-05B冷冻干燥机上海浦东冷冻干燥设备有限公司;RE52-3旋转蒸发仪上海亚荣生化仪器厂;CD400电导率测定仪安莱利思仪器科技有限公司;SynergYHT酶标检测仪基因有限公司;VERsaflux超滤仪上海通用电气有限公司UFP-3-C-3MA超滤柱上海通用电气有限公司;Sephadex G-10 XK16/40脱盐柱,Superdex peptide 10/300GL凝胶过滤柱上海通用电气有限公司;AKTA avant蛋白质纯化仪上海通用电气有限公司;4800Plus MALDI TOF/TOF质谱系统美国AB SCIEX公司;JY-356602型游标卡尺宁波建业工具有限公司;胃蛋白酶(3000 U/mg)上海鼎国生物技术有限公司。
1.2实验方法
1.2.1薛氏丙酸杆菌素发酵条件的研究将丙酸杆菌种子接入SLB培养基中,30 ℃静置培养,活化48 h后作为种子液接入发酵罐中,接种量5%。10 L发酵罐装液量为7 L,115 ℃灭菌30分钟,发酵期间通入CO2使罐压保持0.05 MPa,转速为100 r/min,培养温度30 ℃,连续发酵168 h,每隔24 h取样测量菌体干重、发酵液pH、还原糖含量和氨基氮含量以及发酵上清液抑菌活性。
1.2.2菌体干重(DCW)测定方法采用陈玉梅等人[8]研究中菌体干重测定方法
1.2.3还原糖和氨基氮含量的测定方法采用3,5-二硝基水杨酸法[11]测定不同发酵时间发酵液中还原糖的残留量。采用Ueschel等人[12]利用NH4Cl绘制标准曲线的方法测定发酵液中氨基氮含量。
1.2.4指示菌恶臭假单胞菌的制备方法恶臭假单胞菌接种量为0.5%,30 ℃,摇床转速180 r/min过夜震荡培养至菌液的OD600 nm为0.2,并用无菌LB溶液稀释100倍备用。
1.2.5抑菌活性测定方法采用改良过的梯度稀释法[3,7]测定代谢物的抑菌活性,将抑菌物质用无菌的LB溶液进行2N梯度稀释,然后将不同稀释倍数的抑菌物质分别加入96孔酶标板中,每孔总体积为200 μL,其中20 μL为不同稀释倍数的抑菌物质,180 μL为上述方法中备用的指示菌稀释液。用20 μL空白LB液体培养基和180μL指示菌菌液作为对照,将酶标板置于30 ℃条件下恒温培养,每隔一定时间取出用酶标液测定各加样孔在600 nm处吸光值。当OD600 nm吸光值为对照组吸光值的一半时的稀释度定义为一个抑菌活性单位,单位为AU/mL。
1.2.6丙酸杆菌素粗提物的制备把500 mL离心后的丙酸杆菌发酵上清液采用旋转蒸发仪浓缩2.5~10倍,浓缩温度为75 ℃。浓缩后的发酵液用型号为UFP-3-C-3MA,截留量为3000 u的超滤膜进行超滤,料液流速0.3 L/min,最大压力差为0.35 MPa,去除较大分子量的蛋白质和杂多肽,得到粗丙酸杆菌素溶液,用于接下来分析研究。
1.2.7丙酸杆菌素的纯化方法
1.2.7.1Sephadex G-10脱盐采用Sephadex G-10脱盐柱,检测波长为280 nm。首先用2 mL/min的流速pH5.3,10 mmol/L的HAC-NaAc缓冲液对脱盐柱平衡两个柱体积后上样,上样期间流速为0.5 mL/min并用相同的缓冲液洗脱,流速为2 mL/min;为保证收集样品的纯度,收集方法为深孔板固定体积收集,每个深孔板中收集体积为1 mL,电导率超过1.5 ms/cm时停止收集样品(即每次脱盐收集样品体积为4 mL),相同缓冲液洗脱至基线平稳后进行新一轮脱盐操作。
1.2.7.2superdex peptide凝胶过滤采用型号为superdex peptide10/300GL凝胶过滤柱,检测波长为280 nm,首先用1 mL/min的流速,pH5.3,10 mmol/L的HAC-NaAc缓冲液对柱子平衡3个柱体积后上样,上样流速为0.5 mL/min,洗脱流速为1.2 mL/min。AKTA avant产生的原始数据及图谱由Unicorn 6.3软件导出。
1.2.8样品冷冻干燥方法将1.2.7纯化后的丙酸杆菌素平铺在塑料托盘上,厚度为4 mm,-20 ℃预冻过夜,一次升华18 h,二次升华9 h,得到的干粉即为丙酸杆菌素的纯化产品,置于-80 ℃超低温冰箱中保存备用。
1.2.9MALDI-TOF法测定丙酸杆菌素的相对分子质量将1.2.8冷冻干燥后的丙酸杆菌素干粉送至上海中科新生命研究所,经 ZipTip C4脱盐处理后,在正离子模式下选择反射方法测试样品分子量。质谱数据及图谱处理:4800 plus MALDI-TOF/TOF产生的原始数据及图谱由4000 Series Explorer V3.5软件导出。
1.2.10丙酸杆菌素酶解实验方法[7]将1.2.8纯化后的丙酸杆菌素配成1%的水溶液,pH调节至2.0,加入胃蛋白使其浓度为1 mg/mL,胃蛋白酶酶活为3000 U/mg;37 ℃恒温水浴3 h后将胃蛋白酶灭活,冷却至室温后将其pH回调至初始值;然后将经不同处理的丙酸杆菌素和空白培养基加入LB平板上直径为6 mm的小孔中,LB平板上铺有指示菌恶臭假单胞菌菌液。30 ℃培养12 h后用游标卡尺测量抑菌圈的直径。
2 结果与分析
2.1薛氏丙酸杆菌发酵条件的研究
2.1.1丙酸杆菌发酵过程中各项生化指标变化曲线发酵结果如图1和图2所示。从图1可以看出96 h抑菌活性达到最大,为17.69 Au/mL,菌体干重在96 h也达最大值,为3.1 g/L。96 h以后抑菌活性不再增加,故以后的发酵选取96 h下罐比较合适。
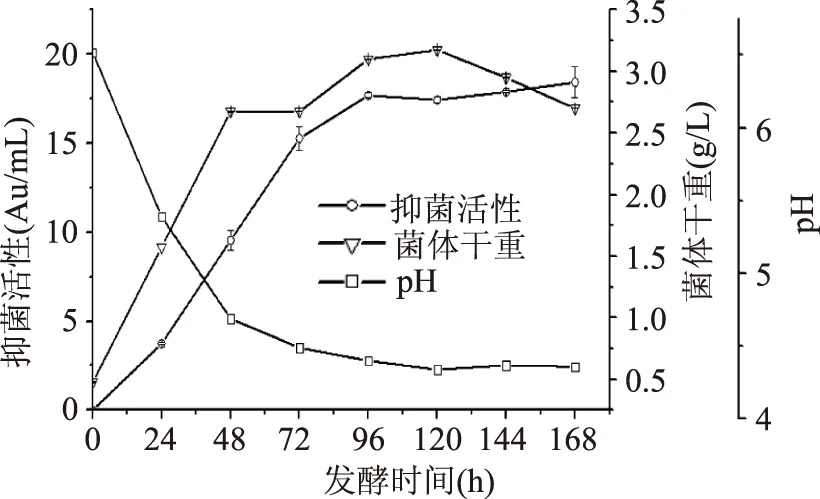
图1 抑菌活性、菌体干重和pH随发酵时间变化曲线Fig.1 antimicrobial activity、DCW and pH change curve with fermentation time
由图2可知,还原糖含量在96 h降到最低值1.22 g/L,氨基氮也降至最低0.175 g/L;这与图1中菌体干重和抑菌活性曲线相一致。表明菌体对碳源、氮源的利用和生物量的增加、抑菌活性的增加相吻合。此后氨基氮又有所增加,可能由于菌体死亡后裂解菌体内部氨态氮释放至培养基中所致。
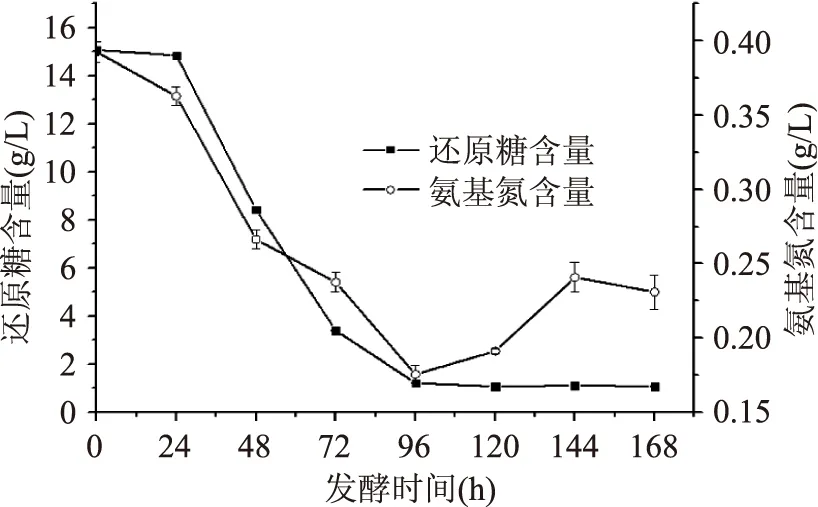
图2 发酵液还原糖和氨基氮变化曲线Fig.2 The curves of reducing sugar and amino nitrogen in the supernate
2.2丙酸杆菌素的分离提取
2.2.1旋转蒸发浓缩倍数对丙酸杆菌素粗提物抑菌活性的影响贾彩凤等人[7]研究结果显示,丙酸杆菌代谢物热稳定性很好,故采用旋转蒸发浓缩发酵上清液。该步操作既提高了发酵液丙酸杆菌素的单位含量,又减少了后续纯化的工作量。由表1可知,当浓缩倍数大于5倍时抑菌活性得率较低,可能由于浓缩倍数较高时浓缩时间延长,部分抑菌物质活性损失所致。故本研究中5倍为最佳浓缩倍数。

表1 旋转蒸发浓缩倍数对丙酸杆菌粗提物抑菌活性的影响
2.3丙酸杆菌素的纯化
2.3.1Sephadex G-10脱盐将经1.2.6步骤制备的丙酸杆菌素粗提物用Sephadex G-10脱盐柱处理,280 nm吸收值和电导率如图3所示,由图可知:280 nm处吸收峰和电导峰完全分开。说明选用1.2.7中Sephadex G-10脱盐方法时该丙酸杆菌素有较好的脱盐效果。
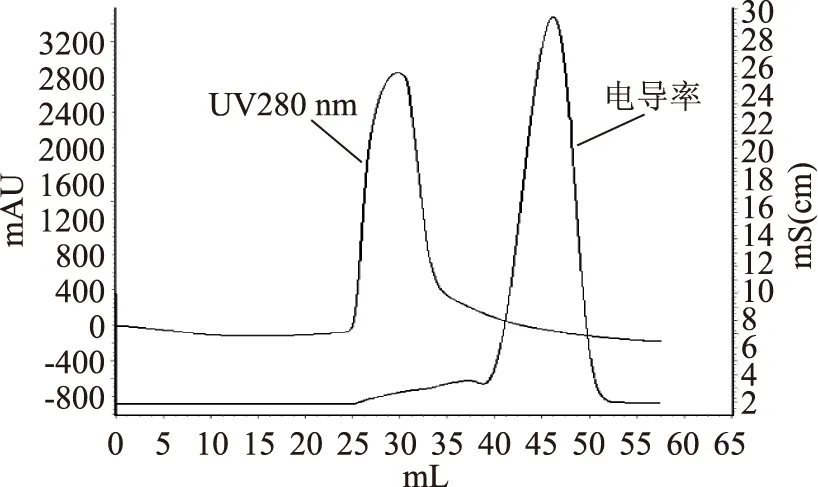
图3 Sephadex G-10脱盐柱层析图Fig.3 Desalination column chromatographyby Sephadex G-10
2.3.2Superdex peptide 10/300GL凝胶过滤由于Sephadex G-10脱盐后样品单位抑菌活性有较大稀释,同时鉴superdex peptide凝胶过滤上样量较小,不利于后续纯化的进行,故对脱盐后样品冷冻干燥。接着用4 mL缓冲液复溶,0.45 μm过滤后上样。脱盐后活性得率较低,仅为17.1%,然后用superdex peptide凝胶过滤,280 nm处的吸收峰如图3所示,样品抑菌活性测定结果显示,体积为42~43.2 mL之间吸收峰有抑菌活性,其它吸收峰处均无抑菌活性,故该处为丙酸杆菌素吸收峰(见图4)。说明选用1.2.7凝胶过滤条件时丙酸杆菌素和杂质有较好的分离效果。
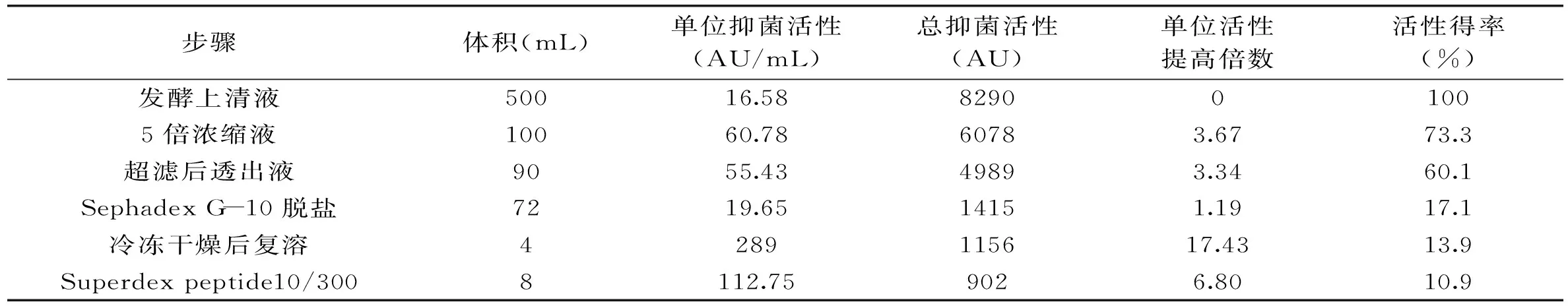
表2 丙酸杆菌素分离与纯化各步数据

图4 Superdex peptide 10/300凝胶过滤图谱Fig.4 Gel filtration chromatographyby superdex peptide 10/300GL
本实验经旋转蒸发浓缩、超滤除杂、Sephadex G-10脱盐、冷冻干燥和superdex peptide凝胶过滤初步分离纯化丙酸杆菌素的各步抑菌活性数据见表2。
由表2可知,发酵上清液经旋转蒸发、超滤、Sephadex G-10脱盐、冷冻干燥和Superdex peptide凝胶过滤后,与发酵上清液相比单位抑菌活性提高了6.8倍,活性得率为10.9%。
2.3.3MALDI-TOF/TOF法测定丙酸杆菌素相对分子质量Ayres,J.W.等人的研究结果[13]指出,薛氏丙酸杆菌素的相对分子质量介于300~1200 u之间,本文采用4800 plus MALDI-TOF/TOF测定经上述步骤纯化后丙酸杆菌素的相对分子质量,结果如图5所示,最高峰呈现出质荷比(m/z,z=1)为698.9556的信号,信号强度为95%左右;故纯化得到丙酸杆菌素的相对分子质量为698.9556 u。由该图还可以看出,经过上述步骤制备的丙酸杆菌素还含有极少量杂质,信号强度为10%左右。

图5 分离纯化后丙酸杆菌素MALDI-TOF图谱Fig.5 Propionibacterium bacteriocinMALDI-TOF map after purification
2.3.4纯化后丙酸杆菌素对胃蛋白酶敏感性实验贾彩凤和陈玉梅[7-8]等人的研究表明,丙酸杆菌发酵粗提物对胃蛋白酶比较敏感[13]。本文用胃蛋白酶处理纯化后丙酸杆菌素,结果如图6所示,纯化后的丙酸杆菌素未经胃蛋白酶处理时抑菌圈直径最大(图6中C所示),为23.6 mm;胃蛋白酶处理后丙酸杆菌素抑菌圈明显减少,为10.2 mm(图6中B所示)。表明本研究纯化得到的丙酸杆菌素仍具有抑菌活性,且对胃蛋白酶非常敏感。

图6 分离纯化后丙酸杆菌素的胃蛋白酶敏感性实验Fig.6 Pepsin sensitivity experimentsto propionibacteria bacteriocin after purificationA:空白发酵培养基+胃蛋白酶酶解;B:纯化后丙酸杆菌素+胃蛋白酶酶解;C:纯化后丙酸杆菌素+不添加胃蛋白酶水浴。
3 结论与讨论
目前国内对丙酸杆菌发酵的研究主要集中在摇瓶发酵方面,本文采用10 L发酵罐进行放大培养,96 h抑菌活性达到最大值17.69 Au/mL,为丙酸杆菌的工业化提供了参考。
本研究采用旋转蒸发浓缩、超滤除杂、Sephadex G-10脱盐、冷冻干燥和Superdex peptide凝胶过滤等技术手段对薛氏丙酸杆菌粗提物进行了初步的分离纯化。最终制备得到一种小分子丙酸杆菌素,MALDI-TOF分析可知该丙酸杆菌素相对分子量为698.9556 u;Sephadex G-10、冷冻干燥和Superdex peptide凝胶过滤得到的丙酸杆菌素单位抑菌活性为初始发酵液的6.8倍,最终抑菌活性得率为10.9%。同时胃蛋白酶实验结果表明:纯化后的丙酸杆菌素仍保留抑菌活性,且对胃蛋白酶敏感,说明该丙酸杆菌素很可能是小分子多肽类物质,这也与贾彩凤等人[7]的研究结果相一致。研究结果表明利用Sephadex G-10脱盐柱和Superdex peptide制备小分子丙酸杆菌素是可行的,为小分子丙酸杆菌素的分离纯化研究提供了理论基础。
[1]Nes,I.F,Diep D B,Håvarstein L S,et al. Biosynthesis of bacteriocins in lactic acid bacteria. Antonie Van Leeuwenhoek,1996,70(2-4):113-128.
[2]Hannuksela M,Haahtela T. Hypersensitivity reactions to food additives. Allergy,1987,42(8):561-575.
[3]王晓云,金凤杰,计芬芬,等. 补加氨水对薛氏丙酸杆菌分批发酵及代谢物抑菌活性的影响. 食品工业科技,2012,33(14):224-227.
[4]李红,赵春燕. 乳酸链球菌素的研究进展. 食品科技,2006,31(1):75-78.
[5]KA Stevens,BW Sheldon,NA Klapes,et al. Nisin treatment for inactivation of Salmonella species and other gram-negative bacteria. Applied and environmental microbiology,1991,57(12):3613-3615.
[6]Michael E. Stiles.Biopreservation by lactic acid bacteria. Antonie Van Leeuwenhoek,1996,70(2-4):331-345.
[7]贾彩凤.丙酸杆菌代谢物做为食品防腐剂的研究[D]. 华东师范大学.2005,56-71.
[8]陈玉梅,常忠义,王疆元,等. 乳酸钠和葡萄糖对薛氏丙酸杆菌生长及代谢物抑菌活性的影响.西北农林科技大学学报(自然科学版),2007,35(2):178-182.
[9]孙帅,常忠义,唐学明,等. 丙酸杆菌代谢物摇瓶补料分批发酵条件研究. 西北农林科技大学学报(自然科学版),2011,39(7):135-140.
[10]潘淼,et al,薛氏丙酸杆菌产抑菌性代谢物发酵培养基优化.食品工业科技. 网络出版时间:2014-12-23 09:50 网络出版地址:http://www.cnki.net/kcms/detail/11.1759.TS. 20141223. 0950.008.html.
[11]齐香君,苟金霞,韩戌珺,等. 3,5-二硝基水杨酸比色法测定溶液中还原糖的研究. 纤维素科学与技术,2004,12(3):17-19.
[12]MA Daeschel. Antimicrobial substances from lactic acid bacteria for use as food preservatives. Food technology(USA),1989.
[13]Ayres J W,Sandine W E,Weber G H. Propionibacteria peptide microcin:U.S. Patent 5,635,484[P]. 1997-6-3.
Propionibacteria Fermentation and Preliminary Explored on Purification of The Bacteriocin
XING Sheng-jie1,JIA Cai-feng1,YANG Xue-xia2,HE Xin-zhou1,LIU Xiao-xia1,GAO Hong-liang1,*,CHANG Zhong-yi1,JIN Ming-fei1
(1.School of Life Science of East China Normal University Shanghai 200241,China;2.Institute of chemical and biological engineering of Donghua University Shanghai 201620,China)
A micromolecule propionibacterium bacteriocin was purified from the supernate of Propionibacterium shermanii,in which the bacteriostatic activity was measured step by step.The study of preliminary purification indicated that the best desalting condition was 5 mL sample application,0.5 mL/min,manual collection,stopped collection when electrical conductivity increased to 1.5 ms/cm. The optimal gel filtration condition of superdex peptide column was 500 μL sample application,0.5 mL/min flow rate,fixed volume collection,each well volume was 200 μL. The antimicrobial activity of propionbacterium bacteriocin improved 6.8 times,but the recovery rate of inbition activity was only 10.9%.The relatively molecular weight of bacteriocin was measured to be 698.9556 u by the MALDI-TOF method.It was indicated that the bacteriocin still remained activity after purification,which was sensitive to pepsin.
propionibacterium;bacteriocin;purification;Propionibacterium shermanii
2015-03-27
邢胜杰(1987-),男,硕士,研究方向:微生物发酵与食品生物技术,E-mail:18818273307@126.com。
高红亮(1973-),男,博士,副教授,研究方向:微生物谷氨酰胺转氨酶,丙酸杆菌细菌素和大豆多糖的工业化生产及应用等,E-mail:hlgao@bio.ecnu.edu.cn。
质检公益行业科研专项项目(201310255)。
TS
A
1002-0306(2016)01-0000-00
10.13386/j.issn1002-0306.2016.01.000

