植物乳杆菌LB17产γ氨基丁酸培养基优化
尹 然,梁金钟
(哈尔滨商业大学食品工程学院,黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
尹然,梁金钟*
(哈尔滨商业大学食品工程学院,黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
以植物乳杆菌(Lactobacillus plantarum Lb-17)为发酵菌株,以发酵产物γ-氨基丁酸产量为检测参数,对植物乳杆菌发酵产γ-氨基丁酸的发酵培养基进行优化。利用单因素实验和Box-Behnken响应曲面实验对发酵培养基进行优化得到最优培养基为:葡萄糖12.0 g/L、酵母粉18.0 g/L、Ca2+55.0 mmol/L、Mg2+60.0 mmol/L、L-谷氨酸钠26.0 g/L。优化后,植物乳杆菌Lb-17发酵γ-氨基丁酸产量达 8.037 g/L,是优化前5.49 g/L提高1.5倍。
γ-氨基丁酸,发酵条件,优化,植物乳杆菌
γ-氨基丁酸(γ-aminobutyric acid,GABA)又名氨酪酸,是由L-谷氨酸或其衍生物在谷氨酸脱羧酶的作用下脱羧而成的一种非蛋白质组成的天然氨基酸,在哺乳动物中是一种重要的抑制性神经递质。GABA能支配神经系统,而且该系统还参与脑循环调节,摄入GABA可以提高葡萄糖磷酸酯酶的活性,使脑细胞活动旺盛,促进脑组织的新陈代谢和恢复脑细胞功能,改善神经机能[1-2]。GABA能作用于脊髓的血管运动中枢,有效促进血管扩张,达到降低血压的目的。据报道,黄芪中的有效降压成分即为GABA[3]。此外,GABA可镇静神经、抗焦虑、改善肾机能和肝机能,促进酒精代谢[1]。
γ-氨基丁酸的微生物发酵法是以谷氨酸或其钠盐(谷氨酸钠)或富含谷氨酸的物质等为原料,利用大肠杆菌[4-5]、曲霉菌[6-7]、乳酸菌[8-10]和酵母菌[11-12]等微生物发酵制得,具有成本低、含量高的优点。乳酸菌作为食品安全级微生物,已被广泛利用于食品和医药行业中及畜牧业[13-14]。日本在应用乳酸菌生物合成GABA的方面研究最早[15],在Luctobacillusbrevis IFO-12005对酒糟的发酵过程中,GABA含量达到了10.18 mmol/L[16]。与日本的研究相比,国内的研究起步较晚,发酵水平有很多差距[17-18]。早期通过实验筛选到乳酸菌株SYFS1.009,经氨基酸自动分析检测发酵液中的GABA含量,达到200 mg/100 mL[19]。2010年,范杰以分离自泡菜的短乳杆菌为研究对象,对其发酵培养基进行了优化,发酵液中GABA含量达到14.15 g/L[20]。2011年,周青等筛选到一株高产GABA的植物乳杆菌Lactobacillus plantarum WZ011,对发酵培养基进行了优化,发酵液中GABA的产量达到5.814 g/L[21]。2014年,林谦等以酸菜汁为原料,筛选出了一株乳酸菌YS2,对培养基和发酵条件进行了优化,发酵液中GABA的产量达到了5.68 g/L[22]。如今GABA及植物乳杆菌已被中华人民共和国卫生部批准为新资源食品,因此研究植物乳杆菌发酵制备富含GABA 功能性食品更具有现实指导意义。本实验采用单因素和响应曲面分析法对发酵条件进行优化,旨在探讨研究植物乳杆菌产γ-氨基丁酸的诸多因素,以提高γ-氨基丁酸的产量,为今后工业化生产γ-氨基丁酸提供参考。
1 材料与方法
1.1材料与仪器
植物乳杆菌Lb-17(Lactobacillus plantarum Lb-17)由哈尔滨商业大学食品工程与科学重点实验室保藏。
γ-氨基丁酸(≥99%)上海源叶生物科技有限公司;硅胶板浙江省台州市路桥四甲生化塑料厂;正丁醇、冰乙酸天津市天力化学试剂有限公司;水合茚三酮天津市巴斯夫化工有限公司;次氯酸钠天津市风船化学试剂有限公司;苯酚天津市科密欧化学试剂开发中心;无水乙醇天津市津东天正精化学试剂厂;四硼酸钠天津市博迪化工有限公司;硼酸哈尔滨市化工试剂厂;碳酸钠天津市天力化学试剂有限公司。
BS 224S电子天平赛多利斯科学仪器(北京)有限公司;LRH-生化培养箱上海一恒科技有限公司;723N可见分光光度计上海精密科学仪器有限公司;H1650-W台式高速离心机湖南湘仪实验室仪器开发有限公司。
1.2培养基
菌种活化、保藏及分离培养基(MRS培养基):蛋白胨10.0 g/L、酵母粉2.0 g/L、牛肉粉10.0 g/L、无水乙酸钠5.0 g/L、柠檬酸氢二铵2.0 g/L、葡萄糖20.0 g/L、MgSO4·7H2O 0.2 g/L、MnSO40.05 g/L、K2HPO42.0 g/L,吐温-80 1.0 mL,自然pH;固体培养基:液体培养基中加入琼脂20.0 g/L(121℃,灭菌15 min)。
发酵培养基(TYG培养基):胰蛋白胨5.0 g/L、葡萄糖10.0 g/L、酵母粉5.0 g/L、丁二酸钠5.0 g/L、L-MSG 10.0 g/L,自然pH(105℃,灭菌20 min)。
1.3液体培养条件
按体积分数2%的初始接种量将种子液接入试管发酵培养基中,试管装液量15 mL/30 mL,用硅胶塞密封,温度37℃,静置培养72 h。
1.4培养基组分优化
1.4.1碳源种类及浓度对GABA发酵的影响分别以5.0 g/L的葡萄糖、蔗糖、麦芽糖、果糖、丁二酸钠、乳糖作为碳源进行发酵实验,测定发酵液中GABA质量浓度,从而筛选出最佳碳源。而后分别向基础发酵培养基TYG中添加5.0、10.0、15.0、20.0、25.0 g/L的葡萄糖,37℃静置培养72 h,测定发酵液中GABA质量浓度,确定合适的葡萄糖质量浓度。
1.4.2氮源种类及浓度对GABA发酵的影响分别向基础发酵培养基中添加8.0 g/L的胰蛋白胨、牛肉膏、酵母粉、蛋白胨、酪蛋白胨、蛋白胨、硫酸铵作为氮源进行发酵实验,测定发酵液中GABA质量浓度,从而筛选出最佳氮源。而后分别向基础发酵培养基TYG中添加5.0、10.0、15.0、20.0、25.0 g/L的酵母粉,37℃静置培养72 h,测定发酵液中GABA质量浓度,确定合适的酵母粉质量浓度。
1.4.3底物对GABA发酵的影响在基础发酵培养基TYG中分别加入10.0、20.0、30.0、40.0、50.0、60.0、70.0 g/L的L-谷氨酸钠,确定最适的底物质量浓度。
1.4.4无机盐对GABA发酵的影响选取CaCl2、MgSO4、MnSO4、KH2PO4、NaCl,分别以5.0 mmol/L离子浓度添加到基础培养基TYG中进行发酵实验,测定发酵液中GABA质量浓度,从而筛选出最佳无机盐。而后分别向基础发酵培养基TYG中添加10.0、20.0、30.0、40.0、50.0、60.0 mmol/L的CaCl2和MgSO4,37℃静置培养72 h,测定发酵液中GABA质量浓度,确定合适的CaCl2和MgSO4离子浓度。
1.5GABA含量测定
Berthelot改良比色法[23]标准曲线的绘制:配制质量浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 g/L的GABA标准溶液。取0.4 mL不同质量浓度的GABA标准溶液,分别加入1 mol/L的Na2CO3溶液0.1 mL;0.2 mol/L pH9.0的四硼酸钠缓冲溶液0.5 mL;质量浓度为6 g/100 mL的苯酚水溶液1 mL;含有10%有效氯的次氯酸钠溶液1 mL,振荡混匀,放置10 min。然后沸水浴10 min;最后冰浴20 min,待溶液出现蓝绿色后加入体积分数为60%乙醇水溶液2 mL,振荡混匀,放置30 min。在640 nm波长处测定其光密度值,并做平行样。最后以GABA的质量浓度为横坐标,640 nm处OD为纵坐标绘制标准曲线。
发酵液中GABA产量的测定:取一定量发酵液,常温条件下,12000 r/min离心5 min,将上清液稀释10倍后取0.4 mL,按标准曲线测定方法测定发酵液中GABA含量。以发酵培养基为空白对照。

图1 GABA标准曲线Fig.1 GABA standard curve
1.6响应面分析法
根据前期实验结果选取对GABA产量影响显著的五个因素:葡萄糖(g/L)、酵母粉(g/L)、Ca2+(mmol/L)、Mg2+(mmol/L)、L-谷氨酸钠(g/L)在发酵培养基中的组分含量为自变量,采用Box-behnken设计,以GABA产量(g/L)为响应值设计响应面实验,因素水平表见表1。

表1 响应面实验因素水平表
2 结果与分析
2.1原始发酵培养基中GABA含量的测定
将在37℃静止培养72 h的原始发酵培养基,按照1.5所述的GABA含量测定方法进行平行测定,所得GABA含量为5.49 g/L。
2.2碳源种类及浓度对GABA发酵的影响
如图2可知,植物乳杆菌Lb-17利用葡萄糖发酵产GABA的能力明显好于其它碳源,确定最佳碳源为葡萄糖。由图3所示,葡萄糖质量浓度10.0 g/L,GABA产量最大为7.896 g/L;推测原因为一般种子培养基中葡萄糖含量不能太高,因为糖分过多,菌体代谢活动旺盛,产生有机酸,使pH降低,容易引起菌种衰老从而影响GABA的产量[24]。
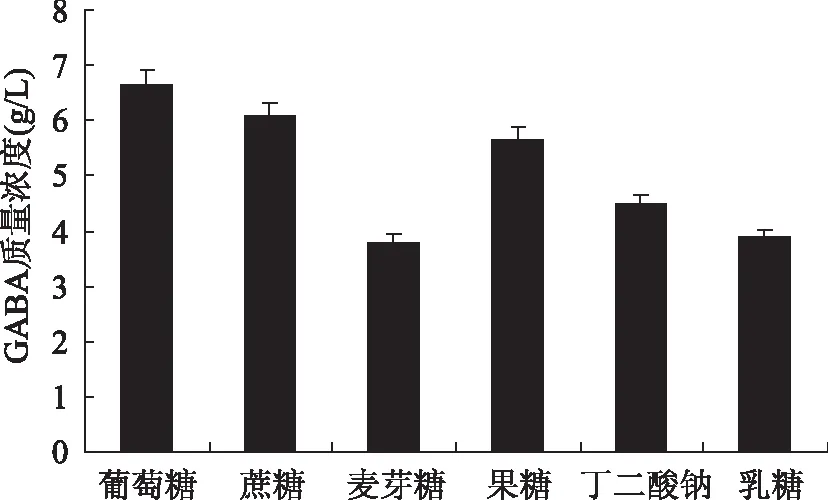
图2 碳源对Lb-17产GABA的影响Fig.2 Effect of carbon sources on the production of GABA
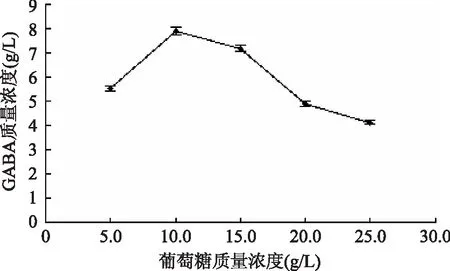
图3 不同质量浓度葡萄糖对Lb-17产GABA的影响Fig.3 Effect of glucose concentration on the production of GABA
2.3氮源种类及浓度对GABA发酵的影响
结果如图4可知,最佳氮源为酵母粉,添加硫酸铵菌体产GABA最小,这是因为酵母粉中含有丰富的营养成分及植物乳杆菌生长所需的生长因子,从而促进菌体的生长代谢,而无机氮源不能提供菌体产GABA所需的营养物质。根据图5所示,酵母粉质量浓度15.0 g/L,GABA产量最大为6.517 g/L;推测原因为酵母粉浓度不断增加导致菌体过度生长而不产谷氨酸脱羧酶[25]。
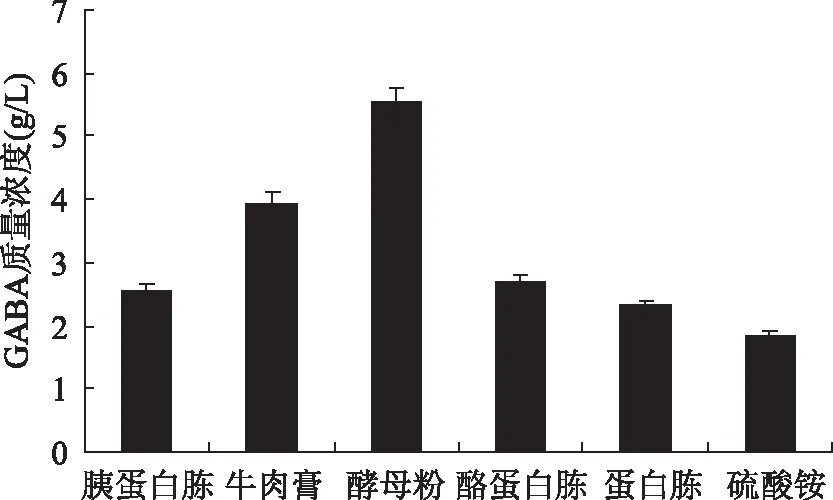
图4 氮源对Lb-17产GABA的影响Fig.4 Effect of nitrogen sources on the production of GABA

图5 不同质量浓度酵母粉对Lb-17产GABA的影响Fig.5 Effect of yeast concentration on the production of GABA
2.4底物对GABA发酵的影响
结果如图6可知,当培养基中L-谷氨酸钠质量浓度为20.0 g/L时,发酵液中GABA质量浓度最大,为7.743 g/L,但当L-谷氨酸钠添加量大于20.0 g/L时,GABA质量浓度降低,可能是由于底物浓度过量,菌体内的谷氨酸脱羧酶不足,产生底物抑制,导致γ-氨基丁酸的产量逐渐降低[25]。
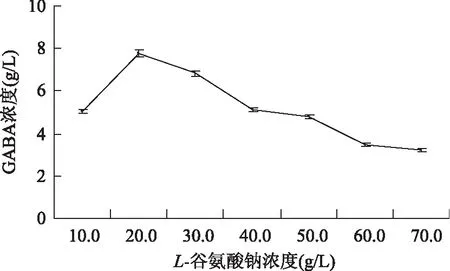
图6 L-谷氨酸钠对Lb-17产GABA的影响Fig.6 Effect of L-MSGon the production of GABA
2.5无机盐对GABA发酵的影响
结果如图7所示,最佳无机盐为MgSO4和CaCl2,GABA质量浓度分别为6.712 g/L和7.081 g/L,加入MnSO4的培养基GABA的产量最低,可能原因为镁构成某些酶的活性成分,钙离子是某些酶的激活剂,Mg2+、Ca2+可以激活谷氨酸脱羧酶的活性,使GABA产量增加,Mn2+抑制酶的活性,使GABA产量减少[25]。结果如图6可知,当培养基中CaCl2、MgSO4离子浓度分别为50.0、60.0 mmol/L时,发酵液中GABA质量浓度最大分别为8.014、7.982 g/L。但随着CaCl2和MgSO4添加量的提高,GABA质量浓度降低,可能原因为CaCl2和MgSO4浓度过高抑制了谷氨酸脱所酶的活性,从而使GABA产量下降。
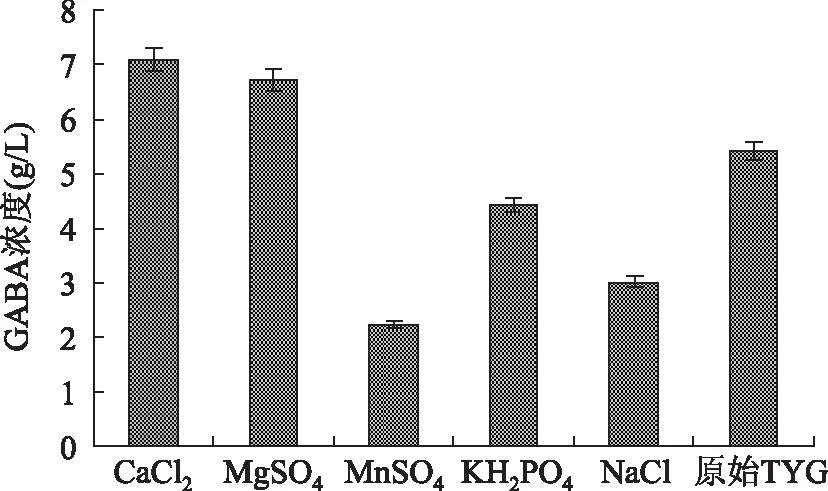
图7 无机盐对Lb-17产GABA的影响Fig.7 Effect of mineral salts on the production of
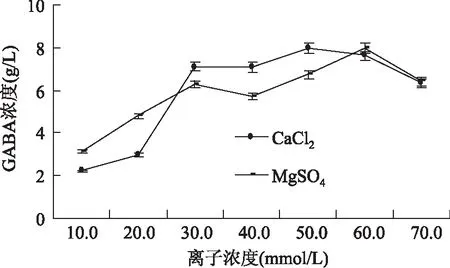
图8 CaCl2和MgSO4对Lb-17产GABA的影响Fig.8 Effect of CaCl2 and MgSO4 on the production of GABA
2.6培养基成分响应曲面优化实验
通过对单因素实验的分析,以GABA产量为指标,对葡萄糖(g/L)、酵母粉(g/L)、Ca2+(mmol/L)、Mg2+(mmol/L)、L-谷氨酸钠(g/L)五个因素设计响应面实验。然后用多元回归分析,拟合二次多项回归模型的Box-Behnken设计,实验结果见表2。
利用Design Expert 软件对表2中的实验数据进行多元回归拟合,得到GABA产量对葡萄糖、酵母粉、Ca2+、Mg2+、L-谷氨酸钠的二次多元回归模型方程为:
GABA产量(g/L)=7.93+2.11A+0.77B-0.054C-0.28D-0.7E+0.19AB+0.50AC-0.35AD+0.35AE+0.42BC-0.25BD+1.56BE+0.17CD+2.17CE-0.9DE-2.46A2-1.80B2-2.40C2-2.20D2-1.14E2
对二次多元回归方程进行显著性验证及方差分析,如表3。
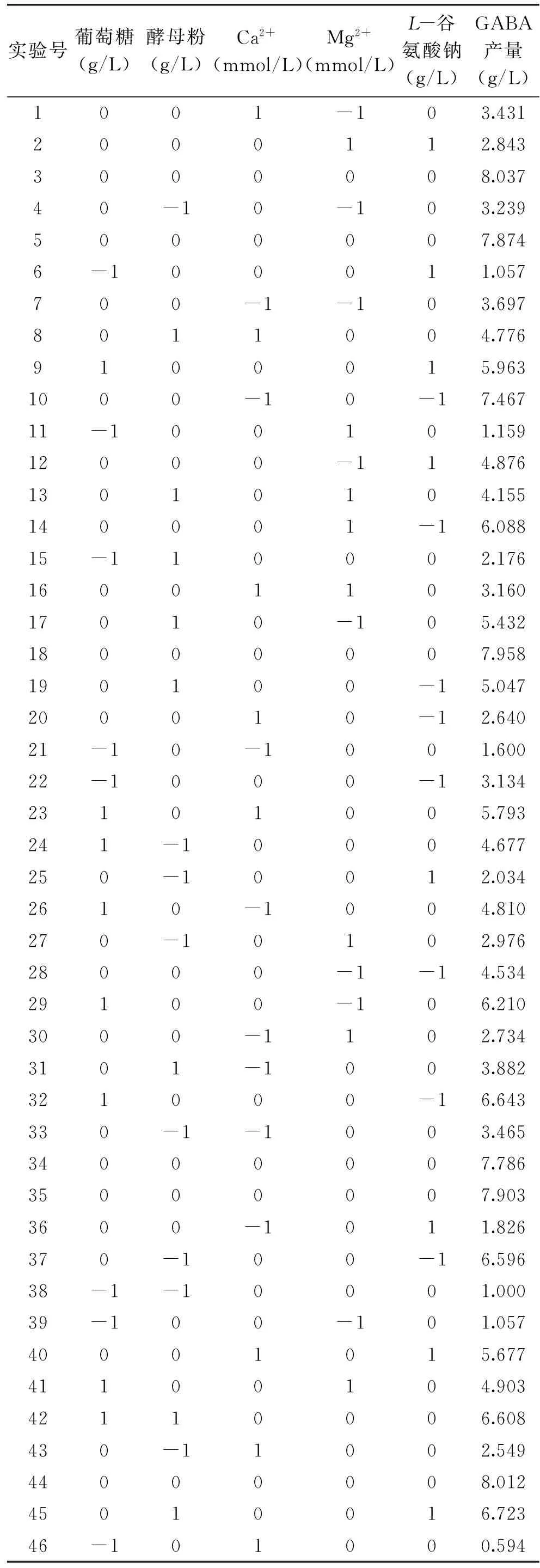
表2 响应面实验设计与结果
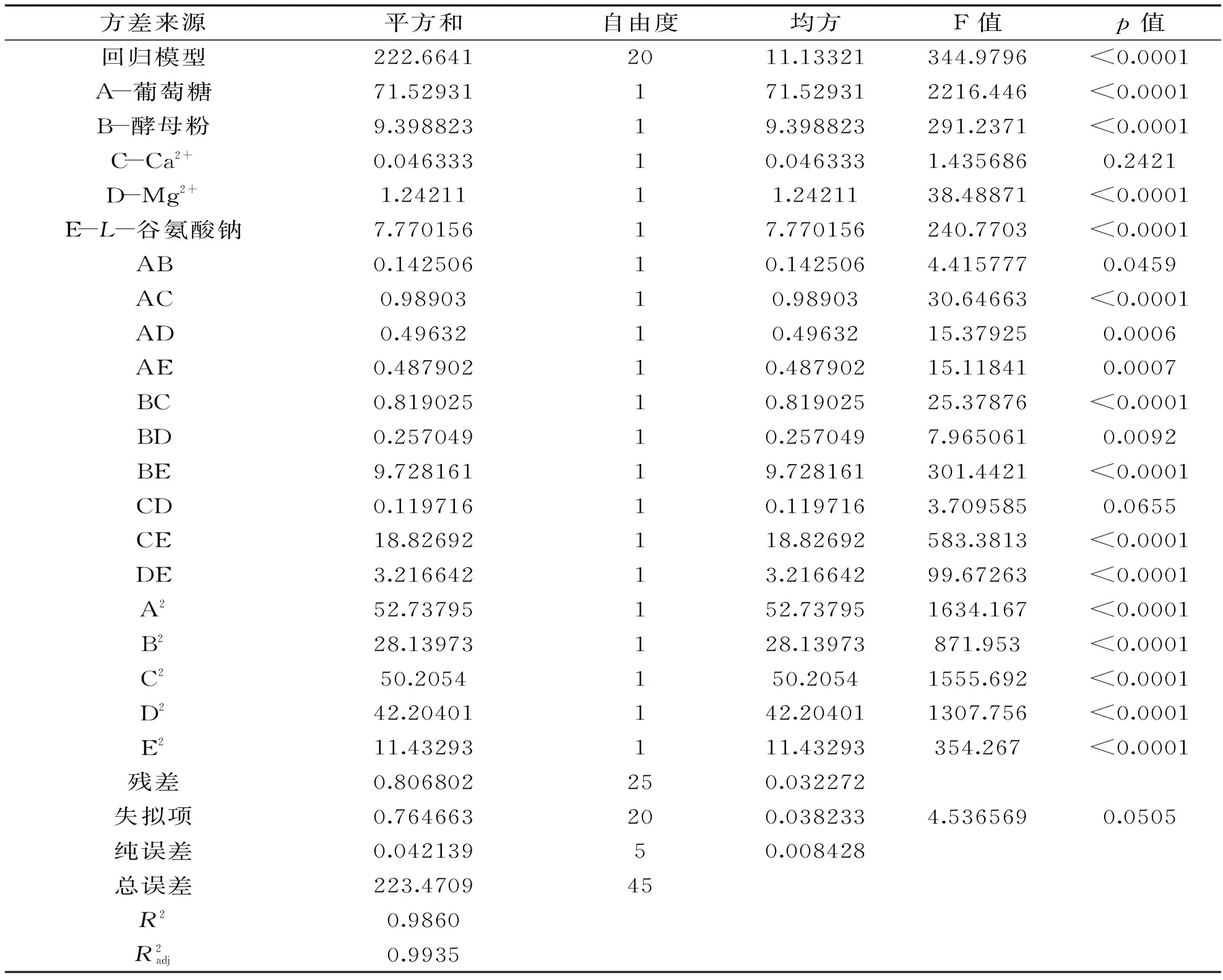
表3 回归模型方程方差分析
2.7响应曲面分析
对发酵培养基中组分含量:葡萄糖(g/L)、酵母粉(g/L)、Ca2+(mmol/L)、Mg2+(mmol/L)、L-谷氨酸钠(g/L)5个因素两两交互作用进行分析,做出相应的响应曲面,如图9所示。通过等高线图得到最优条件下各实验因子的取值。等高线越密集且越趋向椭圆形表示两因素交互作用显著,反之则表示交互作用不显著。图9A~图9G、图9J交互作用显著。图9H中的各组因素两两交互作用的等高线则相对较圆,说明交互作用不显著,该结果与表3的方差分析结果一致。

图9 两因素交互作用对GABA产量影响的分析图Fig.9 Response surface showing theinteractive effects two factors on the production of GABA注:A:葡萄糖和Ca2+;B:葡萄糖和酵母粉;C:葡萄糖和Mg2+;D:葡萄糖和L-谷氨酸钠;E:酵母粉和Ca2+;F:酵母粉和Mg2+;G:酵母粉和L-谷氨酸钠;H:Ca2+和Mg2+;I:Ca2+和L-谷氨酸钠;J:Mg2+和L-谷氨酸钠。
根据回归方程,用Design-Expert软件做出响应曲面,考察拟合响应曲面的形状。通过软件优化,得到最优条件:葡萄糖12.82 g/L、酵母粉18.09 g/L、Ca2+54.12 mmol/L、Mg2+57.29 mmol/L、L-谷氨酸钠26.99 g/L,GABA预测产量为8.55 g/L。
为实验方便可行,将最优条件修正为:葡萄糖12.0 g/L、酵母粉18.0 g/L、Ca2+55.0 mmol/L、Mg2+60.0 mmol/L、L-谷氨酸钠26.0 g/L。按最佳配比配制培养基,并在优化后的培养条件下进行培养,确定模型与实验的相符性,得到GABA实际产量为8.037 g/L。实际发酵的产量与回归方程接近,证明了模型的可靠性。
3 结论
通过单因素实验分析了培养基对GABA产量的影响,并结合Box-Behnken的中心组合设计及响应曲面分析,建立了植物乳杆菌发酵条件的二次多项式模型,并经显著性检验证明了该模型具有可靠性。最终得到植物乳杆菌Lb-17发酵产GABA的最佳条件:葡萄糖12.0 g/L、酵母粉18.0 g/L、Ca2+55.0 mmol/L、Mg2+60.0 mmol/L、L-谷氨酸钠26.0 g/L。在此条件下,GABA的实际产量为8.037 g/L,与理论值(8.55 g/L)的相对误差为5.61%,表明应用响应曲面法优化植物乳杆菌Lb-17产GABA的条件是可行的。优化后,植物乳杆菌Lb-17发酵γ-氨基丁酸产量达 8.037 g/L,比优化前5.49 g/L提高1.5倍。
[1]许建军,江波,许时婴.γ-氨基丁酸(GABA)——一种新型的功能食品因子[J].食品工业科技,2003,01:109-110,42.
[2]徐叔云主编.临床药物指南[M].修订版.合肥:安徽科学技术出版社,1997.
[3]赵长琦,李广民,王军.中药红芪中降压有效成分(γ-氨基丁酸的薄层扫描测定.西北大学学报(自然科学版),1995,25(3):277-278.
[4]赵景联.固定化大肠杆菌细胞生产γ-氨基丁酸的研究[J].生物工程学报,1989,5(2):124-128.
[5]Plokhov A Y,Gusyatiner M M,Yampolskaya T A,et al.Preparation ofγ-aminobutyric acid using E.coli cells with high activity of glutamate decarboxylase[J].Applied Biochemistry and Biotechnology,2000(88):257-266.
[6]Wang Z J.Production of the secondary metabolitesγ-aminobutyric acid and monacalin K by Monascus[J].Jounal of Industrial Microbiology and Biotechnology,2003,30(1):41-46.
[7]Wang Z J.Improvement of monacolin K,γ-aminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpureusNTU601[J].Journal of Industrial Microbiology and Biotech-nology,2003,30(11):669-676.
[8]Ja Y K,Moo Y L,Geun E J,et al.Production ofγ-aminobutyric acid in black raspberry juice during fermentation by Lactobacillus brevis GABA100[J].International Journal of Food Microbiology,2009(130):12-16.
[9]Li H X,Gao D D,Cao Y S,et al.A highγ-aminobutyric acid-producing actobacillus brevis isolated from Chinese traditional paocai[J].Annals of Microbiology,2008,58(4):649-653.
[10]Noriko K,Jun S,Shinichi K,et al.Production ofγ-aminobutyric acid(GABA)by Lactobacillus paracasei isolated from traditional fermented foods[J].Food Microbiology,2005(22):497-504.
[11]Takahashi T,Furukawa A,Hara S,et al.Isolation and characterization of sakeyeast mutants deficient inγ-aminobutyricacidutilization in sake brewing[J].Journal of Bioscience and Bioengineering,2004,97(6):412-418.
[12]胡超,黄丽华,左斌,等.酵母产γ-氨基丁酸发酵培养基的优化[J].现代生物医学进展,2011,11(3):482-484.
[13]江波.GABA(γ-氨基丁酸):一种新型的功能食品因子[J].中国食品学报,2008,8(2):1-4.
[15]T Tadayuki,H Tomoko,M Kiyoshi.Enzyme-based microtiter plate assay forγ-aminobutyric acid:Application to the screening ofγ-aminobutyric acid-producing lactic acid bacteria[J].Amalytica Chimica Acta,2005,540:293-297.
[16]S Yokoyama,J I Hiramatsu,K Hayakawa.Production ofγ-Aminobutyric Acid from Alcohol Distillery Lees by Lactobacillus brevis IFO-12005[J].Journal of Bioscience and Bioengineering,2002,93(1):95-97.
[17]王婧,林亲录,陈海军,等.GABA生产菌株(乳酸菌)的筛选[J].山东食品发酵,2007(3):37-39.
[18]陈海军.高产γ-氨基丁酸乳酸菌的筛选[D].长沙:湖南农业大学,2007.
[19]许建军,江波,许时婴.生物合成γ-氨基丁酸的乳酸菌的筛选[J].食品技术,2002,10:7-10.
[20]范杰,孙君社,张秀清,等.产γ-氨基丁酸乳酸菌的培养基优化[A].International Science and Engineering Center,Hong Kong,Wuhan Institute of Technology,China.Proceedings of 2010 First InternationalConferenceon Cellular,Molecular Biology,Biophysics and Bioengineering(Volume7)[C],2010.
[21]周青,魏春,应向贤,等.产γ-氨基丁酸乳酸菌的筛选及发酵过程研究[J].食品与发酵工业,2011,05:26-31.
[22]林谦,姜康怡,韦素娟,等.产GABA发酵乳杆菌的筛选及发酵条件优化及其谷氨酸脱羧酶基因的克隆[J].广东农业科学,2014,08:192-197.
[23]刘佳荣,梁金钟.黄浆水中高产γ-氨基丁酸乳酸菌的筛选及鉴定[J].食品科学,2014,23:221-225.
[24]张克旭.氨基酸发酵工艺学[M].北京:中国轻工业出版社,1992.
[25]邱文军.产谷氨酸脱羧酶菌株筛选及生产γ-氨基丁酸的研究[D].无锡:江南大学,2014.
Optimization of fermentation conditions for the production ofγ-aminobutyric acid by Lactobacillus plantarum
YIN Ran,LIANG Jin-zhong*
(Key Laboratory of Food Science and Engineering,School of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Lactobacillus plantarum Lb-17 was fermented to produceγ-aminobutyric acid,using the production of GABA as a parameter.And then single factor test andresponse surface analysis were used to optimize the culture medium.The optimum medium constitution was as follows:glucose 12.0 g/L,yeast powder 18.0 g/L,Ca2+55.0 mmol/L,Mg2+60.0 mmol/L,L-Sodium glutamate 26.0 g/L.The yield ofγ-aminobutyric acid was 8.037 g/L after cultivated in optimized medium,which was 1.5 times that of the yield before.
γ-aminobutyric;fermentation conditions;optimization;Lactobacillus plantarum
2015-09-02
尹然(1990-),女,硕士,研究方向:微生物学与发酵工程,E-mail:15244602089@163.com。
梁金钟(1957-),男,本科,教授,研究方向:微生物学与发酵工程,E-mail:Ljz2050@126.com。
黑龙江省高校科技创新团队建设计划项目(2010td04)。
TS201.3
A
1002-0306(2016)07-0110-07
10.13386/j.issn1002-0306.2016.07.014

