响应面优化红米原花青素提取工艺
罗舜菁,马 烨,刘成梅,龚二生,李 倩,曾子聪,张玫美
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
响应面优化红米原花青素提取工艺
罗舜菁,马烨,刘成梅*,龚二生,李倩,曾子聪,张玫美
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
采用响应面法优化红米原花青素的提取条件。以产自哈尔滨延寿县红香米为原料,在单因素实验的基础上,通过响应面实验,得出红米原花青素最佳提取条件为:丙酮浓度76%,温度39℃,料液比1∶25(g/mL),pH5,提取次数2次,时间40 min,原花青素得率是现有文献报道的红米原花青素含量最高的传统斯里兰卡Sudu Heenati红米的1.925倍,为(4.37±0.02)mg/g。红外图谱分析发现红米原花青素纯化物主要是由(表)儿茶素的结构单元构成的原花青定聚合物。清除DPPH自由基实验显示红米原花青素的抗氧化活性强于VC,表明红米原花青素有较强的抗氧化活性,可作为原花青素天然植物来源。
红米,原花青素,提取,纯化,抗氧化
红米(Red Rice)是全谷物中的有色谷物,因其果皮和种皮上沉积色素而显红色。有色米因其远高于浅色米的抗氧化活性,近几年来已逐渐成为研究热点[1-3]。现有研究报道表明,红米是各种谷物中抗氧化活性最强的品种,高于紫米和荞麦,远高于浅色糙米、小麦和燕麦等谷物[4],并且表现出比浅色糙米、紫米更强的癌细胞抗增殖活性[5]。但红米因受其地域和文化限制,仅在一些亚洲国家如中国、斯里兰卡、印度等,被作为一种传统粮食长期种植和食用。在西方国家,红米的种植和消费都十分受限制,人们通常认为红米是一种野草[6]。我国是有色米产量最大的国家,目前国内保存的有色稻种质资源中,红米稻种占据首位[7]。但现阶段国内外对大米的研究多集中在浅色糙米和黑米上,对红米的研究不多。
红米中主要的抗氧化活性物质为原花青素[8]。原花青素有清除自由基、抗癌、保护心血管、美容及抗疲劳等作用,在食品、化妆品、医药等领域应用广泛,是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂,在欧美等国家享有“皮肤维生素”和“口服化妆品”的美誉[9]。原花青素含量丰富的品种主要是水果[10],其中以对葡萄原花青素的研究最多,在一些谷物和豆类也有相关报道,如大麦和扁豆,但在大米品种中少有报道。本实验探讨了溶剂提取法提取红米原花青素的工艺,采用响应面法优化工艺条件,并优化了红米原花青素的纯化工艺,同时测定纯化后红米原花青素的红外结构和抗氧化活性,旨在为红米中原花青素的开发利用提供科学依据,并为发现原花青素的天然植物来源新资源提供更多选择。
1 材料与方法
1.1材料与仪器
红香米,原产地:黑龙江哈尔滨延寿县中和镇;甲醇、丙酮、乙醇均为分析纯上海化学试剂公司;大孔树脂(NKA-9,AB-8,S-8,NKA-Ⅱ,X-5,D101)南开大学化工厂;(+)-儿茶素标准品(色谱纯)美国Sigma公司;DPPH美国Sigma公司;香草醛、VC上海化学试剂公司。
T6紫外可见分光光度计北京普析通用仪器有限公司飞鸽牌;AK/QC-058离心机上海安亭科学仪器厂;FBC1001超纯水机青岛富勒姆科技有限公司;RE-52C旋转蒸发仪上海亚荣生化仪器厂;AR1140型电子天平奥豪斯仪器(上海)有限公司;FW80高速万能粉碎机天津市泰斯特仪器有限公司;FT/IR-480傅里叶变换红外光谱仪日本岛津公司。
1.2实验方法
1.2.1红米原花青素的提取红米粉碎后过60目筛,40℃干燥使水分含量低于10%,并于-20℃储存备用。提取方法:准确称取1.0000 g红米粉,按一定的料液比用有机溶剂在一定的pH下恒温磁力搅拌一定时间,4800×g离心10 min,分离上清,残渣再提一次,合并上清得原花青素提取液,于-20℃储存备用[11]。
1.2.2原花青素含量的测定采用香草醛-浓盐酸法测定[12],精确移取0.5 mL样液置于10 mL试管中,加入2.5 mL 1%香草醛-甲醇溶液和2.5 mL 30%浓盐酸-甲醇溶液,30℃水浴避光反应20 min,以0.5 mL甲醇代替样液作为空白对照,于500 nm波长处测定吸光值,记录实验数值。实验重复测定3次。
1.2.3原花青素标准曲线的绘制精确称取一定质量的(+)-儿茶素标准品,用甲醇溶解并定容于容量瓶中,依次配制1、0.9、0.8、0.7、0.6、0.5 mg/mL浓度的(+)-儿茶素标准溶液。用1.2.2中的方法测定吸光度。以标准品浓度为横坐标,以吸光度为纵坐标绘制标准曲线。
1.2.4红米原花青素提取工艺的优化
1.2.4.1单因素实验设计a.提取溶剂对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),选用70%的不同溶剂(甲醇、乙醇、丙酮),将pH调至6.5,20℃恒温磁力搅拌20 min,提取1次,定容后测吸光度。
b.丙酮浓度对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),选用50%、60%、70%、80%的不同浓度的丙酮,将pH调至6.5,20℃恒温磁力搅拌20 min,提取1次,定容后测吸光度。
c.料液比对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶10,1∶15,1∶20,1∶25,1∶30(g/mL),加入70%丙酮溶液,将pH调至6.5,20℃恒温磁力搅拌20 min,提取1次,定容后测吸光度。
d.pH对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),加入70%丙酮溶液,将pH调至2、3、4、5、6,20℃恒温磁力搅拌20 min,提取1次,定容后测吸光度。
e.提取次数对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),加入70%丙酮溶液,将pH调至6.5,20℃恒温磁力搅拌20 min,重复提取1次、2次、3次,定容后测吸光度。
f.时间对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),加入70%丙酮溶液,将pH调至5,20℃恒温磁力搅拌10、20、30、40、50、60 min,重复提取2次,定容后测吸光度。
g.温度对原花青素提取效果的影响:按1.2.1的方法准确称取1.0000 g红米粉,料液比1∶20(g/mL),加入70%丙酮溶液,将pH调至5,20、30、40、50、60℃恒温磁力搅拌40 min,重复提取2次,定容后测吸光度。
1.2.4.2响应面实验设计在单因素的基础上,以A丙酮浓度(%)、B提取温度(℃)、C料液比(g/mL)三个因素为自变量,以原花青素得率为响应值,根据Box-Behnken 中心组合实验设计因素水平表,并运用Design-Expert 8.0.5 软件进行优化分析,以确定最佳提取工艺。三因素三水平表如表1。
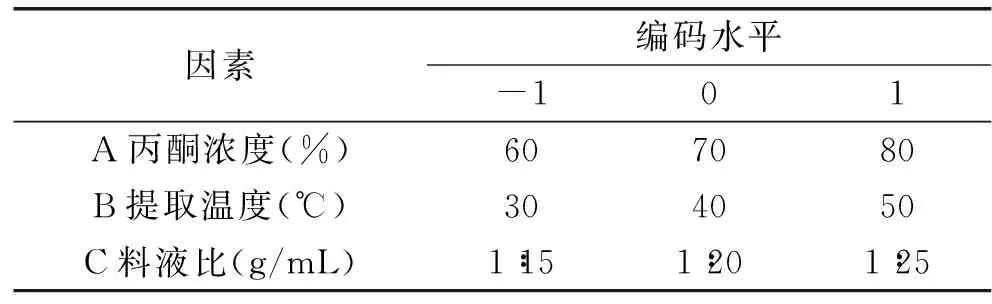
表1 Box-Benhnken实验设计因素和水平
原花青素得率计算公式如下:
原花青素得率(mg/g)=提取液原花青素浓度(mg/mL)×提取液体积(mL)/红米干基质量(g)
1.2.5原花青素的纯化取4.000 g预处理后的D101树脂,湿法装柱,对提取后的红米原花青素进行纯化,纯化条件为:上样流速1 mL/min,上样浓度0.68 mg/mL,上样量5 BV,水洗体积5 BV,丙酮解析液浓度60%,解析液用量4 BV,将解析后的溶液减压旋蒸,冻干备用。原花青素的纯度按下述公式计算:
原花青素纯度(%)=纯化液中原花青素的浓度(mg/mL)×纯化液体积(mL)/纯化物质量(mg)×100
1.2.6红外测定将纯化后的红米原花青素粉末与溴化钾按2%比例混合研磨压片,在红外光谱仪中先对纯溴化钾薄片进行背景扫描,再对含有样品的KBr薄片进行扫描,扫描波数为4000~400 cm-1,测定其红外光谱。
1.2.7抗氧化活性测定参考文献[13],准确称取 DPPH 7.9 mg,用95%的乙醇溶解定容于100 mL容量瓶中,作为反应液备用。配制10、20、50、100、250 μg/mL样品甲醇溶液和10、20、50、100、250 μg/mL VC水溶液,甲醇溶液,分别准确移取1 mL于10 mL试管,再分别加入3 mL DPPH反应液,充分摇匀,在背光处静置30 min,于517 nm处测定其吸光值,重复3次实验。DPPH自由基清除率按下述公式计算,并计算出自由基抑制率为50%时的样品浓度,即为半数抑制率IC50。
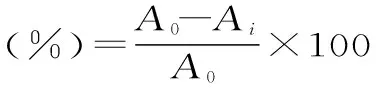
式中:Ai为3 mL DPPH溶液+1 mL样品或VC溶液的吸光度;A0为3 mL DPPH溶液+1 mL甲醇的吸光度。
1.3数据统计分析
实验数据用平均值±标准差(Mean±SD)表示,spss16.0分析各数据间的差异显著性,Design-Expert 8.0进行多元回归拟合和方差分析。
2 结果与讨论
2.1原花青素含量的标准曲线
按方法1.2.2制备儿茶素标准溶液并绘制标准曲线如图1所示,儿茶素当量与吸光度曲线的回归方程为y=0.4514x-0.0356,R2=0.9991,表明原花青素含量在0.4~1 mg/mL儿茶素当量范围内线性关系良好。

图1 儿茶素标准曲线Fig.1 The standard curve of catechin
2.2红米原花青素提取单因素实验
2.2.1不同溶剂对原花青素提取效果的影响原花青素的提取溶剂最常用的有甲醇、乙醇和丙酮。由图2可知,甲醇、乙醇、丙酮均可将原花青素溶出,其中丙酮提取出的原花青素含量最高,甲醇最低,丙酮的羰基氧可作为强的氢键受体,能在葡聚糖上将结合的多聚体酚类取代下来[14]。故选择丙酮为提取溶剂。

图2 不同溶剂对原花青素提取效果的影响Fig.2 Effect of different extraction agents on the extraction of proanthocyanidins
2.2.2丙酮浓度对原花青素提取效果的影响由图3可知,随着丙酮浓度的增大,提取液中原花青素的含量逐渐增大,丙酮浓度为70%时,原花青素提取效果最好,当丙酮浓度大于70%,提取液中原花青素含量反而降低。这可能是因为当丙酮浓度过大时,一些脂溶性杂质被溶出,与原花青素竞争结合丙酮[15]。故选择70%丙酮提取原花青素。

图3 丙酮浓度对原花青素提取效果的影响Fig.3 Effect of acetone concentration on the extraction of proanthocyanidins
2.2.3料液比对原花青素提取效果的影响料液比对原花青素提取效果影响如图4所示。增大料液比可显著提高提取液中原花青素的含量,这可能是因为增大料液比可以使原花青素与丙酮充分接触并溶出[16],当料液比超过1∶20(g/mL)时,提取液中原花青素的含量没有明显的增大,故选择料液比为1∶20(g/mL)提取原花青素。

图4 料液比对原花青素提取效果的影响Fig.4 Effect of liquid-to-material ratio on the extraction of proanthocyanidins
2.2.4pH对原花青素提取效果的影响pH对原花青素提取效果影响如图5所示。原花青素含羟基,呈弱酸性,酸性条件有利于原花青素的溶出,而弱碱处理可造成原花青素的大量损失[17]。随着pH的增大,提取液中原花青素的含量逐渐增大,当pH为5时,提取效果最好,故选择pH5提取原花青素。
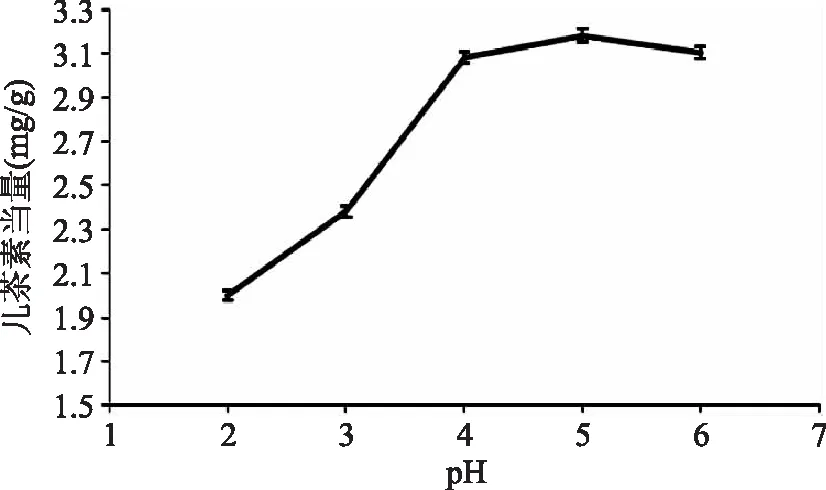
图5 pH对原花青素提取效果的影响Fig.5 Effect of pH on the extraction of proanthocyanidins
2.2.5提取次数对原花青素提取效果的影响提取次数对原花青素提取效果影响如图6所示。提取2次比提取1次显著的提高了原花青素提取量,提取2次后再增加提取次数,原花青素提取量没有明显的增大,故选择提取2次。

图6 提取次数对原花青素提取效果的影响Fig.6 Effect of extraction times on the extraction of proanthocyanidins
2.2.6时间对原花青素提取效果的影响提取时间对原花青素提取效果影响如图7所示。由图7可看出,随着时间的增加,提取出原花青素的含量逐渐增大,这是因为提取时间少,原花青素未被充分溶出,考虑到40 min后增幅不大,故选择40 min提取原花青素。

图7 时间对原花青素提取效果的影响Fig.7 Effect of extraction time on the extraction of proanthocyanidins
2.2.7温度对原花青素提取效果的影响提取温度对原花青素提取效果影响如图8所示。随温度的升高,提取液中原花青素的含量逐渐增大,当温度超过40℃时,提取效果反而降低,这可能是因为随着温度的升高可加快溶质的扩散和溶剂的渗透,但原花青素的结构不稳定,在温度过高时,原花青素的结构容易被破坏[18],故选择40℃提取原花青素。
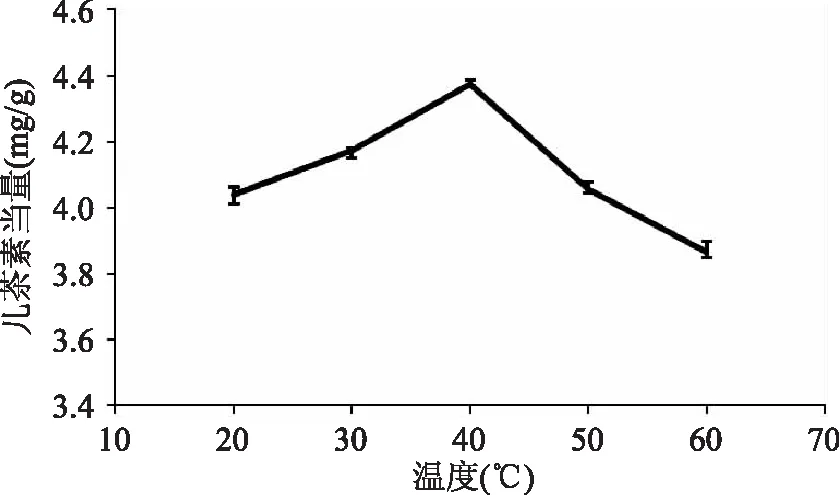
图8 温度对原花青素提取效果的影响Fig.8 Effect of extraction temperature on the extraction of proanthocyanidins
2.3响应面结果分析
在单因素实验的基础上,固定提取pH为5,次数为2次,时间为40 min,选择主要影响因素丙酮浓度(A)、提取温度(B)、料液比(C)为考察因素,采用Box-Benhnken中心组合设计三因素三水平实验的三元二次响应面分析方法,优化红米原花青素提取工艺。因素水平如表1所示。自变量的实验水平分别以-1、0、1进行编码,共设计17个实验点,其中析因点12个,是自变量取值在各因素所构成的三维顶点,中心点5个,用来估计实验误差。为了避免人为因素导致的系统误差,将标准序打乱按照运行序来进行响应面实验。响应面分析设计见表2。
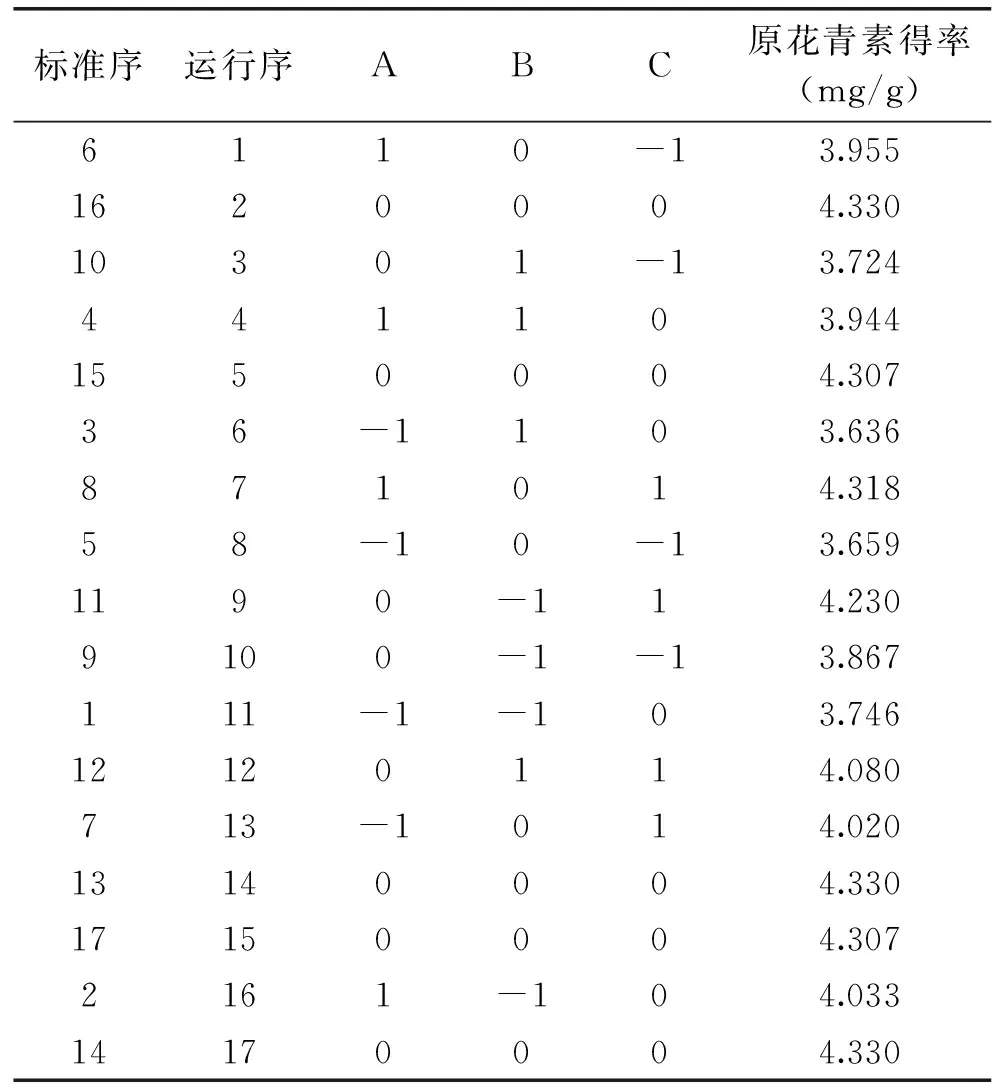
表2 红米原花青素得率响应面方案及结果

表3 响应面回归模型ANOVA分析结果
注:*,p<0.05;**,p<0.01;***,p<0.001。
利用Design-Expert 8.0 软件对表2实验数据进行多元回归拟合,得到以原花青素得率为响应值的二次多项回归模型:Y=4.3208+0.1483A-0.0605B+0.1816C+0.00525AB+0.00025BC-0.2349A2-0.2461B2-0.0974C2(其中,Y:原花青素得率;A:丙酮浓度;B:提取温度;C:料液比)。比较表3的F值可以看出各因素对红米原花青素提取效果影响为:料液比>丙酮浓度>提取温度。

以上述优化工艺条件为参考,将实际条件调整为:丙酮浓度76%,温度39℃,料液比1∶25(g/mL),pH5,提取2次,时间40 min,以检验响应面法优化红米原花青素提取工艺的可靠性。原花青素的得率为(4.37±0.02)mg/g,与模型预测值比较误差为0.928%,说明该模型能较准确的预测红米原花青素的提取率,响应面法优化得到的提取工艺科学合理。
不同文献报道的红米原花青素含量不同,主要是因为品种和提取方法之间存在差异。Gunaratne[19]研究了八种传统斯里兰卡红米,原花青素含量范围为1.07~2.27mg/g,其中Sudu Heenati红米的原花青素含量2.27mg/g,为目前文献报道的原花青素含量最高的红米。本实验所用的红香米经响应面优化提取后原花青素得率为(4.37±0.02)mg/g,是Sudu Heenati红米的1.925倍。
2.4红米原花青素纯化后的红外光谱分析
红米原花青素经过提取、纯化后的纯度为(85.37±1.5)%,纯度较高,纯化效果较好。

图9 纯化后红米原花青素的红外图谱Fig.9 IR Spectra of proanthocyanidin of Red Rice after purification
不同来源的原花青素结构不同,研究原花青素的红外图谱可以获知其基本组成结构单元,其结构分析主要是在1000~1650 cm-1和700~850 cm-1这2个特征骨架振动波数区域。由图9可知,纯化后的红米原花青素在 3426 cm-1处的单峰是-OH的伸缩振动,1614 cm-1处是C=O的伸缩振动,代表没食子酸酰基的存在[20],1522、1447 cm-1处的峰是芳香环的结构。原花青素纯化物的红外谱图在1520~1540 cm-1处有单峰,证明了红米原花青素是以原花青定为主的聚原花青素。在770~780 cm-1处的单峰773 cm-1,说明含有以(表)儿茶素为主要基础单元的原花青素中的平面构象,而730 cm-1没有吸收峰,说明没有以(表)没食子儿茶素为主要基础单元的原花青素中的平面构象[21]。这说明红米经提取纯化后的产物主要是由(表)儿茶素的结构单元构成的原花青定(procyanidin,PC)。
2.5红米原花青素的抗氧化活性
对不同浓度下红米原花青素与VC清除DPPH自由基的活性作比较,结果如图10。从图中可以看出,红米原花青素纯化液和VC溶液的IC50/DPPH分别为(21.927±1.09)μg/mL和(31.247±0.92)μg/mL,说明在实验浓度范围内红米原花青素清除DPPH自由基能力大于VC。
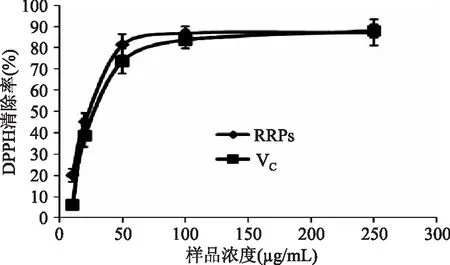
图10 红米原花青素纯化液(RRPs)和VC清除DPPH自由基能力Fig.10 DPPH radical scavenging activity of Red Rice Proanthocyanidins and VC
3 结论
采用响应面法优化了红米原花青素的提取工艺,最佳提取工艺条件为:丙酮浓度76%,温度39℃,料液比1∶25(g/mL),pH5,提取2次,时间40 min,原花青素得率为(4.37±0.02)mg/g,与预测值4.41mg/g相比误差为0.928%。优化后原花青素的得率(4.37±0.02)mg/g,是现有文献报道的红米原花青素含量最高的Sudu Heenati红米[19]的1.925倍。
不同来源的原花青素结构不同,通过红外图谱分析可知,红米原花青素主要是由(表)儿茶素的结构单元构成的原花青定聚合物,其具体结构有待进行更深入的研究。
红米原花青素经过提取纯化后清除DPPH自由基能力强于VC,表明红米原花青素的抗氧化活性较强。
[1]Zhang M W,Guo B J,Zhang R F,et al.Separation,Purification and Identification of Antioxidant Compositions in Black Rice[J].Agricultural Sciences in China,2006,5(6):431-440.
[2]Chung H S,Jin C S.Characterization of antioxidant alkaloids and phenolic acids from anthocyanin-pigmented rice(Oryza sativa cv.Heugjinjubyeo)[J].Food Chemistry,2007,104(4):1670-1677.
[3]Shen Y,Liang J,Peng X,et al.Total phenolics,flavonoids,antioxidant capacity in rice grain and their relations to grain color,size and weight[J].Journal of Cereal Science,2009,49(1):106-111.
[4]Masisi Kabo,Beta Trust,Mohammed H.Moghadasian.Antioxidant properties of diverse cereal grains:A review on in vitro and in vivo studies[J].Food Chemistry,2016,196(1):90-97.
[5]Chen M H,Choi S H,Kozukue N,et al.Growth-inhibitory effects of pigmented rice bran extracts and three red bran fractions against human cancer cells:relationships with composition and antioxidative activities[J].J Agric Food Chem,2012,60(36):9151-9161.
[6]Ahuja U,Ahuja S C,Chaudhary N,et al.Red rices-past,present and future[J].Asian Agri-History,2007,11(4):291-304.
[7]孙明茂,韩龙植,李圭星,等.水稻花色苷含量的遗传研究进展[J].植物遗传资源学报,2006,7(2):239-245.
[8]Nam S H,Sun P C,Mi Y K,et al.Antioxidative activities of bran extracts from twenty one pigmented rice cultivars[J].Food Chemistry,2006,94(4):613-620.
[9]Bagchi D,Bagchi M,Stohs S J,et al.Free radicals and grape seed proanthocyanidin extract:important in human health and diseaseprevention[J].Toxicology,2000,148(2/3):187-197.
[10]Ying W,Sang-Jin C,Song W O,et al.Estimation of daily proanthocyanidin intake and major food sources in the U.S diet[J].Journal of Nutrition,2011,141(3):447-452.
[11]Finocchiaro F,Ferrari B,Gianinetti A.A study of biodiversity of flavonoid content in the rice caryopsis evidencing simultaneous accumulation of anthocyanins and proanthocyanidins in a black-grained genotype[J].Journal of Cereal Science,2010,51(1):28-34.
[12]Prior R L,Fan E,Ji H,et al.Multi-laboratory validation of a standard method for quantifying proanthocyanidins in cranberry powders.[J].Journal of the Science of Food & Agriculture,2010,90(9):1473-8.
[13]Zhou H C,Lin Y M,Wei S D,et al.Structural diversity and antioxidant activity of condensed tannins fractionated from mangosteen pericarp[J].Food Chemistry,2011,129(4):1710-1720.
[14]Kantz K,Singleton V L.Isolation and determination of polymeric polyphenos using sephadex LH-20 and analysis of grape tissre extracts[J].Phytochemistry,1990,41(3):223-228.
[15]赵文恩,陈雷,韩雅珊,等.葡萄皮渣原花色素提取分离的初步研究[J].食品科学,2000,21(12):68-69.
[16]张涛,李超,商学兵.葡萄籽原花青素的纤维素酶辅助提取工艺优化[J].中国食品添加剂,2011,5:82-88.
[17]韩泽梅,李晓波,张玉平,等.树莓种子原花青素的提取分离工艺研究[J].天然产物研究与开发,2006,1:108-111.
[18]赵文杰,敬思群.响应面法回流提取新疆昆仑雪菊原花青素工艺优化[J].食品科技,2013,38(4):214-219.
[19]Gunaratne A,Wu K,Li D,et al.Antioxidant activity and nutritional quality of traditional red-grained rice varieties containing proanthocyanidins[J].Food Chemistry,2013,138(2-3):1153-1161.
[20]Chang S K,Mun S P.Characterization of proanthocyanidin in hot water extract isolated from Pinus radiata bark[J].Wood Science & Technology,2007,41(3):235-247.
[21]Fu C,Yang X,Lai S,et al.Structure,antioxidant andα-amylase inhibitory activities of longan pericarp proanthocyanidins[J].Journal of Functional Foods,2015,14:23-32.
Optimization of extracting proanthocyandins from red rice by response surface methodology
LUO Shun-jing,MA Ye,LIU Cheng-mei*,GONG Er-sheng,LI Qian,ZENG Zi-cong,ZHANG Mei-mei
(State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Response surface methodology was employed to optimize the extraction conditions of proanthocyanidins from red rice grown in Yanshou,Harbin.Based on single experiments,response surface methodology was employed to optimize the extraction conditions of the red rice,the optimum extractive conditions were ascertained as follows:acetone concentration 76%,extraction temperature 39℃,material-to-liquid ratio 1∶25(g/mL),extraction pH5,extraction twice,extraction time 40 min,the yield of proanthocyanidins of this optimized procedure was(4.37±0.02)mg/g,1.925 times than Sudu Heenati red rice of tradition Sri Lanka which was the highest procyanidins content of red rice reported.The result of infrared spectra showed that the proanthocyanidins of the red rice is mainly composed of structure unit of(epi)-catechin consisting of procyanidin polymers.The proanthocyanidins of red rice have stronger scavenging effects to DPPH radicals than VC,suggesting that the red rice reveals better antioxidant activity,and has the potential to be the source of proanthocyanidins.
red rice;proanthocyandins;extraction;purification;antioxidant activity
2015-09-21
罗舜菁(1969-),女,硕士,副教授,研究方向:现代高新技术与食品加工工程,E-mail:luoshunjing@aliyun.com。
刘成梅(1963-),男,博士,研究方向:食品资源利用与开发,E-mail:liuchengmei@aliyun.com。
江西省赣鄱英才555工程领军人才(18000007);国家重点实验室目标导向项目(SKLF-ZZA-201304)。
TS201.2
B
1002-0306(2016)07-0176-06
10.13386/j.issn1002-0306.2016.07.026

