果胶酶提取黑果枸杞花青素的工艺优化
李彩霞,宋 海,焦 杨,高海宁,*
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000;3.河西学院化学化工学院,甘肃张掖 734000)
果胶酶提取黑果枸杞花青素的工艺优化
李彩霞1,2,宋海2,3,焦杨1,高海宁1,2,*
(1.河西学院农业与生物技术学院,甘肃张掖 734000;2.甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000;3.河西学院化学化工学院,甘肃张掖 734000)
研究果胶酶提取黑果枸杞花青素的工艺。在单因素实验的基础上,利用响应曲面法优化果胶酶提取黑果枸杞花青素的工艺条件。结果表明,果胶酶提取黑果枸杞花青素的最佳条件为:酶添加量 70 mg/100 g、酶解温度41℃、酶解时间1.0 h,在此条件下,实验测得黑果枸杞花青素提取率为63.70%,提取量为215.31 mg/100 g鲜果,与实验预测值63.01%相符,且与未加果胶酶样品相比(20.28%),花青素的提取率增加了43.42%,说明响应面优化的酶法提取工艺有利于提高黑果枸杞花青素提取率。
黑果枸杞,果胶酶,花青素,响应面
黑果枸杞(Lycium ruthenicu Murr)为茄科(Solanaceae)枸杞属(Lycium),多年生灌木,分布于西北及西藏等地,是民族医药的常用药材,在藏药中被称为“旁玛”,收载于《四部医典》等藏医药经典著作中,用来治疗心脏病、心热病等疾病[1-2];据文献记载黑果枸杞的果实及根皮可以治疗尿道结石、牙龈出血等疾病[3]。研究表明黑果枸杞含有黄酮、多糖、色素等活性物质,具有调节血糖、血脂及抗氧化功能[4]。黑果枸杞果实成熟后含有丰富的花青素,所含花青素分别是蓝莓、紫薯、葡萄、紫甘蓝的1.75、4.45、10.72、1.91倍[5],是近年来新挖掘的野生资源。研究发现,花青素具有较强的抗氧化活性、可以改善心血管疾病、防止脑神经老化、预防癌症[6-8]等多种生理功能。
目前黑果枸杞主要集中于营养成分和微量元素分析、多糖的提取、叶片的解剖结构等方面的研究[9],部分学者对色素的提取也进行了研究[10-11],但是应用酶解技术提取黑果枸杞中花青素的研究尚未见报道。
基于此,本实验采用果胶酶对黑果枸杞中花青素提取进行研究,通过Box-Behnken实验设计和响应面分析,优化花青素提取最佳工艺条件,旨在为黑果枸杞资源的加工和活性成分的提取提供理论依据。
1 材料与方法
1.1材料与仪器
黑果枸杞鲜果2014年8月采摘于张掖市老寺庙,由河西学院张勇教授鉴定为茄科(Solanceae)枸杞属(Lycium L.)植物黑果枸杞的成熟果实。原料清除叶子、泥土等残留物,冷冻保存。
果胶酶酶活力30000 U/g天津市利华酶制剂技术有限公司;乙醇、氯化钾、盐酸、冰醋酸均为国产分析纯;ABTS(2,2′-朕氮-双(3-乙基苯并噻吡咯林-6-磺酸)购自Sigma公司。
DKB-501数显超级恒温水浴箱扬州市三发电子有限公司;CR22GⅢ高速冷冻离心机 日本日立公司;Sarstorius BT125D电子天平德国;高速组织捣碎匀浆机常州国华电器有限公司;Dr6000紫外可见光分光光度计美国哈希;pH510酸度计安莱立斯仪器科技(上海)有限公司;100、1000 μL精密移液枪日本Nichiryo公司;DL-820E智能超声波清洗器上海之信仪器有限公司。
1.2实验方法
1.2.1黑果枸杞果汁的制备及总花青素的提取将冷冻的黑果枸杞果实在4℃环境下解冻,置于高速组织捣碎匀浆机中匀浆,充分混匀后将果浆分装冷藏备用。准确称取1 g果浆于150 mL的三角瓶中,加入体积分数80%的酸性乙醇(含0.1% HCl)20 mL,超声(800 W,室温)提取至原料为无色[16],于4000 r/min离心20 min,上清液用酸性乙醇定容至100 mL,用于总花青素含量测定。
1.2.2花青素提取率的计算将酶解液稀释100倍,准确吸取稀释液1 mL,分别加入pH为1.0、4.5的缓冲溶液2 mL,分别测定两种pH色素液在530 nm和700 nm波长处的吸光度,用pH示差法[17]计算色素液在pH为1.0、4.5,波长分别为530 nm和700 nm处吸光度的差值A,按以下公式计算花青素含量及花青素提取率:
A=(A530 nmpH1.0-A700 nmpH1.0)-(A530 nmpH4.5-A700 nmpH4.5)
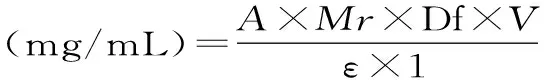
式中:ε为矢车菊素-3-葡萄糖苷的摩尔消光系数26900 L/mol.cm;Mr为矢车菊素-3-葡萄糖苷的相对分子质量449.2;Df为稀释倍数,V为离心后酶解液的体积。花青素的提取率为:
花青素提取率(%)=水解果汁花青素含量/浆果中花青素的含量×100
虚拟现实VR广告是一种创新的广告型态,主要分为各式加载画面广告与应用内植入性广告,形式可以是360度全景视频广告、剧院级大屏幕视频广告、3D模型广告、应用推荐以及综合上述形式的混合型广告。相比于传统的广告,虚拟现实VR广告能够让用户拥有身临其境的沉浸式体验,VR体验内植入不干扰用户的广告形式大大提高了广告效果。可以说,虚拟现实VR广告正在逐步的改变我们传统的广告投放模式,虽然虚拟现实VR广告还没有普及,但是其前景是十分广阔的。
1.2.3单因素实验
1.2.3.1酶添加量对黑果枸杞花青素提取率的影响准确称取黑果枸杞果浆100 g于150 mL的三角瓶中,分别加入30、50、70、90、100 mg 的酶制剂,用保鲜膜封口,共5组,混匀后于50℃酶解2 h,4000 r/min离心20 min,取上清液量其体积,按1.2.2的方法测定花青素的含量,并计算花青素的提取率,确定最适酶添加量。
1.2.3.2酶解时间对黑果枸杞花青素提取率的影响准确称取黑果枸杞果浆100 g于150 mL的三角瓶中,分别加入70 mg的酶制剂,混匀,用保鲜膜封口,共5组,于50℃下分别酶解0.5、1、2、3、4、5h后冷却,4000 r/min离心20 min,取上清液量其体积,按1.2.2的方法测定酶解液中花青素的含量,并计算花青素的提取率,确定最适酶解时间。
1.2.3.3酶解温度对黑果枸杞花青素提取率的影响准确称取黑果枸杞果浆100 g于150 mL的三角瓶中,分别加入70 mg的酶制剂,混合均匀,用保鲜膜封口,共5组,分别置于20、30、40、50、60℃的恒温水浴锅中酶解1 h后冷却,4000 r/min离心20 min,取上清液量其体积,按1.2.2的方法测定酶解液中花青素的含量,并计算花青素的提取率,确定最适酶解温度。
1.2.4响应曲面法分析在单因素实验的基础上,运用Design-Expert8.0软件,根据Box-Behnken中心组合实验设计原理,以酶添加量、酶解时间、酶解温度作为考察因素,分别以X1、X2、X3表示,并以+1、0、-1进行编码,因素编码及水平见表1。

表1 Box-Behnken实验因素水平表
1.2.5优化前后黑果枸杞出汁率、花青素提取率及酶解液的抗氧化力比较对优化前后黑果枸杞的出汁率、花青素提取率及酶解液对ABTS自由基的清除能力进行比较,每个处理重复5次。出汁率根据文献[18]计算,ABTS自由基配制及清除能力参照文献[19]稍有修改,提取物对自由基清除能力测定,准确吸取稀释100倍黑果枸杞色素液0.1 mL,分别加入1.2 mL的ABTS自由基工作液,然后加入2.7 mL体积分数为的80%的乙醇溶液,准确反应6 min,在734 nm测定吸光度Ai,样液对照组以等体积80%的乙醇代替ABTS溶液(Aj),对照组以等体积的酸性乙醇代替样品溶液(A0),并以0.1 mL酸性乙醇与2.9 mL的80%乙醇混合液作空白调零,清除率按下式计算。

1.2.6数据处理与统计采用Excel2003软件进行数据处理,运用Origin9.0作图,采用Design-Expert8.0软件进行实验设计和统计分析。图中数据均为重复测定3次的平均值加标准误差;显著性界值p<0.01为差异极显著,p<0.05为差异显著。
2 结果与分析
2.1黑果枸杞中总花青素的含量
通过pH示差法测定了黑果枸杞中总花青素,其结果为338 mg/100 g鲜果,测定结果在文献[5]报道范围内,并高于紫甘蓝(82.5 mg/100 g鲜重)[20]、不同成熟葡萄(137~187 mg/100 g鲜重)[21]、树莓(30~60 mg/100 g)[22]。由此可见,各果蔬花青素差异较大,相比较黑果枸杞花青素类物质较高。
2.2果胶酶添加量对黑果枸杞花青素提取率的影响
由图1可知,黑果枸杞花青素的提取率随着果胶酶添加量的增加而增加,当果胶酶添加量达到70 mg/100 g(100 g果浆添加70 mg的果胶酶)时,花青素的提取率达到最大,随着果胶酶添加量的进一步增加,花青素的提取率降低。因为当酶量低时,细胞壁及细胞间的果胶物质不能被有效降解,细胞内含物质不能完全释放,导致提取率低,当酶适量时,酶和底物充分作用,花青素从细胞中被释放出来,提取率增高[23],如果继续增加酶用量,花青素提取率反而降低。从酶解的效果和节约成本综合考虑,确定果胶酶添加量为70 mg/100 g比较适宜。
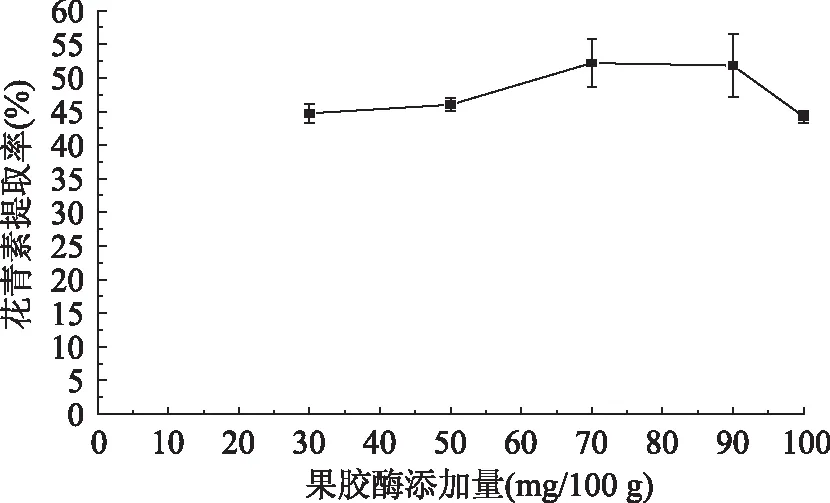
图1 酶添加量对花青素提取率的影响Fig.1 Effect of the pectinase adding amount on the anthocyanin extraction rate
2.3酶解时间对黑果枸杞花青素提取率的影响
由图2可知,随着酶解时间的延长,酶和底物的作用越充分,花青素的提取率大大提高,当继续延长酶解时间,底物浓度不断降低或者产物的积累对酶的活性有反馈抑制作用,酶促反应降低,使花青素的提取率明显降低;其次,花青素含有酚羟基在空气中不稳定,容易氧化,继续延长酶解时间,会使得果汁中花青素的提取率含量降低,这样不仅会增加生产成本,而且造成营养成分的损失[24]。因此,酶解时间不宜过长,在1~2 h范围内,花青素的提取率较高。
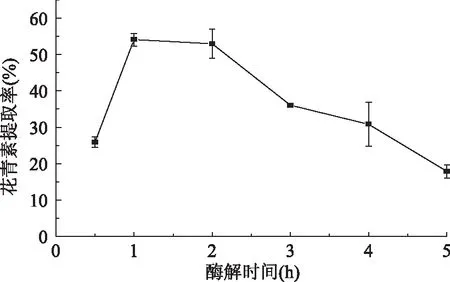
图2 酶解时间对花青素提取率的影响Fig.2 Effect of hydrolysis time on the anthocyanin extraction rate
2.4酶解温度对黑果枸杞花青素提取率的影响
固定酶添加量和酶解时间,温度对黑果枸杞花青素提取率的影响如图3,由图3可知,随着酶解温度的升高,黑果枸杞花青素提取率逐渐增加,40℃时达到最高,温度继续升高,花青素提取率反而下降。这是因为酶促反应,在最适温度下,酶的反应活性最高,温度过高或过低,果胶酶就会变性或者钝化,导致酶活力下降,从而使花青素的提取率降低,其次花青素的稳定性与温度有关,随着温度的升高,花青素的保存率逐渐降低[25]。因此,酶解温度不宜太高以40℃较适宜。

图3 酶解温度对花青素提取率的影响Fig.3 Effect of hydrolysis temperature on the anthocyanin extraction rate
2.5实验结果与模型建立
根据Box-Behnken 实验方案进行三因素三水平的实验,结果见表2。采用Design-Expert8.0软件对表2结果进行二次多元回归拟合,得到以花青素提取率Y对果胶酶添加量(X1)、酶解时间(X2)和酶解温度(X3)的二次多项回归方程:
Y=62.0443+0.581124651X1+3.590648687X2+2.282225964X3-2.730652486X1X2+1.04639X1X3+2.367855112X2X3-13.85893X12-11.78325221X22-9.320402904X32。
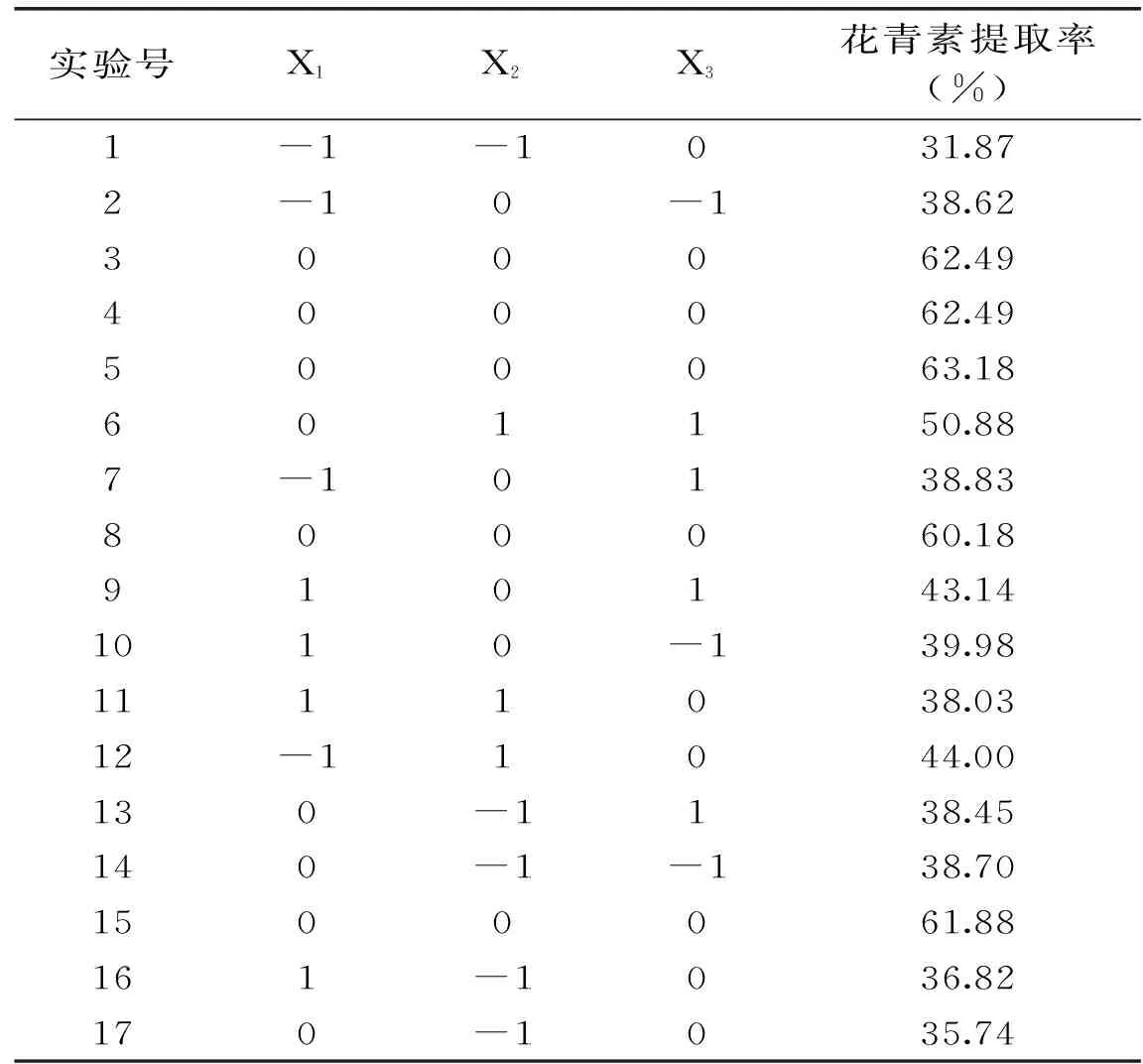
表2 响应面实验设计及结果
从表3可以看出模型是显著p<0.01,失拟项p=0.0608>0.05不显著,模型的决定系数为R2=98.63%,说明该回归模型的拟合情况较好,误差小,因此可用该回归方程代替实验真实点对实验结果进行预测和分析。对实验结果进行方差分析,结果见表 3,由表3的各项p值可知,酶解时间的一次项、酶的添加量、酶解时间、酶解温度的二次项对花青素提取率的影响差异极显著(p<0.01);酶解温度的一次项、酶添加量和酶解时间以及酶解时间和酶解温度的交互项对花青素提取率的影响较显著(p<0.05),由提取率的回归系数一次项的检验值F可知,各因素对花青素提取率的影响顺序为:酶解时间(X2)>酶解温度(X3)>酶添加量(X1)。
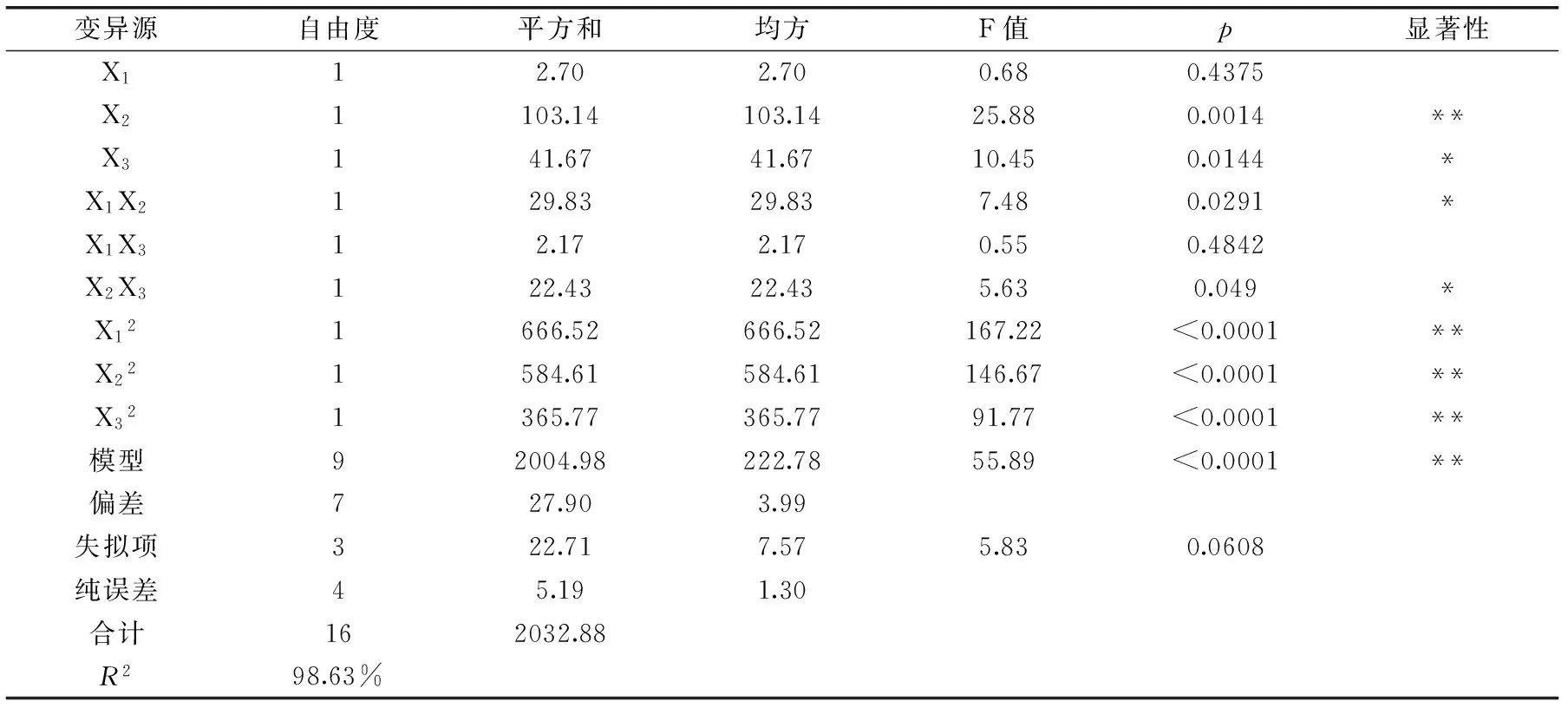
表3 二次响应回归模型方差分析
注:**表示差异极显著p<0.01,*表示p<0.05差异显著。
2.6响应面图分析
由图4A~图4C可知,花青素提取率与对应的因素酶添加量(X1)、酶解时间(X2)、酶解温度(X3)构成的一个三维空间的曲面图,响应面曲面图和等高线的形状可以直观地反映各因素对响应值的影响,曲线越陡峭,等高线形状趋向椭圆且椭圆轴线与坐标轴的曲线越大,则交互作用越显著[26]。当酶解温度为40℃时,酶添加量和酶解时间对黑果枸杞果汁中花青素提取率的交互效应的响应面和等高线图 见图4A,黑果枸杞花青素的提取受酶解时间的影响较大,并随着酶解时间的延长花青素的提取率呈先上升后下降的趋势,变化曲度较大。从等高线可以看出,酶添加量和酶解时间交互作用显著,等高线趋向椭圆形且沿酶解时间轴向较酶添加量轴向密集,说明酶解时间对花青素的提取影响较大,当酶的添加量在70 mg/100 g、酶解时间1.1 h附近时,花青素的提取率较大。
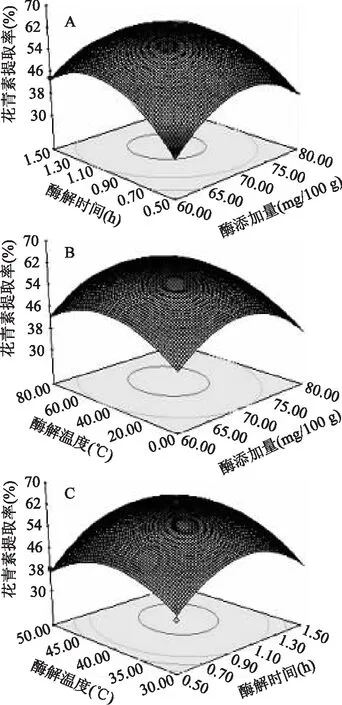
图4 各因素间交互作用的响应面图Fig.4 Response surface plots for the effects of cross-interactions among different factors
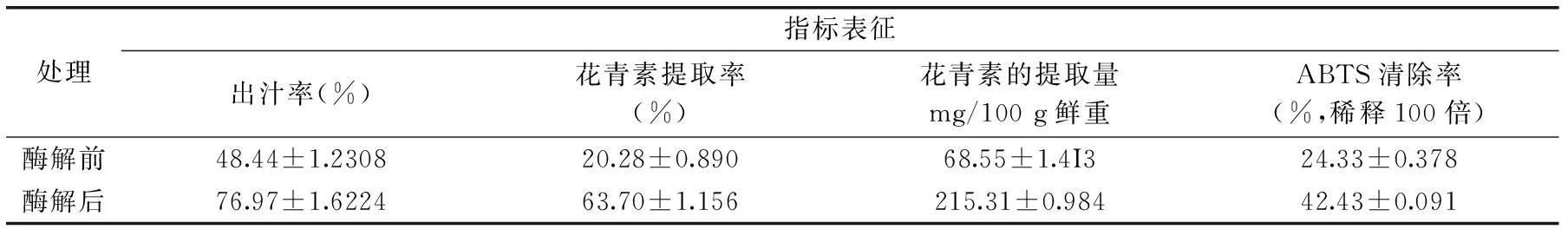
表4 优化前后黑果枸杞出汁率、花青素提取率及抗氧化力比较(n=5)
图4B表明,当酶解时间为1 h时,随着酶的添加量和酶解温度增加,黑果枸杞中花青素的提取率呈现先增后降的趋势,且变化较平缓,从等高线看出,酶的添加量和酶解温度的等高线呈圆形,两者交互效应不显著,当酶解温度40℃、酶添加量在70 mg/100 g附近时,花青素的提取率较大。
图4C可以看出,当酶的添加量为 70 mg/100 g时,花青素的提取率随酶解温度和酶解时间都呈现先增后降的趋势,说明酶解温度过高或过低、酶解时间延长或过短都不利于花青素的提取。两者交互作用的等高线趋向椭圆形,说明酶解温度和酶解时间交互作用显著,等高线沿酶解时间轴向较酶解温度轴向曲度较大,说明酶解时间比酶解温度对黑果枸杞花青素提取率的影响大,在酶解温度40℃、酶解时间1 h附近时,花青素的提取率相对较高。
2.7酶解法提取黑果枸杞中花青素响应面实验模型的验证
将数据在模型参数范围进行优化,求出酶法提取花青素的最佳工艺参数:果胶酶的添加量为70.09 mg/100 g,酶解时间 1.08 h,酶解温度41.43℃,预测花青素提取率为63.01%。为了各参数的可操作性,将最佳工艺参数修正为酶的添加量70 mg/100 g,酶解时间 1.0 h,酶解温度41℃,在这种工艺条件下花青素提取率为63.70%,与模型预测值基本符合。
2.8优化前后黑果枸杞出汁率、花青素提取率及酶解液对ABTS自由基的清除能力
对酶解前后黑果枸杞的出汁率、花青素提取率及对ABTS自由基清除能力进行比较,结果见表4。
从表4可以看出,优化后花青素平均提取率为63.70%,提取量为215.31 mg/100 g鲜重、出汁率和酶解液(稀释100倍)对ABTS的清除作用在数值上分别增加了28.35%和18.18%,由此说明果胶酶可以降低果汁的粘度,提高产品的出汁率,增加活性成分的溶出。
3 结论
本实验采用Design-Expert8.0软件对果胶酶提取黑果枸杞中花青素的工艺进行了优化,建立了多元回归模型。根据模型求出酶法提取花青素的最佳工艺条件:果胶酶添加量为 70 mg/100 g,酶解时间为 1 h,酶解温度41℃,在该工艺条件下花青素的平均提取率为63.70%,平均提取量为215.31 mg/100 g鲜重,相比未处理的样品,花青素的提取率增加2.14倍。黑果枸杞花青素的提取前人也做了大量的研究,但由于产地、采样时间及采用的材料干鲜果不同,结果差异较大,鲜果色素在160~625 mg/100 g范围内[5],干果在821~3146 mg/100 g变幅范围[27]。本研究通过响应面酶法优化提取率为63.70%,提取量为215.21 mg/100 g,该方法样品直接酶解,条件温和,能耗少,提取率高,说明响应面酶法提取黑果枸杞花青素是有效可行的。
仇小妹等[18]研究了复合酶酶解对蓝莓出汁率及总抗氧化能力的影响,结果发现酶解后活性成分和抗氧化均高于未加酶的果汁。本研究比较了酶解后黑果枸杞的出汁率及酶解液对ABTS自由基的清除作用,结果表明出汁率和酶解液对ABTS自由基清除作用均高于酶解前,因为黑果枸杞的花青素主要分布在果皮和液泡中,果胶酶可以水解细胞壁和细胞间隙中的果胶,使细胞破裂,促使活性成分释放[28],降低果汁粘度,提高出汁率和营养成分,进而提高抗氧化活性。该研究对于黑果枸杞的加工及活性成分的提取奠定了基础。
[1]甘青梅.浅述藏药的研究[J].中草药,2001,32(4):371-373.
[2]Peng qiqng,Lv pengxiao,Li yu,et al.Isolation and structural characterization of the polysaccharide LRGP1 from Lycium ruthenicum[J].Carbohydrate Polymers,2012,90(1):95-101.
[3]刘永民.维吾尔药志(下)[M].乌鲁木齐:新疆科技卫生出版社,1999:478-485.
[4]李进,翟伟菁,张素军,等.黑果枸杞色素的抗氧化活性研究[J].中国中药杂志,2006,31(14):1179-1183
[5]闫亚美,代彦满,冉林武,等.黑果枸杞与5种果蔬中花色苷组成及体外抗氧化活性比较[J].食品工业科技,2014,35(16):133-136.
[6]Wangl S,Kuoc T,Chos J.Black raspberry-derived anthocyanins demethylate tumor suppressor genes through theinhibition of DNMT 1 and DNMT3B in colon cancer cells[J].Nutrition and Cancer,2013,65(1):118-125.
[7]Liu Yi xiang,Zhang Di,Wu Yong pei,et al.Stability and absorption of anthocyanins from blueberries subjected to a simulated digestion process[J].Food Composition and Analysis,2014,65(4):440-448.
[8]Hu Na,Zheng Jie,Li Wencong,et al.Isolation,Stability,and antioxidant activity of Anthocyanins from Lycium ruthenicum Murray and Nitraria Tangutorum Bobr of Qinghai-Tibetan Plateau[J].Separation Science and Technology,2014,49(18):2897-2906.
[9]姜霞.黑果枸杞耐盐机理的相关研究[D].陕西:西北农林科技大,2012.
[10]Zheng Jie,Ding Chen xu,Wang Liang sheng,et al.Anthocyanins composition and antioxidant activity of wild Lycium ruthenicum Murr.from Qinghai-Tibet Plateau[J].Food Chemistry,2011,126(3):859-865.
[11]白红进,汪河滨,罗锋.黑果枸杞色素的提取及清除DPPH自由基作用的研究[J].西北农业学报,2007,16(2):190-192.
[12]王卫东,许时婴.黑莓澄清汁的酶解工艺.食品与发酵工业,2006,32(10):156-159.
[13]William Tchabo,Yongkun Ma,Felix N.Engmann,et al.Ultrasound-assisted enzymatic extraction(UAEE)of phytochemical compounds from mulberry(Morus nigra)must and optimization study using response surface methodology[J].Industrial Crops and Products,2015,63:214-225.
[14]刘刚,孟宪军,李斌,等.响应面法优化酶法提取蓝莓果汁工艺条件[J].食品科学,2013,34(14):70-71.
[15]张慢,潘丽军,姜绍通,等.响应面法优化酶-超声波辅助同步提取紫薯花青素工艺[J].食品科学,2014,35(10):23-28.
[16]陈晨,赵晓辉,文怀秀,等.黑果枸杞的抗氧化成分分析及抗氧化能力测定[J].中国医院药学杂志,2011,31(15):1305-1306.
[17]闫亚美,冉林武,曹有龙,等.黑果枸杞花色苷含量测定方法研究[J].食品工业,2012,33(6):145-147.
[18]仇小妹,王英,董明盛,等.复合酶酶解对蓝莓出汁率及总抗氧化能力的影响[J].食品科学,2013,34(24):25-29.
[19]李彩霞,高海宁,焦扬,等.“黑美人”土豆黄酮提取及抗氧化活性[J].食品科学,2013,34(4):88-93.
[20]黄慧英,武国星,郑立军,等.正交实验优化紫叶甘蓝型油菜花色苷提取工艺[J].北方园艺,2015,(21):125-128.
[21]郭红辉,凌文华.花色苷类植物化学物对心血管系统的保护作用[J].生命科学,2015,27(4):495-503.
[23]卢锋波,刘桂玲,王烁,等.响应面法优化果胶酶酶解提取黑莓花色苷的工艺参数[J].食品科学,2010,31(16):11-15.
[24]黄晓杰,田雪瑛,郭彦玲,等.桑葚果浆中花色苷及其色泽的热降解动力学[J].食品与发酵工业,2014,40(4):51-55.
[25]李颖畅,马弛,吕艳芳,等.树莓花色苷稳定性的研究[J].食品工业科技,2014,35(10):205-208.
[26]范金波,蔡茜彤,冯叙桥,等.超声波辅助提取牛蒡根多酚工艺参数优化[J].食品与发酵工业,2014,40(11):247-252.
[27]闫亚美,戴国礼 冉林武,等.不同产地野生黑果枸杞资源果实多酚组成分析[J].中国农业科学 2014,47(22):4540-4550.
[28]李亚辉,马艳弘,黄开红,等.超声波辅助酶法提取黑莓酒渣中花色苷工艺优化及其生物活性[J].食品科学,2015,36(6):63-68.
Optimization of extraction technology of anthocyanin from Lycium ruthenicum by pectinase
LI Cai-xia1,2,SONG Hai2,3,JIAO Yang1,GAO Hai-ning1,2,*
(1.College of Agriculture and Biotechnology,Hexi University,Zhangye 734000,China; 2.Key Laboratory of Hexi Corridor Resources Utilization of Gansu Universities,Hexi University,Zhangye 734000,China; 3.College of Chemistry and Chemical Engineering,Hexi University,Zhangye 734000,China)
To optimize the extraction technology of anthocyanin from Lycium ruthenicum by pectinases.The pectinase extraction techeques of anthocyanin by response surface methodology were studied on the basis of single factor test.The result showed that the optimal extraction conditions were as follows:the pectinase adding amount 70 mg/100 g(mass fraction),hydrolysis temperature 41℃,and ahydrolysis time 1 h.Under the optimal extraction conditions,the extraction rate of anthocyanin from Lycium ruthenicum was 63.70% and the extraction amount was 215.31 mg/100 g,consistent with the predicted 63.01%,which was increased by 43.42%,compared with the non-using pectinase samples.The optimal extraction conditions by response surface enzyme method were benefit to improve the anthocyanins extraction rate from Lycium ruthenicum.
Lycium ruthenicu;pectinase;anthocyanins;response surface methodology
2015-09-07
李彩霞(1967-),女,学士,高级实验师,研究方向:天然产物开发与利用,E-mail:pengli131@163.com。
高海宁(1973-),男,硕士,副教授,研究方向:植物资源与环境,E-mail:gaohn2004@163.com。
国家中医药管理局2012年中医药行业科研专项(201207002);甘肃省高校河西走廊特色资源利用省级重点实验室科研资助项目(XZ12-2)。
TS255.1
B
1002-0306(2016)07-0204-06
10.13386/j.issn1002-0306.2016.07.031

