白骨壤抗菌蛋白对香蕉炭疽病菌的抑制作用
周 桂,谢贻冬,赵 钦,吴丹丹,陈欢儿,江 蕾,武 波
(1.广西民族大学海洋与生物技术学院/广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族师范学院,广西崇左 532200)
白骨壤抗菌蛋白对香蕉炭疽病菌的抑制作用
周桂1,谢贻冬1,赵钦1,吴丹丹1,陈欢儿1,江蕾1,武波2,*
(1.广西民族大学海洋与生物技术学院/广西高校微生物与植物资源利用重点实验室,广西南宁 530006;2.广西民族师范学院,广西崇左 532200)
本文以红树植物白骨壤叶为材料,以硫酸铵分级沉淀分离不同的抗菌蛋白,采用抑制菌丝生长速率和孢子萌发的方法测定白骨壤抗菌蛋白对香蕉炭疽病菌的抗菌活性,显微观察分析抗菌作用方式机理,进行白骨壤抗菌蛋白对感病香蕉的贮藏防病实验。结果表明:35%、75%、85%硫酸铵沉淀分离的抗菌蛋白(抗菌蛋白Ⅰ、Ⅱ、Ⅲ)具有明显抗菌活性,其抑制菌丝生长的半效应浓度(EC50)分别为:7.93±0.29、6.80±0.28、16.21±0.13 μg/mL。100 μg/mL的抗菌蛋白(Ⅰ、Ⅱ、Ⅲ)溶液对香蕉炭疽分生孢子的萌发抑制率分别达到95.5%±0.01%、97.5%±0.03%、92.5%±0.01%。显微观察发现三种抗菌蛋白处理的菌丝分别出现了扭曲、断裂、畸形以及原生质外渗现象。经抗菌蛋白处理后的采后感病香蕉果实具有明显降低发病率的效果。抗菌蛋白Ⅰ、Ⅱ、Ⅲ对香蕉炭疽病的防治效果分别达到74.48%±0.68%、77.24%±0.53%、75.87%±0.24%。
白骨壤,抗菌蛋白,香蕉炭疽病,抗菌活性,抗菌机理
香蕉是热带和亚热带地区普遍种植食用的水果,其味香,并富含钾元素,有“南国四大果品之一”之称[1-2]。香蕉炭疽病(Calletotrichum musae)是危害香蕉生产最严重的病菌之一[3],能使香蕉叶变黄,果实变黑、腐烂。因炭疽病菌的浸染具有潜伏性,使得采后香蕉在运输期间的发病最为严重,造成的病害是世界性的[4-5]。采取化学手段对香蕉炭疽病进行控制容易造成农药残留超标和环境污染,且长期大量使用化学药物易使病菌产生耐药性。所以,从自然界中寻找高效、无毒、环保的植物天然抑菌成分,用于果蔬的炭疽病害防治,越来越受到人们的重视[6-11]。
植物抗菌蛋白(Antimicrobial protein)是植物生理反应中一种重要的免疫分子,存在于植物各器官和组织中[12]。这些蛋白在一级序列的基础上可被分为转脂蛋白、硫堇、植物防御素、Hevein和Knottin型蛋白家族[13]。他们能够有效地抑制许多病原细菌和真菌的生长,已有用于肿瘤治疗和病菌感染治疗及农作物真菌病害防治的研究报道[14-19]。
白骨壤(Avicenniamarina)是马鞭草科红树植物,生长于高盐度的海岸潮间带[20],具有红树先锋树种称号。作为广西北部湾的民间传统药食同源植物,白骨壤具有抗癌、收敛止血、敛肺止咳、涩肠止泻等功效[21],常用于医治脓肿、出血、腹泻、蛇虫咬伤、溃疡、疟疾等疾病。但有关白骨壤抗菌蛋白的研究没见报道。本文以白骨壤叶为材料,筛选研究不同的蛋白成分对香蕉炭疽病菌的抗菌活性,为海岸潮间带植物用于果蔬病害的绿色防治提供理论与实践基础。
1 材料与方法
1.1材料与仪器
白骨壤叶采自广西北海红树林生态自然保护区,并于本实验室-20 ℃冰箱冻存。供试香蕉炭疽病菌(Calletotrichum musae)由广西高校微生物与植物资源利用重点实验室分离和保存。
供试培养基:固体PDA培养基(土豆200.00 g,葡萄糖20.00 g,琼脂20.00 g,水1000 mL,pH7),液体PDA培养基:(土豆200.00 g,葡萄糖20.00 g,水1000 mL,pH7)。
供试香蕉品种为成熟度和物理状况基本一致的西贡蕉。
TU-1901双光束紫外可见分光光度计北京普析通用仪器有限责任公司;HeraeusTMMultifugeTMX1冷冻高速离心机美国Thermo公司;BX43荧光倒置显微镜日本Olympus公司;HZ250LBG恒温摇床金坛瑞华仪器有限公司;HPS-250生化培养箱哈尔滨东明医疗仪器有限公司;BYC-310低温冷藏柜山东博科生物产业有限公司;超低温冰箱美国NUAIRE-6382E;HV-110高压灭菌锅日本Hirayama;Smart Spec TM plus核酸蛋白测定仪美国伯乐Bio-Rad;SW-CJ-2F超净工作台上海跃进医疗器械有限公司。
1.2白骨壤抗菌蛋白的制备与浓度测定
取白骨壤鲜叶100 g于4 ℃低温研匀浆,加入10倍体积的Tris-HCl提取缓冲液(pH9)4 ℃提取48 h,分别用35%、45%、55%、65%、75%、85%的硫酸铵进行沉淀,4 ℃ 12000 r/min离心30 min收集沉淀,并溶解于0.01 mol/L pH7的PBS缓冲液中,用3 ku管超滤除盐,即为抗菌蛋白提取液。采用Bradford法测抗菌蛋白在595 nm处的OD值,利用标准曲线换算得到浓度。将制备的蛋白液用0.22 μm的除菌过滤器在无菌环境中过滤,于4 ℃冰箱保存备用。
1.3供试病菌的活化
配制PDA固体培养基,于高压灭菌锅中121 ℃灭菌30 min,备用。在超净工作台中将供试菌种试管斜面接种PDA培养基中,于28 ℃恒温培养箱培养4 d备用。
1.4白骨壤抗菌蛋白抗香蕉炭疽病菌的活性检测
1.4.1抗菌蛋白活性筛选用滤纸片扩散法[22]进行抗菌蛋白的活性筛选,无菌条件下用无菌0.01 mol/L pH7的PBS分别将不同饱和度硫酸铵沉淀制备的蛋白稀释成40 μg/mL的浓度,再取20 μL涂布于直径9 mm的灭菌滤纸片上,冷冻干燥后备用。
在无菌环境下,用打孔器在靶菌落边沿取直径7 mm的菌饼,接种到固体PDA培养基中,在离菌饼15 mm处贴上涂抹了蛋白液的滤纸片,每个处理设3个重复,放入28 ℃恒温培养箱中培养4 d,观察抑菌圈出现的情况。
1.4.2抗菌蛋白抑制菌丝生长的毒力检测选择有抗菌活性的抗菌蛋白,在无菌条件下加入到PDA培养基中,分别配制成40、30、20、10、5 μg/mL的含蛋白培养基。将7 mm直径的菌饼接种到含抗菌蛋白的培养基中央,以PBS作为对照,于28 ℃恒温培养箱培养4 d,每个处理设3个重复。十字交叉法[23]测菌落的直径,计算各浓度蛋白的抑菌率。并以蛋白浓度的对数值为自变量X,以抑菌率的机率值Y为因变量,应用SPSS软件计算出蛋白抑制菌丝生长的毒力回归方程及其半效应浓度EC50。
抑菌率(%)=对照菌落净生长直径-处理菌落净生长直径/对照菌落净生长直径×100
1.4.3抗菌蛋白对病菌分生孢子萌发的抑制活性检测在无菌条件下,用100 μg/mL抗菌蛋白液配制香蕉炭疽病菌的孢子悬液(浓度为106个/mL),用载玻片悬滴法[24]在28 ℃恒温培养箱中培养48 h,以PBS为对照,用血球计数法观察分生孢子萌发情况,计算萌发抑制率。
萌发抑制率(%)=对照孢子萌发率-处理孢子萌发率/对照孢子萌发率×100
1.4.4抗菌蛋白对液体培养菌丝生长的抑制作用配制PDA液体培养基,经121 ℃灭菌30 min后,在无菌条件下加入抗菌蛋白液,配制成浓度为10 μg/mL的含抗菌蛋白培养基,并接种香蕉炭疽病菌的孢子悬液5 μL(浓度为106个/mL),以PBS为对照,于28 ℃恒温摇床培养4 d,观察培养液中菌丝球的生长情况,并通过镜检对其抑菌机理进行初步判断。
1.5抗菌蛋白防治感病香蕉炭疽病菌的效果测定
将入选的香蕉果实表面消毒、洗净、晾干,涂抹上100 μg/mL的抗菌蛋白液,自然晾干后接种香蕉炭疽病菌孢子悬液100 μL(浓度为106个/mL),以PBS为对照,28 ℃,95%的湿度条件下观察并统计香蕉发病率和防治效果。每30根香蕉果实为一个处理,每个处理重复3次,储藏一周后统计各处理的发病率、病情指数和防治效果。

表2 三种抗菌蛋白对菌丝生长的抑制作用
注:表中字母不同表示在5%水平上的差异显著,表3、表4同。
香蕉炭疽病情指数的分级标准:0级:无病害;1级:果面有少许病斑,病斑面积占果面积约1/16;2级:较多病斑,病斑面积占果面积的1/8;3级:病斑面积占果面积约1/4,或病斑在基部1/2内的主脉上;4级:病斑面积占果面积约1/2,或病斑在基部;5级:病斑面积占果面积约3/4,果体松软腐烂,果柄易折断。
病情指数=∑(各级病果数×相对级数)/处理总果数×5×100
防治效果(%)=对照病情指数-处理病情指数/对照病情指数×100
1.6数据统计分析
所有相关数据均重复测定3次,取平均值,运用origin9.0和SPSS22.0软件对数据进行统计分析,并采用邓肯氏新复极差进行差异显著性检验。
2 结果与分析
2.1抗菌蛋白的筛选
以不同饱和度的硫酸铵沉淀分离,并经过超滤透析的蛋白,用滤纸片扩散法检测,分别表现出不同程度的抑菌活性(表1),其中35%、75%、85%(NH4)2SO4沉淀析出的蛋白具有显著的抑菌活性,而45%、55%、65%(NH4)2SO4沉淀析出的蛋白没有表现出显著(p<0.05)的抑菌活性,表明不同饱和度的(NH4)2SO4沉淀析出的蛋白的抑菌活性存在显著的差异。故选择35%、75%、85%(NH4)2SO4沉淀析出制备的蛋白作为进行抑菌活性进一步研究对象。
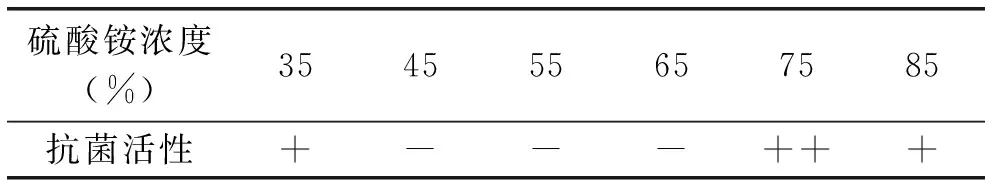
表1 抗菌蛋白活性筛选
注:++,+和-分别表示抑菌圈极显著、显著、不显著。
2.2三种抗菌蛋白对固体培养菌丝生长的抑制作用
35%、75%、85%硫酸铵沉淀析出制备的三种抗菌蛋白(Ⅰ、Ⅱ、Ⅲ)对香蕉炭疽病菌的菌丝生长均具有显著的抑制作用(表2)。随着培养基中抗菌蛋白浓度的增加,炭疽病菌的菌落直径逐渐减小,抑菌率逐渐增加,三种抗菌蛋白的抑菌活性均表现出浓度效应。
抗菌蛋白Ⅰ与Ⅱ的EC50无明显差别(p>0.05),而抗菌蛋白Ⅲ的EC50则明显(p<0.05)高于抗菌蛋白Ⅰ与Ⅱ。表明抗菌蛋白Ⅰ与Ⅱ抑制菌丝生长的毒力相对抗菌蛋白Ⅲ强。
2.3抗菌蛋白对孢子萌发的抑制作用
100 μg/mL白骨壤抗菌蛋白对香蕉炭疽病菌孢子萌发具有显著(p<0.05)的抑制作用,其中抗菌蛋白Ⅰ、Ⅱ、Ⅲ对分生孢子的萌发抑制率分别达到95.5%±0.01%、97.5%±0.03%,92.5%±0.01%。
由此可见三种白骨壤抗菌蛋白不仅对香蕉炭疽病菌的菌丝有显著的抑制作用,并且对孢子的萌发也有显著的抑制作用。
2.4抗菌蛋白对液体培养的香蕉炭疽病菌的抑制作用
由图1可以看出,与对照相比(图1a),在PDA液体培养基中分别添加三种抗菌蛋白(Ⅰ、Ⅱ、Ⅲ)摇床培养4 d后没有产生菌丝球,且液体变浑浊,在液面上方瓶壁出现挂壁菌膜。而在PBS对照组中产生较多的菌丝球,且培养基仍为澄清的黄色透明液体,瓶壁上无挂壁菌膜出现。

表3 三种抗菌蛋白对孢子萌发的抑制作用

图1 抗菌蛋白对液体培养的香蕉炭疽病菌抑制作用Fig.1 Inhibition of antimicrobial proteins against banana anthrax in liquid culture注:a:对照,b、c、d分别为抗菌蛋白Ⅰ、Ⅱ、Ⅲ处理,图2~图4同。
对培养液的镜检结果进一步确定了抗菌蛋白处理引起了菌丝断裂和变形现象(图2)。PBS对照组中取出菌丝球后的培养液在显微镜下观察到少量的分散态正常菌丝。抗菌蛋白Ⅰ处理的培养液在镜下观察到一些不规则的细胞碎片,抗菌蛋白Ⅱ处理的培养液在镜下观察到不但出现细胞碎片,而且有大量细小且断裂的畸形菌丝,抗菌蛋白Ⅲ处理的培养液在镜下也出现许多细胞碎片,由此可进一步确定香蕉炭疽病菌在抗菌蛋白的作用下发生了菌丝断裂和变形现象。

图2 抗菌蛋白处理菌液镜检图Fig.2 The microscopic examination graphof the fungal liquid by antimicrobialprotein treatment
通过对挂壁菌膜的镜检,发现3种抗菌蛋白抗香蕉炭疽病菌的作用方式有所不同(图3)。抗菌蛋白Ⅰ处理的菌膜中菌丝呈现出扭曲变形,并产生少量棕黄色代谢产物。抗菌蛋白Ⅱ处理的菌膜中的菌丝出现严重的扭曲断裂、肿胀状态,且产生棕黄色的代谢物使颜色变黄,抗菌蛋白Ⅲ处理的菌膜中菌丝呈干瘪扭曲形态。

图3 抗菌蛋白处理后菌丝形态变化Fig.3 Morphological changes of myceliumafter treatment with antimicrobial proteins
由此可见,三种不同的抗菌蛋白对香蕉炭疽病菌的形态改变有着不同的作用方式,有待更进一步深入研究和探讨。
2.5抗菌蛋白防治香蕉炭疽病菌的效果
采后感病香蕉经三种抗菌蛋白液分别处理后,在28 ℃下储藏一周后依然处于轻微病害发生状态,而PBS对照组香蕉变黑并开始腐烂(图4),三种抗菌蛋白液处理后的香蕉病情指数与PBS对照组形成显著(p<0.05)的差异,抗菌蛋白Ⅰ、Ⅱ、Ⅲ对采后香蕉的炭疽病防治效果分别达到74.48%±0.68%、77.24%±0.53%、75.87%±0.24%,对香蕉炭疽病的防治效果良好。

图4 抗菌蛋白对香蕉炭疽病的防治效果Fig.4 Effect of antimicrobial proteins on the prevention and cure of banana

表4 抗菌蛋白对香蕉炭疽病的防治效果
3 结论与讨论
抗菌蛋白作为一种可替代抗生素的生物体天然产物,对植物真菌生长有很强的抑制作用。Grewal等从铜绿假单胞菌中分离到一种新型蛋白可以抑制5种植物真菌生长[25]。Pelegrini等人从百香果种子分离出的小分子蛋白类似于2S清蛋白家族,能够抑制烟曲霉等6种真菌的生长[26]。这些抗菌蛋白具有的广谱抗菌性、低浓度高效应及对微生物作用方式的广泛性等特征使得它们的开发和利用具有广阔的前景[27]。
三种抗菌蛋白的作用方式有所不同,镜检结果显示出炭疽病菌菌丝畸变甚至断裂的现象,这可能是抗菌蛋白直接破坏细胞壁几丁质的形成或者激活菌体内的几丁质酶而裂解几丁质,或者细胞膜离子失衡引起菌体断裂所导致[28]。因此,可以对其抑菌机理和理化性质及分子结构进行进一步的研究探讨,为海洋植物天然抗菌蛋白的开发和应用奠定理论和实践基础。
本文以红树林白骨壤为材料,从叶子中提取天然抗菌蛋白,对其抗香蕉炭疽病菌的活性及作用方式进行探讨。35%、75%、85%硫酸铵沉淀分离的三种抗菌蛋白(抗菌蛋白Ⅰ、Ⅱ、Ⅲ)对香蕉炭疽病菌的菌丝生长和孢子的萌发都有极强的抑制作用,其抑制菌丝生长的EC50分别为7.93±0.29、6.80±0.28、16.21±0.13 μg/mL。100 μg/mL的抗菌蛋白(Ⅰ、Ⅱ、Ⅲ)溶液对香蕉炭疽分生孢子的萌发抑制率分别达到95.5%±0.01%、97.5%±0.03%、92.5%±0.01%。经抗菌蛋白处理后的采后感病香蕉发病率显著降低。抗菌蛋白Ⅰ、Ⅱ、Ⅲ对香蕉炭疽病的防治效果分别达到74.48%±0.68%、77.24%±0.53%、75.87%±0.24%,对香蕉炭疽病均具有良好的防治效果,为采后香蕉的保鲜和贮藏提供良好的理论和实践意义。
[1]. 李玉萍,方佳. 中国香蕉产业现状与发展对策研究[J]. 中国农学通报,2008,24(8):443-447.
[2]李玉萍,方佳,梁伟红,等.国内外香蕉中农药残留限量标准的比较分析[J].热带作物学报,2006(4):113-118.
[3]Jat B L,Sharma P,Gour H N. Production of Enzymes and Culture Filtrates by Colletotrichum gloeosporioides Penz. Causing Banana Fruit Rot[J]. Proceedings of the National Academy of Sciences,India Section B:Biological Sciences,2013,83(2):177-180.
[4]Udayanga D,Manamgoda D S,Liu X,et al. What are the common anthracnose pathogens of tropical fruits?[J]. Fungal Diversity,2013,61(1):165-179.
[5]胡美姣,李敏,高兆银,等.香蕉炭疽病菌不同菌株的特性比较[J].热带作物学报,2007,28(2):87-91.
[6]周亚奎,陈旭玉,郑服丛. 香蕉炭疽病生物防治研究进展[J].中国农学通报,2008,24(4):328-331.
[7]Bautista-Rosales P U,Calderon-Santoyo M,Servín-Villegas R,et al. Biocontrol action mechanisms of Cryptococcus laurentii on Colletotrichum gloeosporioides of mango[J]. Crop Protection,2014,65:194-201.
[8]Maqbool M,Ali A,Alderson P G,et al. Postharvest application of gum arabic and essential oils for controlling anthracnose and quality of banana and papaya during cold storage[J]. Postharvest Biology and Technology,2011,62(1):71-76.
[9]张娜,关文强,阎瑞香.芥末精油对芒果采后病原真菌抑制效果和保鲜效应的研究[J].食品工业科技,2011,32(3):349-353.
[10]De los Santos-Villalobos S,Guzmán-Ortiz D A,Gómez-Lim M A,et al. Potential use of Trichoderma asperellum(Samuels,Liechfeldt et Nirenberg)T8a as a biological control agent against anthracnose in mango(Mangifera indica L.)[J]. Biological Control,2013,64(1):37-44.
[12]Veronese P,Ruiz M T,Coca M A,et al. In defense against pathogens. Both plant sentinels and foot soldiers need to know the enemy[J]. Plant Physiology,2003,131(4):1580-1590.
[13]McManus A M,Nielsen K J,Marcus J P,et al. MiAMP1,a novel protein from Macadamia integrifolia adopts a greek keyβ-barrel fold unique amongst plant antimicrobial proteins[J]. Journal of Molecular Biology,1999,293(3):629-638.
[14]Regente M C,Giudici A M,Villalain J,et al. The cytotoxic properties of a plant lipid transfer protein involve membrane permeabilization of target cells[J]. Letters in Applied Microbiology,2005,40(3):183-189.
[15]Kovalskaya N,Hammond R W. Expression and functional characterization of the plant antimicrobial snakin-1 and defensin recombinant proteins[J]. Protein Expression and Purification,2009,63(1):12-17.
[16]Arazi T,Huang P L,Huang P L,et al. Production of antiviral and antitumor proteins MAP30 and GAP31 in cucurbits using the plant virus vector ZYMV-AGII[J]. Biochemical and Biophysical Research Communications,2002,292(2):441-448.
[17]Che Y Z,Li Y R,Zou H S,et al. A novel antimicrobial protein for plant protection consisting of a Xanthomonas oryzae harpin and active domains of cecropin A and melittin[J]. Microbial biotechnology,2011,4(6):777-793.
[18]Sun J,Xia Y,Li D,et al. Relationship between peptide structure and antimicrobial activity as studied by de novo designed peptides[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes,2014,1838(12):2985-2993.
[19]Seo J K,Lee M J,Jung H G,et al. Antimicrobial function of SHbAP,a novel hemoglobinβchain-related antimicrobial peptide,isolated from the liver of skipjack tuna,Katsuwonus pelamis[J].Fish & Shellfish Immunology,2014(37):173-183.
[20]石莉.中国红树林的分布状况、生长环境及其环境适应性[J].海洋环境保护,2002(4):14-18.
[21]贾睿,郭跃伟,侯惠欣.中国红树林植物白骨壤化学成分的研究[J]. 中国天然药物,2004,2(1):16-19.
[22]Kumar C,Karthik L,Bhaskara K.V.Invitroanti-candida activity of Calotropis gigantea against clinical isolates of Candida[J]. Pharm Res 2010;3:539-542.
[23]潘磊庆,朱娜,邵兴锋,等.丁香精油对樱桃番茄的保鲜作用[J].食品工业科技,2012,33(23):335-338.
[24]何红,蔡学清,陈玉森,等.辣椒内生枯草芽孢杆菌BS-2和BS-1防治香蕉炭疽病[J].福建农林大学学报(自然科学版),2002,31(4):442-444.
[25]Grewal S,Bhagat M,Vakhlu J. Antimicrobial protein produced by pseudomonas aeruginosa JU-Ch 1,with a broad spectrum of antimicrobial activity[J]. Biocatalysis and Agricultural Biotechnology,2014,3(4):332-337.
[26]Pelegrini P B,Noronha E F,Muniz M A R,et al. An antifungal peptide from passion fruit(Passiflora edulis)seeds with similarities to 2S albumin proteins[J]. Biochimica et Biophysica Acta(BBA)-Proteins and Proteomics,2006,1764(6):1141-1146.
[27]Oard S V,Enright F M. Expression of the antimicrobial peptides in plants to control phytopathogenic bacteria and fungi[J]. Plant Cell Rep,2006(25):561-572.
[28]Zasloff M. Antimicrobial peptides of multicellular organisms[J]. nature,2002,415(24):389-395.
Inhibition ofAvicenniaMarinaantimicrobial protein against banana anthrax
ZHOU Gui1,XIE Yi-dong1,ZHAO Qin1,WU Dan-dan1,CHEN Huan-er1,JIANG Lei1,WU Bo2,*
(1.School of Marine Sciences and Biotechnology,Guangxi University for Nationalities/Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources,Nanning 530006,China;2.Guangxi Noraml University for Nationalities,Chongzuo 532200,China)
In this paper,the leaves ofAvicenniaMarinawere selected as materials. The different antimicrobial proteins were isolated by ammonium sulphate precipitation on different saturation ranges. The inhibition ratio of antimicrobial proteins against banana anthrax was evaluated by mycelial growth rate and spore germination. Storage experiments of postharvest banana fruits treated by the antimicrobial proteins were carried out separately. The results showed that,the three type of antimicrobial proteins separated by 35%,75%,85% ammonium sulfate precipitation(antimicrobial proteinⅠ,Ⅱ,Ⅲ)showed obvious antifungal activity,which inhibited mycelial growth and the EC50value was 7.93±0.29,16.21±0.28,6.80±0.13 μg/mL,respectively. The inhibition ratio of 100 μg/mL antimicrobial protein(Ⅰ,Ⅱ,Ⅲ)against spore germination was 95.5%±0.01%,97.5%±0.01%and 92.5%±0.01% respectively. By microexamination it was found that the three type of antimicrobial proteins could induce deformed growth of hyphae of banana anthrax,including twist of hyphae,necrosis of the hyphal wall and leakage of the cytoplasma. Application of the antimicrobial protein lead to a significant decrease in the incidence of banana anthrax during storage of postharvest banana fruits. The control efficiency of antimicrobial protein(Ⅰ,Ⅱ,Ⅲ)on banana anthracnose was 74.48%±0.68%,77.24%±0.53% and 75.87%±0.24%,respectively.
Avicenniamarina;antimicrobialprotein;banana anthracnose;antimicrobial activity;antimicrobial mechanism
2015-12-02
周桂(1969-),女, 博士,教授,研究方向:生物化学,E-mail:13077739608@163.com。
武波(1962-),男, 博士,教授,研究方向:微生物学,E-mail:wubo@gxnun.edu.cn。
广西自然科学基金项目(2014GXNSFAA118047);广西自然科学基金项目(2014GXNSFAA118076);广西高校科学技术研究重点项目(2D2014041);广西科学研究与技术开发项目(桂科合14125008-1-2); 2015年广西研究生教育创新计划资助研究生科研创新项目(YCSZ2015129);2015年广西大学生创新创业训练计划项目(201510608085)。
TS205.9
A
1002-0306(2016)13-0072-06
10.13386/j.issn1002-0306.2016.13.006

