青龙衣提取物的抗真菌和抗肿瘤活性研究
段燕玲,魏晓璐,任先伟,刘 丽,冯 悦,夏雪山
(昆明理工大学 生命科学与技术学院,云南昆明 650500)
青龙衣提取物的抗真菌和抗肿瘤活性研究
段燕玲,魏晓璐,任先伟,刘丽*,冯悦,夏雪山
(昆明理工大学 生命科学与技术学院,云南昆明 650500)
将青龙衣乙醇提取物用石油醚、氯仿、乙酸乙酯、正丁醇四种不同极性的有机溶剂依次萃取,以4种玉米主要病原真菌和2种肿瘤细胞对青龙衣提取物进行抗真菌和抗肿瘤活性研究。结果表明:乙醇提取物及其不同极性萃取相对供试病原真菌和肿瘤细胞均有一定的抑制作用。其中青龙衣乙醇提取物对玉米穗腐菌、玉米黑粉菌、玉米弯孢菌和玉米纹枯菌等真菌的抑菌率分别为92.5%、86.0%、83.2%、50.0%,乙酸乙酯萃取相的抑菌效果最好,其EC50分别为7.354、9.546、10.341和96.532 mg/mL;MTT比色法实验表明:不同萃取相对Hela细胞和Huh7.5.1细胞的抑制呈现剂量-效应关系,其中石油醚萃取相对两种细胞的抑制效果最明显,其对Hela和Huh7.5.1细胞的IC50分别为124.99 μg/mL和45.33 μg/mL,并可诱导Huh7.5.1细胞凋亡。说明青龙衣提取物对玉米穗腐菌、玉米黑粉菌、玉米弯孢菌、玉米纹枯菌和Hela细胞、Huh7.5.1细胞均有抑制作用,具有剂量依赖性。
青龙衣提取物,抑菌活性,抗肿瘤活性
青龙衣是核桃壳外部一层厚厚的未成熟绿色果皮[1],据《本草纲目》记载,青龙衣具有良好的止痛功效。早在20世纪50年代期间,我国民间就用青龙衣泡酒剂治疗胃痛、痛经、癌症痛等,用来代替阿片酊、吗啡等止痛药。现代化学和药理学研究证明,青龙衣中主要是胡桃醌、黄酮类、鞣花酸和核桃多糖等有效活性成分发挥药理作用,其中胡桃醌在青龙衣中发挥着主要的毒性作用,具有显著的抑菌和抗癌作用[2-5]。
玉米穗腐菌、玉米黑粉菌、玉米弯孢菌和玉米纹枯菌都是玉米易染的主要病原真菌[6-9],常导致玉米发生严重的真菌病害,对玉米的产量和品质产生严重影响,防治玉米病害是当前农业生产亟待解决的问题。恶性肿瘤对人类健康的影响是当今医学界的一大难题,其造成的死亡率是城市人口死亡率的1/4,从各种植物中开发出新型有效的抗肿瘤药物是国内外科学家的重要任务。青龙衣作为核桃产业的副产品,大量被丢弃在田间地头,造成了严重的资源浪费,如何充分发挥其药效,将其运用于农业生产和医药行业,是目前国内外研究的热点。
本研究用乙醇对青龙衣中的活性物质进行初提取,并用4种不同极性有机溶剂对醇提物进行萃取,以4种玉米病原真菌和2种肿瘤细胞对青龙衣提取物进行抑菌抗肿瘤活性研究,为青龙衣的综合开发利用提供理论依据。
1 材料与方法
1.1材料与仪器
青龙衣采自云南临沧核桃产区,清洗自然晾干后,粉碎过100目筛,密封储存备用。
DMEM培养液、胎牛血清(FBS)GIBCO公司;胰蛋白酶Invitrogen公司;青链霉素、溴化四氮唑蓝(MTT)Sigma公司;羟基喜树碱(HCPT)哈尔滨圣泰药业公司;十二甲基亚砜(DMSO) Amresco公司,分析纯;乙醇、石油醚、正丁醇、乙酸乙酯、丙酮、氯仿等试剂均为分析纯天津博迪化工有限公司。
供试玉米病原真菌 玉米纹枯菌RhizotoniasolaniKuhn、玉米黑粉菌Ustilagomaydis、玉米弯孢菌Curvularialunata、玉米穗腐菌Fusariumgraminearum由云南农业大学提供。
供试细胞株人肝癌细胞Huh7.5.1,人宫颈癌细胞Hela来源于昆明理工大学分子病毒学课题组。
培养基真菌用马铃薯葡萄糖琼脂培养基(PDA培养基),细胞用DMEM培养液。
Q-250B粉碎机广州市旭朗机械设备有限公司;RE1002旋转蒸发仪、RE300B高压真空泵、RE1002旋转蒸发仪水浴槽上海科升仪器有限公司;XFH-40CA高温高压灭菌锅湟中东山建材开发有限公司;HH-1恒温水浴锅常州赛普实验仪器厂;TS-100C恒温摇床金坛市精达仪器制造有限公司;MJ-160B-II型真菌培养箱上海博泰实验设备有限公司;LRH-70F恒温生化培养、AllEGRA X-15R高速冷冻离心机河南兄弟仪器设备有限公司;BHC-1300IIB2超净工作台苏州苏洁净化设备公司;DW-86l828超低温冰箱苏州柏兆科学仪器有限公司;Scientz-18SN冷冻干燥机上海市茸研仪器有限公司;BC-J160SCO2恒温恒湿细胞培养箱上海博迅实业有限公司;Leica倒置荧光显微镜河北光学仪器制造有限公司;BECKMAN Avanti J-26XP高速冷冻离心机贝克曼库尔特商贸(中国)有限公司;Bio-Rad680酶标仪上海麦莎生物科技有限公司。
1.2实验方法
1.2.1青龙衣提取物制备采用目前大多数相关研究所采用的有机提取法和不同极性有机溶剂萃取法,用85%的乙醇作为提取溶剂,将青龙衣干粉按照1∶5的质量(g)体积(mL)比于37 ℃150 r/min摇床浸提4次,合并滤液减压浓缩成浸膏。取部分浸膏用50%丙酮溶液配制成浓度500 mg/mL的待测液。将剩余部分浸膏用水溶解,依次用石油醚、氯仿、乙酸乙酯、正丁醇按1∶1的体积比各萃取3次,合并萃取液减压浓缩得各萃取相的浸膏,用50%丙酮溶液分别溶解配制成100 mg/mL的待测液,再稀释为不同浓度的待测液。
1.2.2抑制活性检测
1.2.2.1不同萃取相待测液对4种玉米病原真菌的抑制作用病原真菌抑制实验采用菌丝生长速率法[10]。将待测液100 μL与800 μL无菌水混匀后加入9 cm培养皿中,加入10 mL PDA培养基,混匀、冷却凝固,制成带毒培养基。阴性对照为相应浓度的溶剂,阳性培养基含50 mg/mL的放线菌酮。对照及每个浓度的处理设3个重复。待平板凝固后,接入生长一致的菌饼(Φ=9 mm),于30 ℃恒温培养箱中培养3 d,用十字交叉法测量菌落直径,然后按下式计算生长抑制率[11]。
纯生长量=菌落平均直径-菌饼直径
抑菌率(%)=[(对照纯生长量-处理纯生长量)/对照纯生长量]×100
1.2.2.2乙酸乙酯萃取相对4种玉米病原真菌生长抑制作用的毒性测定将筛选出的有机萃取相配制成不同浓度的供试液,以四种病原真菌为供试菌,测定其对菌丝生长的抑制率。参照机率值换算表,将菌丝生长抑制率换算成机率值。将不同浓度的对数值作为横坐标,将抑菌机率值作为纵坐标,应用最小二乘法计算最佳有机萃取相的毒力回归方程以及半数效应浓度(EC50)。
使用Excel工具作图,用SPSS统计学软件对实验数据进行Duncan多重差异分析,采用Finney 机率分析法进行毒力回归分析。
1.2.2.3MTT法筛选青龙衣各萃取相的抗肿瘤活性取对数生长期的细胞,用0.25%胰酶消化,800 r/mim离心5 min,血球计数板计数后,调整细胞浓度为1×105cells/mL,以每孔100 μL的接种量接种于96孔板中。在37 ℃、5% CO2培养箱中培养12 h后,加入用无血清培养基梯度稀释的6个浓度的青龙衣萃取物100 μL/孔,使每孔终体积为200 μL。每一浓度做三个重复,同时设细胞对照组(不含药物)、药物颜色对照(不含细胞)。对于Hela细胞,孔中最终药物浓度为300、60、12、2.4、0.48、0.098 μg/mL;对于Huh7.5.1细胞,孔中最终药物浓度为300、150、75、37.5、18.75、9.375 μg/mL,阳性药HCPT的浓度分别为0.01、0.1、l、10、100 μg/mL。将96孔板置于37 ℃、5% CO2培养箱中培养72 h后,于实验孔中加入20 μL的5 mg/mL MTT溶液,37 ℃、5% CO2继续培养4 h。使用针头注射器小心吸弃上清,每孔加入150 μL DMSO,在微型振荡器上振荡10 min后,用酶标仪测定OD 490 nm值,并按下式计算生长抑制率,软件Graphpad Prism 5计算药物半抑制浓度(IC50)。
细胞生长抑制率(%)=[1-(实验孔OD值/对照组OD值)]×100
1.2.2.4Hoechst 33342染色观察凋亡细胞形态将对数生长期的细胞按1×105cells/mL的密度、每孔100 μL的接种量接种于96孔板中,在37 ℃、5% CO2培养箱中培养12 h后,加入供试药物继续培养72 h。细胞固定化后,依次加入100 μL的1×Apollo染色反应液,避光、室温脱色摇床孵育30 min,弃反应液;100 μL渗透剂(0.5% TritonX-100的PBS)脱色摇床清洗3次,每次10 min,弃渗透剂;100 μL甲醇清洗2次,每次5 min;PBS清洗5 min。加入100 μL 1×Hoeches 33342反应液,室温孵育30 min,弃染色反应液,每孔每次加入100 μL PBS清洗3次,于荧光显微镜下观察并采集图像。

表1 青龙衣乙醇提取物对4种玉米病原真菌的抑制效果
2 结果与分析
2.1青龙衣乙醇提取物对4种玉米病原真菌的抑制作用
在供试浓度为干样500 mg/mL时,青龙衣乙醇提取物对4种供试玉米病原真菌都具有不同程度的抑制作用(表1),对玉米穗腐菌、玉米黑粉菌和玉米弯孢菌3种真菌有较好的抑制效果,抑菌率均在80%以上。其中对玉米穗腐菌的抑制效果最好,抑菌率为92.5%,对玉米黑粉菌和玉米弯孢菌的抑制作用次之,抑菌率分别为86.0%和83.2%,对玉米纹枯菌抑制效果最差,抑制率为50.0%。青龙衣乙醇提取物不仅对玉米病原真菌表现出良好的抑制效果,丁存宝[12]等人也研究证实,青龙衣提取物对酵母菌等真菌有抑制效果,表明它在抑菌防腐剂领域有巨大的开发利用潜力。
2.2青龙衣乙醇提取物不同极性萃取相对4种玉米病原真菌的抑制作用
不同极性萃取相对4种玉米病原真菌的抑制效果见图1,各萃取相对4种病原真菌均有一定的抑制作用。对玉米穗腐菌、玉米纹枯菌、玉米黑粉菌的抑制作用大小依次为:乙酸乙酯相>石油醚相>氯仿相>正丁醇相,对玉米弯孢菌的抑制作用大小为乙酸乙酯相>氯仿相>正丁醇相>石油醚相,各相对4种真菌的抑制效果与供试相浓度呈正相关。各萃取相对不同病原真菌的抑制效果作用不同,有一定的选择性。50 mg/mL时浓度时,乙酸乙酯相对4种病原真菌均有较好的抑制作用,抑制率依次为90.24%、87.19%、46.32%、83.94%;石油醚相对玉米穗腐菌的抑制效果最好,抑制率达88.77%;氯仿相、正丁醇相对玉米弯孢菌表现出最佳抑制效果,抑制率分别达到88.12%和64.15%。
青龙衣醇提物各萃取相的抑菌效果显著大于醇提物的抑菌效果,说明经过不同极性有机溶剂萃取后,有抑菌活性的物质得以富集在不同极性部位,为分离纯化相应的活性物质奠定了理论基础。经过四种不同极性有机溶剂萃取得到的各相对不同植物病原菌的抑制效果有较大的差异,可能是因为不同植物病原菌生长所需的生长要素以及代谢方式不同,不同极性萃取液中有生物活性的化学成分也可能存在差异。

图1 不同萃取相对4种病原真菌的抑制效果Fig.1 Antifungal activities for differentextract against 4 corn pathogenic fungi注:A、B、C、D依次代表不同萃取相对玉米穗腐菌、玉米弯孢菌、玉米纹枯菌、玉米黑粉菌的抑制效果。
2.3乙酸乙酯萃取相对4种玉米病原真菌的抑制作用
从图1可以看出,不同浓度乙酸乙酯萃取相的处理对玉米穗腐菌、玉米弯孢菌和玉米黑粉菌3种菌在所有处理浓度的抑制率差异为极显著,对玉米纹枯菌在3.125 mg/mL和6.25 mg/mL的抑制率差异不显著。
各浓度乙酸乙酯相对玉米弯孢菌和玉米黑粉菌的抑制效果不相上下,对玉米纹枯菌的抑制率不到50%,均小于其他3种菌,说明玉米纹枯菌为最耐药菌。在6.25 mg/mL以上各浓度作用下,对4种菌的抑制作用由大到小依次为:玉米穗腐菌>玉米黑粉菌和玉米弯孢菌>玉米纹枯菌;6.25 mg/mL浓度作用下,对玉米穗腐菌、玉米黑粉菌和玉米弯孢菌的抑制效果相当,几乎没有差别,均强于玉米纹枯菌;而3.125 mg/mL浓度作用下却是对玉米黑粉菌的抑制作用大于其他3种菌。所以乙酸乙酯萃取相在6.25 mg/mL以上的浓度时对各菌发挥较强的抑菌作用。
从表2可以看出,乙酸乙酯萃取相对4种玉米病原真菌都有较好的毒力,其EC50为7.35~96.53 mg/mL。其对玉米穗腐菌、玉米黑粉菌和玉米弯孢菌具有较好的抑制效果,EC50分别为7.354、9.546和10.341 mg/mL,对玉米纹枯菌抑制效果最差,EC50为96.532 mg/mL。
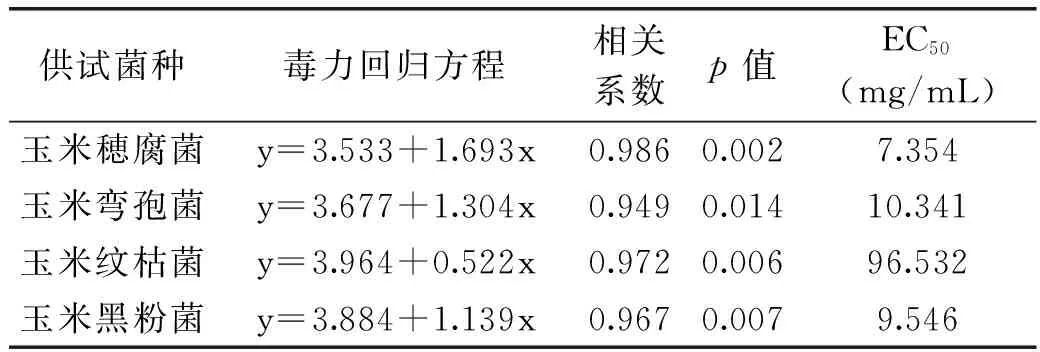
表2 乙酸乙酯萃取相对4种玉米病原真菌菌丝生长抑制作用的毒力测定结果
青龙衣乙醇提取物乙酸乙酯萃取相的抑制效果优于石油醚、氯仿和正丁醇萃取相,说明对供试真菌起抑制作用的活性部位主要集中在偏中等极性的部位中。有学者从青龙衣醇提物的乙酸乙酯相中分离得到黄酮类化合物、酚类化合物和邻苯二甲酸酯类化合物,这些化合物对以上4种玉米病原真菌的抑制效果如何,有待深入研究。
2.4青龙衣各萃取相对Hela和Huh7.5.1细胞的抑制作用
青龙衣各萃取相对人宫颈癌细胞Hela的抑制作用如图2,随作用浓度的升高抑制率逐渐变大,呈现出剂量-效应关系。在2.4~300 μg/mL浓度时,各萃取相的抗肿瘤作用由大到小依次为:石油醚>氯仿>乙酸乙酯>正丁醇;在0.098、0.48 μg/mL浓度时,各萃取相的抗肿瘤作用由大到小依次为:氯仿>石油醚>乙酸乙酯>正丁醇。300 μg/mL浓度时,除正丁醇萃取相外,其他三相的抑制率均达到50%以上;60 μg/mL浓度时,仅石油醚萃取相的抑制率在50%以上;0.098~12 μg/mL浓度间,各萃取相的抑制效果相当处于20%~30%之间。综合分析,石油醚萃取相为四相中抑制效果最好。

图2 青龙衣各萃取相对Hela细胞的生长抑制作用Fig.2 The growth inhibition of Hela cells by all the extraction
青龙衣各萃取相对人肺癌细胞Huh7.5.1的抑制作用如图3,随作用浓度的升高抑制率逐渐变大,呈现出剂量-效应关系。各萃取相的抗肿瘤作用由大到小依次为:石油醚>氯仿和乙酸乙酯>正丁醇。石油醚萃取相在37.5~300 μg/mL浓度之间显示出显著的抗肿瘤作用,其抑制率均大于50%,最高可达96.24%,而在低浓度9.375和18.75 μg/mL时抑制效果不佳;氯仿萃取相在150、300 μg/mL浓度时抑制效果非常明显,抑制率分别为86.76%和86.96%,在75 μg/mL浓度时下降到16.3%,说明氯仿萃取相的最佳抑制浓度大于75 μg/mL。乙酸乙酯萃取相在150、300 μg/mL浓度时抑制效果良好,抑制率均在50%以上,分别为58.83%和91.15%,而在低浓度9.375~37.5 μg/mL之间时抑制效果不理想,抑制率均不到10%;正丁醇萃取相在高浓度300 μg/mL时抑制效果明显,低浓度时几乎无明显的抗肿瘤作用。

图3 青龙衣各萃取相对Huh7.5.1细胞的生长抑制作用Fig.3 The growth inhibition of Huh7.5.1cells by all the extraction
2.4.1青龙衣各萃取相对肿瘤细胞Hela和Huh7.5.1细胞的IC50通过对比表3中阳性对照HCPT和各萃取相对Hela和Huh7.5.1细胞的IC50值大小,可看出4种萃取相对Huh7.5.1细胞的IC50值均小于Hela细胞,表明Huh7.5.1细胞的生长更容易受到青龙衣各萃取相的影响;4种萃取相中石油醚萃取相的抗肿瘤效果最佳,对Hela和Huh7.5.1细胞的IC50值分别为124.99、45.33 μg/mL。石油醚相对Huh7.5.1细胞的抑制效果与HCPT的抑制效果相当,提示青龙衣在临床抗肿瘤运用,尤其在对肝癌的治疗方面,具有很大的开发利用价值。

表3 各萃取相对Hela和Huh7.5.1细胞的IC50
2.4.2Hoechst 33342染色观察Huh7.5.1细胞形态Huh7.5.1细胞在不同浓度石油醚萃取相作用后,经染料Hoechst 33342染色得到的抑制效果如图4。正常细胞表面光滑,发出均匀淡蓝色荧光,染色质分布均匀;石油醚萃取相作用于Huh7.5.1细胞72 h后,随着石油醚萃取相浓度的升高,Huh7.5.1细胞核或细胞质内出现强蓝色致密的颗粒状荧光,染色质蜷缩,细胞内的凋亡小体也逐渐增多,表明石油醚萃取相能够诱导Huh7.5.1细胞凋亡。

图4 Huh7.5.1在荧光检测下的形态学特征(×400)Fig.4 Morphological appearance of Huh7.5.1 cells by fluorescence detection(×400)注:A~F分别为300、150、75、37.5、18.75、9.375μg/mL石油醚相,G为对照。
据文献报道,大多数植物中的有效活性成分发挥抗肿瘤作用是通过诱导肿瘤细胞凋亡来完成的[13-14],本实验结果也证实了这一点。也有研究表明青龙衣中主要起抗肿瘤作用的物质为胡桃醌,它通过诱导细胞凋亡来发挥抗癌活性,但对于胡桃醌诱导细胞凋亡的信号调控机制尚未得出一致结论[15-20]。
3 结论与讨论
本研究中青龙衣乙醇提取物及石油醚、氯仿、乙酸乙酯、正丁醇萃取相对4种玉米主要病原真菌和2种肿瘤细胞有不同程度的抑制效果。醇提物对玉米穗腐菌的抑制效果最好,抑菌率为92.5%;醇提物的4种萃取相对4种植物病原真菌均有抑制作用。其中乙酸乙酯萃取相的抑制优于其他3种萃取相,对玉米穗腐菌、玉米弯孢菌、玉米纹枯菌、玉米黑粉菌的EC50分别为7.354、10.341、96.532、9.546 mg/mL,对玉米穗腐菌的抑制效果最佳。在抗肿瘤效果研究中,石油醚相对Hela和Huh7.5.1细胞的抑制效果均最好,其IC50值分别为124.99、45.33 μg/mL。通过Hoechst 33342染色观察Huh7.5.1细胞凋亡,随着作用浓度的升高,Huh7.5.1细胞内的凋亡小体也逐渐增多,证实发挥青龙衣提取物的抗肿瘤作用是通过诱导肿瘤细胞凋亡来完成的。
青龙衣中存在着丰富的抑菌或杀菌活性物质。翟梅枝等人[21]对青龙衣乙醇提取物及其萃取相进行抑菌效果研究,表明乙醇提取物的乙酸乙酯萃取相的抑菌活性优于石油醚相、氯仿相和正丁醇相,其对棉花立枯、小麦纹枯等菌的EC50值在5.6~10.3 mg/mL之间。本研究结果同其一致,乙醇提取物的乙酸乙酯萃取相亦表现出最佳的抑菌效果,有望进一步开发成无污染、高安全性、低残留的生物农药。
青龙衣乙醇提取物石油醚萃取相对两种肿瘤细胞的抑制效果最好,且能诱导细胞凋亡,推测青龙衣中具有抗肿瘤活性的物质可能存在于低极性部位。近年来,有关应用青龙衣治疗恶性肿瘤的临床报道日渐增多,但是对青龙衣中具体化合物的细胞毒性及其作用机理研究较少。本实验采用不同极性的有机溶剂提取青龙衣中的化合物并进行细胞毒性实验,通过Hoechst 33342染色观察细胞凋亡,为后期有针对性地分离有特定活性的物质和研究抗肿瘤作用机理打下基础。
本实验室前期研究表明[22],青龙衣醇提物和不同极性萃取物对金黄色葡萄球菌、肺炎克雷伯菌等7种临床耐药细菌具有良好的抑制效果。结合本实验研究结果,表明青龙衣提取物对细菌和真菌均有较广的抗菌谱,对肿瘤细胞也有不同程度的抑制作用,可见其在资源综合利用及医药开发方面具有重要的意义。
[1]中国科学院中国植物志编委会. 中国植物志[M]. 北京:科学出版社,1979.
[2]李冬梅,彭友伦,刘光明. 漾濞泡青龙衣化学成分的研究[J]. 中草药,2015,46(7):962-965.
[3]Ji Y B,QU Z Y,ZOU X. Juglone-induced apoptosis in human gastric cancer SGC-7901 cells via the mitochondrial pathway[J]. Experimental And Toxicologic Pathology,2011,63(1):69-78.
[4]Xu H L,Yu X F,Qu S C,et al,Anti-proliferative effect of juglone from Juglans mandshurica Maxim on human leukemia cell HL-60 by inducing apoptosis through the mitochondria-depent pathway[J]. Biochemical And Biophysical Research Communications,2012,421(2):268-273.
[5]Arshi M,Sarah A,Mohammad S,et al. Influence of ellagic acid on prostate cancer cell proliferation:A caspase-dependent pathway[J]. Asian Pacific Journal of Tropical Medicine,2011(7):550-555.
[6]Buyuk O,Ozer N. Beaerches on zearalenone producing of Fusarium verticilloides,the causal agent of maize ear rol,from maize field in West Blacksea[J]. Bitki Koruma Bulteni,2012,52(4):337-347.
[7]魏国荣,李凯瑞,黄雪玲. 玉米黑粉菌实时荧光定量PCR检测方法的建立[J]. 生物技术,2014,24(4):66-70.
[8]陈广泉,陈占伟,郑天翔,等. 河西走廊制种玉米3种真菌性叶斑病的诊断与识别[J]. 种子,2015,34(3):94-96.
[9]丁婷,孙微微,王帅,等. 杜仲内生真菌中抗玉米纹枯病活性菌株的筛选[J]. 植物保护,2014,40(6):29-35.
[10]王静,叶敏,范黎明,等.菌丝生长速率法筛选纤维素降解菌的研究[J]. 中国农学通报,2013,29(33):323-326.
[11]刘浩,张娜,阴春晖,等.两种测定化合物对真菌菌丝生长抑制活性方法的比较[J].天然产物研究与发,2009,21(4):577-580.
[12]丁存宝,吴尚卓,李桂秋,等. 核桃青皮提取物的抑真菌活性研究[J]. 现代食品科技,2013,29(4):722-724.
[13]Park D I,Lee J H,Moon S K,et al. Induction of apoptosis and inhibition of telomerase activity by aqueous extract from Platycodon grandiflorum in human lung carcinoma cells[J]. Pharmacological Research,2005,51(5):437-443.
[14]Tan M L,Sulaiman S F,Najimuddin N,et al. Methanolic extract of Pereskia bleo(Kunth)DC.(Cactaceae)induces apoptosis in breast carcinoma,T47-D cell line[J]. Journal of Ethnopharmacology,2005,96(1):287-294.
[15]Yang J,Wu L J,Tashino S,et al. Critical roles of reactive oxygen species in mitochondrial permeability transition in mediating evodiamine-induced human melanoma A375-S2 cell apoptosis[J]. Free Radical Research,2007,41(10):1099-1108.
[16]Lu K P,Zhou X Z. The prolyl isomerase PIN1:a pivotal new twist in phosphorylation signalling and disease[J]. Nature Reviews Molecular Cell Biology,2007,8(11):904-916.
[17]Paulsen M T,Ljungman M. The natural toxin juglone causes degradation of p53 and induces rapid H2AX phosphorylation and cell death in human fibroblasts[J]. Toxicology and Applied Pharmacology,2005,209(1):1-9.
[18]Seya T,Shime H,Ebihara T,et al. Pattern recognition receptors of innate immunity and their application to tumor morimmunotherapy[J]. Cancer Science,2010,101(2):313-320.
[19]Maruo S,Kuriyama I,Kuramochi K,et al. Inhibitory effect of novel 5-O-acyl juglones on mammalian DNA polymerase activity,cancer cell growth and inflammatory response[J]. Bioorganic & Medicinal Chemistry Letters,2011,19(19):5803-5812.
[20]Aithal B K,Kumar M R,Paw B N. Juglone,a naphthoquinone from walnut,exerts cytotoxic and genotoxic effects against cultured melanoma tumor cells[J]. Cell Biology International,2009,33(10):1039-1049.
[21]翟梅枝,王磊,何文君,等. 核桃青皮乙醇提取物抑菌活性研究[J].西北植物学报,2009,29(12):2542-2547.
[22]任先伟,魏晓璐,黄鑫,等.核桃青皮提取物抑菌活性及抑菌机理研究[J].食品工业科技,2015,36(18):93-98.
Antifungal and antitumor activity of walnut green husk’ extracts
DUAN Yan-ling,WEI Xiao-lu,REN Xian-wei,LIU Li*,FENG Yue,XIA Xue-shan
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
The ethanol extracts of walnut green husk were further extracted with petroleum ether,chloroform,ethyl acetate and n-butanol. Antifungal and antitumor activity of the walnut green husk’different solvent extracts against 4 corn pathogenic fungi and 2 tumor cells were studied. The results showed that the ethanol extract from walnut green husk and different solvent extracts had certain inhibition on testing microbial. For the corn pathogenic fungi,the inhibition rate of ethanol extract toFusariumgraminearum,Curvularialunata,RhizotoniasolaniKuhnandUstilagomaydiswere 92.5%,86.0%,83.2%,50.0% respectively. The ethyl acetate extract had the best antimicrobiol activity among the different solvent extracts,which the EC50were 7.354,9.546,10.341,96.532 mg/mL. MTT assay showed that the different extracts inhibited the growth of Hela cells and Huh7.5.1 cells in a dose-dependent manner. The petroleum ether extract had the most obvious antitumor effect on testing cells,which the IC50were 124.99 μg/mL and 45.33 μg/mL,it could induce Huh7.5.1 cell’s apoptosis. The ethanol extracts of walnut green husk can inhibit Fusarium graminearum,Curvularialunata,RhizotoniasolaniKuhn,Ustilagomaydisand Hela cells,Huh7.5.1 cells in a dose-dependent manner.
walnut green husk extract;antimicrobial activity;antitumor activity
2016-01-12
段燕玲(1991-),女,硕士研究生,主要从事药物化学与生物技术方面的研究,E-mail:yanlingcoolgirl@126.com。
刘丽(1969-),女,理学博士,教授,主要从事环境微生物方面的研究,E-mail:liuli2272@163.com。
国家科技支撑计划项目(2011BAD46B00)。
TS201.3
A
1002-0306(2016)13-0077-06
10.13386/j.issn1002-0306.2016.13.007

