牛磺酸降低高胆固醇HepG2细胞内胆固醇的作用机制研究
郭俊霞,张 静,张 珊,高 亚,陈 文
(北京联合大学应用文理学院食品科学系,北京 100191)
牛磺酸降低高胆固醇HepG2细胞内胆固醇的作用机制研究
郭俊霞,张静,张珊,高亚,陈文*
(北京联合大学应用文理学院食品科学系,北京 100191)
目的:探讨牛磺酸对高胆固醇HepG2细胞胆固醇降解作用及其机制。方法:以0.02 mmol/L胆固醇加入培养液中建立高胆固醇细胞模型后,分别加入1、10、20 mmol/L牛磺酸培养48 h,测定细胞内总胆固醇(TC)、游离胆固醇(FC)、胆固醇酯(EC)及细胞内总胆汁酸(TBAc)和培养液总胆汁酸(TBAm)水平;并检测20 mmol/L牛磺酸作用24 h后细胞CYP7A1及其调控分子的蛋白表达水平。结果:10 mmol/L和20 mmol/L牛磺酸作用48 h可显著降低细胞内TC、FC和EC(p<0.01),同时升高了TBAc和TBAm(p<0.05或p<0.01);20 mmol/L牛磺酸作用24 h时使CYP7A1显著增加(p<0.05);20 mmol/L牛磺酸作用24 h后MAPK、ERK、JNK、c-jun和p-c-jun表达明显降低(p<0.05),而对HNF4α则无显著影响。结论:牛磺酸可抑制高胆固醇HepG2细胞MAPK/ERK和MAPK/JNK表达水平,降低c-jun蛋白表达及c-jun磷酸化水平,促进CYP7A1蛋白表达升高,从而加速胆固醇转化为胆汁酸。
牛磺酸,胆固醇,胆固醇7α-羟化酶(CYP7A1),HepG2细胞
牛磺酸(Taurine)是机体中一种含硫的非必需氨基酸,自身合成极少,主要通过膳食摄入,尤其是海产品。近些年来多项动物实验和临床实验研究均发现食源性牛磺酸具有良好的降低胆固醇作用。临床实验显示牛磺酸能有效降低志愿者的血清总胆固醇与动脉粥样指数[1-2]。而动物实验表明,牛磺酸可显著降低大鼠、小鼠、豚鼠等高胆固醇动物模型的血清和肝脏总胆固醇含量,促进粪便胆汁酸的排出,并且牛磺酸主要是通过提高肝脏胆固醇降解限速酶-胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)mRNA或活性水平而起到降胆固醇作用的[1,3-5]。
牛磺酸降胆固醇的体外细胞研究虽然较少,但其作用于人肝细胞HepG2、鼠肝细胞H4IIE和人THP-1源性巨噬细胞,也均显著降低细胞内胆固醇水平[6-7],且促进细胞内CYP7A1的mRNA表达和蛋白表达[6-8]。这与动物实验结果相一致。但到目前为止,关于牛磺酸促进CYP7A1上调的分子机制尚不清晰。
本文以人肝细胞HepG2为研究对象,通过外源加入胆固醇建立高胆固醇细胞模型,加入不同浓度牛磺酸,观察牛磺酸对细胞内胆固醇和胆汁酸的调节作用,并检测细胞内CYP7A1及其调控分子肝细胞核转录因子(HNF4α)、MAPK、JNK、ERK、c-Jun、磷酸化c-Jun(p-c-Jun)的蛋白表达变化,从而探讨牛磺酸调节肝细胞内胆固醇向胆汁酸生物转化的作用及其机制。
1 材料与方法
1.1材料与仪器
HepG2细胞中国协和医科大学基础医学研究所细胞中心;胆固醇(纯度≥99%)、牛磺酸(纯度>99%)、胆固醇氧化酶、辣根过氧化物酶、胆固醇酯水解酶、水合牛胆酸钠和4-氨酰安替比林美国Sigma公司;抗CYP7A1(sc-25536)、抗JNK(sc-571)、抗p-c-jun(sc-7980-R)、抗c-jun(sc-1694)、抗ERK(sc-292838)、抗HNF4α(sc-8987)等一抗、山羊抗兔二抗(sc-2004)美国Santa Cruz公司;抗MAPK抗体(D1A5)美国CST(Cell Signaling Technology)公司,抗β-actin一抗美国Genview公司;BCA试剂盒北京鼎国昌盛生物技术有限公司;总胆汁酸测定试剂盒南京建成生物工程研究所。
uQuant Bio-Tek酶标仪美国Bio-Tek公司;电泳仪和转膜仪美国Bio-Rad公司;凝胶成像系统美国通用公司。
1.2细胞培养及处理
HepG2细胞于含10%胎牛血清的DMEM培养基中,37 ℃、5% CO2恒温培养,以1×105~2×105个/孔接种于六孔板中。培养液中加入0.02 mmol/L胆固醇孵育24 h细胞内胆固醇浓度升高了33%,因此本实验以0.02 mmol/L胆固醇建立细胞高胆固醇模型。根据处理不同分为:正常对照组(N),高胆固醇模型对照组(H),在模型基础上分别加入1、10、20 mmol/L牛磺酸为牛磺酸组(T),共同培养12、24或48 h。
1.3细胞内胆固醇测定
细胞每孔加入1 mL正己烷-异丙醇(2∶1,v/v)慢摇60 min以提取细胞内脂类物质;4 ℃、10000 r/min离心10 min,上清通氮气40 min除去有机溶剂;以含10% TritonX-100异丙醇130 mL振荡溶解上述脂类提取物。按照表1配制总胆固醇(total cholesterol,TC)和游离胆固醇(free cholesterol,FC)测定工作液。取50 μL脂类提取物,分别加入TC和FC测定工作液,37 ℃水浴30 min,用酶标仪于500 nm波长处测定吸光度[9-10]。

表1 胆固醇测定工作液配制成分
1.4细胞胆汁酸测定
分别收集细胞和培养液,1% TritonX-100裂解细胞,以总胆汁酸测定试剂盒测定细胞内胆汁酸(TBAc)和培养液内胆汁酸(TBAm)。
1.5细胞内蛋白含量测定
细胞提取脂类物质后加入裂解液冰上提取细胞内总蛋白,4 ℃、10000 r/min离心10 min,取上清液为测试样品。或者测定TBAc后的裂解液上清为测试样品。各测试样品以BCA试剂盒测定蛋白质含量。
细胞胆固醇含量以胆固醇与蛋白质比值(μg/mg·pro)表示,胆固醇酯(cholesterol ester,EC)=TC-FC;TBAc含量以胆汁酸与蛋白质比值表示(μmol/g·pro)表示。
1.6Western Blot法
裂解细胞提取细胞总蛋白并以BCA试剂盒定量蛋白浓度。等量取每孔细胞蛋白30 μg进行聚丙烯酰胺凝胶电泳,转至PVDF膜,在含5%脱脂奶粉封闭1 h,加入不同目的蛋白一抗和内参β-actin抗体4 ℃孵育过夜。TBST缓冲液漂洗3次后加入二抗,室温孵育2 h。以ECL高效化学发光试剂曝光显影。条带结果用凝胶图像分析系统进行目的蛋白及内参(β-actin)灰度值分析,以目的蛋白灰度值与内参照蛋白灰度值之比作为所测目的蛋白相对含量。
1.7数据处理
2 结果与分析
机体肝脏胆固醇降解为胆汁酸是胆固醇清除的重要途径,也是体内胆固醇平衡的重要环节之一。CYP7A1是胆固醇向胆汁酸生物转化经典途径的限速酶[11]。综述近年来关于牛磺酸降低胆固醇作用的动物实验结果,高脂膳食诱导建立高胆固醇血症大鼠或小鼠模型,经饲料或饮水途径给予牛磺酸,血清TC降低22%~67%,肝脏胆固醇降低26%~42%,同时CYP7A1的mRNA增加95%~119%,CYP7A1活性升高82%~151%[1]。
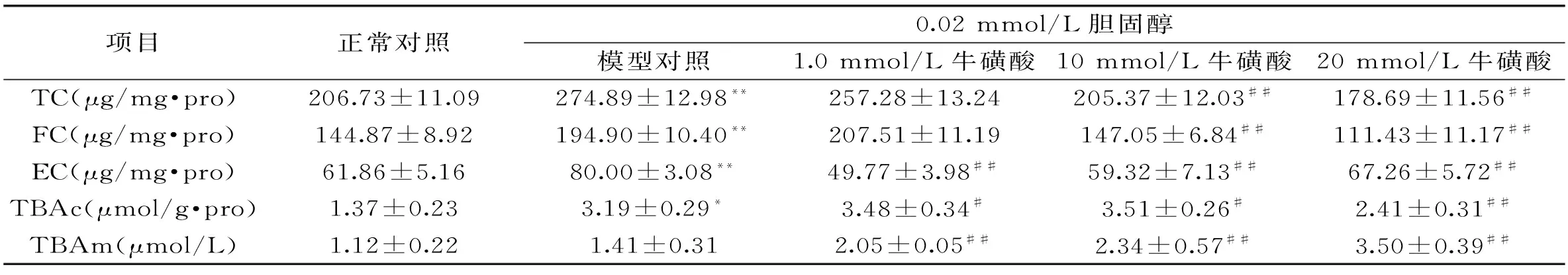
表2 牛磺酸作用48 h对高胆固醇HepG2细胞内胆固醇和胆汁酸的影响
注:与正常对照比较,*p<0.05,**p<0.01;与模型对照比较,#p<0.05,##p<0.01。
本研究以HepG2细胞外源加入0.02 mmol/L胆固醇建立高胆固醇细胞模型,在细胞水平探讨牛磺酸调节肝细胞内胆固醇向胆汁酸生物转化的作用及其机制。
2.1牛磺酸对高胆固醇HepG2细胞内胆固醇和胆汁酸的影响
由表2可见,以0.02 mmol/L胆固醇加入HepG2细胞,细胞内TC、FC和EC均明显升高(p<0.01),表示高胆固醇细胞模型建立成功。在此高胆固醇细胞模型基础上,不同浓度牛磺酸作用48 h均使得细胞内胆固醇下降,其中1.0 mmol/L牛磺酸仅使得EC下降,而10 mmol/L牛磺酸使TC和FC分别显著下降25.3%与24.6%,20 mmol/L牛磺酸则使TC和FC下降幅度达35.0%与42.8%。从胆汁酸的结果看出,与模型对照组相比,1 mmol/L和10 mmol/L牛磺酸均使胞内胆汁酸TBAc显著增多,20 mmol/L牛磺酸却使TBAc含量有所下降,但培养液TBAm水平则随着牛磺酸浓度的增加显著上升,在牛磺酸为20 mmol/L时达最大值,表示胞内胆汁酸排出到了培养液中。这些结果显示牛磺酸促进了细胞内胆固醇向胆汁酸转化,其中20 mmol/L牛磺酸作用最强。
已有的体外细胞实验显示,Yanagita等在HepG2细胞加入0.1 mmol/L和1 mmol/L牛磺酸,细胞内胆固醇和甘油三酯水平显著下降[12],而我们之前的研究也显示牛磺酸(1~20 mmol/L)作用显著降低HepG2细胞内TC、FC和EC[6]。这些牛磺酸对正常HepG2细胞的作用与本研究中对高胆固醇模型的作用不同,可见对于高胆固醇细胞需要较高浓度(10 mmol/L和20 mmol/L)牛磺酸孵育才能表现出降低胆固醇的效果。
2.2牛磺酸对高胆固醇HepG2细胞CYP7A1表达的影响
牛磺酸对细胞CYP7A1及其调控分子的表达实验均选取降低胆固醇作用的最佳浓度20 mmol/L。从图1可知,20 mmol/L牛磺酸分别作用12、24和48 h,与模型对照组比较CYP7A1表达量在24 h时显著上升(p<0.05)。据此,后续调控CYP7A1表达的分子检测实验选取20 mmol/L牛磺酸孵育24 h。在正常HepG2细胞也有对CYP7A1作用的报道,牛磺酸(0~20 mmol/L)可诱导细胞内CYP7A1 mRNA和蛋白表达水平增加,且具有浓度依赖性和时间依赖性[6,8]。

图1 牛磺酸对高胆固醇HepG2细胞CYP7A1表达的影响 Fig.1 The effect of taurine on the expression of CYP7A1 in high-cholesterol HepG2注:N:正常对照组;H:高胆固醇模型组;T:牛磺酸组;A:CYP7A1和内参蛋白条带代表图;B:CYP7A1相对表达量柱状图;*:p<0.05。
2.3牛磺酸对高胆固醇HepG2细胞内调节CYP7A1表达重要分子的影响
体内有多条信号途径严密调控CYP7A1的表达以维持机体胆固醇胆汁酸的平衡。一方面,膳食胆固醇与肝X受体α(LXRα)结合活化后可上调CYP71的表达,促进胆汁酸的生成[11,13-14]。另一方面,产生的胆汁酸又可与胆汁酸受体(FXR)结合活化而抑制CYP7A1的表达。到目前为止,CYP7A1启动子的invitro研究分析以及HNF4α缺失小鼠的实验都已证实肝细胞核转录因子(HNF4α)是CYP7A1表达的重要调控因子,可促进CYP7A1转录表达,增加胆固醇向胆汁酸的生物转化[15-16]。胆汁酸可以通过LXR/FXR-依赖与FXR-非依赖两条负反馈途径抑制HNF4α的作用,从而降低CYP7A1的转录表达,实现CYP7A1表达平衡[8,11,17]。本研究重点锁定牛磺酸对CYP7A1表达负反馈通路FXR-非依赖途径的影响。在FXR-非依赖途径中,主要包括MAPK、ERK、JNK、c-Jun等信号因子。在这条途径中,产生的胆汁酸会通过激活MAPK/JNK、MAPK/ERK途径,激活和磷酸化转录因子c-Jun,而磷酸化的c-Jun(p-c-jun)与HNF-4α的结合可抑制HNF-4α的表达或活性,直接导致CYP7A1表达下调[17-18]。

图2 牛磺酸对调节高胆固醇肝细胞内CYP7A1表达的关键分子的影响Fig.2 The effect of taurine on several key moleculars associated with CYP7A1 expressions in high-cholesterol HepG2注:N:正常对照组;H:高胆固醇模型组;T:牛磺酸组;A、B、C和D:分别为MAPK、ERK、JNK和c-Jun/p-c-Jun蛋白表达结果,每组图中上为目的蛋白和内参蛋白条带代表图,下为目的蛋白相对表达量柱状图;*:p<0.05。
由图2结果可知,与正常对照组相比较,高胆固醇模型组MAPK表达下降而ERK、JNK、c-jun和p-c-jun表达无明显变化。从图2A~图2C可以看出,20 mmol/L牛磺酸作用于高胆固醇HepG2细胞模型24 h,细胞内MAPK、ERK和JNK表达比模型细胞组明显下降(p<0.05);图2D结果表明20 mmol/L牛磺酸使细胞内c-jun和p-c-jun表达也明显降低(p<0.05)。这些结果说明20 mmol/L牛磺酸显著降低了细胞内关键信号分子MAPK、ERK、JNK、c-jun和p-c-jun的蛋白表达水平。
由图3可以看出,高胆固醇模型与正常对照组比较细胞内HNF4α表达无明显差异,且20 mmol/L牛磺酸对高胆固醇HepG2细胞HNF4α也无明显影响。

图3 牛磺酸对高胆固醇HepG2细胞HNF4α表达的影响Fig.3 The effect of taurine on the expression of HNF4α in high-cholesterol HepG2注:N:正常对照组;H:高胆固醇模型组;T:牛磺酸组;图中上为HNF4α蛋白和内参蛋白条带代表图,下为目的蛋白相对表达量柱状图。
以上这些结果提示牛磺酸可能抑制了胆汁酸对MAPK/ERK、MAPK/JNK通路的激活,使得c-Jun表达及其磷酸化也受到抑制,导致p-c-Jun的蛋白表达下降,减少了其与HNF-4α的结合,最终减弱了产生的胆汁酸对CYP7A1的反馈性抑制,使CYP7A1蛋白表达显著增加。
3 结论
综上所述,10 mmol/L和20 mmol/L牛磺酸作用48 h可显著降低高胆固醇HepG2细胞内胆固醇水平,增加胆汁酸生成;20 mmol/L牛磺酸作用于高胆固醇HepG2细胞24 h,可抑制MAPK/ERK和MAPK/JNK表达水平,降低c-jun蛋白表达及c-jun磷酸化水平,促进了CYP7A1蛋白表达升高,从而加速胆固醇转化为胆汁酸。
[1]Chen W,Guo JX,Chang P. The effect of taurine on cholesterol metabolism[J]. Mol Nutr Food Res,2012,56(6):681-690.
[2]Murakami S. Taurine and atherosclerosis[J]. Amino Acids,2012,46(1):73-80.
[3]Yokogoshi H,Mochizuki H,Nanami K,et al. Dietary taurine enhances cholesterol degradation and reduces serum and liver cholesterol concentrations in rats fed a high-cholesterol diet[J]. J Nutr,1999,129(9):1705-1712.
[4]Murakami S,Fujita M,Nakamura M,et al. Taurine ameliorates cholesterol metabolism by stimulating bile acid production in high cholesterol-fed rats[J]. Clin Exp Pharmacol Physiol. 2015 Dec 28[Epub ahead of print].
[5]ChenW,Suruga K,Nishimura N,et al. Comparative regulation
of major enzymes in bile acids biosynthesis pathways by cholesterol,cholic acid and taurine in mice and rats[J]. Life Sci,77(2005):746-757.
[6]张珊,郭俊霞,张艳贞,等.牛磺酸对HepG2细胞胆固醇水平的影响[J].食品科学,2014,35(23):21-24.
[7]Hong MH,Jia Y,Jun H,et al. Taurine is a liver X receptor-αligand and activates transcription of key genes in the reverse cholesterol transport without inducing hepatic lipogenesis[J]. Molecular Nutrition & Food Research,2012,56(6):900-911.
[8]Lam NV,Chen W,Suruga K,et al. Enhancing effect of taurine on CYP7A1 mRNA expression in HepG2 cells[J]. Amino Acids,2006,30(1):43-48.
[9]Omodeso SF,Marchesini S,Fishman PH,et al. A sensitive enzymatic assay for determination of cholesterol in lipid extracts[J]. Anal Biochem,1984,142(2):347-350.
[10]陈昱杨. 炎症干扰细胞内胆固醇外排导致肝脏脂质异常积聚的分子机制[D]. 重庆:重庆医科大学,2011.
[11]Chiang JY. Bile acids:regulation of synthesis[J]. J Lipid Res,2009,50(10):1955-1966.
[12]Yanagita T,Han SY,Hu Y,et al. Taurine reduces the secretion of apolipoprotein B100 and lipids in HepG2 cells[J]. Lipids in Health and Disease,2008,7:38.
[13]Peet DJ,Truly SD,Ma W,et al.Cholesterol and bile acid metabolism are impaired in mice lacking the nuclear oxysterol receptor LXR-([J]. Cell,1998,93:693-704.
[14]Goodwin B,Jones SA,Price RR,et al. A regulatory cascade of the nuclear receptors FXR,SHP-1 and LRH-1 represses bile acid biosynthesis[J]. Mol Cell,2006,6:517-526.
[15]Cooper AD,Chen J,Botelho-Yetkinler MJ,et al. Characterization of hepatic-specific regulatory elements in the promoter region of the human cholesterol 7alpha-hydroxylase gene[J]. J Biol Chem,1997,272:3444 -3452.
[16]Inoue Y,Yu AM,Yim SH,et al. Regulation of bile acid biosynthesis by hepatocyte nuclear factor 4α[J]. J Lipid Res,2006,47:215-227.
[17]Kim DH,Lee JW. Tumor suppressor p53 regulates bile acid homeostasis via small heterodimer partner[J]. Proc Natl Acad Sci U S A,2011,108(30):12266-12270.
[18]Li T,Jahan A,Chiang JY. Bile acids and cytokines inhibit the human cholesterol 7 alpha-hydroxylase gene via the JNK/c-jun pathway in human liver cells[J]. Hepatology,2006,43(6):1202-1210.
Cholesterol-lowering effect of taurine and its mechanism in high-cholesterol HepG2 cells
GUO Jun-xia,ZHANG Jing,ZHANG Shan,GAO Ya,CHEN Wen*
(College of Applied Arts and Science,Beijing Union University,Beijing 100191,China)
Objective:To study the effect of taurine on cholesterol degradation and its preliminary mechanism. Methods:HepG2 cells were treated with 1,10,and 20 mmol/L taurine for 48 h after being cultured in DMEM supplemented with 0.02 mmol/L cholesterol. Then the levels of intracellular total cholesterol(TC),free cholesterol(FC),ester cholesterol(EC),total bile acids(TBAc)and medium TBA(TBAm)were determined. The expression of CYP7A1 and its regulatory key molecules were detected by western blot after HepG2 cells were incubated with 20 mmol/L taurine for 24 h. Results:TC,FC and EC were significantly reduced and TBAc and TBAm were increased by 10 mmol/L and 20 mmol/L taurine for 48 h-treatment(p<0.05 orp<0.01). The expression of CYP7A1 was significantly increased by 20 mmol/L taurine at 24 h(p<0.05). The expression of MAPK,ERK,JNK,c-jun and p-c-jun were obviously decreased(p<0.05)and the expression of HNF4αhad no significant change by 20 mmol/L taurine for 24 h. Conclusion:Taurine can enhance CYP7A1 expression by inhibiting MAPK/JNK,MAPK/ERK and c-Jun/p-c-Jun expression,to promote the transformation of cholesterol to bile acid in liver cells.
taurine;cholesterol;bile acid;CYP7A1;HepG2 cell
2016-01-20
郭俊霞(1976-),博士,副教授,研究方向:食品营养与功能,E-mail:junxia@buu.edu.cn。
陈文(1966-),博士,教授,研究方向:食品营养与功能,E-mail:wlchenwen@buu.edu.cn。
北京市自然科学基金资助项目(5142004);北京市教委科技计划面上项目(KM201511417014);北京联合大学新起点计划项目(Zk10201404)。
TS201.4
A
1002-0306(2016)13-0112-05
10.13386/j.issn1002-0306.2016.13.014

