碳源对裂殖壶菌类胡萝卜素积累的影响
刘 源,李蕾蕾,张 涛,娄 菲,常 明,金青哲,王兴国
(食品科学与技术国家重点实验室 食品安全与营养协同创新中心 江南大学食品学院,江苏无锡 214122)
碳源对裂殖壶菌类胡萝卜素积累的影响
刘源,李蕾蕾,张涛,娄菲,常明,金青哲*,王兴国
(食品科学与技术国家重点实验室 食品安全与营养协同创新中心 江南大学食品学院,江苏无锡 214122)
本文研究了葡萄糖和甘油分别作为单一碳源对裂殖壶菌ATCC20888发酵过程中脂质和类胡萝卜素变化特性的影响,初步讨论了在裂壶藻中类胡萝卜素与脂质代谢之间的关系。结果表明,作为碳源,葡萄糖相比甘油更有利于菌体生长,而甘油更有利于脂质,尤其是DHA的积累。此外,碳源不同,总类胡萝卜素的含量及组成也会因此而不同。当发酵7 d时,以甘油作碳源发酵得到的β-胡萝卜素含量是以葡萄糖作碳源时的3.25倍。而以葡萄糖为碳源发酵得到的番茄红素和虾青素含量分别是甘油发酵1.60倍和2.81倍。并且,在不同碳源发酵条件下,进入脂质反耗阶段后,菌体内PKS途径的脂肪酸比例均与总类胡萝卜素含量呈正相关,因此表明类胡萝卜素对细胞内多不饱和脂肪酸的稳定性发挥着积极作用。
裂殖壶菌,碳源,类胡萝卜素,脂代谢
裂殖壶菌(Schizochytrium)属于真菌门(Eumycota)、卵菌纲(Oomycetes)水霉目(Saprolegniales)、破囊壶菌科(Thraustochytriaceae)的一类类藻的海洋真菌[1]。其在一定培养条件下胞内可以积累大量的脂肪酸,同时会合成一定量的脂质伴随物,如类胡萝卜素、角鲨烯、甾醇等[2]。其中90%以上的脂质以中性脂质—甘油三酯(TG)的形式存在,易被人体吸收[3],因此是一种理想的适宜工业生产的产油微生物。裂殖壶菌的脂肪酸组成简单,主要有DHA(22∶6 n-3)、DPA(22-5 n-6)、豆蔻酸(C14∶0)和棕榈酸(C16∶0)等,其中DHA含量很高,相比于传统DHA来源的鱼油,具有品质稳定、产量高和安全性可靠等优势[4],受到人们的青睐。
类胡萝卜素作为裂殖壶菌重要的脂质伴随物,在胞内抗氧化方面发挥着重要作用。目前,类胡萝卜素在微生物中被广泛发现,如三孢布拉氏霉、黏红酵母以及杜氏盐藻等[5-7]。研究表明碳源种类、金属离子、C/N比以及溶氧等发酵条件都可能是影响微生物胞内类胡萝卜素含量和组成的重要因素[8-10]。目前,对于裂殖壶菌的研究主要集中在产脂方面,而对发酵过程中类胡萝卜素的变化以及其与脂质合成之间的关系研究较少。
本文将探究裂殖壶菌利用葡萄糖和甘油发酵过程中脂质和类胡萝卜素的组成及变化,结合胞内脂肪酸和类胡萝卜素的代谢通路,探讨二者间的内在联系,为利用类胡萝卜素来提高脂质品质提供理论基础。
1 材料与方法
1.1材料与仪器
裂殖壶菌ATCC20888美国菌种收藏中心;β-胡萝卜素标准品、番茄红素标准品和虾青素标准品美国Sigma公司;
菌种活化培养基(g/L):葡萄糖 5;蛋白胨 1;酵母粉 1;琼脂粉 18;海盐 30。pH用氢氧化钠调节至7.0,随后115 ℃灭菌20 min。
种子培养基(g/L):葡萄糖 30;酵母膏 5;氯化钠 0.3;硫酸钠 15;谷氨酸钠 5;硫酸钾 1;七水硫酸镁 3;磷酸氢二钾 2;磷酸二氢钾 3;氯化钙 0.02;维生素B10.005;维生素B60.002;维生素B120.005。pH用氢氧化钠调节至6.5,随后115 ℃灭菌20 min,其中葡萄糖单独灭菌。
摇瓶发酵培养基(g/L):葡萄糖/甘油75;酵母膏 10;氯化钠 0.3;硫酸钠 15;谷氨酸钠 15;硫酸钾 1;七水硫酸镁 4;磷酸二氢钾 0.1;氯化钙 0.05;维生素B10.008;维生素B60.002;维生素B120.008。pH用氢氧化钠调节至6.5,随后115 ℃灭菌20 min,其中葡萄糖和甘油单独灭菌。
超净工作台上海智城分析仪器制造有限公司ZHJH-C1112B;高压灭菌锅上海申安医疗器械厂LDZX-50KB;恒温振荡培养器上海智城分析仪器制造有限公司ZWY-211B;恒温培养箱上海一恒科技有限公司;烘箱Binder;超低温冰箱Thermo Scientific Herafreeze Basic;气相色谱仪Agilent Technologies 7820A;液相色谱仪Agilent Technologies 1100。
1.2实验方法
1.2.1培养条件将保藏于-80 ℃超低温冰箱中的甘油管菌株划线接种到菌种活化斜面上,于25 ℃下培养48 h。挑取活化后的单菌落,接种到含有种子培养基的250 mL摇瓶中,装液量50 mL,于25 ℃和200 r/min条件下培养48 h。经过两级种子扩增后,将5 mL种子液接种于含45 mL发酵培养基的250 mL摇瓶中,200 r/min,25 ℃培养7 d。每次三个平行,取平均值。
1.2.2类胡萝卜素的提取发酵结束后,离心取菌丝体避光冷冻干燥26 h,然后用提取液(二氯甲烷-甲醇=25-75,v/v)反复振荡提取,直至菌丝体呈几乎无色,离心浓缩萃取液,避光保存于-20 ℃。整个提取过程于暗室里进行。
1.2.3类胡萝卜素的测定β-胡萝卜素、虾青素以及番茄红素的含量均通过高效液相法测得[10]。并且以上三种类胡萝卜素含量之和计为总类胡萝卜素含量。
1.2.4总脂肪酸的提取将冷冻干燥后的菌丝体研磨均匀,精确称取1 g加入7 mL 20% HCl,于75 ℃水浴震荡40 min。然后用20 mL正己烷分三次抽提脂质,旋转蒸发脱溶后氮气吹除残留溶剂。称重并计算脂质占干重含量[11]。
1.2.5脂肪酸组成的分析气相色谱法。毛细管柱(CP Sil-88:50.0 m×250 μm×0.20 μm),FID检测器。进样温度250 ℃,进样体积1 μL。柱温条件:80 ℃保持2 min,然后以10 ℃/min速度升温到120 ℃,接着以5 ℃/min升温到180 ℃,保持2 min,最后以2 ℃/min升温到230 ℃,再在230 ℃保持5 min。氮气作为载气。以归一化方法计算各脂肪酸的百分含量。检测得到的脂肪酸DPA和DHA为PKS产物,而脂肪酸C14∶0,C16∶0和C18∶0作为FAS产物[12]。
1.2.6甘油浓度的测定高效液相色谱法。离心后的发酵液经煮沸后稀释,微孔滤膜过滤。色谱柱ZORBAX NH2(5 μm,250 mm×4.6 mm),洗脱条件为以70%乙腈平衡60 min,洗脱时间20 min,流速为1 mL/min,检测器为示差检测器。
1.2.7葡萄糖浓度的测定采用DNS法测得发酵液中葡萄糖浓度。
2 结果与分析
2.1碳源对生物量和脂质的影响
由图1可知,裂殖壶菌对葡萄糖的同化速率大于对甘油的同化速率,证明葡萄糖更有利于其生长[13]。发酵第4 d时,胞内脂质含量都达到最高,此时利用甘油发酵,胞内总脂比例(64.15%)和DHA占总脂肪酸的比例(39.35%)都分别高于利用葡萄糖发酵(61.05%和32.94%),说明甘油作碳源相比于葡萄糖更有利于裂壶藻的脂质,尤其是DHA的积累,这与常桂芳和李靖等人的实验结果一致[14-15]。从发酵第4 d起,裂殖壶菌胞内总脂比例不断下降,表明细胞开始从脂质积累阶段进入脂质反耗阶段。甘油作碳源条件下细胞脂质反耗的速率高于葡萄糖作碳源,前者反耗48 h后脂质反耗导致总脂损失达47.17%,远远高于后者的23.11%。

图1 裂殖壶菌分别以葡萄糖和甘油为碳源的发酵曲线Fig.1 Fermentation profiles of Schizochytrium ATCC20888 in batch cultures on glycerol and glucose separately
2.2碳源对类胡萝卜素含量的影响
在裂壶藻发酵过程中,细胞内脂质积累的同时,色素(尤其是类胡萝卜素)也在发生着变化。裂殖壶菌胞内的类胡萝卜素主要有β-胡萝卜素,虾青素和番茄红素[16]。由图2a可知,无论是以葡萄糖还是以甘油为碳源,β-胡萝卜素的含量随着发酵时间的推移而增加。发酵第4 d以后,细胞进入脂质反耗阶段,在以甘油为碳源条件下,胞内β-胡萝卜素的增加量和积累速率远远高于以葡萄糖为碳源。发酵第7 d,甘油为碳源条件下胞内β-胡萝卜素产量是葡萄糖为碳源条件下的3.25倍。与β-胡萝卜素不同,在以葡萄糖为碳源条件下胞内番茄红素和虾青素含量的积累比以甘油为碳源条件下更迅速,在发酵7 d番茄红素和虾青素含量的积累分别是甘油组的1.60倍和2.81倍,这可能是由于裂壶藻在以葡萄糖为碳源条件下,细胞进入脂质反耗时胞内环境的改变刺激了胞内虾青素和番茄红素的合成[17]。

图2 发酵过程中胞内β-胡萝卜素、虾青素和番茄红素的变化Fig.2 Change of β-carotene, astaxanthin and lycopeneconcentration during fermentation by Schizochytrium ATCC20888注:(a)β-胡萝卜素,(b)番茄红素,(c)虾青素。
2.3类胡萝卜素与脂质之间的关系
如图4所示,裂殖壶菌脂肪酸的合成主要有FAS途径和PKS途径,聚酮合成酶PKS系统主要负责催化合成多不饱和脂肪酸如DPA和DHA等,脂肪酸合成酶FAS负责催化合成短链饱和脂肪酸如C14∶0,C16∶0和C18∶0[11-12]等。这两种途径都需要乙酰辅酶A和NADPH的参与[18]。而类胡萝卜素合成的也需要以乙酰辅酶A为底物[19],因此,类胡萝卜素的合成与脂肪酸的合成存在着底物竞争的关系。当底物充足时,胞内总脂和类胡萝卜素的含量都会上升。当进入到脂质反耗后,胞内能量主要来自脂质氧化,为类胡萝卜素的合成提供底物[8],因此探究FAS和PKS不同代谢产物与类胡萝卜素之间的关系,对揭示脂质代谢和类胡萝卜素合成有重要作用。
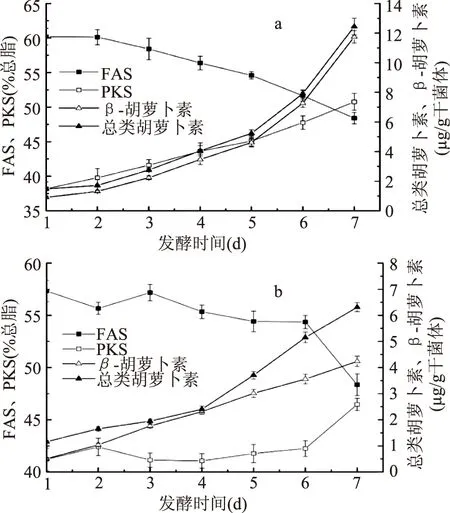
图3 碳源对脂质和类胡萝卜素合成的影响Fig.3 Effects of the carbon source on the accumulation of lipids and carotenoids during fermentationby Schizochytrium ATCC20888注:(a)以甘油为碳源,(b)以葡萄糖为碳源。
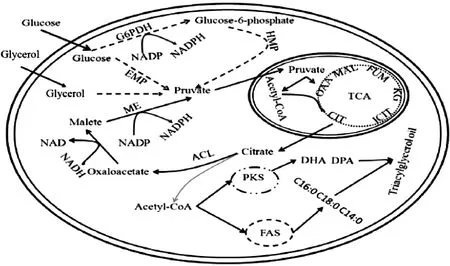
图4 裂殖壶菌胞内脂质合成途径Fig.4 Generalized pathway for thesynthesis of lipids in Schizochytrium
从图3a和图3 b可以看出,在裂殖壶菌以葡萄糖或甘油为底物发酵时,胞内积累的类胡萝卜素主要是β-类胡萝卜素,当培养基中氮源不足但有过量的碳源时,就会刺激胞内脂质和类胡萝卜素的积累[20]。
在发酵第4 d到第7 d的脂质反耗阶段,以甘油为碳源条件下FAS产物的比例由56.4%降低到48.41%,以葡萄糖为碳源发酵时FAS产物比例也降低了12.65%。同时PKS产物被“相对浓缩”了,这说明FAS产物相比PKS产物被优先降解,经β-氧化途径供能,以维持细胞正常的生理代谢。与此同时发酵第7 d时的单位干菌体总类胡萝卜素含量m葡萄糖(μg/g干菌体)比发酵第4 d增加了162.50%,发酵第7 d的m甘油(μg/g干菌体)比发酵第4 d增加了207.16%,这可能是由于进入反耗阶段后,发酵液中溶氧上升,引发氧化应激反应,这种氧化应激会刺激胞内类胡萝卜素的合成[21],由于类胡萝卜素通常积累于油体上,类胡萝卜素的增加提高了细胞的抗氧化能力[22],从而对PKS产物,即不饱和脂肪酸DHA和DPA起到了保护作用。
3 结论
以甘油为碳源发酵相比以葡萄糖为碳源更有利于裂殖壶菌胞内脂质和总类胡萝卜素的合成。在脂质积累阶段,β-胡萝卜素是胞内主要的类胡萝卜素。进入脂质反耗后,以葡萄糖为碳源发酵时虾青素和番茄红素的含量和积累速率显著增加。无论以甘油或葡萄糖为碳源发酵,进入脂质反耗后,总类胡萝卜素含量与PKS产物占总脂肪酸的比例都呈正相关关系,因此提高类胡萝卜素含量,可以提高胞内多不饱和脂肪酸的稳定性。
[1]Li Q,Chen GQ,Fan K,et al. Screening and characterization of squalene-producingthraustochytridsfrom Hong Kong mangroves[J]. Journal of Agricultural and Food Chemistry,2009,57(10):4267-4272.
[2]Ren L J,Sun G N,Ji X J,et al. Compositional shift in lipid fractions during lipid accumulation and turnover in Schizochytrium sp[J]. Bioresource Technology,2014(157):107-113.
[3]Yaguchi T,Tanaka S,Yokochi T,et al. Production of high yields of docosahexaenoic acid bySchizochytriumsp. strain SR21[J]. Journal of the American Oil Chemists’ Society,1997,74(11):1431-1434.
[4]魏萍,马小琛,任路静,等. 裂殖壶菌发酵生产DHA研究进展[J]. 食品工业科技,2010,31(10):398-401.
[5]Hu X,Sun J,Yuan Q. Improvedβ-carotene biosynthesis and gene transcription inBlakesleatrisporawith arachidonic acid[J]. Biotechnology letters,2012,34(11):2107-2111.
[6]孙协军,李秀霞,励建荣,等. 杜氏盐藻β-胡萝卜素提取皂化工艺参数优化[J]. 中国食品学报,2014,14(11):90-95.
[7]Yen H W,Chang J T. Growth of oleaginousRhodotorulaglutinisin an internal-loop airlift bioreactor by using lignocellulosic biomass hydrolysate as the carbon source[J]. Journal of Bioscience and Bioengineering,2015,119(5):580-584.
[8]Mata-Gómez L C,Montaez J C,Méndez-Zavala A,et al. Biotechnological production of carotenoids by yeasts:an overview[J]. Microbial Cell Factories,2014,13(1):1-12.
[9]Nanou K,Roukas T. Oxidative stress response ofBlakesleatrisporainduced by iron ions during carotene production in shake flask culture[J]. Applied Biochemistry and Biotechnology,2013,
169(8):2281-2289.
[10]Nanou K,Roukas T,Papadakis E. Oxidative stress and morphological changes inBlakesleatrisporainduced by enhanced aeration during carotene production in a bubble column reactor[J]. Biochemical Engineering Journal,2011,54(3):172-177.
[11]Chang G F,Luo Z L,Gu S T,et al. Fatty acid shifts and metabolic activity changes ofSchizochytriumsp. S31 cultured on glycerol[J]. Bioresource Technology,2013(142):255-260.
[12]Ratledge C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie,2004(86):807-815.
[13]Yokochi T,Honda D,Higashihara T,et al. Optimization of docosahexaenoic acid production by Schizochytrium limacinum SR21[J]. Applied Microbiology and Biotechnology,1998,49(1):72-76.
[14]Chang G F,Gao N,Tian G,et al. Improvement of docosahexaenoic acid production on glycerol bySchizochytriumsp.S31 with constantly high oxygen transfer coefficient[J]. Bioresource Technology,2013(142):400-406.
[15]Li J,Liu R J,Chang G F,et al. A strategy for the highly efficient production of docosahexaenoic acid by Aurantiochytrium limacinum SR21 using glucose and glycerol as the mixed carbon sources[J]. Bioresource Technology,2015(177):51-57.
[16]张娟梅,江贤章,黄建忠. 裂殖壶菌 Schizochytrium sp. FJU-512细胞油脂的研究[J]. 福建师范大学学报:自然科学版,2007,3(2):75-80.
[17]Bhosale P. Environmental and cultural stimulants in the production of carotenoids from microorganisms[J]. Appl Microbiol Biotechnol,2004,63(4):351-361.
[18]Lippmeier J C,Crawford K S,Owen C B,et al. Characterization of both polyunsaturated fatty acid biosynthetic pathways inSchizochytriumsp[J]. Lipids,2009,44(7):621-630.
[19]郑琰晶,李赟. 类胡萝卜素合成酶基因及海洋微藻合成类胡萝卜素的研究进展[J]. 海洋湖沼通报,2004(1):88-95
[20]Zhang Z,Zhang X,Tan T. Lipid and carotenoid production byRhodotorulaglutinisunder irradiation/high-temperature and dark/low-temperature cultivation[J]. Bioresource Technology,2014,157(4):149-153.
[21]Nanou K,Roukas T,Papadakis E. Improved production of carotenes from synthetic medium byBlakesleatrisporain a bubble column reactor[J]. Biochemical Engineering Journal,2012,67(2):203-207.
[22]Davoli P,Mierau V,W S R. Carotenoids and fatty acids in red yeastssporobolomycesroseusandrhodotorulaglutinis[J]. Applied Biochemistry and Microbiology,2004(40):392-397.
Influence of carbon source on the accumulation of carotenoid during theSchizochytriumATCC20888 fermentation
LIU Yuan,LI Lei-lei,ZHANG Tao,LOU Fei,CHANG Ming,JIN Qin-zhe*,WANG Xing-guo
(State Key Laboratory of Food Science and Technology & School of Food Science and Technology,Jiangnan University,Wuxi 214122,China,)
The biosynthesis of lipids and carotenoids during theSchizochytriumATCC20888 fermentation was investigated in this study using glucose and glycerol as single carbon source,separately. The results showed glucose benefited cell growth more than glycerol while glycerol fermentation was better for the accumulation of lipid especially of DHA. Besides,it showed Different content and composition of carotenoids were observed between the different carbon sources. After 7 days fermentation,the content ofβ-carotene when used glycerol as carbon source was 3.25 folds of that used glucose,while the content of lycopene and astaxanthin of the latter were 0.60 and 1.81 times higher than the former. There was a positive correlation between the carotenoids content and PKS products during the turnover stage with both carbon source,which indicated that carotenoids might play an important role in increasing the stability of the PUFAs in cells.
Schizochytrium;carbon source;carotenoids;metabolism of fatty acids
2015-12-16
刘源(1990-),男,硕士研究生,研究方向:微生物油脂,E-mail:liu314yuan@126.com。
金青哲(1962-),男,博士,教授,主要从事油脂化学方向,E-mail:jqzwuxi@163.com。
国家自然基金青年基金项目(31401619);江苏省自然基金青年基金项目(BK20140156)。
TS201.3
A
1002-0306(2016)13-0148-04
10.13386/j.issn1002-0306.2016.13.021

