产甲壳素酶多粘类芽孢杆菌A1的筛选鉴定及发酵产酶条件研究
杜敬河,王 栩,朱永安,吴凤英,段 杉,*
(1.华南农业大学食品学院,广东广州 510642;2. 广东省天然活性物工程技术研究中心,广东广州 510642;3.广东永昊食品有限公司,广东阳江 529536)
产甲壳素酶多粘类芽孢杆菌A1的筛选鉴定及发酵产酶条件研究
杜敬河1,2,王栩1,朱永安1,吴凤英3,段杉1,2,*
(1.华南农业大学食品学院,广东广州 510642;2. 广东省天然活性物工程技术研究中心,广东广州 510642;3.广东永昊食品有限公司,广东阳江 529536)
从土壤中分离得到一株产甲壳素酶的细菌,经形态学、生理生化及分子生物学鉴定,确定为多粘类芽孢杆菌,命名为A1。研究发现甲壳素、壳聚糖和淀粉可诱导该菌产甲壳素酶;添加尿素可提高甲壳素酶产量。本文研究确定该菌发酵产酶条件如下:培养基采用1%甲壳素(120目),0.05% MgSO4·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,初始pH4.5,接种龄12 h,接种量1%,于37 ℃培养78 h,在此条件下,该菌产甲壳素酶水平达到0.549 U/mL。该菌在对数期,其产酶曲线的上升略滞后于生长曲线变化;而在衰亡期,产酶曲线的降低略早于生长曲线的降低,说明该酶的mRNA的稳定性较差。
甲壳素酶,多粘类芽孢杆菌,发酵条件
甲壳素(chitin)又称几丁质,广泛存在于虾、蟹等甲壳类动物以及低等生物菌类、藻类细胞中,是自然界中产量仅次于纤维素的第二大生物资源,它是由N-乙酰氨基-D-葡萄糖单体(D-GlcNAc)通过β-1,4糖苷键连接而成的直链高分子化合物[1-3]。甲壳素酶(chitinase E.C.3.2.1.14)又称几丁质酶,可以降解甲壳素生成甲壳寡糖。甲壳寡糖是甲壳素糖链β-1,4糖苷键断裂形成的寡聚体,具有抑菌、抗肿瘤、保湿、提高植物防御力等功能[4],已被广泛应用到各个领域。
1961年,Euniauxc在动物体内发现甲壳素酶,目前已在细菌、真菌和植物中均发现甲壳素酶的存在。已报道产甲壳素酶的细菌主要有弧菌(Vibrio)、粘质沙雷氏菌(Serratiamarcescens)、假单胞菌(Pseudomonas)、类芽孢杆菌(Paenibacillus)和芽孢杆菌(Bacillus)等[5-6]。多数微生物只有在含有甲壳素等诱导物的培养基中才能产生甲壳素酶,所产甲壳素酶多是分泌型的,即胞外酶[7]。
本文从土壤中筛选出一株产甲壳素酶的多粘类芽孢杆菌,并对其发酵产酶条件进行了初步研究。
1 材料和方法
1.1材料与仪器
土壤样品广州华南农业大学校园内湖边、宁波海边、阳江海边等地;甲壳素按照文献[8]的条件制备甲壳素;ZR Fungal/Bacterial DNA KitTMZYMO RESEARCH;27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′通用引物广州生工生物科技有限公司合成;DNA Marker DL2000NEW GENE BIOTECHNOLOGY;Goldview染料(含量95%)CAT;6×上样缓冲液WOSLEN;2×Taq PCR Master MixDBI;其他试剂均为市售分析纯试剂。
pHS-3CW酸度计上海般特仪器有限公司;LDZX-40B型立式自控电热蒸汽灭菌器上海申安医疗器械厂;EnSpire酶标仪PerkinElmer公司;PCR仪Bio-Rad公司。
1.2培养基
初筛培养基组成(w/v):1%胶体甲壳素,1%(NH4)2SO4,0.07% K2HPO4,0.03% KH2PO4,0.5% NaCl,0.05% MgS04·7H2O,0.3%酵母提取粉,1.5%琼脂,pH为6.0。
胶体甲壳素的制备:称取10 g甲壳素(100目),缓缓加入浓盐酸200 mL,迅速搅拌,待其全部溶解后用玻璃棉过滤除去杂质,溶液加入1000 mL蒸馏水。离心得到沉淀,用蒸馏水洗至中性,冷冻干燥即得胶体甲壳素[9]。
复筛培养基组成(w/v):1%胶体甲壳素,1%(NH4)2SO4,0.07% K2HPO4,0.03% KH2PO4,0.5% NaCl,0.05% MgS04·7H2O,0.3%酵母提取粉,pH为6.0。
发酵培养基组成(w/v):1%甲壳素,0.05% MgS04·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,pH为4.5。
种子培养基:LB培养基。
1.3实验方法
1.3.1菌株初筛将土壤用无菌水稀释后,涂布于初筛培养基平板上,于37 ℃培养箱中培养3~4 d。挑取菌落周围有明显透明圈的菌落,再采用平板划线法分离纯化。
1.3.2菌株复筛挑取初筛得到的菌落,接种到100 mL液体复筛培养基中,37 ℃恒温揺床160 r/min培养72 h,测定发酵上清液中的甲壳素酶活力。
1.3.3甲壳素酶活力的测定参考韩宝芹[10]的测定方法,并改进如下:将发酵液于4 ℃下10000 r/min离心5 min得上清液,取0.1 mL上清液(对照组中的酶液先在100 ℃煮沸5 min灭活),加入1.9 mL 1%胶体甲壳素(将胶体甲壳素溶于0.05 mol/L pH5.0 HAc-NaAc缓冲溶液中),混匀后于50 ℃水浴中反应0.5 h,再加入3 mL DNS溶液,沸水浴反应5 min,冷却后定容至25 mL,于520 nm处测定吸光值。酶活力单位(U)定义:上述条件下,1 mL酶液1 min转化甲壳素产生1 μmol N-乙酰氨基葡萄糖所需的酶量为1个酶活力单位,同时以N-乙酰氨基葡萄糖制作标准曲线。
1.3.4菌株鉴定
1.3.4.1形态学鉴定参考《伯杰氏系统细菌学手册》[11]对菌株进行形态鉴定。
1.3.4.216S rDNA鉴定及系统进化树的构建提取待鉴定菌株的DNA,采用细菌通用引物27F和1492R扩增细菌的16S rDNA[12]。PCR反应条件为95 ℃预变性3 min;95 ℃变性30 s;55 ℃退火45 s,72 ℃延伸l.5 min,30个循环,最后72 ℃延伸10 min,4 ℃保存。反应结束后,取5 μL PCR反应液,在加Gold View的1%琼脂糖凝胶电泳液中电泳30 min,用凝胶成像系统检测扩增结果。将PCR扩增产物送往广州生工生物科技有限公司进行测序,并将测序结果在NCBI数据库中查找与之匹配的核苷酸序列。利用MEGA 5.1软件构建系统进化树。
1.3.4.3生理生化鉴定细菌的生理生化鉴定参考《伯杰氏系统细菌学手册》[11]和文献[13]方法进行。
1.3.5发酵条件研究将5 mL种子液(培养24 h)接种于100 mL复筛培养基中,37 ℃恒温揺床160 r/min培养72 h。
不同碳源对菌株A1发酵产酶的影响:在培养基中分别以1%蔗糖、1%葡萄糖、1% N-乙酰氨基葡萄糖、1%可溶性淀粉、1%甲壳素(120目)、1%壳聚糖和1%胶体甲壳素作为碳源,培养72 h后测定发酵上清液中的酶活力。
不同氮源对菌株A1发酵产酶的影响:在培养基中分别以1%(NH4)2SO4、1% NaNO3、1% NH4NO2、1%牛肉膏、1%蛋白胨和1%尿素作为氮源,培养72 h后测定发酵上清液中的酶活力。
尿素浓度对菌株A1发酵产酶的影响:调节培养基中的尿素浓度,培养72 h后测定发酵上清液中的酶活力。
不同发酵温度对菌株A1发酵产酶的影响:培养温度对微生物的生长及代谢有着重要的影响,在不同的培养温度下微生物产酶种类和数量各不相同。分别在30、35、37、40、45 ℃条件下,培养72 h后测定发酵上清液中的酶活力。
培养基不同pH对菌株A1发酵产酶的影响:将培养基的初始pH分别调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,培养72 h后测定发酵上清液中的酶活力。
种龄对菌株A1发酵产酶的影响:在培养基中分别接种12、18、24、36、48 h不同种龄的菌液,培养72 h后测定发酵上清液中的酶活力。

表2 菌株A1生理生化特征
注:“+”.阳性,“-”.阴性 。

表3 碳源对发酵产酶的影响
注:“-”.未检测到酶活力。
接种量对菌株A1发酵产酶的影响:分别按1%、5%、10%、15%、20%(体积分数)的接种量接种到培养基中,培养72 h后测定发酵上清液中的酶活力。
1.3.6菌株A1的生长曲线及产酶曲线测定在确定了发酵培养基组成和发酵条件后,在此条件下发酵培养菌株A1,每隔6~12 h取样,采用比浊法于600 nm波长处测定该菌发酵液的光密度,绘制生长曲线;同时测定发酵上清液的甲壳素酶活力,绘制产酶曲线。

图2 系统发育进化树Fig.2 Phylogenetic tree of strain A1
2 结果与分析
2.1产甲壳素酶菌株的初筛
在以胶体甲壳素为唯一碳源的初筛培养基上,发现5株产生透明圈的细菌,通过平板划线法分离纯化并进行保存。
2.2产甲壳素酶菌株的复筛
表1为5株细菌发酵上清液中的甲壳素酶活力,发现其中A1的酶活力明显高于其他菌株。因此,选择A1菌株作为甲壳素酶的产生菌株。
2.3菌种鉴定
从图1可以看出,菌株A1在初筛培养基上形成圆形、乳白色菌落,菌落稍凸起,湿润光滑,边缘整齐,挑起有黏性。菌株A1经革兰氏染色实验观察为革兰氏阴性菌。
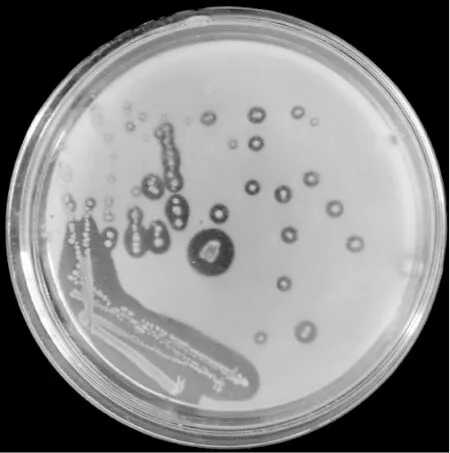
图1 菌株A1的菌落形态Fig.1 Colony morphology of strain Al
将菌株A1的16S rDNA序列提交到NCBI的GenBank数据库进行比对,与多粘类芽孢杆菌相似度达到99%。MEGA 5.1软件系统发育树分析结果显示,该菌株的遗传进化与多粘类芽孢杆菌最近,构成一个分支(图2)。
菌株A1生理生化特征如表2所示,与《伯杰氏系统细菌学手册》(第九版)芽孢杆菌目,类芽孢杆菌科,类芽孢杆菌属,多粘类芽孢杆菌的描述相符。
结合形态学、生理生化特征和16S rDNA序列分析结果,将菌株A1鉴定为多粘类芽孢杆菌(Paenibacillus polymyxa)。
2.4发酵条件
2.4.1碳源对发酵产酶的影响表3显示,多粘类芽孢杆菌A1以粉末甲壳素作为碳源时,甲壳素酶活力最高;其次是胶体甲壳素、壳聚糖和可溶性淀粉,分别为最高酶活力的53%、24%和17%。该菌以葡萄糖、蔗糖和N-乙酰氨基葡萄糖作为碳源时均可生长,但不能产生甲壳素酶,表明该菌所产甲壳素酶为诱导酶。
2.4.2氮源对发酵产酶的影响由图3可知,氮源对多粘类芽孢杆菌A1产甲壳素酶影响很大,其中以尿素作为氮源时甲壳素酶最高,其次是硝酸钠和硫酸铵。在以牛肉膏和蛋白胨作为氮源时,该菌生长繁殖速度快,但产甲壳素酶能力低。

图3 氮源对多发酵产酶的影响Fig.3 Effects of various nitrogen sources on chitinase production
2.4.3尿素浓度对发酵产酶的影响从图4可以看出,随着培养基中尿素浓度的增加,多粘类芽孢杆菌A1产甲壳素酶能力先增高后降低;当尿素浓度为1.2%时,甲壳素酶活力达到最大值。

图4 尿素浓度对发酵产酶的影响Fig.4 Effects of different concentrations of CO(NH2)2 on chitinase production
2.4.4培养温度对发酵产酶的影响从图5可以看出,培养温度在35~40 ℃范围内,多粘类芽孢杆菌A1产甲壳素酶较高;当培养温度为37 ℃时,甲壳素酶活力达到最大值。当培养温度高于40 ℃或低于35 ℃时,甲壳素酶活力均会显著降低。

图5 温度对发酵产酶的影响Fig.5 Effect of temperatures on chitinase production
2.4.5培养基初始pH对发酵产酶的影响从图6可以看出,培养基初始pH在4.0~5.0之间变动时,pH对多粘类芽孢杆菌A1产甲壳素酶影响不大,都保持在较高水平;当初始pH为4.5时,甲壳素酶活力达到最大值。当初始pH大于5.0时,随着pH的增大,甲壳素酶活力逐渐降低。
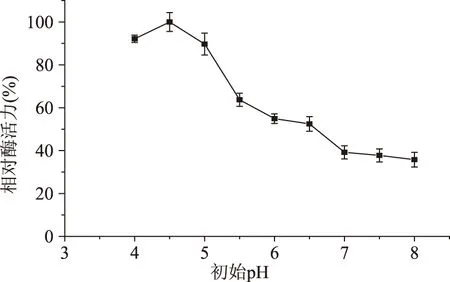
图6 培养基初始pH对发酵产酶的影响Fig.6 Effect of initial medium pH on chitinase production
2.4.6接种龄对发酵产酶的影响从图7可以看出,当接种龄为12 h时,多粘类芽孢杆菌A1产甲壳素酶活力最高;12 h后,随着种龄时间的延长,甲壳素酶活力逐渐降低,在24 h后基本保持不变。12 h左右时该菌种处于对数期,此时细胞的生命力最强,生长至24 h左右时该菌种已进入稳定期,此时细胞的代谢活力开始减弱。

图7 接种龄对发酵产酶的影响Fig.7 Effect of inoculating age on chitinase production
2.4.7接种量对发酵产酶的影响从图8可以看出,接种量对多粘类芽孢杆菌A1产甲壳素酶活力影响不大。当接种量为1%时,甲壳素酶活力最高;当接种量为5%~20%时,甲壳素酶活力随接种量的增加而略有下降,推测这是因为过多的接种量导致装液量增加,溶氧不足,细菌增殖缓慢,甲壳素酶活力降低。
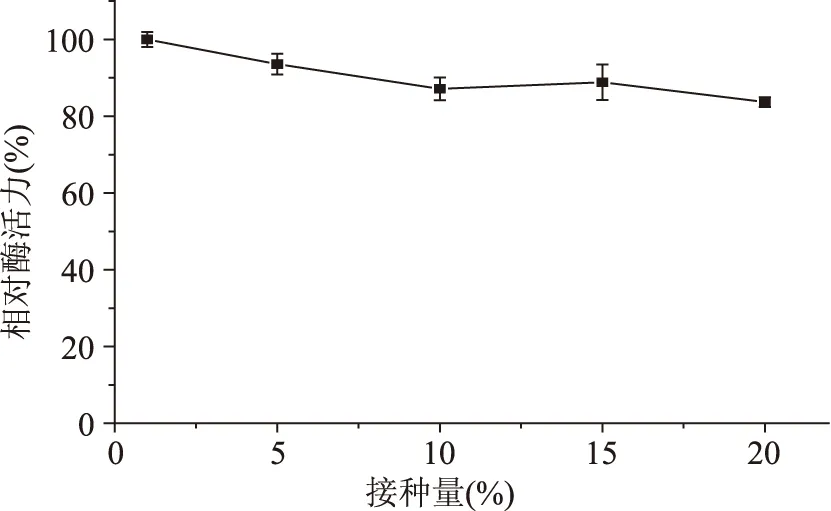
图8 接种量对发酵产酶的影响Fig.8 Effect of inoculum size on chitinase production
2.5菌株的生长曲线和产酶曲线测定
从图9可以看出,多粘类芽孢杆菌A1在12 h时开始迅速生长,进入对数生长期;78 h左右进入稳定期,之后菌体密度不再随培养时间的延长而增加;108 h后菌体密度开始降低,进入衰亡期。12 h左右,甲壳素酶活力开始出现,酶活力的最高峰几乎与生长曲线的最高峰同时出现,在78 h时达到最大值0.549 U/mL;随着培养时间延长,甲壳素酶活力不再上升;96 h时,酶活力开始逐渐下降。根据细胞生长与产酶的关系,可以把酶生物合成的模式分为4种类型:同步合成型、延续合成型、中期合成型、滞后合成型。该菌在对数期,其产酶曲线的上升略滞后于生长曲线变化;而在衰亡期,产酶曲线的降低略早于生长曲线的降低,说明甲壳素酶合成模式为中期合成型,该酶的mRNA的稳定性较差[14]。

图9 菌株A1生长和产酶曲线Fig.9 Time course of growth and enzyme production of strain A1
3 结论与讨论
经鉴定产甲壳素酶菌株A1为多粘类芽孢杆菌(Paenibacilluspolymyxa)。通过单因素实验对多粘类芽孢杆菌A1的发酵条件进行了初步研究,得到其产甲壳素酶的发酵条件为:1%甲壳素,0.05% MgSO4·7H2O,1.2%尿素,0.5% NaCl,0.07% K2HPO4,0.03% KH2PO4,0.3%酵母提取粉,培养基起始pH4.5,于37 ℃培养78 h。在此发酵条件下,该菌产甲壳素酶水平达到0.549 U/mL。该菌所产甲壳素酶为胞外酶,以甲壳素、壳聚糖和淀粉为底物可以诱导该菌产甲壳素酶;葡萄糖、蔗糖和N-乙酰氨基葡萄糖都不能诱导该菌产甲壳素酶。
多粘类芽孢杆菌(Paenibacilluspolymyxa)是一类重要的植物生防细菌和根际促生菌。2002年,美国环保署(EPA)已将其列为可商业上应用的微生物种类之一,对人和动植物没有致病性[15-16]。目前国内对多粘类芽孢杆菌的研究主要集中在:其对植物病害的防治、所产代谢活性物质的种类及抗菌机理等方面[17-18],对其产甲壳素酶的相关研究未见报道。
[1]伊金玲.产甲壳素酶菌株HD002的筛选鉴定发酵条件优化酶的分离纯化及酶学性质研究[D].青岛:中国海洋大学,2010.
[2]Gooday GW. The Ecology of Chitin Degradation[M]. New York:Plenum Press,1990:387-430.
[3]Shaikh SA,Deshpande MV. Chitinolytic enzymes:their contribution to basic and applied research[J]. Microbiol Biotechnol,1993,9(4):468-475.
[4]Tzu-Wen Liang,Yue-Yin Chen,Po-Shen Pan,et al. Purification of chitinase/chitosanase from Bacillus cereus and discovery of an enzyme inhibitor[J]. International journal of biological macromolecules,2014,63:8-14.
[5]付星,闫巧娟,江正强,等.高产几丁质酶巴伦葛兹类芽孢杆菌的筛选和发酵条件优化[J].微生物学通报,2015,42(4):625-633.
[6]于潇淳.产甲壳素酶菌株HD001的筛选、发酵及酶的分离纯化与酶学性质研究[D].青岛:中国海洋大学,2008.
[7]许梦秋,钟增明,龚琰,等.几丁质酶在植物病害生物防治中的应用[J].现代农业科技,2010,(5):122-123.
[8]Shan Duan,Li Lei,Liu Shi-ya,et al. Improved production of chitin from shrimp waste by fermentation with epiphytic lactic acid bacteria[J]. Carbohydrate Polymers,2012,89:1283-1288
[9]Paraman Ilankovan,San Hein,Chuen-How Ng,et al. Production of N-acetyl chitobiose from various chitin substrates using commercial enzymes[J]. Carbohydrate Polymers,2006,63:245-250.
[10]韩宝芹,伊金玲,蔡文娣,等.产甲壳素酶菌株的发酵条件、酶的分离纯化及酶学性质研究[J].中国海洋大学学报,2010,40(10):57-62.
[11]Holt JG. Bergey’s Manual of Determinative Bacteriology[M]. 9th Edition. Baltimore:Williams & Wilkins,1994:190-255.
[12]Yimin Cai,Y Benno,M Ogawa,et al. Effect of Applying Lactic Acid Bacteria Isolated from Forage Crops on Fermentation Characteristics and Aerobic Deterioration of Silage[J]. Journal of Dairy Science,1999,82(3):520-526.
[13]Bloemberg G,Lugtenberg VBJ. Molecular basis of plant growth promotion and biocontrol by Rhizobacteria[J]. Current Opinion in Plant Biology,2001,4(4):343-350.
[14]郭勇.酶学工程[M].北京:科学出版社,2009:35-39.
[15]Choong-min R,Jinwook,Okheec,et al. Improvement of biological control capaeity of E681 by seed pelleting on sesame[J]. Biological Control,2006,39(3):282-289.
[16]韩俊华,陈大欢,黄继翔.响应面法优化多粘类芽孢杆菌HT16产生抗菌蛋白的培养基[J].食品工业科技,2014,35(13):262-266.
[17]程爱芳,邓政东,陈文,等.多粘类芽孢杆菌HD-1产纤维素酶的条件优化[J].食品工业科技,2015,36(10):173-177.
[18]苍桂璐,张付云,杨阳,等.多粘类芽孢杆菌的研究进展[J].安徽农业科学,2013,41(2):487-489.
Screening of a strain of chitinase producingPaenibacilluspolymyxaA1 and investigation on its fermentation conditions for chitinase production
DU Jing-he1,2,WANG Xu1,ZHU Yong-an1,WU Feng-ying3,DUAN Shan1,2,*
(1.College of Food Science,South China Agricultural University,Guangzhou 510642,China;2.Guangdong Engineering Research Center of Natural Active Substance,Guangzhou 510642,China;3.Guangdong Yonghao Foods Limited,Yangjiang 529536,China)
A strain of chitinase producing bacteria was isolated from soil,and was identified to bePaenibacilluspolymyxabased on its morphological,physiological and biochemical characteristics and 16S rDNA sequencing. The strain was named as A1. Chitin,chitosan and starch can induce A1 to produce chitinase. The adding of urea in medium improved the production of chitinase. The fermentation conditions for chitinase production were determined as follows:the fermentation medium consisting of 1% chitin(120 mesh),0.05% MgSO4·7H2O,1.2% CO(NH2)2,0.5% NaCl,0.03% KH2PO4,0.07% K2HPO4,0.3% yeast extract powder,pH4.5,starter culture age 12 h,inoculum size 1%,fermenting at 37 ℃ for 78 h. Under such conditions,the chitinase activity achieved 0.549 U/mL. At the exponential phase,the rising of chitinase production curve slightly lagged behind the growth curve of A1,at the decline phase,the falling of chitinase production curve was slightly earlier than the falling of growth curve. The results indicated that the mRNA of the chitinase was unstable.
Chitinase;Paenibacilluspolymyxa;fermention condition
2016-01-14
杜敬河(1991-),男,硕士研究生,研究方向:水产品加工与贮藏,E-mail:dujingheyouxiang@163.com 。
段杉(1966-),男,博士,副教授,研究方向:水产品综合利用,E-mail:duanshan@scau.edu.cn。
广东省省部产学研合作专项资金项目(2013B090600111);广东省教育厅科研项目(2013gjhz0003)。
TS201.1
A
1002-0306(2016)13-0157-05
10.13386/j.issn1002-0306.2016.13.023

