产木聚糖酶毕赤酵母工程菌株构建及表达条件优化研究
周晨妍,刘振华,王丹丹,2,李同彪,高启禹
(1.新乡医学院生命科学技术学院,合成生物学改造工程与应用实验室,河南新乡 453000;2.新乡医学院三全学院,河南新乡453000)
产木聚糖酶毕赤酵母工程菌株构建及表达条件优化研究
周晨妍1,刘振华1,王丹丹1,2,李同彪1,高启禹1
(1.新乡医学院生命科学技术学院,合成生物学改造工程与应用实验室,河南新乡 453000;2.新乡医学院三全学院,河南新乡453000)
将黑曲霉XZ-3S木聚糖酶Xyn43A成熟肽基因插入表达载体pPIC9K,重组质粒SalⅠ线性化后分别电击转化2种毕赤酵母GS115和KM71,转化液经MD平板、G418浓度梯度平板和摇瓶复筛,获得两株重组菌GS115/Xyn43A(Mut+)和KM71/Xyn43A(Muts)。其中GS115/Xyn43A菌株最优表达条件为:甲醇浓度2.0%,接种时间24 h,诱导时间108 h,诱导温度30 ℃、诱导培养基初始pH6.3;KM71/Xyn43A菌株最优表达条件为:甲醇浓度1.75%,接种时间26 h,诱导时间132 h,诱导温度30 ℃、诱导培养基初始pH6.5。在最优表达条件下两重组菌GS115/Xyn43A和KM71/Xyn43A比酶活力分别可达139.36、143.29 U/mg。
黑曲霉,毕赤酵母,木聚糖酶,诱导表达
木聚糖酶作为一种十分重要的水解酶类[1],广泛应用于工业生产中[2-3]。自然界中木聚糖酶的来源非常广,很多细菌、真菌、放线菌等都可产生木聚糖酶[4-5]。木聚糖酶种类很多,分布于糖基水解酶GH5,7,8,10,11,16,43,52及62多个家族,目前报道的木聚糖酶主要归属于糖基水解酶GH10和GH11两大家族[6-8],其他家族的木聚糖酶报道偏少。
在前期的研究过程中,已从实验室保藏的黑曲霉(Aspergillusniger)XZ-3S中克隆出木聚糖酶Xyn43A基因,并对其进行了详细的生物信息学分析,前期研究发现它是一种新的木聚糖酶基因,属于糖基水解酶GH43家族[9]。鉴于毕赤酵母体系表达异源蛋白的诸多优势[10],本研究将木聚糖酶Xyn43A基因在2种毕赤酵母GS115(Mut+)和KM71(Muts)中表达,并对表达条件进行了优化,以期为该酶后续重组酶酶学性质测定及结构与功能研究奠定基础。
1 材料与方法
1.1材料与仪器
pMD18-T-xyn43A重组载体由作者所在实验室构建保存;E.coliDH5α、表达质粒pPIC9K及毕赤酵母(Pichiapastoris)GS115(Mut+)和KM71(Muts)Invitrogen公司。限制性内切酶、DNA聚合酶、T4DNA连接酶TaKaRa公司;胶回收试剂盒、质粒提取试剂盒Sangon公司;G418、无氨基酵母氮源(YNB)Amresco公司;桦木木聚糖Sigma公司;其他生化试剂均为国产或进口分析纯产品。实验所用酵母培养基YPD、MD、BMGY、BMMY的配制方法均参照Invitrogen公司的毕赤酵母操作手册。
梯度PCR扩增仪(C1000);电转化仪(Gene PulserⅡ)美国BIO-RAD公司;稳压稳流电泳仪(DYY-2)北京市六一仪器厂;低温恒温槽(DC-0506)上海比朗仪器有限公司;恒温振荡器(HZQ-F160A)上海一恒科学仪器有限公司;高速冷冻离心机(Neofuge 23R)上海力申科学仪器有限公司。
1.2毕赤酵母重组表达载体的构建
根据xyn43A基因序列(Genbank:JQ700383)及pPIC9K表达载体上多克隆位点的特点,设计以下引物:正向引物PC:5′-CCGGAATTCAATCCCGTC TTCCCCGGCT-3′(EcoRⅠ);PZ:5′-ATAAGAAT GCGGCCGCCTACGATACGATAAAGTCCTCC-3′(NotⅠ)。引物由苏州金唯智生物科技有限公司合成。
以重组质粒pMD18-T-xyn43A为模板,PC、PZ为引物进行PCR扩增。PCR扩增条件为:94 ℃反应2 min;94 ℃ 30 s变性,67 ℃ 30 s退火,72 ℃ 1 min延伸,进行26个循环;72 ℃ 10 min延伸。扩增产物纯化后与pPIC9K表达载体酶切、连接,转化E.coliDH5α感受态细胞,阳性克隆子筛选后,提取质粒经酶切及PCR验证,最终获得重组质粒pPIC9K-xyn43A。
1.3重组毕赤酵母的构建及高拷贝转化子的筛选
参照Invitrogen公司操作手册,重组质粒pPIC9K-xyn43A经SalⅠ线性化,胶回收后分别电击转化毕赤酵母GS115和KM71。转化液涂布MD平板,筛选出His+克隆子,接种YPD培养基平板,这些平板含有不同浓度(1.0、2.0、3.0、4.0、6.0 mg/mL)的G418,30 ℃培养3~5 d,筛选出的高拷贝转化子,经摇瓶复筛后,最终获得两株重组毕赤酵母菌株,分别标记为:P.pastorisGS115/Xyn43A,P.pastorisKM71/Xyn43A。
1.4重组毕赤酵母工程菌株的表达条件优化
1.4.1基本表达条件挑取P.pastorisGS115/Xyn43A,接种于含有20 mL BMGY培养基的250 mL的三角瓶中(对于P.pastorisKM71/Xyn43A,挑取单菌落接种于含有50 mL BMGY培养基的500 mL的三角瓶中),30 ℃,250 r/min培养24 h,离心收集菌体,转接至装有20 mL BMMY培养基的250 mL三角瓶中,相同条件下继续培养,每24 h补加100%甲醇至终浓度为0.5%,诱导表达6 d。
1.4.2单因素实验在基本表达条件的基础上分别调整培养温度(26、28、30、32、34、36 ℃);诱导前种龄(12、16、20、24、28、32、36 h);BMMY培养基初始pH(4.5、5.0、5.5、6.0、6.5、7.0、7.5);甲醇诱导浓度(0.25%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%);诱导表达时间(24、48、72、96、120、144、168 h)。
1.4.3正交实验根据单因素实验结果,选择单因素中对工程菌酶产量影响较大的几个因素设计因素水平表(表1)进行L9(34)正交实验,得到最佳表达条件。

表1 L9(34)正交实验因素水平表
1.5测定方法
1.5.1细胞光密度(A600)的测定以空白培养基为对照,菌液稀释后于波长600 nm下比色测定,A600=OD值×稀释倍数。
1.5.2木聚糖酶酶活力的测定木聚糖酶活力测定采用改进的DNS法[11]。1个酶活力单位(1 U)定义为:在pH5.0、50 ℃的反应条件下,以0.5%桦木木聚糖为底物,每分钟产生1 μmol木糖所需要的酶量。
测定蛋白质浓度采用Bradford法[12],标准蛋白为牛血清白蛋白。蛋白标准曲线方程为y=5.4200x+0.0328,R2=0.9997。
木聚糖酶比酶活力(U/mg)=酶活力/蛋白质浓度
1.6数据处理与统计学分析
实验数据表示为平均值±标准差(X±SD%),用Sigmaplot软件绘制曲线图。
实验结果单向方差分析(方差)由Student-Newman-Keuls用SPSS17.0检验。
2 结果与分析
2.1毕赤酵母重组表达载体的构建
以PC、PZ为引物,pMD18-T-xyn43A为模板,PCR扩增可得到xyn43A基因。以正确的读码框将xyn43A基因插入到表达载体pPIC9K中,获得重组表达载体pPIC9K-xyn43A(图1),该载体经EcoRⅠ和NotⅠ双酶切及PC、PZ引物PCR验证(图2),最后经测序检验重组表达载体构建成功。

图1 重组表达载体pPIC9K-xyn43A的构建图谱Fig.1 Construction of recombinant plasmid pPIC9K-xyn43A

图2 重组表达载体pPIC9K-xyn43A的酶切和PCR验证Fig.2 Verification of recombinant plasmidpPIC9K-xyn43A by restriction analysis and PCR注:1:pPIC9K-xyn43A双酶切产物;2:xyn43A PCR扩增产物;M:DNA Marker。
2.2重组毕赤酵母的构建及高拷贝转化子的筛选
重组表达载体pPIC9K-xyn43A经SalⅠ线性化后,分别电击转化感受态受体菌GS115和KM71,转化液涂布MD平板,筛选His+转化子。挑取转化子分别点种于含不同浓度G418的YPD平板,将6.0 mg/mL G418 YPD平板上的重组菌株,经摇瓶复筛,最终筛选到两株木聚糖酶表达量较高的工程菌株,分别记作P.pastorisGS115/Xyn43A(Mut+),P.pastorisKM71/Xyn43A(Muts),初始重组酶活力分别为:12.9、13.4 U/mg。
2.3重组毕赤酵母工程菌株的表达条件优化
2.3.1甲醇诱导浓度的优化毕赤酵母中有两个基因AOX1、AOX2,编码乙醇氧化酶,AOX1受甲醇专一性诱导且能高水平表达。只有当AOX1基因受到抑制或损伤而不能正常表达时,AOX2才会进行低水平的表达。在以甲醇为唯一碳源的培养基上,含有AOX1基因的酵母菌株生长表现为正常野生型(Mut+),如果AOX1基因被替换或者被破坏,只有AOX2基因起作用的菌株利用甲醇的能力减弱,则表现为生长缓慢型(Muts)。为系统研究木聚糖酶Xyn43A基因在毕赤酵母中的表达情况,本研究选择2种毕赤酵母GS115(Mut+)和KM71(Muts)作为表达宿主[13]。
图3结果显示,GS115/Xyn43A、KM71/Xyn43A两株重组菌的甲醇最佳诱导浓度分别为2.0%、1.5%。以醇氧化酶启动子启动外源基因表达的毕赤酵母,在碳源只有甘油的BMGY培养基中,甲醇氧化酶AOX1不会产生,外源基因也不会表达[13]。在BMMY培养基中毕赤酵母只能以甲醇作为碳源,一方面会表达醇氧化酶来利用甲醇[14],且醇氧化酶基因在木聚糖酶基因的上游,所以木聚糖酶的表达与醇氧化酶的表达成正比关系;另一方面,甲醇既可作为酵母的碳源也可作为诱导物,因此,在一定范围内提高甲醇的浓度可能会增加外源蛋白的表达量,但是,添加过量,甲醇对酵母生长也会产生毒害作用[15]。

图3 诱导浓度的优化Fig.3 Optimization of methanolconcentration for xylanase expression
2.3.2诱导前种龄的优化外源蛋白在毕赤酵母系统中的表达可分为两个阶段:第一阶段为生长阶段,在含有甘油的BMGY培养基中生长,使A600达到一定数值时停止培养,并离心收集菌体;第二阶段为诱导表达阶段,将收集来的菌体重新转入含有诱导剂甲醇的BMMY培养基中诱导培养。在重组蛋白诱导表达过程中,种子的选择非常关键。在摸索诱导前最佳接种时间前,先测定了GS115/Xyn43A和KM71/Xyn43A两株菌的生长曲线。由图4可以看出,对于两株重组菌来讲,20~36 h左右的菌体浓度成对数生长趋势,为对数生长期。

图4 重组菌生长曲线Fig.4 Growth curves of recombinant P. pastoris
根据生长曲线所揭示的信息,优化了诱导前两株菌的种龄,图5结果显示对于GS115/Xyn43A、KM71/Xyn43A 两株重组菌株来说,种龄分别为24、28 h时重组酶比酶活力最高。这可能由于在一定时间范围内,随着生长时间的延长,菌体生长量增加,表达量也会增加,但是时间过久,菌体老化,不利于外源蛋白的表达。
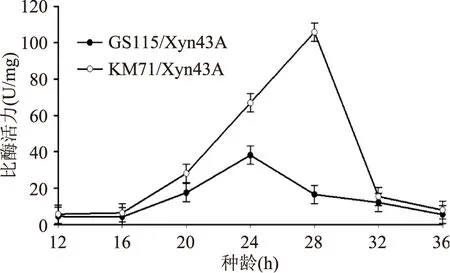
图5 种龄的优化Fig.5 Optimization of the inoculationtime for xylanase expression
2.3.3诱导表达培养基pH的优化pH不仅能够影响酶的活性,使菌体的新陈代谢受阻;还能够影响细胞膜的通透性,进一步影响菌体对营养物质的吸收以及代谢物的排泄;此外,pH还能够通过影响培养基中某些成分与中间代谢物的解离来影响微生物对这些物质的利用[16]。图6结果显示:GS115/Xyn43A、KM71/Xyn43A两株重组菌分别在pH为6.0、6.5时重组酶酶活力最高。
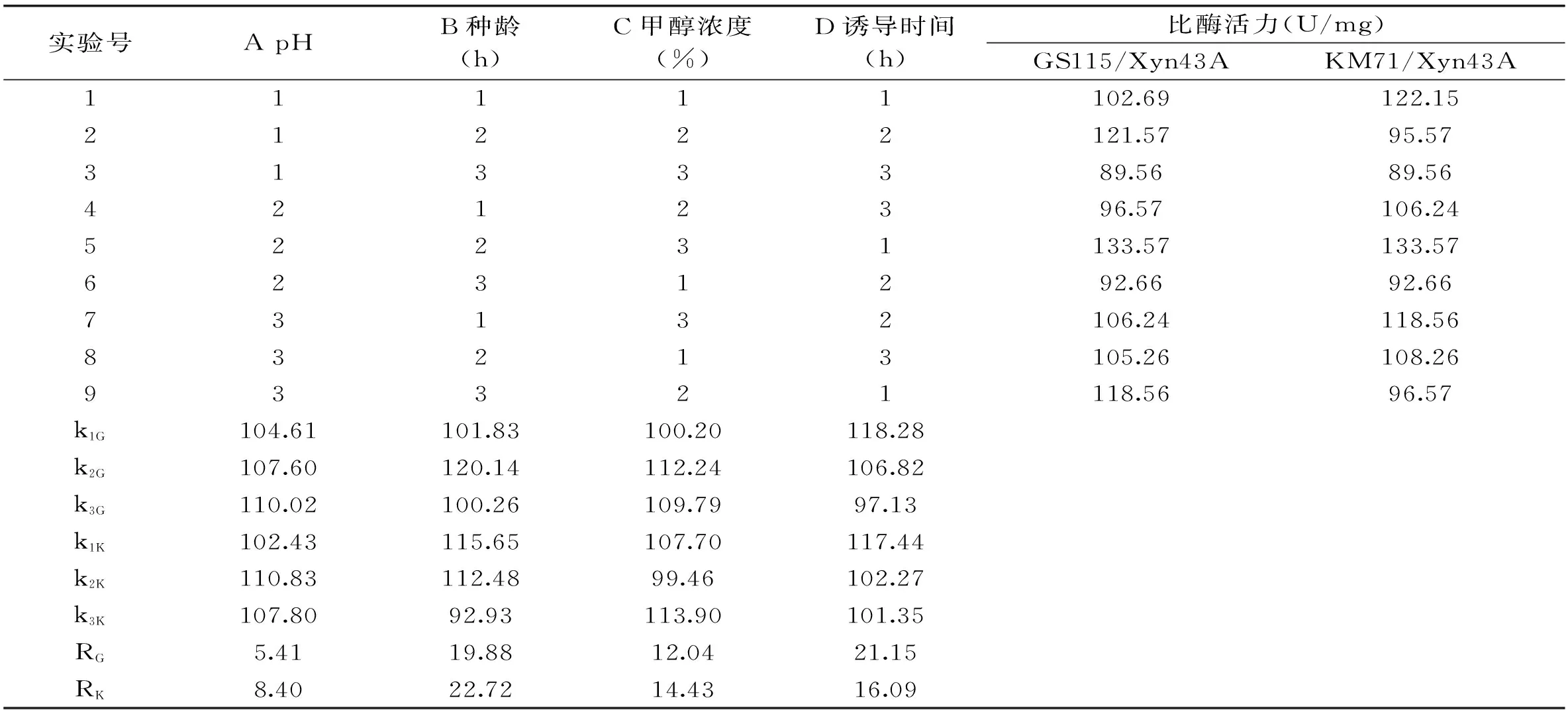
表2 L9(34)正交实验结果及极差分析

图6 诱导表达培养基pH的优化Fig.6 Optimization of pH for xylanase expression
2.3.4甲醇诱导时间的优化同一木聚糖酶基因在不同的宿主菌中表达水平的高低与诱导时间关系非常大。诱导时间过短时,诱导剂还未充分发挥作用,培养基中营养物质并未大量消耗,目的蛋白表达量少,比酶活力较低;诱导时间过长,培养液pH会发生明显改变,并且随着营养物质的大量消耗,目的蛋白的表达将会受阻,导致培养液中目的酶比酶活力下降。图7结果显示,GS115/Xyn43A、KM71/Xyn43A的最佳甲醇诱导时间分别为120、144 h。

图7 甲醇诱导时间的优化Fig.7 Optimization of the induction time for xylanase expression
2.3.5培养温度的优化温度对微生物生长的影响主要表现在两个方面:一方面,随着环境温度升高,微生物细胞中的酶活力增强,生物化学反应加快,生长速率提高;另一方面,随着温度上升,微生物细胞中对温度较敏感的组成部分如蛋白质、核酸等会受到不可逆的破坏[17]。图8结果显示,GS115/Xyn43A、KM71/Xyn43A两株重组菌最适培养温度均为30 ℃。

表3 L9(34)正交实验方差分析
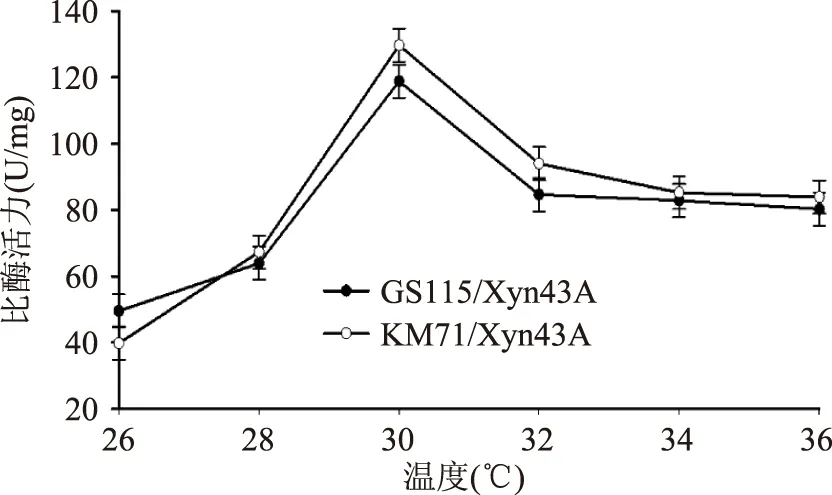
图8 培养温度的优化Fig.8 Optimization of temperature for xylanase expression
2.3.6L9(34)正交实验在单因素实验的基础上,对两株重组菌的培养基初始pH、种龄、甲醇浓度和诱导时间进行优化,进行L9(34)正交实验。表2极差分析结果显示,四种因素对于GS115/Xyn43A产酶影响大小而言,诱导时间>种龄>甲醇浓度>pH,最优的培养组合是pH6.3、种龄24 h、甲醇浓度2.0%,诱导时间是108 h;对于KM71/Xyn43A来说,种龄>诱导时间>甲醇浓度>pH,最优的培养组合是pH6.5、种龄26 h、甲醇浓度1.75%,诱导时间是132 h。
方差分析结果表3显示,四种诱导因素的F值均小于p=0.05时的F临界值,说明四种因素对重组酶的影响没有显著性差异。
将两株重组菌在最优水平上进行验证性实验,比酶活力分别为139.36、143.29 U/mg。
3 结论
黑曲霉木聚糖酶Xyn43A基因在2种毕赤酵母GS115(Mut+)和KM71(Muts)中成功实现异源表达,通过G418浓度梯度平板初筛及摇瓶复筛,获得两株木聚糖酶工程菌株P.pastorisGS115/Xyn43A(Mut+),P.pastorisKM71/Xyn43A(Muts)。摇瓶条件下GS115/Xyn43A菌株最优表达条件为:甲醇浓度2.0%,种龄24 h,诱导时间108 h,培养温度30 ℃,诱导培养基初始pH6.3;KM71/Xyn43A菌株最优表达条件为:甲醇浓度1.75%,种龄26 h,诱导时间132 h,培养温度30 ℃,诱导培养基初始pH6.5。两重组菌GS115/Xyn43A和KM71/Xyn43A比酶活力分别可达139.36、143.29 U/mg。
[1]Shi H L,Yin X,Wu M C,et al. Cloning and bioinformatics analysis of an endoglucanase gene(Aucel12A)fromAspergillususamiiand its functional expression inPichiapastoris[J]. Journal of Industrial Microbiology and Biotechnology,2012,39(2):347-357.
[2]彭伟林,刘国锋,王颖,等. 复合酶制剂在玉米原料酒精发酵中的应用[J]. 酿酒科技,2015(2):69-72.
[3]Nagar S,Mittal A,Gupta V K. Enzymatic clarification of fruit juices(Apple,Pineapple,and Tomato)using purifiedBacilluspumilusSV-85S xylanase[J]. Biotechnology and Bioprocess Engineering,2012,17(6):1165-1175.
[4]宫晓,郑喜群,刘晓兰,等. 脉孢霉固体发酵产木聚糖酶的条件研究[J]. 粮食与饲料工业,2015(6):51-55.
[5]赵联正,谢占玲,赵朋. 一种新的镰刀菌Q7-31木聚糖酶 Xyn9的分离纯化鉴定及酶学特性[J]. 江苏农业科学,2015,43(5):42-45.
[6]龚燕燕,朱天地,殷欣,等. 糖苷水解酶第10家族真菌木聚糖酶保守区及进化关系的分析[J]. 中国生物制品学杂志,2014,27(1):46-51.
[7]Henrissat B,Bairoch A. Updating the sequence-based classification of glycosyl hydrolases[J]. Biochemical Journal,1996,316(2):695-696.
[8]林源清,张光亚. G/11木聚糖酶最适pH的预测及其与氨基酸位置的关系[J].华侨大学学报:自然科学版,2014,35(3):316-320.
[9]周晨妍,王燕,朱新术,等. 黑曲霉木聚糖酶Xyn43A基因的克隆和生物信息学分析[J]. 生物技术,2015,25(3):217-222,237.
[10]傅小蒙,孔令聪,裴志花,等. 毕赤酵母表达系统优化策略概述[J]. 中国生物工程杂志,2015,35(10):86-90.
[11]Fu G H,Wang Y T,Wang D D,et al. Cloning,expression,and characterization of an GHF 11 xylanase fromAspergillusnigerXZ-3S[J]. Indian Journal of Microbiology,2012,52(4):682-688.
[12]Bradford M M. A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(2):248-254.
[13]Cregg J M,Madden K R,Barringer K J,et al. Functional characterization of the two alcohol oxidase genes from the yeast,Pichiapastoris[J]. Molecular and Cellular Biology,1989,9(3):1316-1323
[14]Li S,Sing S R,Wang Z X. Improved expression of Rhizopus oryzae(-amylase in the methylotrophic yeast Pichia pastoris[J]. Protein Expression and Purification,2011,79(1):142-148.
[15]Liu L,Yang H Q,Shin H D,et al. How to achieve high-level expression of microbial enzymes[J]. Bioengineered,2013,4(4):212-223.
[16]孙家凯,吴晓娇,史建明,等. pH对大肠杆菌发酵异亮氨酸的影响[J]. 食品与发酵工业,2012,38(3):56-60.
[17]何瑞. 一株好氧性纳西杆菌(Naxibactersp.SD-09)的产纤维素酶特性研究[D].长春:东北师范大学,2012.
Study on the construction and expression of the engineered strain ofPichiapastorisfor xylanase production
ZHOU Chen-yan1,LIU Zhen-hua1,WANG Dan-dan1,2,LI Tong-biao1,GAO Qi-yu1
(1.School of Life Science and Technology,Xinxiang Medical University,Synthetic Biology Remaking Engineering and Application Laboratory,Xinxiang 453003,China;2.San Quan Medlcal College,Xinxiang Medical University,Xinxiang 453003,China)
A gene encoding xylanase Xyn43A fromAspergillusnigerXZ-3S was cloned into thePichiapastorisexpression vector,pPIC9K. The recombinant plasmid was linearized withSalI and then transformed intoPichiapastorisGS115 and KM71 by electroporation,respectively. After screening by MD medium,G418 concentration plate and shake bottle selection,two recombinant strains GS115/Xyn43A and KM71/Xyn43A were obtained. The best optimization schemes were obtained by single factor experiment and L9(34)experiment. The optimal expression conditions of GS115/Xyn43A were methanol concentration of 2.0%,inoculation time of 24 h,induction time of 108 h,induction temperature of 30 ℃,and initial pH6.3. The optimal expression conditions of KM71/Xyn43A were methanol concentration of 1.75%,inoculation time of of26 h,induction time of 132 h,induction temperature of 30 ℃,and initial pH6.5. Under the optimum conditions,the xylanase activity of the two recombinant strains were 139.36 U/mg and 143.29 U/mg,respectively.
Aspergillusniger;Pichiapastoris;xylanase;induction expression
2015-12-16
周晨妍(1979-),女,博士,副教授,从事微生物酶工程研究,E-mail:zhouchenyan2008@163.com。
河南省科技攻关计划项目(162102210118);河南省教育厅科学技术研究重点项目(13A180861;14A180018);河南省高等学校青年骨干教师资助计划项目(2011GGJS-125);新乡医学院科研项目培育基金(2013ZD113)。
TS201.3
A
1002-0306(2016)13-0162-06
10.13386/j.issn1002-0306.2016.13.024

