葡萄糖浓度及补料方式对透明质酸发酵的影响
吴祥坤,王腾飞,李丕武
(齐鲁工业大学生物工程学院,山东济南 250353)
葡萄糖浓度及补料方式对透明质酸发酵的影响
吴祥坤,王腾飞,李丕武*
(齐鲁工业大学生物工程学院,山东济南 250353)
本研究以兽疫链球菌(Streptococcuszooepidemicus)为出发菌株,在10 L全自动发酵罐中进行透明质酸的发酵研究,考察葡萄糖浓度和补料方式对发酵结果的影响。结果显示,控制葡萄糖总浓度为80 g/L,采用初始葡萄糖浓度为40 g/L,一次性补加剩余40 g/L葡萄糖的方式时,菌体量和透明质酸的产量比分批培养时分别提高了13.5%和28.5%,乳酸的积累量降低7.89%,透明质酸的相对产率达到了10.02%,平均分子量达到了1.56×106u。因此,透明质酸的发酵生产可以采用补糖的方式提高生产强度和产品质量。
兽疫链球菌,分批培养,补料分批培养,透明质酸
透明质酸(hyaluronic acid,HA)是由N-乙酰胺基葡萄糖(GlcNAc)和葡萄糖醛酸(GlcUA)为双糖单位聚合而成的酸性高分子粘多糖,广泛存在于高等动物的结缔组织内。由于其结构上的特殊性,HA具有很高的粘弹性和极强的保水性,已被大量用于医学医药[1]、化妆品工业[2]。随着研究的不断深入,HA的生产方法也完成了由传统的动物组织提取法向微生物发酵法的转变,和传统的动物组织提取法相比,微生物发酵法生产HA有着显著的优点,因其成本低廉、工艺简单、质量稳定而被广泛地应用于工业化生产。
山东临朐华元生物工程有限公司是国内首家采用微生物发酵法工业化生产透明质酸的公司,产品主要用于化妆品行业[3]。成霞[4]等研究发现初始葡萄糖浓度为65.8 g/L有利于透明质酸的生产,产量达5.9 g/L,平均分子量达1.90×106u,产率系数为0.17 g/g。高海军[5]等采用流加发酵的方式研究发现初始葡萄糖浓度为30 g/L时,透明质酸产量达4 g/L,平均分子量达2.0×106u,产率系数为0.04 g/g。汤栋等[6]利用氧化胁迫联合UV、DES诱变选育出的透明质酸菌株的生产能力仅仅为4.26 g/L。虽然透明质酸的平均分子量和产率系数较高,但是应用到产业以后,受原料和发酵条件等影响,产量比国际工厂的8~10 g/L低很多[4-6]。
本研究以兽疫链球菌(Streptococcuszooepidemicus)为出发菌株,在10 L全自动发酵罐中进行透明质酸的发酵研究,考察葡萄糖浓度和补料方式对菌体生长、HA产量、分子量、乳酸积累量和发酵周期的影响,研究适合菌体生长繁殖的最佳初始葡萄糖浓度和有利于发酵过程中HA积累及控制发酵液中乳酸积累的葡萄糖流加方式,达到提高HA最终产量的目的。
1 材料与方法
1.1材料与仪器
兽疫链球菌(Streptococcuszooepidemicus)SL-2齐鲁工业大学微生物酶技术实验室筛选并保藏;葡萄糖(分析纯)诸城东晓生物科技有限公司;蛋白胨;酵母粉(分析纯)北京奥博星生物技术有限公司;磷酸氢二钾;硫酸镁;氢氧化钠(分析纯)天津市广成化学试剂有限公司;谷氨酸(分析纯)阿拉丁试剂(上海)有限公司。
种子培养基:葡萄糖5 g/L,蛋白胨15 g/L,酵母粉5 g/L,磷酸氢二钾2 g/L,硫酸镁2 g/L。调pH7.0,121 ℃高压蒸汽灭菌20 min。
发酵培养基:蛋白胨17.5 g/L,酵母粉6 g/L,磷酸氢二钾2 g/L,硫酸镁2 g/L,谷氨酸0.5 g/L。葡萄糖的添加量见后文。调pH7.0,121 ℃高压蒸汽灭菌20 min。
5804R型高速冷冻离心机德国Eppendorf公司;UV-7200型分光光度计上海精密科学仪器有限公司;SBA-40D生物传感分析仪山东省科学院生物研究所;10 L全自动发酵罐上海百伦生物科技有限公司。
1.2实验方法
1.2.1分批培养在10 L的全自动发酵罐中加入发酵培养基,121 ℃下高压蒸汽灭菌20 min。接种量10%,发酵温度为37 ℃,pH7.0,初始搅拌转速为200 r/min,随着发酵的进行不断提高转速,维持溶氧饱和度30%,直至转速达到600 r/min。五次分批发酵实验的初始葡萄糖浓度分别为20、40、60、80、100 g/L。葡萄糖溶液单独灭菌115 ℃、20 min。
1.2.2一次性补糖培养在10 L的全自动发酵罐中加入发酵培养基,121 ℃下高压蒸汽灭菌20 min。接种量10%,发酵温度为37 ℃,pH7.0,初始搅拌转速为200 r/min,随着发酵的进行不断提高转速,维持溶氧饱和度30%,直至转速达到600 r/min。初始葡萄糖浓度为40 g/L,将剩余的40 g/L葡萄糖溶液在发酵6 h时一次性补加到发酵罐中。葡萄糖溶液单独灭菌115 ℃、20 min。
1.2.3间歇性补糖培养在10 L的全自动发酵罐中加入发酵培养基,121 ℃下高压蒸汽灭菌20 min。接种量10%,发酵温度为37 ℃,pH7.0,初始搅拌转速为200 r/min,随着发酵的进行,不断提高转速,维持溶氧饱和度30%,直至转速达到600 r/min。初始葡萄糖浓度为40 g/L,将剩余的40 g/L葡萄糖溶液在发酵6、10、14 h时分三次补加到发酵罐中。葡萄糖溶液单独灭菌115 ℃、20 min。
1.2.4恒速流加补糖培养在10 L的全自动发酵罐中加入发酵培养基,121 ℃下高压蒸汽灭菌20 min。接种量10%,发酵温度为37 ℃,pH7.0,初始搅拌转速为200 r/min,随着发酵的进行不断提高转速,维持溶氧饱和度30%,直至转速达到600 r/min。初始葡萄糖浓度为40 g/L,将剩余的40 g/L葡萄糖溶液在发酵6 h时开始以恒定的速率补加到发酵罐中,直至发酵结束。葡萄糖溶液单独灭菌115 ℃、20 min。
1.3分析方法
1.3.1菌体量取25 mL发酵液,经3000 r/min离心后再用蒸馏水洗涤2次,得到的湿菌体在105 ℃下烘至恒重,计算出菌体干重(dry cell weight,DCW)。在660 nm处测定发酵液的吸光度,建立吸光度与菌体干重的关系式,通过测定发酵液的吸光度计算菌体量。
1.3.2平均分子量将发酵液与0.1%十二烷基磺酸钠(SDS)等体积混合,室温下静置10 min以释放细胞外壁附着的HA。发酵液经4200 r/min离心15 min,去除菌体,取上清液,加入2.5倍的无水乙醇,4 ℃静置1 h,离心取沉淀,加入所取上清液适当倍数体积的去离子水,振荡溶解,即制得样液[7],用Laurernt法计算出平均分子量[8]。
1.3.3葡萄糖含量SBA-40D生物传感分析仪(山东省科学院生物研究所)测定。
1.3.4乳酸含量SBA-40D生物传感分析仪(山东省科学院生物研究所)测定。
1.3.5透明质酸产量Bitter-Muir法[9]。
1.3.6透明质酸相对产率相对产率=透明质酸产量/(葡萄糖添加量-葡萄糖剩余量)。
2 结果与分析
2.1分批发酵工艺中透明质酸的合成过程
图1为不同初始葡萄糖浓度对兽疫链球菌菌体量的影响,图2为不同初始葡萄糖浓度下葡萄糖浓度随培养时间的变化曲线。从图1和图2中可以得知,兽疫链球菌可以在初始葡萄糖浓度为20~80 g/L的范围内正常生长,并且菌体量在初始葡萄糖浓度为80 g/L时达到了最大值10.98 g/L。当初始葡萄糖浓度为20 g/L时,兽疫链球菌在发酵4 h时进入快速增长的阶段,但由于葡萄糖既要为菌体生长提供能量和前体物质又要为透明质酸的合成提供前体物质而导致菌体量未能达到较高的水平;初始葡萄糖浓度为40 g/L时,兽疫链球菌生长的停滞期较短,在6 h时即达到对数生长期;初始葡萄糖浓度为60 g/L和80 g/L时对数期的到达时间分别为发酵开始8 h和10 h,而当初始葡萄糖浓度为100 g/L时,兽疫链球菌生长的停滞期则延续到了12 h。分析其原因为较低的初始葡萄糖浓度有利于细胞的生长,但是较高的初始葡萄糖浓度则会抑制细胞的生长,这和邓开野[10]得到的结论一致。随着初始葡萄糖浓度的提高,葡萄糖的消耗情况和兽疫链球菌的生长情况相一致,当初始葡萄糖浓度为40 g/L时,发酵6 h时,葡萄糖浓度开始明显减少,说明6 h时HA合成和菌体生长同步进行导致葡萄糖浓度急剧减少。

图1 不同初始葡萄糖浓度对菌体量的影响Fig.1 Effect of different initial glucose concentration on cell amount

图2 葡萄糖浓度随时间变化曲线Fig.2 Different initial glucose concentration change curve
图3为不同初始葡萄糖浓度对透明质酸发酵的影响。由图3可以看出,当初始葡萄糖浓度为20~80 g/L时,随着初始葡萄糖浓度的增加,HA产量也不断增加,尤其是初始葡萄糖浓度为80 g/L时,HA的最高产量更是达到了5.94 g/L,当初始葡萄糖浓度为100 g/L时,HA的最高产量降低到了3.52 g/L;当初始葡萄糖浓度分别为20、40、60、80 g/L时,透明质酸的平均分子量也不断增加,在一定的初始葡萄糖浓度范围内(40~80 g/L),初始葡萄糖浓度越高,HA的分子量越高。田毅红[11]认为较高的葡萄糖初始浓度有利于透明质酸分子量的提高,原因在于构成透明质酸的GlcNAc和GlcUA均由葡萄糖分子衍生而来[12],葡萄糖是透明质酸多聚物的一个必需构建单元,同时也是菌体生长的能量来源。在高初始葡萄糖浓度下,单体UDP-GlcUA和UDP-GlcNAc被激活,外部的葡萄糖连接到这些单体上,使透明质酸分子链延长;然而过高的初始葡萄糖浓度(100 g/L)会抑制菌体生长,进而影响HA的产量和分子量。乳酸积累量在初始葡萄糖浓度为20~80 g/L的范围内一直增加,当初始葡萄糖浓度提高到100 g/L时,乳酸产量降低为38.8 g/L。随着初始葡萄糖浓度的增加,透明质酸的发酵周期不断增加,这和菌体的生长代谢情况有着很大的关系。分批培养时,HA产量、平均分子量和乳酸产量都是和菌体量的生长情况呈现正相关的关系。分析图1~图3可知,在透明质酸的分批发酵实验中,初始葡萄糖浓度为80 g/L(葡萄糖总浓度为80 g/L)时有利于提高透明质酸的产量和分子量,但是副产物乳酸的产量比初始葡萄糖浓度为20~60 g/L时高。

图3 不同初始葡萄糖浓度对透明质酸发酵的影响Fig.3 Effect of different initial glucose concentration on Hyaluronic acid fermentation
产生上述结果的原因可能与发酵液中乳酸的积累有关。乳酸是透明质酸发酵过程中的主要副产物,与菌体的生长相偶联,且乳酸对菌体的生长和产物的合成有抑制作用[13]。王瑞明[14]等研究发现,副产物乳酸的积累对发酵过程的抑制作用主要体现在对细胞生长的抑制上。高海军[5]和邓开野[10]研究发现,乳酸产生的原因主要是兽疫链球菌的TCA循环不完全[15],不能将其彻底分解氧化,菌体生长要靠葡萄糖不完全氧化生成乳酸和乙酸产生的能量来进行,故乳酸和菌体生长是偶联的,而作为非细胞基本成分的HA在达到一定量后就不再增加。
在不同初始葡萄糖浓度的分批发酵实验中,乳酸积累量在初始葡萄糖浓度为20~80 g/L的范围内一直增加,当初始葡萄糖浓度提高到100 g/L时,乳酸产量降低为38.8 g/L。由分批发酵实验结果可知,葡萄糖浓度为40 g/L时,透明质酸产量为2.46 g/L,分子量为1.25×106u,乳酸产量为26.35 g/L,发酵周期为15 h,有利于前期的菌体生长和缩短发酵周期,但透明质酸产量和分子量较低;葡萄糖浓度为80 g/L时,透明质酸的产量和分子量达到了5.94 g/L和1.68×106u,均高于葡萄糖浓度为20、40、60、100 g/L时的产量和分子量,但乳酸产量高和发酵周期长;为保证菌体正常生长和透明质酸发酵正常进行,降低发酵过程中副产物乳酸的积累量,因此下面的实验采用补糖培养的方式继续研究葡萄糖浓度的控制模式对透明质酸发酵的影响,葡萄糖总浓度为80 g/L,初始葡萄糖浓度为40 g/L,将剩余的40 g/L葡萄糖在培养过程中分别进行一次性补加、间歇性补加和恒速流加的发酵实验。
2.2葡萄糖补料方式对透明质酸发酵的影响
2.2.1一次性补糖方式对透明质酸发酵的影响图4为一次性补糖方式对透明质酸发酵的影响。由图4可以看出,一次性补糖的方式下兽疫链球菌的最大菌体量为12.46 g/L,比分批培养的最大菌体量10.98 g/L提高了13.5%;透明质酸浓度的最大值达到了7.63 g/L,比分批培养时的5.94 g/L提高了28.5%;随着发酵过程的进行,乳酸的积累量不断升高,在发酵20 h时达到了最高值48.73 g/L,比分批培养的52.9 g/L降低了7.89%。

图4 一次性补糖方式对透明质酸发酵的影响Fig.4 Effect of disposable carbohydrate supplement way on Hyaluronic acid fermentation
2.2.2间歇性补糖方式对透明质酸发酵的影响图5为间歇性补糖方式对透明质酸发酵的影响。由图5可以看出,间歇性补糖分批培养的方式下兽疫链球菌菌体量的最大值为12.91 g/L,比分批培养的菌体量最大值10.98 g/L提高了17.58%,透明质酸浓度的最大值达到了6.23 g/L,比分批培养的5.94 g/L提高了4.88%,副产物乳酸的最高积累量为57.61 g/L,比分批培养的52.9 g/L增加了8.9%。

图5 间歇性补糖方式对透明质酸发酵的影响Fig.5 Effect of intermittent feeding mode on Hyaluronic acid fermentation
2.2.3恒速流加补糖方式对透明质酸发酵的影响图6为恒速流加补糖方式对透明质酸发酵的影响。由图6可以看出,恒速流加补糖方式下分批培养的方式下兽疫链球菌菌体量的最大值为13.29 g/L,比分批培养的菌体量最大值10.98 g/L提高了21.04%,透明质酸浓度的最大值达到了5.46 g/L,比分批培养降低了4.37%,乳酸的最高浓度为58.36 g/L,比分批培养增加了10.32%。

图6 恒速流加补糖方式对透明质酸发酵的影响Fig.6 Effect of constant speed fed-sugar on Hyaluronic acid fermentation
由图7结合上述2.2结果可以看出,当葡萄糖添加量为80 g/L时,补糖发酵的HA产量和HA相对产率均优于分批发酵的HA产量和HA相对产率。在补糖发酵过程中,采用一次性补糖方式培养时,HA的产量和相对产率均为最高,并且分子量的变化较小。由于构成HA的N-乙酰氨基葡糖和和葡糖醛酸就是由葡萄糖分子衍生而来的[10],因此在发酵过程中控制适当的葡萄糖浓度,不仅可以保障菌体生长所需要的碳源和能量,更重要的是能够提供充足的N-乙酰氨基葡糖和和葡糖醛酸,有利于HA的合成,故得到的HA分子量较高。间歇性补加葡萄糖和恒速流加葡萄糖的方式下HA产量和分子量均低于一次性补加葡萄糖方式下的产量和平均分子量,分析其原因可能为以下两点,一是在6 h第一次补加葡萄糖时,间歇性补加葡萄糖和恒速流加葡萄糖的方式未能使葡萄糖浓度达到可以激活单体UDP-GlcUA和UDP-GlcNAc的浓度[9];二是葡萄糖过多流向菌体生长,导致发酵后期HA合成前体物质供应不足。
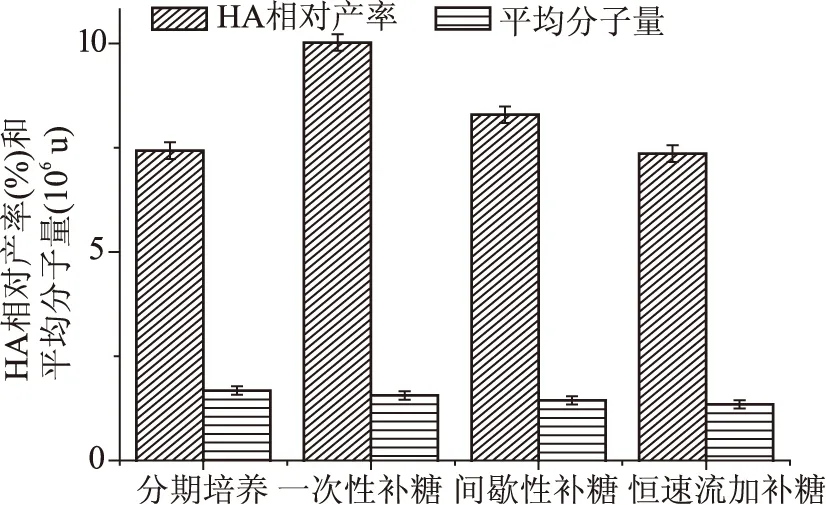
图7 不同培养方式对透明质酸发酵的影响Fig.7 Effect of different cultivation methods on Hyaluronic acid fermentation
3 结论
采用分批培养的方式进行发酵生产透明质酸时,初始葡萄糖浓度为80 g/L(葡萄糖总浓度为80 g/L)时透明质酸的产量和分子量达到了5.94 g/L和1.68×106u,均高于葡萄糖浓度为20、40、60、100 g/L时的产量和分子量,发酵周期为24 h,但是副产物乳酸的产量较高,达到了52.9 g/L。
采用补料培养的方式进行发酵生产透明质酸时,控制葡萄糖总浓度为80 g/L,采用初始葡萄糖浓度为40 g/L,在发酵6 h时一次性补加剩余40 g/L葡萄糖的方式可以使兽疫链球菌的菌体量增加13.5%,透明质酸的产量提高28.5%,乳酸的积累量降低7.89%平均分子量达到1.56×106u。
[1]邱丽筠,黄丽丽,俞淑文.透明质酸在肿瘤治疗药物新型给药系统中的应用[J].中国实用医药,2014,9(16):238-241.
[2]李真,朱维波,尹研婷,等.壳聚糖/魔芋葡甘聚糖/透明质酸钠共混多孔膜的制备与表征[J].高分子材料科学与工程,2015,31(5):159-163,168.
[3]国内首家采用微生物发酵工艺工业化生产透明质酸 高级化妆品的理想保湿因子——透明质酸(HA)[J]. 中国化妆品,
1994(5):3.
[4]成霞,刘登如,陈坚,等.高产量、高分子量透明质酸发酵条件优化[J].过程工程学报,2006,6(5):808-813.
[5]高海军,陈坚,管轶众,等.不同培养方式下兽疫链球菌发酵生产透明质酸的研究[J].应用与环境生物学报,1999,5(6):614-617.
[6]汤栋,荣绍丰,管世敏,等.氧化胁迫联合UV、DES诱变选育高产、高分子量透明质酸菌株[J].食品工业科技,2015,36(11):136-140.
[7]Chong B F,Nielsen L K.Amplifying the cellular reduction potential of Streptococcus zooepidemicus[J]. Biotechnol,2003,100:33-341.
[8]Laurent TC,Ryan M,Pietruszkiewicz A. Fractionation of hyaluronic acid,the poly dispersity of hyaluronic acid from the bovine vitreous body[J]. Biochim Biophys Acta,1960,42(3):476-485.
[9]Bitter T,Muir HM. A modified hyaluronic acid carbazole reaction[J].Anal Biochem,1962,4(6):330-334.
[10]邓开野,谭梅唇.透明质酸产生菌分批发酵工艺条件的研究[J].食品工业科技,2011,32(3):221-223,407.
[11]田毅红,蔡海波,陆仕灿,等.高分子量透明质酸的发酵研究[J].中国医药工业杂志,2004,35(5):13-15.
[12]武薇,杜连祥,路福平,等.透明质酸补糖分批发酵工艺研究[J].食品研究与开发,2008,29(11):108-111.
[13]Honda H,Toyama Y,Takahashi H,et al. Effectible lactic acid production by two-phase system[J]. Biotechnol Bioeng,1960,50:280-290.
[14]王瑞明,宋磊,王腾飞,等.透明质酸分批发酵动力学模型[J].齐鲁工业大学学报:自然科学版,2012,26(2):1-5.
[15]Johns MR,Goh L-T,Oeggerli A. Effect of pH,agitation and aeration on hyaluronic acid produced by Streptococcus zooepidemicus[J]. Biotech Lett,1988,15(5):507-512.
Effect of glucose concentration and feeding methods on hyaluronic acid fermentation
WU Xiang-kun,WANG Teng-fei,LI Pi-wu*
(Department of Bioengineering,Qilu University of Technology,Ji’nan 250353,China)
In this study,Streptococcus zooepidemicus(Streptococcuszooepidemicus)as the starting strain,the effect of glucose concentration and feeding methods on Hyaluronic acid fermentation was studied in 10 L automatic fermentation tank. The results showed that the total concentration of glucose should be controlled at 80 g/L,and both of the initial and supplemented glucose concentration was 40 g/L. The cell amount and production of hyaluronic acid were increased by 13.5% and 28.5% compared with the batch culture while the accumulation of lactic acid was reduced by 7.89%,the relative yield of hyaluronic acid was 10.02%,and average molecular weight was 1.56×106u. Thus,the production of hyaluronic acid fermentation can be used single carbohydrate supplement cultured ways to enhance the intensity of production and product quality.
Streptococcuszooepidemicus;batch fermentation;fed-batch fermentation;hyaluronic acid
2015-12-16
吴祥坤(1989-),男,在读硕士研究生,研究方向:微生物酶技术,E-mail:wuxk1989@126.com。
李丕武(1970-),男,博士,副教授,研究方向:微生物酶技术,E-mail:piwuli@126.com。
国家“863计划”项目(2012AA021504);泰山学者建设工程专项经费资助。
TS201.1
A
1002-0306(2016)13-0198-05
10.13386/j.issn1002-0306.2016.13.031

