超声辅助分散液液微萃取-高效液相色谱法测定蜂蜜中溴氰菊酯残留
于玲(邢台学院化学工程与生物技术学院,河北邢台054001)
超声辅助分散液液微萃取-高效液相色谱法测定蜂蜜中溴氰菊酯残留
于玲
(邢台学院化学工程与生物技术学院,河北邢台054001)
采用超声辅助分散液液微萃取技术结合高效液相色谱法测定蜂蜜中的溴氰菊酯。蜂蜜样品用乙腈∶水(1∶4,v/v)混合溶液提取,加入氯仿萃取,超声,离心,得到沉积相,进行HLPC分析。溴氰菊酯在10~1000 μg/kg范围内线性良好,相关系数r=0.9998,富集倍数高达600倍。当蜂蜜样品的加标浓度为10、50、100 μg/kg时,加标回收率为82.6%~97.3%,相对标准偏差为2.1%~3.8%。蜂蜜样品中溴氰菊酯的检出限为8 μg/kg,定量限为40 μg/kg。本方法具有简便快捷、准确灵敏、萃取效率高、有机溶剂消耗少等特点,可成功地应用于蜂蜜中溴氰菊酯残留的测定。
分散液液微萃取,高效液相色谱法,溴氰菊酯,蜂蜜
溴氰菊酯俗称敌杀死,是目前杀虫活性最高的杀虫剂之一,可有效防治粮、棉、油、果、菜、茶等多种农作物、经济林木上的害虫。但由于其化学性质稳定,不易分解,长期在自然环境中迁移、富集,各种环境介质、动植物及人体内仍可检出,残留问题十分严重。
蜂蜜是一种传统的天然保健食品,具有补中,润燥,止痛,解毒之功效,常被用来直接饮用或制作成饮料和糕点等食品,由于其香甜可口而备受人们青睐。蜂蜜是蜜蜂从开花植物的花中采得的花蜜在蜂巢中酿制而成的。然而蜜源植物和蜜蜂体内的农药残留可能污染蜂蜜,从而危害人体健康[1]。近年来,欧盟等国家和地区一再对蜂蜜产品设置极为严格的农药残留限量标准,但主要是针对蜂蜜中的除螨剂。我国也仅是对蜂蜜中氟胺氰菊酯、氟氯苯氰菊酯、溴螨酯等除螨剂作出了最大残留限量的限定。对使用更为广泛的杀虫剂,尤其是占杀虫剂使用比例较大的溴氰菊酯,无论国际还是国内检测组织对其最大残留限量均没有规定。这无疑成为了对蜂蜜质量严控和把关的漏洞。严格监测蜂蜜中溴氰菊酯的残留关系到消费者健康,并能直接反映出环境本底的农药污染状况。可见,相关检测标准的制定势在必行,因此,建立一种简便高效的测定蜂蜜中溴氰菊酯的方法尤为重要。
测定溴氰菊酯的主要方法有气相色谱法(GC)[2]、气相色谱-质谱联用法(GC-MS)[3-4]、液相色谱法(HPLC)[5]和液相色谱-质谱联用法(HPLC-MS)[6]等。进样前所使用的样品前处理技术主要是索氏提取[7]、微波辅助提取[8]、固相萃取[9]以及液液萃取[10-11],这些处理方法耗费大量的有毒有害有机溶剂、操作繁琐耗时,结果误差偏大。分散液液微萃取(DLLME)是由Rezaee[12]于2006年首次提出的一种新型样品前处理技术,集采样、萃取和浓缩于一体,是一种操作简单、快速、成本低、富集效率高且对环境友好的样品前处理新技术。根据文献报道,目前分散液液微萃取处理的样品大多数为简单基质(如水样)[13-15],而对复杂样品中低含量成分的测定鲜有报道。蜂蜜中含有糖类、有机酸、维生素等180多种物质,基质复杂,本文在DLLME基础上辅以超声技术,提高萃取效率,并与高效液相色谱联用,建立了测定蜂蜜中溴氰菊酯残留的新方法。
1 材料与方法
1.1 材料与仪器
溴氰菊酯(纯度98%) 上海市农药研究所;二氯甲烷、氯仿、二氯乙烷、四氯乙烷、四氯化碳、氯苯、二硫化碳、甲醇、丙酮、乙醇、乙腈 分析纯,北京化工厂;流动相中使用的乙腈 色谱纯;实验用水 超纯水;实验过程中所用的柑橘蜜、党参蜜、荔枝蜜、洋槐蜜、紫云英蜜、枸杞蜜、椴树蜜、野桂花蜜、枣花蜜、益母草蜜和荆条蜜等11种,33个样品(每一种蜂蜜选择3个样品) 均为市售蜂蜜。
LC-20AT高效液相色谱仪,配SPD-M20A二极管阵列检测器 日本岛津公司;SC-36112型低速离心机 安徽中科中佳科学仪器有限公司;Exceed-Ad-24型超纯水机 成都艾柯水处理设备有限公司;KQ-50B型超声波清洗器 天津市瑞普电子仪器公司。
1.2 实验方法
1.2.1 色谱条件 WondaSilTM C18色谱柱(25 cm×4.6 mm i.d.,5 μm);流动相为乙腈-水(88∶12,v/v),流速:1 mL/min,柱温:30℃,检测波长:230 nm,进样量5 μL。
1.2.2 标准溶液的配制 准确称取10 mg溴氰菊酯对照品于100 mL容量瓶中,用甲醇溶解并定容至刻度,混匀,配成100 μg/mL溴氰菊酯标准储备液,使用时用水稀释至所需的浓度。
1.2.3 样品前处理 准确称取蜂蜜5 g,用乙腈∶水(1∶4,v/v)混合溶液稀释至50 mL,经0.45 μm滤膜抽滤,备用。取滤液5 mL加入5 mL带刻度尖底玻璃离心管中,用移液枪快速注入20 μL氯仿萃取剂,剧烈振荡混匀,使萃取剂均匀地分散在水相中,形成水/分散剂/萃取剂的乳浊液体系,超声3 min(功率60 W),以3500 r/min离心5 min,萃取剂沉积在离心管底部,然后用微量进样器吸取5 μL沉积相,进行HPLC分析测定。
1.2.4 条件优化样品溶液的配制 取不含溴氰菊酯的益母草蜂蜜样品,加入一定体积的100 μg/mL溴氰菊酯标准溶液,按实验方法配制成终含量为0.05 μg/mL的蜂蜜样品溶液,供条件优化实验使用。
1.2.5 工作曲线的绘制 准确称取7份1 g不含溴氰菊酯的益母草蜂蜜试样,分别加入一定体积的溴氰菊酯标准溶液,用乙腈∶水(1∶4,v/v)混合溶液稀释至50 mL,使其浓度分别为10、25、50、100、250、500、1000 μg/kg,按1.2.3进行样品前处理后,上机分析做基质标准曲线。
1.2.6 方法回收率计算公式 回收率是萃取后有机相中的分析物含量相对样品中所有分析物含量的百分比,即:
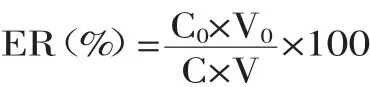
式中,ER为回收率,C0为萃取后分析物在有机相中的浓度(μg/mL),C为萃取前分析物在样品水溶液中的浓度(μg/mL),V0为萃取后有机相体积(mL),V为萃取前水相体积(mL)。
2 结果与分析
2.1 超声辅助分散液相微萃取方法的优化
2.1.1 萃取剂的种类 采用乙腈∶水(1∶4,v/v)制备的0.05 μg/mL溴氰菊酯的蜂蜜样品溶液5 mL,分别与20 μL不同萃取剂(氯仿、四氯化碳、二氯甲烷、二硫化碳、氯苯、二氯乙烷、四氯乙烷)进行微萃取实验,见图1。结果表明:采用氯仿作萃取剂时,峰形极佳而且吸收很强,回收率最高;二氯甲烷作萃取剂时无沉积相;其他5种萃取剂回收率都较低,不适合分析测定。综上所述,本实验采用氯仿作为萃取剂。

图1 萃取剂种类的选择Fig.1 Selection of extraction agent

图2 萃取剂体积的选择Fig.2 Selection of extraction solvent volume
2.1.2 萃取剂的体积 采用乙腈∶水(1∶4,v/v)配制的0.05 μg/mL溴氰菊酯的蜂蜜样品溶液5 mL,选择不同体积的氯仿(10、20、30、40、50 μL)做微萃取实验。结果表明:随着萃取剂用量的增加,沉积相体积逐渐增多,相应的萃取相中溴氰菊酯的浓度逐渐降低,方法回收率也呈现同样的趋势,结果见图2。当采用10 μL氯仿时,由于溶解损失,离心后无沉积相,所以不适合做最终的体积;当氯仿加入量为20 μL时,既可以保持较高回收率,也能满足进样测定所需的体积,再增加萃取剂用量,萃取回收率随之下降,所以氯仿体积选择20 μL。
2.1.3 分散剂的种类 分散剂种类对萃取过程中的回收率影响较大。分别采用乙腈、甲醇、丙酮、乙醇等4种分散剂和水的比例为1∶4制备蜂蜜样品溶液,取样品溶液5 mL,分别加入20 μL氯仿进行微萃取实验。结果表明:以乙腈作为分散剂时,回收率最高,为89.3%,萃取效果最好;其次是丙酮,回收率为60.9%。以甲醇和乙醇为分散剂时,没有沉积相,不能形成两相系统,这可能与其较大的溶解性有关。综上所述,本实验采用乙腈为分散剂。
2.1.4 提取溶剂的选择和分散剂的关系 通过实验发现,溴氰菊酯不溶于水,为了提高水溶液对蜂蜜样品中溴氰菊酯的提取率,需在水中加一定量的有机溶剂。由于分散剂为乙腈,为了保证溶剂体系的一致,因此选用乙腈-水混合溶液对蜂蜜样品进行提取。同时又研究了乙腈-水混合溶液对蜂蜜样品萃取效率的影响,实验分别采用1∶2、1∶3、1∶4、1∶5、1∶6等5组不同体积比的乙腈-水混合溶液提取蜂蜜样品,并向5 mL样品溶液中加入20 μL氯仿进行萃取实验,如图3。结果表明:当乙腈-水比例为1∶2时,没有沉积相;乙腈-水比例为1∶3时,沉积相不足5 μL,精密度较差;在乙腈-水比例为1∶4时,回收率达到最大,随后乙腈-水比例从1∶4变到1∶6时,分散剂(乙腈)比例不断减少,萃取剂未能均匀的分散在水相中,导致回收率降低。实验选择乙腈-水比例为1∶4。

图3 乙腈-水比例的选择Fig.3 Selection of acetonitrile-water ratio
2.1.5 样品体积 样品体积的多少对萃取效果也会产生一定的影响。分别采用乙腈∶水(1∶4,v/v)制备的溴氰菊酯蜂蜜样品溶液3、4、5、6、7、8、9 mL,分别加入20 μL氯仿进行微萃取实验,见图4。结果表明:蜂蜜样品溶液体积在3~5 mL时,回收率逐渐增加,这是因为更多的样品溶液可以提供多一些的目标物质;此后,当蜂蜜样品溶液体积在6 mL时,沉积相不足5 μL,精密度较差;当蜂蜜样品溶液体积在7~9 mL时,没有沉积相。当样品溶液体积为5 mL时,萃取基本达到平衡,回收率最高。因此,实验选择样品体积为5 mL。
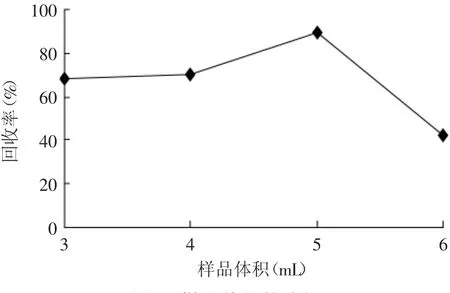
图4 样品体积的选择Fig.4 Selection of sample volume
2.1.6 超声时间的影响 实验采用体积为5 mL的蜂蜜样品溶液,其他条件不变,改变超声时间(分别为0、1、2、3、5、7、10、15、20 min),考察对目标物回收率的影响,见图5。结果表明:在前3 min,随着超声时间的延长,目标物的回收率逐渐增大,在3 min后,回收率有所下降。这是因为一方面超声促进了两相的混合,加快了萃取过程中的传质作用,从而提高了萃取效率;另一方面过长的超声时间产生热量更多,可能增加试剂的挥发程度而降低萃取效果。实验选择超声时间为3 min。
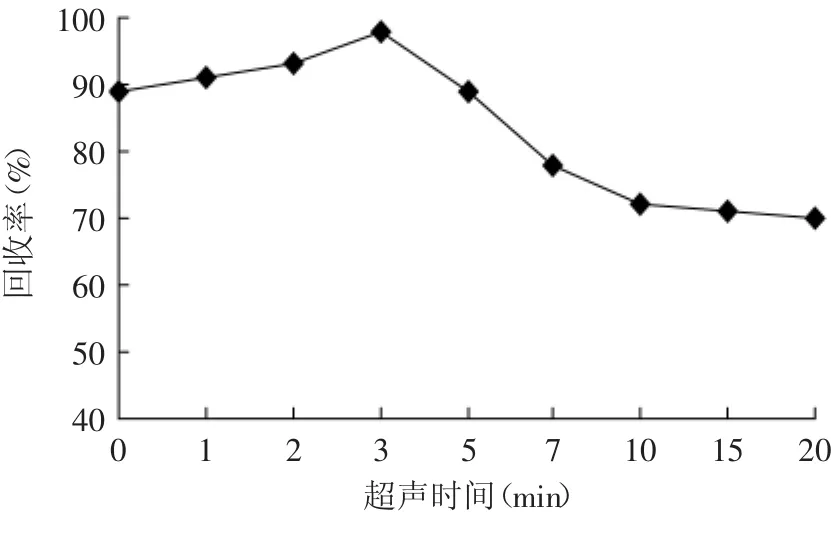
图5 超声时间的选择Fig.5 Selection of ultrasonic time
2.1.7 盐度的影响 实验采用乙腈∶水(1∶4,v/v)配制的0.05 μg/mL溴氰菊酯的蜂蜜样品溶液5 mL,分别向样品溶液中加入氯化钠使其含量为0%、2%、4%、6%、8%、10%。再向其中分别加入20 μL氯仿,超声3 min做微萃取实验,考察了盐浓度对萃取效率的影响。结果表明:随着NaCl浓度的增加,回收率显著降低。这是由于随着离子强度的增加,有机萃取剂在水相中的溶解度减小,萃取剂在体系中未能达到均匀状态,未能形成微小液滴,所以本实验选择不加盐。
2.1.8 pH的影响 根据溴氰菊酯的性质,在酸性条件下能够稳定存在,在碱性条件下不稳定。考虑到pH=1~2时,强酸对色谱柱可能存在的损害,实验采用乙腈∶水(1∶4,v/v)配制的0.05 μg/mL溴氰菊酯的蜂蜜样品溶液5 mL,加入20 μL氯仿,超声3 min做微萃取实验。考察pH=3~8之间目标分析物的萃取效率,见图6。蜂蜜空白溶液的pH为4,通过在水相中加入盐酸或氢氧化钠稀溶液调节待测溶液pH,实验得到的沉积相体积均为15 μL左右,说明pH对沉积相体积基本无影响。随着pH的增加,回收率先增大后减小,当pH=4时,萃取回收率最高;当pH=8时显著降低,这是因为一方面在酸性条件下溴氰菊酯更易于分配到有机相中,另一方面,在碱性条件下溴氰菊酯极易分解。因此选择pH=4为最佳条件,对于本实验不用调节pH。
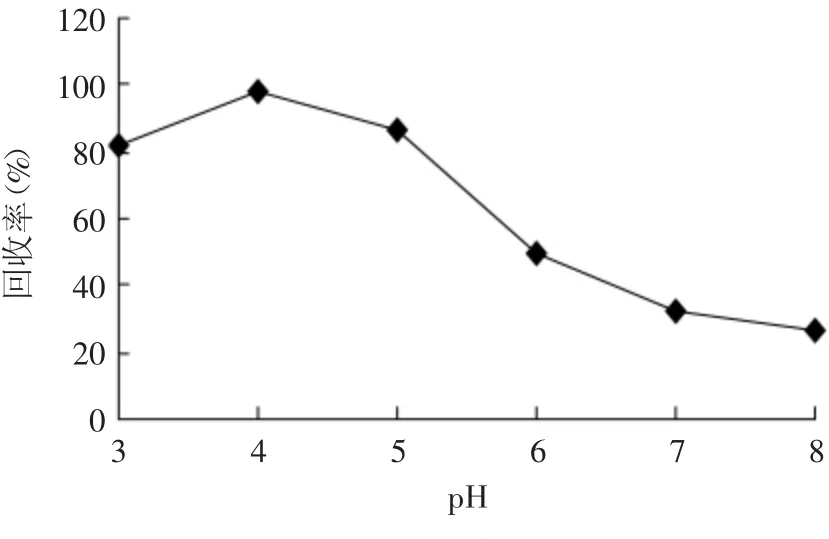
图6 pH的选择Fig.6 Selection of pH
2.2 富集倍数、线性范围和检出限
富集倍数的计算方法为:有机相浓度的计算,用氯仿作溶剂配制溴氰菊酯的浓度分别为1、10、20、40、60、80、100 μg/mL的标准混合溶液,以峰面积对浓度作标准曲线,根据测得的样品峰面积求得其有机相浓度。富集倍数为萃取后有机相浓度和水溶液中初始浓度之比。在实验条件下,蜂蜜样品中溴氰菊酯浓度为0.5 mg/kg时,富集倍数为600倍。
按1.2.4配制标准系列,每个浓度重复测定3次,以平均峰面积值Y对待测物质量浓度x做线性回归。在10~1000 μg/kg范围内线性良好,线性方程为:Y= 854741x+4076,相关系数r=0.9998。检出限(LOD,以信噪比S/N=3计)为8 μg/kg,定量限(LOQ,以信噪比S/N=10计)为40 μg/kg,可满足实际样品测定的需要。
2.3 准确度和精密度
选用空白蜂蜜样品,进行不同添加浓度的萃取、测定。溴氰菊酯添加量分别为10、50、100 μg/kg,重复实验5次,计算方法的回收率与相对标准偏差见表1。平均加标回收率为82.6%~97.3%,相对标准偏差为2.1%~3.8%,方法的准确度和精密度令人满意。蜂蜜空白色谱图及标准添加色谱图见图7。
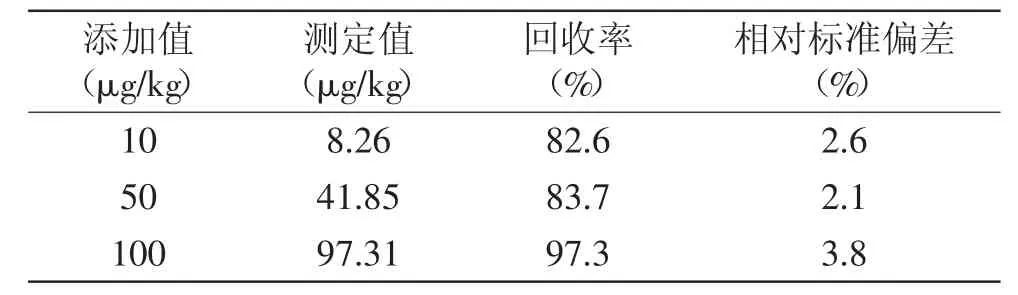
表1 蜂蜜中溴氰菊酯的加标回收率与相对标准偏差(n=5)Table1 Recoveries and relative standard deviations of deltamethrin in honey samples(n=5)
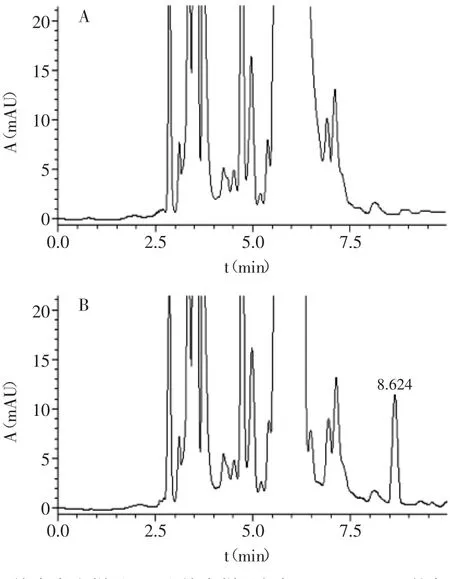
图7 蜂蜜空白样品(A)和蜂蜜样品加标100 μg/kg(B)的色谱图Fig.7 Chromatograms of honey blank(A)and spiked(100 μg/kg)honey sample(B)
2.4 样品分析
应用本方法对市售11种,33个蜂蜜样品进行分析测定,结果发现,其中有3种蜂蜜样品中检出了溴氰菊酯农药,分别为:枸杞蜜含溴氰菊酯10.6 μg/kg、柑橘蜜含溴氰菊酯10.8 μg/kg,枣花蜜含溴氰菊酯20.5 μg/kg,样品色谱图见图8。从样品测定结果可以看出,蜂蜜中确实含有痕量的溴氰菊酯残留,这一方面说明溴氰菊酯的化学稳定性很强,不易降解,容易从一个环境(土壤、植物、空气)被蜜蜂转移到蜂蜜中;另一方面则是由于近年来溴氰菊酯作为杀虫剂在农业生产中应用广泛,直接或间接造成大量蜜源被污染。
目前,关于蜂蜜中溴氰菊酯的测定报道仅有两篇[16-17],它们的前处理方法都经过了加盐、液液萃取、过柱净化和浓缩等步骤,一个样品前处理至少需要2 h,其中每处理一个样品需要有机溶剂40 mL。而本文采用超声辅助分散液相微萃取技术仅需超声和微萃取两步,全程下来不超过10 min,且每处理一个样品需有机溶剂不到1.5 mL。由此可以看出,本方法具有效率高、测试成本低以及有机溶剂消耗量少等明显优势,开辟了对复杂基质如蜂蜜中溴氰菊酯含量测定的新方法。
3 结论
本文建立了将超声辅助分散液液微萃取作为前处理技术结合高效液相色谱法测定蜂蜜中溴氰菊酯农药残留量的分析方法。该分析方法用于复杂基质-蜂蜜中溴氰菊酯含量的测定,富集倍数高达600倍,在10~1000 μg/kg范围内线性良好,检出限为8 μg/kg,加标回收率为82.6%~97.3%,相对标准偏差为2.1%~3.8%。本方法具有操作简便、效率高、成本低,环保等突出优点,完全能够满足蜂蜜中痕量溴氰菊酯残留的分析要求。同时,也是对样品前处理方法的完善和深化。我国是一个蜂蜜出口大国,面对国际上对蜂蜜质量的严苛要求以及消费者的身体健康,建议有关部门尽快制定蜂蜜中溴氰菊酯残留的最大限量标准。同时,本方法的开发和应用对其他菊酯类农药残留限的检测能够提供技术支持。
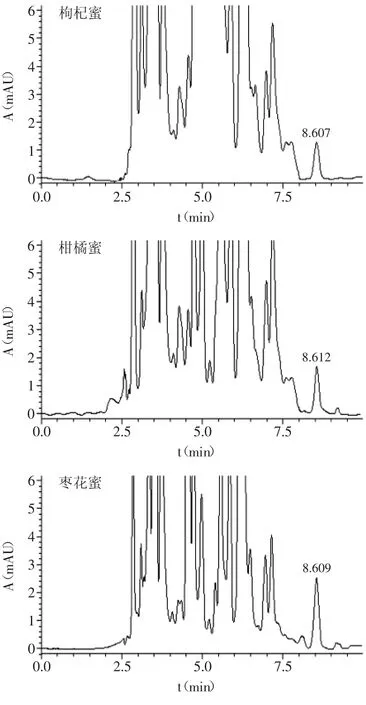
图8 蜂蜜样品色谱图Fig.8 Chromatograms of the honey samples
[1]顾雪竹,李先端,钟银燕,等.蜂蜜的现代研究及应用[J].中国实验方剂学杂志,2007,13(6):70-72.
[2]陈猛,陆婉清,韩燕,等.固相萃取-气相色谱法对河水与海水中36种农药残留的同时测定[J].分析测试学报,2009,28 (12):1378-1383.
[3]Hou M Y,Zang X H,Wang C,et al.The use of silica-coated magnetic graphene microspheres as the adsorbent for the extraction of pyrethroid pesticides from orange and lettuce samples followed by GC-MS analysis[J].Journal of Separation Science,2013,36(19):3242-3248.
[4]Dell' Oro D,Casamassima F,Gesualdo G,et al.Determination of pyrethroids in chicken egg samples:development and validation of a confirmatory analytical method by gas chromatography/mass spectrometry[J].International Journa l of Food Science and Technology,2014,49(5):1391-1400.
[5]Jenkins D W,Hensens A,Lloyd J,et al.Development and validation ofa‘universal' HPLC method for pyrethroid quantification in long-lasting insecticidal mosquito nets for malaria control and prevention[J].Tropical Medicine&International Health,2013,18(1):2-11.
[6]李永夫,高华鹏,张健玲,等.超高效液相色谱-串联质谱法测定鳗鱼中呋线威和溴氰菊酯残留[J].分析化学,2008,36 (6):755-759.
[7]Daka P S,Obuseng V C,N Torto,et al.Deltamethrin in sediment samples of the Okavango Delta,Botswana[J].Water SA,2006,32 (4):483-488.
[8]Li H P,Lin C H,Jen J F.Analysis of aqueous pyrethroid residuals by one-step microwave-assisted headspace solid-phase microextraction and gas chromatography with electron capture detection[J].Talanta,2009,79(2):466-471.
[9]Chen S B,Yu X J,He X Y,et al.Simplified pesticide multiresidues analysis in fish by low-temperature cleanup and solid-phase extraction coupled with gas chromatography/mass spectrometry[J].Food Chemistry,2008,113(4):1297-1300.
[10]徐虹,曹文婷,易承学,等.液液萃取气相色谱法测定饮用水中百菌清等12种农药残留[J].中国卫生检验杂志,2014,24 (23):3363-3365.
[11]Pinho G P,Neves A A,Queiroz M E L R,et al.Optimization of the liquid-liquid extraction method and low temperature purification(LLE-LTP)for pesticide residue analysis in honey samples by gas chromatography[J].Food Control,2010,21(10):1307-1311.
[12]Rezaee M,Assadi Y,Milani Hosseini M R,et al.Determination of organic compounds in water using dispersive liquid-liquid microextraction[J].Journal of Chromatography A,2006,1116(1-2):1-9.
[13]Maleki R,Farhadi K,Nikkhahi Y.Trace determination of malachite green in water samples using dispersive liquid-liquid microextraction coupled with high-performance liquid chromatography-diode array detection[J].International Journal of Environmental Analytical Chemistry,2012,92(9):1026-1035.
[14]Zhou S,Wu B,Ma C,et al.Solid-phase extraction followed by dispersive liquid-liquid microextraction for the sensitive determination of carbamates in environmental water by high-performance liquid chromatography[J].Journal of Liquid Chromatography&Related Technologies,2012,35(20):2860-2872.
[15]Li Y Y,Wei G H,Hu J,et al.Dispersive liquid-liquid microextraction followed by reversed phase-high performance liquid chromatography for the determination of polybrominated diphenyl ethers at trace levels in landfill leachate and environmental water samples[J].Analytica Chimica Acta,2008,615(1):96-103.
[16]吴玉环,高晓辉,许月红,等.蜂蜜中溴氰菊酯残留量的测定[J].农药科学与管理,1984(3):16-19.
[17]金珍,林竹光,陈美瑜,等.气相色谱-质谱法分析蜂蜜中的多种农药残留[J].色谱,2006,24(5):440-446.
Determination of deltamethrin residues in honey by HPLC coupled with ultrasound-assisted dispersive liquid-liquid microextraction
YU Ling
(Chemical Engineering and Biotechnology College,Xingtai College,Xingtai 054001,China)
A method of HPLC combined with ultrasound-assisted dispersive liquid-liquid microextraction was used for the determination of deltamethrin in honey.The honey sample was extracted with mixed solution of acetonitrile∶water(1∶4,v/v).After the chloroform extraction,ultrasound and centrifugation,sedimentary facies were determined by HPLC.Deltamethrin of 10~1000 μg/kg ranged with good linearity.The correlation coefficient was 0.9998,and the enrichment factor was up to 600.When the spiked concentration of honey samples came to 10,50,100 μg/kg,the recovery rates measured by standard addition method ranged from 82.6%to 97.3%,with the relative standard deviation(RSD)between 2.1%and 3.8%.The detection limit of deltamethrin in honey samples was 8 μg/kg,and the limit of quantification was 40 μg/kg.This method was simple and accurate,with high efficiency of extraction and little consumption of organic solvent.It could be successfully applied to the determination of deltamethrin residues in honey.
dispersive liquid-liquid microextraction;high performance liquid chromatography;deltamethrin;honey
TS201.1
A
1002-0306(2016)02-0068-05
10.13386/j.issn1002-0306.2016.02.005
2015-05-26
于玲(1983-),女,硕士,讲师,主要从事色谱分析方法的研究,E-mail:44427364@qq.com。

