花生红衣乙醇提取物乙酸乙酯组分抑菌活性的研究
赵 萍,竹 军,刘 冰,2,王克辉,刘 辉,张 政,伍宏泽,杜枭雄(.兰州理工大学生命科学与工程学院,甘肃兰州730050;2.合肥工业大学生物与食品工程学院,安徽合肥230009)
花生红衣乙醇提取物乙酸乙酯组分抑菌活性的研究
赵 萍1,竹 军1,刘 冰1,2,王克辉1,刘 辉1,张 政1,伍宏泽1,杜枭雄1
(1.兰州理工大学生命科学与工程学院,甘肃兰州730050;2.合肥工业大学生物与食品工程学院,安徽合肥230009)
花生红衣乙醇提取物乙酸乙酯部位加入AB-8大孔树脂层析柱中,用20%、40%、60%、80%、100%乙醇水溶液依次洗脱,得到花生红衣乙醇提取物乙酸乙酯组分,采用滤纸片法研究其抑菌活性,确定最小抑菌浓度。结果表明:花生红衣乙醇提取物乙酸乙酯组分对大肠杆菌、金黄色葡萄球菌、枯草芽胞杆菌、青霉、毛霉和黑曲霉的生长具有一定的抑制作用,最低抑菌浓度均为0.5 g/L,且抑菌圈大小随浓度的增加而变大。花生红衣乙醇提取物乙酸乙酯组分均具有广谱抑菌活性。
花生红衣乙醇提取物乙酸乙酯部位,洗脱组分,抑菌活性
花生在我国的产量居于世界第一,是主要的油料作物和经济作物[1]。花生红衣,即花生种皮,占粒重的1%~3%,其中的碳水化合物含量高达40%以上,含有大量粗纤维和蛋白质,还含有原花青素、白藜芦醇、维生素K等生物活性物质[2]。花生红衣是花生加工业的副产物,其研究和利用依然不够充分。在我国,花生红衣主要用来做饲料的辅助添加物,用量及使用范围极为有限,还未涉及到深加工的领域[3]。对花生红衣的生物活性的研究主要集中在抗氧化活性方面[4-7],也有对其抗肿瘤活性[8]、抑菌活性[9]、抗敏反应[10]、降胆固醇[11]、降血脂[12]等方面的研究。
目前,常用的抑菌剂是一些抗生素,滥用抗生素会使药物疗效降低,疾病更难治,从天然植物中提取抑菌防腐活性物质具有很强的现实意义。本实验供试菌为大肠杆菌(G-)、金黄色葡萄球菌(G+)、枯草芽孢杆菌(G+)、青霉、毛霉、黑曲霉,是食品中常见的污染菌。本实验对花生红衣乙醇提取物乙酸乙酯组分(EEPT,the ethyl acetate fraction of ethanol extract of peanut testa)的抑菌活性进行研究,从加工副产物综合利用和抑菌防腐物质的筛选两个方面均有意义。
1 材料与方法
1.1 材料与仪器
鲁花大花生花生红衣 山东鲁花集团有限公司提供;供试菌株为大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、青霉(Penicillium sp.)、毛霉(Actinomucor sp.)和黑曲霉(Aspegillus niger) 由兰州理工大学生命科学与工程学院实验中心提供;乙醇、乙酸乙酯、石油醚 均为分析纯。
6 E220型粉碎机 北京中兴伟业仪器厂;HX202T型分析天平 慈溪市天东衡器厂;RE5203型旋转蒸发仪 上海亚荣生化仪器厂;HH-4型数显恒温水浴锅 北京国华电器有限公司;AB104-N型电子分析天平 梅特勒-托利多仪器有限公司;JJ-CJ-ID型洁净工作台 吴江市净化设备总厂。
1.2 实验方法
1.2.1 EEPT各组分的制备 将5 kg花生红衣粉碎,过40目筛,用双层纱布包裹,置于装有80%乙醇的渗漉桶中进行提取[13]。料液比为1∶5,提取时间24 h。静置后弃去沉淀,上清液减压浓缩。浓缩后的样品转至5 L的分液漏斗中,加入2 L石油醚,充分振荡,静置过夜。反复进行萃取,直至上相无色,合并上相。石油醚萃取后的下相中加入2 L乙酸乙酯,充分振荡,静置过夜,重复萃取多次,直至上相无色,合并萃取液,即为乙酸乙酯有机相。
乙酸乙酯有机相加入AB-8大孔树脂层析柱中(BV=1250 mL),经20%、40%、60%、80%、100%的乙醇水溶液洗脱(20 mL/min,各个梯度洗脱2.5 BV),各洗脱组分45℃真空蒸发,得到乙酸乙酯有机相20%乙醇、40%乙醇、60%乙醇、80%乙醇、100%乙醇洗脱组分,分别记为E20、E40、E60、E80、E100。
1.2.2 抑菌活性的测定 采用滤纸片法,通过测定抑菌圈直径(mm),来评价各洗脱组分的抑菌活性[14-16]。将蒸干得到的各洗脱组分样品用80%的乙醇水溶液溶解并配制成5个浓度梯度10、5、2.5、1、0.5 g/L的样液。
将滤纸圆片(10 mm)灭菌后浸泡入不同浓度的样品中,15 min后取出,用无菌镊子放置到涂布好菌液的培养基上(各菌液含菌量106CFU/mL,金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌菌液涂布于牛肉膏-蛋白胨培养基上,黑曲霉、毛霉、青霉菌液涂布于PDA培养基上)。对照为0.85%无菌生理盐水。3次平行,细菌37℃恒温培养箱中培养24 h,霉菌28℃恒温培养箱中培养48 h。观察测量抑菌圈直径,记录结果。
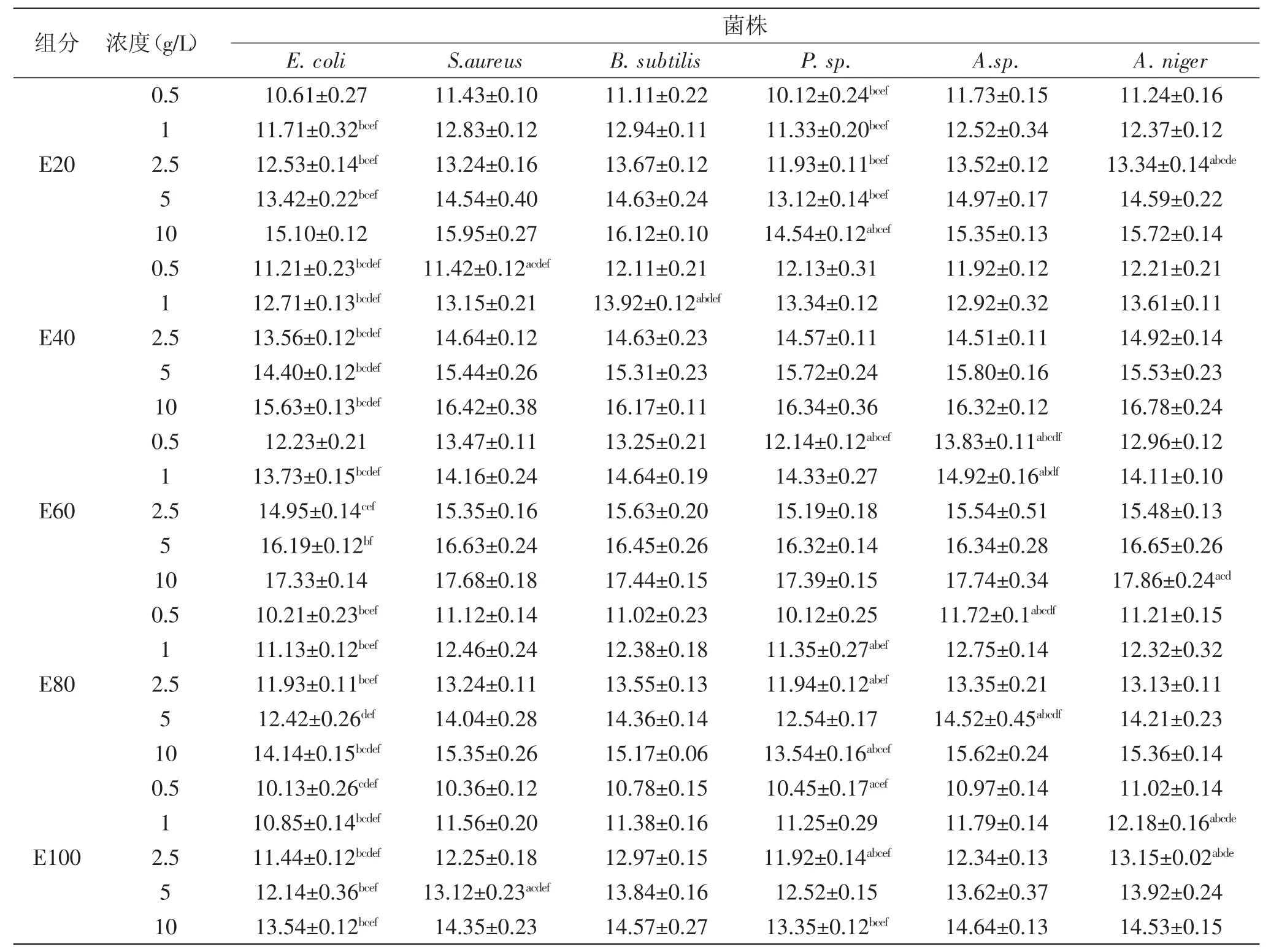
表1 EEPT提取物不同组分的抑菌活性(mm)Table1 The antimicrobial activity of elution fraction of EEPT(mm)
1.2.3 最小抑菌浓度(MIC)的测定 采用滤纸片法,以不出现抑菌圈的最低样品溶液浓度为该样液的MIC。洗脱组分样品用80%的乙醇水溶液溶解并配制成0、0.1、0.25、0.5、1 g/L 5个浓度梯度的溶液,对供试菌株做MIC实验。0.85%的无菌生理盐水为对照。3次平行,培养同1.2.2,观察各种菌有无生长。
1.2.4 统计分析 SPSS 13.0软件对实验数据统计分析,p<0.05有统计学意义,具有显著的抑制作用。
2 结果与讨论
2.1 抑菌作用
生理盐水对照组未观测到明显的抑菌圈。由表1分析可知,E20、E40、E60、E80、E100对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、青霉、毛霉、黑曲霉均有抑制作用。当浓度达到0.5 g/L及以上时,培养基上可以观察到明显的抑菌圈。相同洗脱组分对同一种菌的抑制作用随样品溶液浓度的不断升高,抑菌圈直径逐渐增大,抑菌能力也随之增强,但是均没有显著性差异,而相同洗脱组分同一浓度对不同种菌的抑制作用呈现不同的差异性。
2.1.1 E20的抑菌活性 0.5、5 g/L E20对毛霉的抑制作用最强,1、2.5、10 g/L E20对枯草芽孢杆菌的抑制作用最强;5个浓度的E20对青霉的抑制作用均为最弱。
2.1.2 E40的抑菌活性 0.5、2.5、10 g/L E40对黑曲霉的抑制作用最强,5 g/L E40对毛霉的抑制作用最强;0.5 g/L E40对金黄色葡萄球菌有显著的抑制作用,五个浓度的E40对大肠杆菌均没有显著的抑制作用。
2.1.3 E60的抑菌活性 0.5、1g/L E60对毛霉的抑制作用最强,2.5 g/L E60对枯草芽孢杆菌的抑制作用最强,5、10 g/L E60对黑曲霉的抑制作用最强;0.5 g/L E60对青霉没有显著的抑制作用,1、2.5、5、10 g/L E60对大肠杆菌的抑制作用均为最弱。
2.1.4 E80的抑菌活性 0.5、1、5、10 g/L E80对毛霉的抑制作用最强,且0.5、5 g/L E80对毛霉的抑制作用具有显著性,2.5 g/L E80对枯草芽孢杆菌有显著的抑制作用;0.5 g/L E80对青霉的抑制作用最弱,1、2.5、5 g/L E80对大肠杆菌的抑制作用最弱,10 g/L E80对大肠杆菌和青霉均没有显著的抑制作用。
2.1.5 E100的抑菌活性 0.5、1、2.5、5 g/L E100对黑曲霉的抑制作用最强,且1 g/L E100对黑曲霉的抑制作用具有显著性,10 g/L E100对毛霉的抑制作用最强;5个浓度的E100对大肠杆菌的抑制作用均为最弱,且1、2.5 g/L E100对大肠杆菌没有显著性的抑制作用,2.5 g/L E100对青霉没有显著的抑制作用。
2.2 最小抑菌浓度(MIC)
生理盐水对照组未观测到明显的抑菌圈。由表2可知,E20、E40、E60、E80、E100对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、青霉、毛霉、黑曲霉的MIC均为0.5 g/L。
3 结论
E20、E40、E60、E80、E100 5个洗脱组分对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、青霉、毛霉、黑曲霉均有抑制作用。5个洗脱组分均对毛霉有很强的抑制作用,E20、E60、E80组分对枯草芽孢杆菌的抑制作用最强,E40、E60、E100组分对黑曲霉的抑制作用最强;E20组分对青霉的抑制作用最弱,E40对大肠杆菌的抑制作用最弱,E60、E80、E100组分对大肠杆菌和青霉抑制作用均很弱。5个洗脱组分对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、青霉、毛霉、黑曲霉的最低抑菌浓度均为0.5 g/L,且抑菌圈大小随浓度的增加而变大。花生红衣乙酸乙酯组分具有广谱抑菌活性。
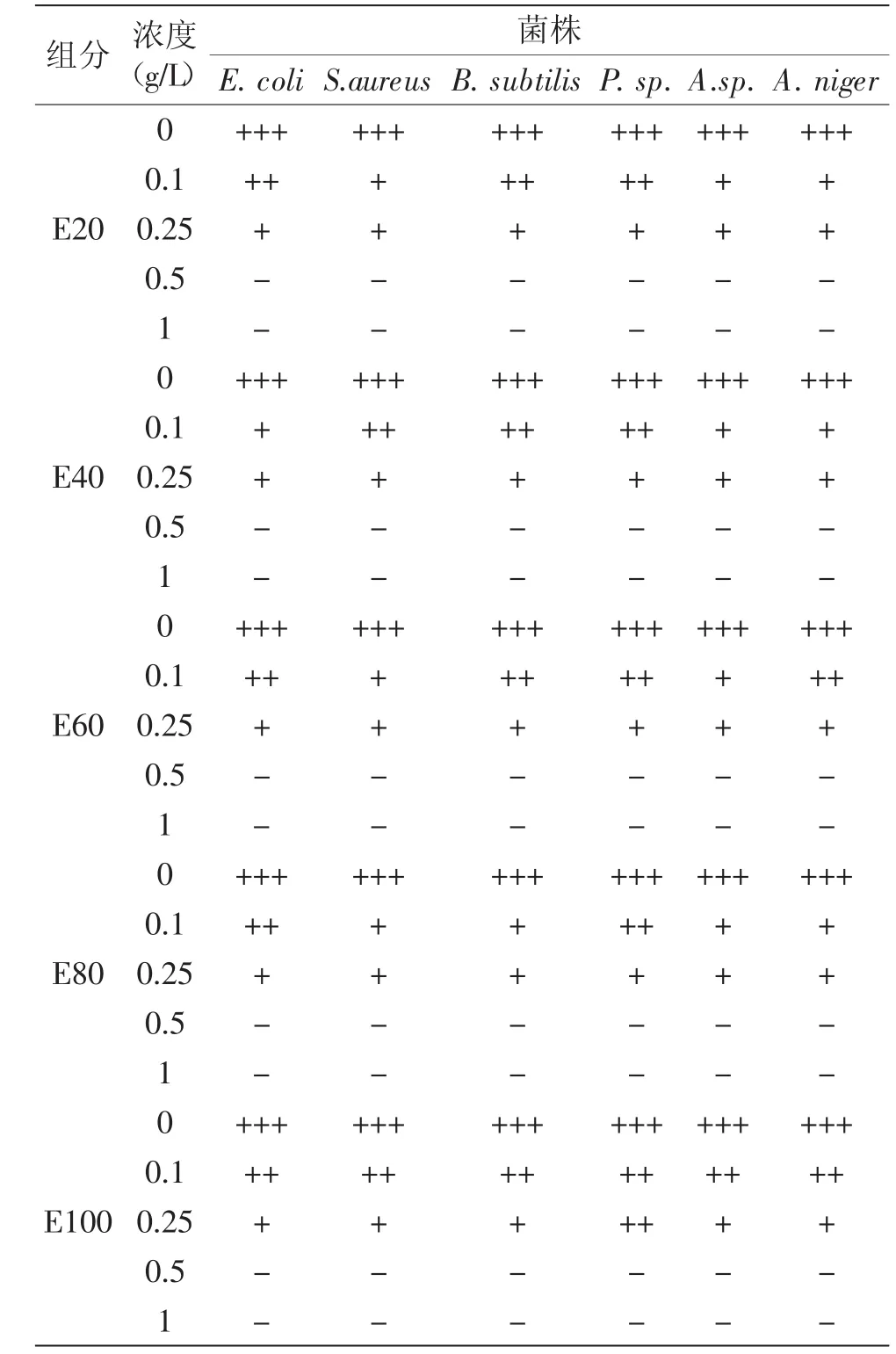
表2 EEPT提取物不同组分的最小抑菌浓度Table2 The minimal inhibitory concentration of elution fraction of EEPT
[1]杨静.中国花生生产及贸易现状与展望[J].花生学报,2009,38(1):27-31.
[2]亦森.花生皮生理活性[J].粮食与油脂,2001(4):44-45.
[3]刘晓军.花生加工副产品的再利用[J].加工技术,2006(38):35-38.
[4]Huang S C,Yen G C,Chang L W,et al.Identification of an antioxidant,ethyl protocatechuate,in peanut seed testa[J].Journal of Agricultural and Food Chemistry,2003(51):2380-2383.
[5]Van Ha HOANG,Petra APOšTOLOVÁ,Jana DOSTÁLOVÁ,et al.Antioxidant activity of peanut skin extracts from conventional and high-oleic peanuts[J].Czech J Food Sci,2008,26(6):447-457.
[6]Valeria Nepote,N R Grosso,C A Guzman.Extraction of antioxidant components from peanut skins[J].Grasasy Aceites,2002,53(4):391-395.
[7]单辉君,张名位,张瑞芬,等.花生红衣抗氧化活性物质不同提取工艺的比较[J].广东农业科学,2006(11):51-53.
[8]Hiramatsu M,Murao T,Takahashi T,et al.Molecular properties and biological action of peanut skin extract[J].Natural Antioxidants and Micronutrients,2005(2):133-138.
[9]Sarnoski,Paul J Boyer,Renee R,et al.Application of proanthocyanidins from peanut skins as a natural yeast inhibitory agent[J].Journal of Food Science,2012,77(4):M242-M249.
[10]Takano Fumihide,Takata Takanobu,Yoshihara Akio,et al.Aqueous extract of peanut skin and its main constituent procyanidin A1 suppress serum IgE and IgG1 levels in mice-immunized with ovalbumin[J].Biological& Pharmaceutical Bulletin,2007,30(5):922-927.
[11]Shimizu-Ibuka Akiko,Udagawa Haruhide,Kobayashi-Hattori Kazuo.Hypocholesterolemic effect of peanut skin and its fractions:A case record of rats fed on a high-cholesterol diet[J].Bioscience Biotechnology and Biochemistry,2009,73(1):205-208.
[12]Bansode Rishipal R,Randolph Priscilla,Hurley Steven,et al.Evaluation of hypolipidemic effects of peanut skin-derived polyphenol in rats on Western-diet[J].Food Chemistry,2012,135 (3):1659-1666.
[13]姚永志,左锦静,王子涵.乙醇提取花生红衣多酚物质的研究[J].中国油脂,2007,32(03):51-53.
[14]曾晓艳,吴巧风,程东庆.石香薷、苏州荠芋抑菌作用的实验研究[J].中国中医药科技,2007,14(1):35-36.
[15]王建军,赵宝玉,张为民.茎直黄芪提取物的体外抑菌作用[J].西北农业学报,2007,16(2):108-112.
[16]严赞开.生姜提取物的抑菌实验[J].中国食品添加剂,2005 (1):74-76.
Antimicrobial activity of ethyl acetate fractions of ethanol extract of peanut testa
ZHAO Ping1,ZHU Jun1,LIU Bing1,2,WANG Ke-hui1,LIU Hui1,ZHANG Zheng1,WU Hong-ze1,DU Xiao-xiong1
(1.School of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China;2.School of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
The ethyl acetate fraction of ethanol extract of peanut testa joined into the AB-8 macroporous resin column chromatography and eluted by 20%,40%,60%,80%and 100%of ethanol solutions.The bacteriostatic activities and the minimum inhibitory concentrations of EEPT were invested by method of filter paper.The results showed that the different fractions of EEPT could inhibit the growth of Escherichia coli,Staphylococcus aureus,Bacillus subtilis,Penicillium sp.,Actinomucor sp.and Aspegillus niger.All of the minimum inhibitory concentration of them was 0.5 g/L,and the inhibition zone size became large with the concentration increasing.The different fractions of ethyl acetate fraction of ethanol extract of peanut testa were of broad spectrum bactericidal activity.
ethyl acetate fraction of ethanol extract of peanut testa;elution fraction;bacteriostatic activity
TS201.1
A
1002-0306(2016)02-0134-04
10.13386/j.issn1002-0306.2016.02.018
2015-04-07
赵萍(1964-),女,硕士,教授,主要从事食品科学、农产品加工与副产物综合利用方面的研究,E-mail:pingzhaogdqg@163.com。

