产果胶酶菌株的筛选鉴定及产酶条件优化
卢晓华,杨 苗,王常高,林建国,杜 馨,蔡 俊(湖北工业大学,发酵工程教育部重点实验室和工业发酵湖北省协同创新中心,湖北武汉430068)
产果胶酶菌株的筛选鉴定及产酶条件优化
卢晓华,杨 苗,王常高,林建国,杜 馨,蔡 俊*
(湖北工业大学,发酵工程教育部重点实验室和工业发酵湖北省协同创新中心,湖北武汉430068)
为了得到产果胶酶菌株,采用含有以果胶为唯一碳源的溴酚蓝平板,结合DP/DC值、平板颜色变化和摇瓶发酵后果胶酶活力的测定等方法进行筛选;对筛选到的菌株XHV25进行菌落形态特征、显微形态结构观察和18S rRNA、ITS、26S rRNA基因序列的测定与分析;通过单因素实验优化菌株XHV25产果胶酶的发酵条件。菌株XHV25的果胶酶活力可达到2937.34 U/mL;经鉴定该菌株XHV25为囊酵母(Zygoascus sp.);其最适发酵产酶条件为:培养基初始pH为5.5,摇床转速为160 r/min,接种量为4%(v/v),装液量为25 mL/250 mL,发酵温度为31℃,发酵时间为48 h;在此发酵条件下果胶酶活力为4849.90 U/mL,较优化前显著提高了65.11%。
果胶酶,筛选,鉴定,囊酵母(Zygoascus sp.),产酶条件优化
果胶是植物中由一系列包含部分甲基酯化的半乳糖醛酸亚单位通过α-1,4-糖苷键连接的复杂结构多糖[1]。果胶酶是能分解果胶物质的复合酶类的总称。按果胶酶对果胶底物作用的方式可分为四类:聚半乳糖醛酸酶、原果胶酶、裂解酶和果胶酯酶[2]。多年来,果胶酶已应用于几种传统的工业生产过程,例如果汁果酒的生产提取,纺织加工和棉纤维的生物煮练,植物韧皮纤维麻类脱胶,废水处理,咖啡和茶发酵,动物饲料,植物病毒的纯化,石油开采,饮料和葡萄酒[3-6]。
果胶酶可从植物或诸如真菌和细菌等的微生物中分离得到[7-8],但天然来源于植物的果胶酶产量低且不易提取,难以大规模制备。目前微生物已成为生产果胶酶的优良生物资源,主要包括黑曲霉(Aspergillus niger)、枯草芽孢杆菌(Bacillus subtilis)、米根霉(Rhizopus oryzae)等[9-11],其中黑曲霉也已成为工业生产果胶酶最为安全常见的真菌菌种[12],但果胶酶的产量和质量依然不能满足食品工业的需求。选育新的高产果胶酶优良菌种,成为果胶酶工业化生产的关键。
近年来,研究产果胶酶的微生物主要集中在黑曲霉和枯草芽孢杆菌等,但极少有报道利用酵母产果胶酶相关的研究。本文采用以果胶为唯一碳源的平板筛选到一株产果胶酶的酵母菌株XHV25,并通过单因素实验优化该菌株产果胶酶的发酵条件,以期选育出高产果胶酶菌株,为果胶酶的工业化生产提供理论依据。
1 材料与方法
1.1 材料与仪器
橙子皮粉 自制过100目筛;果胶和半乳糖醛酸 Sigma公司;3,5-二硝基水杨酸 国药集团化学试剂有限公司;溴酚蓝 Amresco;富集培养基 牛肉膏5 g,蛋白胨5 g,葡萄糖3 g,NaCl 1 g,MgSO41 g,K2HPO4·3H2O 1 g,KH2PO40.5 g,水1000 mL;初筛培养基 果胶5 g,NaNO33 g,NaCl 1 g,MgSO41 g,K2HPO4·3H2O 1 g,KH2PO40.5 g,溴酚蓝0.1 g,琼脂20 g,水1000 mL;发酵培养基:桔皮粉20 g,蛋白胨5 g,NaCl 1 g,MgSO41 g,K2HPO4·3H2O 1 g,KH2PO40.5 g,水1000 mL;种子培养基 葡萄糖20 g,蛋白胨20 g,酵母提取物10 g,水1000 mL;YPD培养基 葡萄糖20 g,蛋白胨20 g,酵母提取物10 g,琼脂20 g,水1000 mL;其他试剂 均为分析纯。
PHS-25 pH计 上海雷磁;3K15冷冻离心机 德国Sigma公司;SynergyTM2多功能酶标仪 BioTek。
1.2 实验方法
1.2.1 初筛 取样品约10 g置于适量无菌生理盐水中,充分搅拌静置后吸取4 mL接种于100 mL富集培养基,30℃摇床振荡培养24 h。取富集培养后的菌悬液0.5 mL做适当梯度稀释,再取不同稀释度的菌悬液0.1 mL涂布于初筛培养基上,30℃培养48 h后,挑选出能使溴酚蓝平板生成黄色圈的单菌落,进行菌株的划线分离纯化[13];将纯化好的菌株划线接种于初筛平板上培养60 h后,测量其变色圈直径(Dp)和菌落直径(Dc),挑选出Dp/Dc值较大的菌株作复筛的出发菌株[14]。
1.2.2 复筛 取上述初筛所得到的Dp/Dc值较大的菌株接种于液态初筛培养基中,30℃振荡培养24 h后,再取3 mL培养液接种于50 mL/250 mL发酵培养基中,30℃振荡培养48 h。发酵液9000 r/min离心15 min后,吸取上清液适当稀释作稀释粗酶液,采用DNS法使用酶标仪测定稀释粗酶液的果胶酶活力,筛选出酶活力较高的菌株。
1.2.3 菌株鉴定和保藏 菌株鉴定和保藏由中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)执行。鉴定内容包括:微生物菌株的形态特征,18S rRNA基因序列、ITS序列和26S rRNA基因序列的测定与分析,微生物菌株碳源氧化和利用检测。菌株XHV25已于2015年3月31日保藏在中国典型培养物保藏中心,保藏编号为:CCTCC M 2015183。
1.2.4 粗酶液的制备 取上述筛选出的菌株接种于种子培养基,置于30℃、160 r/min摇床振荡培养14 h,此时种子培养液的菌体细胞达108个/mL。取3 mL(接种量6%)种子培养液接种于50 mL发酵培养基,30℃摇床振荡培养48 h。4℃、8000 r/min离心15 min后取上清液即得粗酶液。
1.2.5 酶活测定
1.2.5.1 半乳糖醛酸标准曲线的绘制 取标准D-半乳糖醛酸溶液(1 mg/mL)0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL,分别置于11支25 mL具塞比色管中,分别用蒸馏水补足至2 mL,各加入DNS试剂[14]3 mL,置沸水浴中煮沸10 min,然后以流动水迅速冷却,用蒸馏水定容至25 mL,充分混匀,各取0.2 mL于96孔板中,用酶标仪在540 nm处测定吸光度,以吸光值(A)为横坐标,半乳糖醛酸浓度(B,mg/mL)为纵坐标,绘制标准曲线,得标准曲线方程为B=0.23×A-0.03(R2=0.9940)。
1.2.5.2 酶液酶活的测定 吸取1.8 mL质量分数为1%的果胶底物溶液(用pH为5.0的柠檬酸-磷酸盐缓冲液配制)于具塞比色管中,加入0.2 mL稀释粗酶液,50℃水浴精确反应30 min后取出,加入3 mL DNS试剂混匀后立即用沸水浴10 min灭活,定容至25 mL;以煮沸灭活的粗酶稀释液作为空白对照[15-16]。用酶标仪在波长540 nm处测OD值。果胶酶活力的定义:在上述反应条件(50℃,pH5.0)下,1 mL酶液每分钟水解果胶底物生成1 μg半乳糖醛酸的能力定义为1个酶活力单位D(U)。
D=(B×C×1000)/(0.2×30)
式中,C为粗酶液的稀释倍数,D为酶活(U)。
1.2.6 发酵产酶条件实验 初始发酵条件为:发酵温度30℃,发酵时间48 h,初始pH为6.0,摇床转速160 r/min,接种量6%(v/v),装液量50 mL/250 mL。
采用单因素实验研究了初始pH、摇床转速、接种量、装液量、发酵周期、发酵温度对菌株XHV25产果胶酶活力的影响。
1.2.6.1 初始pH的单因素实 调整初始pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0,其他发酵条件为初始发酵条件。研究初始pH对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行。
1.2.6.2 摇床转速的单因素实验 初始pH取上述实验确定的最优结果,调整摇床转速分别为140、160、180、200、220 r/min,其他发酵条件为初始发酵条件。研究摇床转速对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行。
1.2.6.3 接种量的单因素实验 初始pH和摇床转速取上述实验确定的最优结果,调整接种量分别为2%、4%、6%、8%、10%(v/v),其他发酵条件为初始发酵条件。研究接种量对对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行。
1.2.6.4 装液量的单因素实验 初始pH、摇床转速和接种量取上述实验确定的最优结果,采用250 mL摇瓶装液,调整摇瓶装液量分别为12.5、25、37.5、50、62.5、75 mL,其他发酵条件为初始发酵条件。研究装液量对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行,并通过SPSS作不同装液量对酶活的差异显著性分析。
1.2.6.5 发酵温度的单因素实验 初始pH、摇床转速、接种量和装液量取上述实验确定的最优结果,调整发酵温度分别为25、28、31、34、37、40℃,其他发酵条件为初始发酵条件。研究发酵温度对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行。
1.2.6.6 发酵时间的单因素实验 初始pH、摇床转速、接种量、装液量和发酵温度取上述实验确定的最优结果,调整发酵时间分别为12、24、36、48、60、72、84 h。研究发酵温度对囊酵母(Zygoascus sp.)产果胶酶活力的影响,每组三个平行。
1.3 数据处理
用软件Origin 8绘制出发酵产酶条件优化的各个单因素图。用SPSS进行差异显著性分析,p<0.05差异显著。
2 结果与讨论
2.1 菌株的筛选
2.1.1 初筛 初筛是根据菌株生长时利用果胶使平板产生变色圈(水解圈)的能力,挑选出Dp/Dc值较大的菌株作为复筛的出发菌株。最终筛选得到的菌株中有24株降解果胶能力较好的菌株,其水解圈和菌落直径结果见表1。通过平板菌落观察,发现菌株38、40的菌落由中间致密的一点向外蔓延着不规则的丝绒状菌丝,可初步确定为放线菌;菌株b1、q3的菌落形态较大,菌丝质地疏松,不透明,呈白色绒毛棉絮状,可初步确定为霉菌;菌株hq1、hq2的菌落形态较大,菌丝呈疏松的黑色蛛网状交织,与培养基连接紧密,不易挑起,可初步确定为霉菌;其他菌株在以果胶为唯一碳源的初筛平板上呈白色,边缘齿状不规则,继续培养一段时间后菌体从中心向外由白色变黑色。部分菌株如b1、v25的变色圈(水解圈)见图1、图2。菌株v25的菌落呈白色凸起状,较湿润,质地均匀,边缘略呈齿状不规则,继续培养一段时间后菌体从中心向外由白色变黑色;围绕菌落周围由紫色变成直径大小不一的黄色圈,其变黄的程度也有所差异。
2.1.2 复筛 将初筛得到的24株菌株在斜面活化后制备种子液,接种于液态发酵培养基发酵后测定粗酶液的果胶酶活力,其果胶酶活力见表2。其中菌株v25的果胶酶活力最大,为2937.34 U/mL,将菌株v25重新命名为XHV25。
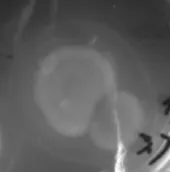
图1 菌株b1的水解圈Fig.1 Hydrolysis circle of strain b1

图2 菌株v25的变色圈Fig.2 Discoloration circle of strain v25
2.1.3 菌株的鉴定 菌株XHV25在YPD平板上的菌落呈圆形,乳白色,表面光滑湿润,丰厚粘稠,边缘较整齐,其显微镜和平板菌落观察分别见图3、图4。对菌株XHV25的18S rRNA、ITS、26S rRNA基因序列进行测定后再在NCBI中使用Blast进行比对,发现XHV25的ITS序列与Zygoascus meyerae(HM450996.1,GenBank)、Z.hellenicus(AY447034.1,GenBank)具有99%的相似度;XHV25和Z.meyerae、Z.hellenicus的18S rRNA、26S rRNA基因序列同源性最高,根据以上结果分析确定菌株XHV25为囊酵母(Zygoascus sp.)。
2.2 发酵产酶条件优化

表1 水解圈直径(Dp)与菌落直径(Dc)比值Table1 Hydrolysis circle diameter(Dp)and colony diameter(Dc)ratio
2.2.1 培养基初始pH对果胶酶活力的影响 由图5可知,随着pH的增大菌株XHV25所产果胶酶的酶活逐渐增加,在pH为5.5时酶活达到最大值为3096.38 U/mL。随pH数值的进一步增大,果胶酶的酶活反而逐渐减少,说明此菌在弱酸性的条件下,比较适合产酶,pH过高或过低对产酶都会产生很大的抑制作用。据方差分析,培养基初始pH对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。
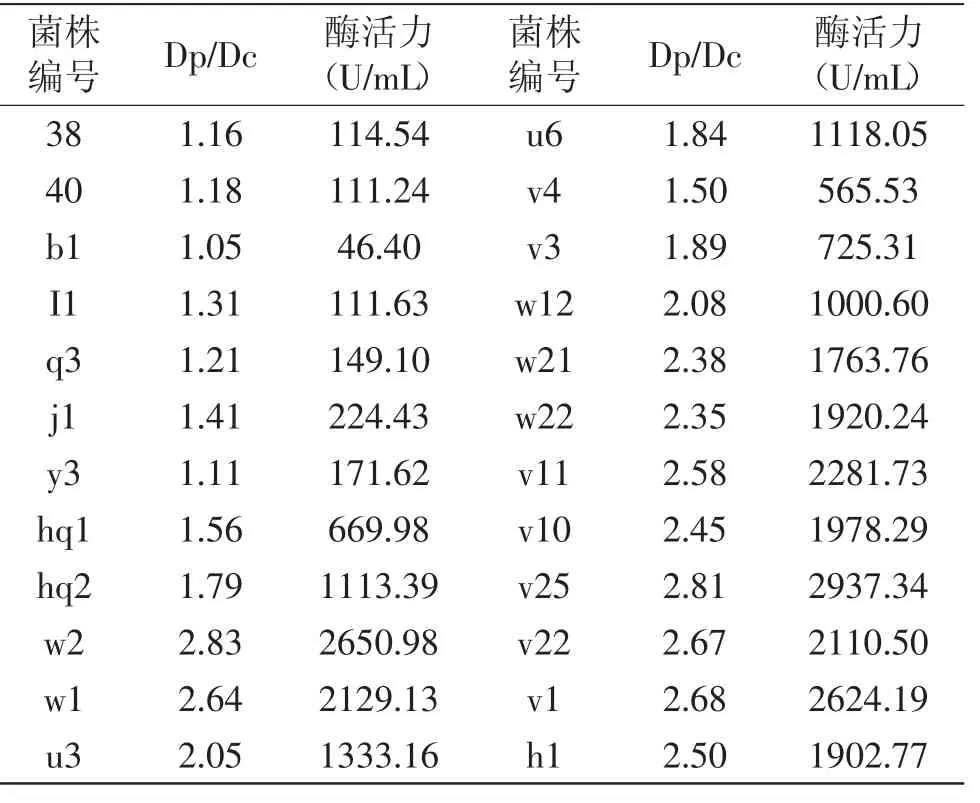
表2 24株菌株所产的果胶酶活力Table2 Pectinase activity of 24 strains produced
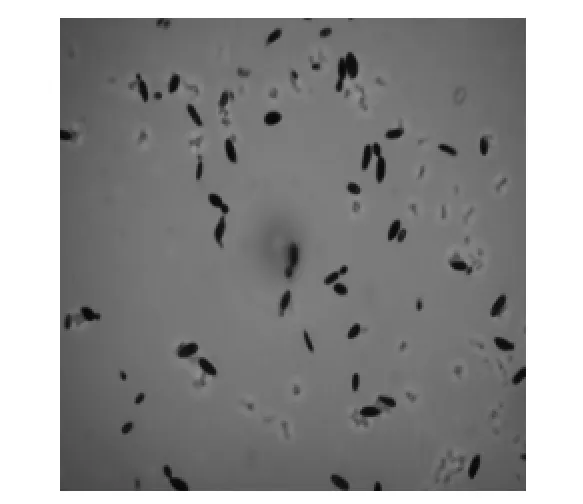
图3 菌株XHV25显微镜(400×)Fig.3 Strain XHV25 microscope observed(400×)
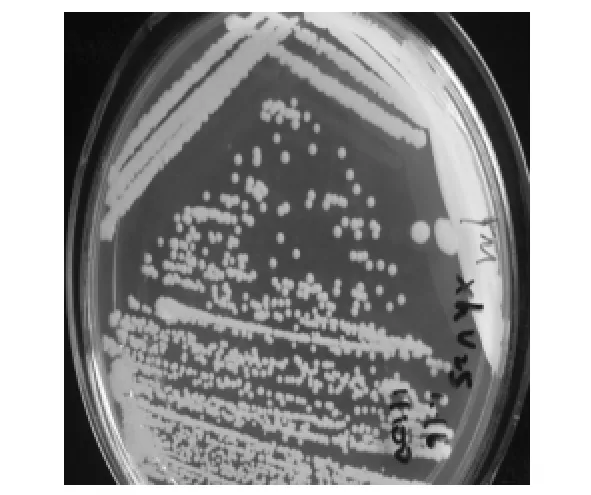
图4 菌株XHV25平板菌落观察Fig.4 Strains XHV25 colony observed
2.2.2 摇床转速对果胶酶活力的影响 由图6可知,当摇床转速为160 r/min时,菌株XHV25所产果胶酶的酶活达到最大值为3427.27 U/mL。随转速的继续增大,酶活趋于稍微降低。据方差分析,摇床转速对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。

图5 培养基初始pH对果胶酶活力的影响Fig.5 Effect of initial pH on pectinase activity
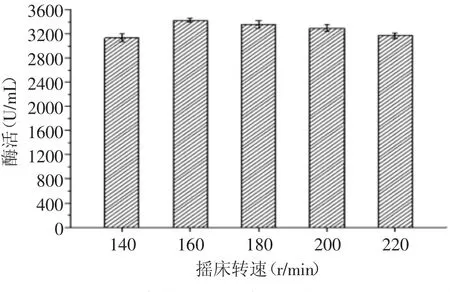
图6 摇床转速对果胶酶活力的影响Fig.6 Effect of rotating speed on pectinase activity
2.2.3 接种量对果胶酶活力的影响 由图7可知,当接种量为4%(v/v)时,菌株XHV25所产果胶酶的酶活达到最大值为3570.94 U/mL。此后,随着接种量的增大酶活逐渐下降,可能是因为接种量的增大导致发酵液中菌体浓度过高,导致菌体生长旺盛,营养物质消耗过快,溶氧不足,代谢受抑制,致使产酶能力降低。据方差分析,接种量对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。
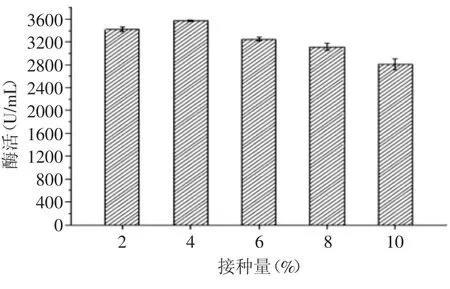
图7 接种量对果胶酶活力的影响Fig.7 Effect of inoculum concentration on pectinase activity
2.2.4 装液量对果胶酶活力的影响 由图8可知,当装液量为25 mL/250 mL时,菌株XHV25所产果胶酶的酶活达到最大值为4562.30 U/mL,此时发酵培养基中的溶氧最适合菌体生长和代谢产酶。在最适装液量25 mL/250 mL以后,随着装液量的增大,酶活明显逐渐降低,可能是因为发酵体系溶氧不足,或菌体生长与代谢产酶失去平衡,从而代谢产酶过程受抑制。据方差分析,装液量对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。

图8 装液量对果胶酶活力的影响Fig.8 Effect of loading volume on pectinase activity
2.2.5 发酵温度对果胶酶活力的影响 由图9可知,当温度为31℃时,菌株XHV25所产果胶酶的酶活达到最大值为4654.32 U/mL,但当温度进一步增大时,酶活极速下降,可能是因为温度过高,不利于代谢产酶。据方差分析,发酵温度对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。

图9 发酵温度对果胶酶活力的影响Fig.9 Effect of fermentation temperature on pectinase activity
2.2.6 发酵时间对果胶酶活力的影响 由图10可知,在发酵时间为48 h时,菌株XHV25所产果胶酶的酶活达到最大值为4849.90 U/mL。发酵初期,培养基中的营养物质主要用于菌体的生长,代谢产物积累较少。此后,随着发酵时间的继续延长,酶活略微降低,可能是因为营养物质的耗尽及代谢产物的大量积累,导致菌体自溶。据方差分析,发酵时间对囊酵母(Zygoascus sp.)产果胶酶活力具有显著性影响(p<0.05)。

图10 发酵时间对果胶酶活力的影响Fig.1 0 Effect of fermentation time on pectinase activity
3 结论
本研究采用含有以果胶为唯一碳源的溴酚蓝平板分离得到产果胶酶的菌株,通过测定各菌株所产果胶酶活力复筛选出产果胶酶菌株XHV25,其酶活可达到2937.34 U/mL。通过对菌株XHV25进行菌落形态特征、显微形态结构观察和18S rRNA、ITS、26S rRNA基因序列的测定与分析,确定该菌株XHV25为囊酵母属(Zygoascus sp.)。该菌株已于2015年3月31日保藏于中国典型培养物保藏中心,保藏编号为:CCTCC M 2015183。通过单因素实验确定该菌株的最适发酵产酶条件为:培养基初始pH为5.5,摇床转速为160 r/min,接种量为4%,装液量为25 mL/250 mL,发酵温度为31℃,发酵时间为48 h,在此发酵条件下果胶酶活力可达4849.90 U/mL,较优化前显著提高了65.11%。
[1]Silva E G,Borges M D F,Medina C,et al.Pectinolytic Enzymes Secreted By Yeasts From Tropical Fruits[J].Fems Yeast Research,2006,5(9):859-865.
[2]Jayani R S,Saxena S,Gupta R.Microbial pectinolytic enzymes:A review[J].Process Biochemistry,2005,40(9):2931-2944.
[3]Wu R,He B H,Zhao G L,et al.Immobilization of pectinase on oxidized pulp fiber and its application in whitewater treatment.[J].Carbohydrate Polymers,2013,97(2):523-529.
[4]Ahlawat S,Dhiman S S,Battan B,et al.Pectinase production by Bacillus subtilis and its potential application in biopreparation of cotton and micropoly fabric[J].Process Biochemistry,2009,44 (5):521-526.
[5]Amid M,Abdul Manap M Y,Mustafa S.Purification of pectinase from mango(Mangifera indica L.cv.Chokanan)waste using an aqueous organic phase system:a potential low cost source of the enzyme.[J].J Chromatogr B Analyt Technol Biomed Life Sci,2013,931(14):17-22.
[6]Alimardani-Theuil P,Gainvors-Claisse A,Duchiron F.Yeasts:An attractive source of pectinases—From gene expression to potential applications:A review[J].Process Biochemistry,2011,46(8):1525-1537.
[7]Gonc-alves D B,Teixeira J A,Bazzolli D M S,et al.Use of response surface methodology to optimize production of pectinasesby recombinant Penicillium griseoroseum T20[J].Biocatalysis&Agricultural Biotechnology,2012,1:140-146.
[8]张红霞,江晓路,牟海津,等.微生物果胶酶的研究进展[J].生物技术,2005,15(5):92-94.
[9]Meneghel L,Reis G P,Reginatto C,et al.Assessment of pectinase production by Aspergillus oryzae in growth-limiting liquid medium under limited and non-limited oxygen supply[J].Process Biochemistry,2014,49:1800-1807.
[10]汤鸣强,戴智钦.桔子园土壤中果胶分解菌的分离及其特性[J].中国酿造,2009,202(1):55-58.
[11]Ibrahim D,Weloosamy H,Sheh L.Potential use of nylon scouring pad cubes attachment method for pectinase production by Aspergillus niger HFD5A-1[J].Process Biochemistry,2014,49(4):660-667.
[12]Esawy M A,Gamal A A,Kamel Z,et al.Evaluation of free and immobilized Aspergillus niger NRC1ami pectinase applicable in industrial processes[J].Carbohydr Polym,2013,92(2):1463-1469.
[13]张飞,岳田利,费坚,等.果胶酶活力的测定方法研究[J].西北农业学报,2004,13(4):134-137.
[14]张浩森,缪静,余晓斌,等.果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008,25(1):28-30.
[15]Miller G L.Use of DinitrosaIicyIic Acid Reagent for Determination of Reducing Sugar[J].Analytical Chemistry,1959,31(3):426-428.
[16]Zeni J,Cence K,Grando C E,et al.Screening of Pectinase-Producing Microorganisms with Polygalacturonase Activity[J].Applied Biochemistry&Biotechnology,2011,163(3):383-392.
Screening and identification of pectinase-producting strains and optimization of pectinase-producting condition
LU Xiao-hua,YANG Miao,WANG Chang-gao,LIN Jian-guo,DU Xin,CAI Jun*
(Key Laboratory of Fermentation Engineering(Ministry of Education),Hubei Provincial Cooperative Innovation Center of Industrial Fermentation,Hubei University of Technology,Wuhan 430068,China)
To obtain the pectinase-producing strains,the bromophenol blue plate separation method which contains the pectin as the sole carbon source was used,combined with DP/DCvalue and flat color changes.The strains screened were inoculated for the liquid fermentation culture,and the activities were determinated,then screened again out a strain XHV25 with the pectinase activity of 2937.34 U/mL.Morphology,physiology and biochemistry research coupled with 18S rRNA,ITS,26S rRNA sequence and analysis indicates that the strain of XHV25 was Zygoascus sp.Single-factor method was used for optimizing the fermentation condition.The optimum pectinase-producting conditions were as follows:initial medium pH5.5,shaking speed 160 r/min,inoculum amount 4%(v/v),loading volume 25 mL/250 mL,optimum fermentation temperature 31℃,fermentation time 48 h.Under this fermentation conditions,pectinase activity reached 4849.90 U/mL,which was 65.11%higher than that of before optimization.
pectinase;screening;identification;Zygoascus sp.;optimization of fermentation conditions
TS201.3
A
1002-0306(2016)02-0189-06
10.13386/j.issn1002-0306.2016.02.030
2015-05-11
卢晓华(1989-),男,在读硕士研究生,研究方向:发酵过程优化与放大,E-mail:924268082@qq.com。
*通讯作者:蔡俊(1968-),男,博士,教授,研究方向:微生物发酵工程,E-mail:caijun@mail.hbut.edu.cn。
湖北省自然科学基金重点项目(2009CDA059)。

