基于不同抗氧化机制的黄酮类化合物构效关系研究进展
任 红,郑少杰,张小利,卢可可,吴素蕊,明 建,3,4,*(.西南大学食品科学学院,重庆40075;.中华全国供销合作总社昆明食用菌研究所,云南昆明6503;3.重庆市特色食品工程技术研究中心,重庆40075;4.西南大学国家食品科学与工程实验教学中心,重庆40075)
基于不同抗氧化机制的黄酮类化合物构效关系研究进展
任 红1,郑少杰1,张小利1,卢可可1,吴素蕊2,明 建1,3,4,*
(1.西南大学食品科学学院,重庆400715;2.中华全国供销合作总社昆明食用菌研究所,云南昆明650223;3.重庆市特色食品工程技术研究中心,重庆400715;4.西南大学国家食品科学与工程实验教学中心,重庆400715)
目前很多疾病的发生都与体内氧化损伤密切相关,如癌症、糖尿病、心脑血管疾病、动脉粥样硬化等。黄酮类化合物因具有较强的抗氧化活性而备受关注,其抗氧化活性与结构有很大的关系,如羟基数目与位置、双键、糖苷键结构等。本文就不同抗氧化机理下的黄酮类化合物构效关系进行综述,以期为今后充分认识和开发黄酮类功能食品或者药品提供一定的参考。
黄酮类化合物,抗氧化机制,构效关系,自由基
大量研究证实,很多疾病的发生都与由自由基引起的氧化损伤密切相关,如癌症、糖尿病、心脑血管疾病、动脉粥样硬化等[1]。黄酮类化合物因具有较强的抗氧化活性而备受关注[2]。它能够直接清除体内自由基、抑制产生自由基的酶、螯合金属离子、促进抗氧化因子再生和抗氧化酶的水平,是一种良好的天然抗氧化剂[3]。其抗氧化活性与结构有着很大的关系,如羟基数目与位置、双键位置、糖苷键结构等。尽管黄酮类化合物的抗氧化活性研究的已比较清楚,但在不同抗氧化作用机制中,其抗氧化作用效果与结构之间的构效关系研究的不够深入,即具有何种羟基位点、羰基结构和糖苷键位置的黄酮类化合物才能表现出直接清除自由基、抑制氧化酶、螯合金属离子、促进抗氧化物质再生等不同的抗氧化能力。因此,本文就不同抗氧化作用机制下黄酮类化合物抗氧化活性构效关系进行了综述,以期为开发黄酮类功能食品或者药品提供参考。
1 黄酮类化合物的结构、种类
黄酮类化合物是经过苯丙烷类和类黄酮代谢途径合成的一类次生代谢产物,广泛存在于天然植物、水果、蔬菜、花卉以及茶叶中[4]。黄酮类化合物是由一个呋喃环(C环)连接两个苯环(A、B环)形成的C6-C3-C6结构,如图1所示[5]。由于黄酮类化合物中间C环的氧化程度以及两侧A环、B环上取代基的位置、数量、种类不同,形成多种多样的黄酮类化合物。
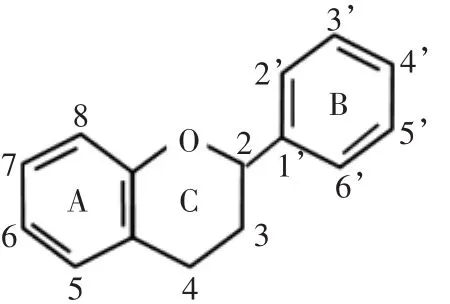
图1 黄酮类化合物的基本骨架Fig.1 Genericstructure of flavonoid molecule
根据其分子结构特征,可分为黄酮类、黄酮醇类、黄烷酮类、黄烷醇类、异黄酮类、花色苷等[6]。其结构如图2所示。
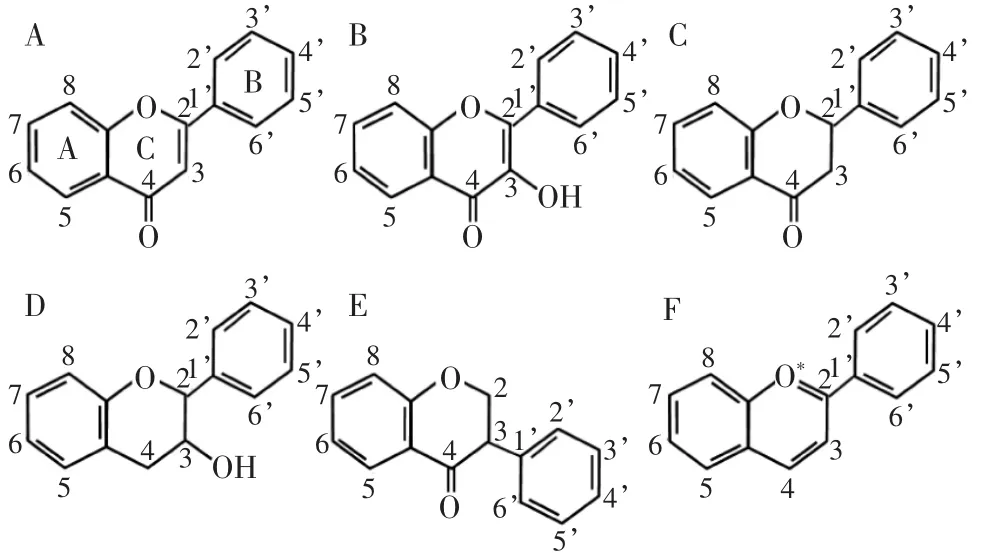
图2 黄酮化合物的基本分类和结构Fig.2 The basic groups of flavonoids
2 黄酮类化合物抗氧化机理及其构效关系
当机体内自由基水平较高,膜脂质、核酸、蛋白质、DNA、酶和其他小分子就容易发生氧化损伤,诱发多种疾病,如癌症、动脉粥样硬化、衰老等[7-8]。黄酮类化合物具有极强的抗氧化活性,其抗氧化作用机制主要表现为:直接清除自由基、抑制氧化酶产生自由基、螯合催化自由基生成的金属离子、促进抗氧化物质(抗氧化酶和小分子抗氧化因子)再生。
2.1 基于直接清除自由基的构效关系
在自由基的直接清除中,黄酮B环发挥着重要作用,C环起次要作用,而A环最弱,C3-OH与C5-OH也能够有效清除自由基,它们能够提供氢原子到C-4羰基上,形成稳定的结构[9]。一般来讲,具有3′,4′-邻二羟基、C3-OH、C2=C3和C-4羰基结构的黄酮化合物抗氧化活性最强,如槲皮素和杨梅素,其中槲皮素又强于杨梅素,主要是B环5′-OH抑制了杨梅素的抗氧化活性[10]。
Wolfe等[11]采用细胞抗氧化活性(CAA)方法也证实具有3′,4′-邻二羟基、C3-OH、C2=C3和C-4羰基结构的黄酮类化合物有较高的CAA值。Sghaier等[12]发现节节草中3种黄酮类化合物芜花素、蓟黄素、4′,7-二甲氧基芹菜素都具有较高的抗氧化活性,其中蓟黄素显示出最高的抗氧化活性,证实C5-OH和C7-OH能够增强抗氧化活性。
在黄酮各环的羟基位点上,除C3-OH、3′-OH、4′-OH是与自由基反应的主要位点,2′-OH、C7-OH结构也能提高黄酮类化合物的抗氧化活性[13-14]。异黄酮中3′-OH和5′-OH具有明显的自由基清除能力,4′-OH 比4′-O-Me具有更强的活性;二氢异黄酮中,C5-OH和2′-O-Me具有增强抗氧化效果的作用[15]。Dueñas等[16]发现3′-O-Me表儿茶素与槲皮素的抗氧化活性要低于4′-O-Me表儿茶素与槲皮素,但4′-O-Me儿茶素的抗氧化活性低于3′-O-Me儿茶素,这可能是因为这两类儿茶素C3-OH的立体位置不同而造成的抗氧化差异,而槲皮素C-4羰基与C2=C3结构有较强的电子离域能力和稳定性,儿茶素与表儿茶素却没有此结构。
此外,黄酮化合物C-糖基化会增强清除自由基的能力[17]。聚合度对黄酮类化合物的抗氧化活性也有影响,如原花青素平均聚合度(mDP)<10时,其抗氧化活性与mDP呈正相关[18]。
2.2 基于抑制相关氧化酶的构效关系
体内氧化酶的催化也能产生过量自由基,这些氧化酶包含有:脂氧合酶(LOX)、黄嘌呤氧化酶(XO)、醛氧化酶(AO)、NADPH氧化酶(NOX)等[19]。黄酮类化合物抑制氧化酶活性的基团及构效关系如表1所示。
2.2.1 抑制LOX LOX能直接催化生成过氧化物。Ribeiro等[20]研究证实A环中C5-OH、C7-OH以及B环中羟基数目和位置是抑制LOX的关键位点;A环与LOX-1接触更亲密,但其结合位点不清楚。Knaup等[21]研究翠雀素(Dp)、矢车菊素(Cy)、芍药花青素(Pn)、锦葵色素(Mv)及它们的糖苷对LOX-1和5-LOX的抑制作用,结果发现翠雀素葡萄糖苷(Dp 3-O-glucoside,Dp3glc)和翠雀素半乳糖苷(Dp 3-O-galactoside,Dp3gal)能够显著抑制LOX-1和5-LOX,对LOX-1的作用强于对5-LOX;其他苷元的抑制作用顺序是Dp>Cy>Pn>Mv,表明B环邻位羟基结构与C环3位连接的糖种类对酶的抑制作用至关重要。
2.2.2 抑制XO XO能够催化次黄嘌呤/黄嘌呤氧化产生过氧化物、自由基。Pauff等[22]发现姜黄素对XO没有抑制作用,说明C3-OH不是必要的抑制XO活性的基团,相反,会略微降低其抑制效率。Li等[23]研究九种类黄酮化合物对XO的抑制作用,结果发现C2=C3是抑制XO活性的必要结构,C3-OH被糖基取代,如芦丁、异槲皮苷,会降低其对XO的抑制作用。Özyürek等[24]发现芹菜素、木犀草素、山奈酚、槲皮素和杨梅素等都能很好地抑制XO产生自由基,说明C7-OH非常重要,C5-OH对于抑制XO活性不是必要基团,但它可以显著增强黄酮活性。
2.2.3 抑制AO AO能够催化多种化合物发生氧化反应。Tayama等[25]发现绿茶儿茶素及其衍生物能够很大程度上抑制AO的活性。Hamzeh-Mivehroud等[26]研究黄酮、黄酮醇、黄烷酮、异黄酮能够抑制鼠肝脏AO活性,结果发现C7-OH是抑制AO活性的重要基团;比较槲皮素、儿茶素与表儿茶素、大豆黄酮和染料木黄酮、橙皮素与柚皮素等,发现C-4羰基、C5-OH、4′-O-Me对抑制AO活性很重要;C3-OH显示有较强的抑制AO活性,而C环3-O-糖基化有较低的活性;比较牡荆素和金雀异黄素,C8-OH有较低的抑制AO活性;这可能是因为化合物自身芳环堆积以及A环芳香烃和羟基之间相互作用造成的。
2.2.4 抑制NOX NOX能够产生超氧自由基。木犀草素可以通过抑制NOX2 mRNA表达,减少ROS产生,B环邻二酚未被取代的黄酮能够清除自由基,但不能抑制NOX活性;B环中邻二酚O-甲基化或者缺失一个羟基的黄酮(如B环中只含有4′-OH的芹菜素、山奈酚)能够抑制NOX活性;C2=C3双键的氢化(花旗松素与槲皮素;二氢山奈酚与山奈酚)能够增强抑制NOX活性[27]。Steffen等[28]发现(-)-表儿茶素能够清除O·,不能抑制NOX活性,而它的代谢产物3′-O-Me和4′-O-Me表儿茶素却能够抑制NOX活性,但其不是清除NOX的必要基团。
2.3 基于螯合金属离子的构效关系
金属离子是自由基产生的催化剂,如Fe2+、Cu2+可介导脂质过氧化,催化羟基自由基产生。过量的金属离子能够诱导氧化应激,增加脂质过氧化反应、蛋白质和DNA氧化损伤引发的多种疾病[29-30]。黄酮类化合物螯合金属离子的基团及构效关系见表2。
黄酮化合物螯合Fe2+最有效的位点为C6-OH、C7-OH结构,增加A环游离羟基数目会提高螯合金属离子能力;酸性环境下,B环中含有一个羟基或者两个、三个羟基,螯合金属离子活性没有太大差异;C3-OH 与C-4羰基能够对Fe3+有更高的亲和性,C5-OH与C-4羰基能够增强螯合能力,但低于C3-OH与C-4羰基的螯合作用,而C-4羰基单独存在时会降低螯合Fe3+能力;C2=C3会增加螯合Fe3+能力[31]。Olenikov等[32]发现A环中C5-OH、C7-OH与未被羟基基团取代的黄酮化合物相比,表现出很有效的螯合Fe2+能力;如果C7-OH被甲氧基取代,会降低其螯合能力;C5-OH、C7-OH都被甲氧基取代,则完全失去螯合能力;如果其中C6-OH被甲氧基取代或者C8-OH被甲氧基取代则会降低螯合Fe2+的能力;比较芹菜素与白杨素发现4′-OH能够增强螯合能力;B环羟基数目增加能显著增加螯合能力,但如果它们分别被甲氧基取代,3′-OH比4′-OH的螯合能力低;此外,C3-OH的存在增强螯合能力,相反,C3-OH被取代会显著降低螯合能力。
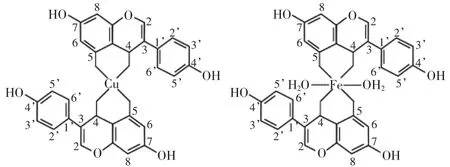
图3 染料木黄酮螯合金属铜(左)和铁(右)的可能结构[3-4]Fig.3 Suggested structural configuration of Cu(left)and Fe(right)chelate of genistein(4′,5,7-trihydroxyisoflavone)[3-4]
2.4 基于诱导其他抗氧化物质生成的构效关系
生物体拥有多层次、复杂的抗氧化系统用来消除或减少活性氧对机体的伤害;根据分子量大小,可以分为低分子量(<1ku)和大分子量(>1ku)抗氧化物质,低分子量抗氧化物质主要有VC、VE、类胡萝卜素等,大分子量抗氧化物质有GSH等,能够直接控制ROS水平[35]。此外,机体还能促进减少游离自由基的抗氧化酶(SOD、CAT、GSH或GSH-Px、GST)。
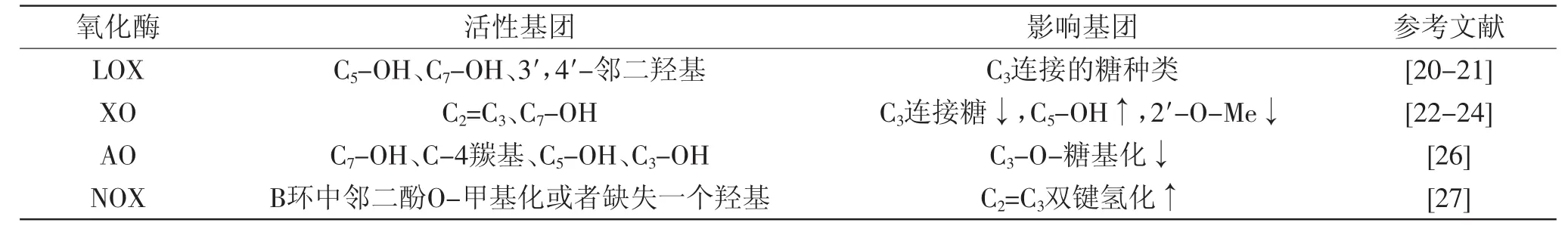
表1 黄酮类化合物抑制氧化酶活性的活性基团及构效关系Table1 The activity groups and structure-activity relationship of restrain activity of oxidaseof flavonoids

表2 黄酮类化合物螯合金属离子的活性基团及构效关系Table2 The activity groups and structure-activity relationship ofchelating metal ionof flavonoids
有研究发现槲皮素、鼠李素及柚皮苷均能显著提高SOD、CAT、GST、GSH或GSH-Px水平,降低氧化应激反应减少脂质过氧化、减少蛋白质和DNA损伤,从而保护细胞免受损伤[36-38]。Li等[39]研究发现,就提高SOD、GSH-Px、CAT活性来说,芦丁和芹菜苷的效果相当。由于芦丁含有4′-OH与7′-OH,而芹菜苷没有,说明4′-OH与7′-OH不是提高抗氧化酶活性的必要基团。由此表明3′,4′-二羟基、C-4羰基、C5-OH是提高这些抗氧化物质再生的重要基团。
3 结语
黄酮类化合物具有很强的抗氧化活性,其抗氧化活性与结构有着密切的关系,不同结构(如羟基数目及位置、羰基结构和糖苷键位置等)的黄酮类化合物,表现出不同的抗氧化能力。一般而言,黄酮类化合物B环发挥着重要作用,C环起次要作用,而A环作用最弱。具有3′,4′-邻二羟基、C3-OH、C2=C3和C-4羰基结构的黄酮化合物直接清除自由基能力最强;最有效的螯合金属离子位点是A环C6,7-二羟基结构;抑制氧化酶活性的关键是A环中C5-OH、C7-OH及B环中羟基数目和位置。细胞抗氧化实验也证实具有3′,4′-邻二羟基、C3-OH、C2=C3和C-4羰基结构的黄酮类化合物有较高的抗氧化活性。
目前,对于黄酮类化合物抗氧化构效关系研究多局限于体外和单一黄酮化合物,然而对于多种黄酮类化合物之间或者与其他小分子抗氧化物质协同作用的构效关系,不同结构的黄酮类化合物在体内消化吸收后所表现出的构效关系却少有报道。同时,黄酮类化合物的抗氧化效果还与浓度及酸碱环境有密切的关系。因此,全面探讨黄酮类化合在不同条件下的抗氧化作用及其构效关系具有重要理论价值和实际意义。
[1]Silva E M,Souza J N S,Rogez H,et al.Antioxidant activities and polyphenolic contents of fifteen selected plant species from the amazonianregion[J].Food Chemistry,2007,101(3):1012-1018.
[2]Yao L H,Jiang Y M,Shi J,et al.Flavonoids in food and their health benefits[J].Plant Foods for Human Nutrition,2004,59 (3):113-122.
[3]Pietta P G.Flavonoids as antioxidants[J].Journal of Natural Products,2000,63(7):1035-1042.
[4]Weston L A,Mathesius U.Flavonoids:their structure,biosynthesis and role in the rhizosphere,including allelopathy[J].Journal of Chemical Ecology,2013,39(2):283-297.
[5]Balasundram N,Sundram K,Samman S.Phenolic compounds in plants and agri-industrial by-products:Antioxidant activity,occurrence,and potential uses[J].Food Chemistry,2006,99(1):191-203.
[6]Passamonti S,Terdoslavich M,Franca R,et al.Bioavailability of flavonoids:a review of their membrane transport and the function of bilitranslocase in animal and plant organisms[J].Current Drug Metabolism,2009,10(4):369-394.
[7]Rao P S,Kalva S,Yerramilli A,et al.Free radicals and tissue damage:role of antioxidants[J].Free Radicals and Antioxidants,2011,1(4):2-7.
[8]Lobo V,Patil A,Phatak A,et al.Free radicals,antioxidants and functional foods:Impact on human health[J].Pharmacognosy Reviews,2010,4(8):118-126.
[9]Procházková D,Boušová I,Wilhelmová N.Antioxidant and prooxidant properties of flavonoids[J].Fitoterapia,2011,82(4):513-523.
[10]赵静,李玉琴,王芳乔,等.6种黄酮类化合物清除超氧阴离子自由基能力及其构效关系[J].中国医药导报,2014,11(29):7-10.
[11]Wolfe K L,Liu R H.Structure-activity relationships of flavonoids in the cellular antioxidant activity assay[J].Journal of Agricultural and Food Chemistry,2008,56(18):8404-8411.
[12]Sghaier M B,Skandrani I,Nasr N,et al.Flavonoids and sesquiterpenes from tecurium ramosissimum promote antiproliferation of human cancer cells and enhance antioxidant activity:a structure-activity relationship study[J].Environmental Toxicology and Pharmacology,2011,32(3):336-348.
[13]Mendoza-Wilson A M,Santacruz-Ortega H,Balandrán-Quintana R R.Relationship between structure,properties,and the radical scavenging activity of morin[J].Journal of Molecular Structure,2011,995(1):134-141.
[14]Zhang Y,Wang D,Yang L,et al.Purification and characterization of flavonoids from the leaves of zanthoxylum bungeanum and correlation between their structure and antioxidant activity[J].PloS One,2014,9(8):e105725.
[15]Promden W,Monthakantirat O,Umehara K,et al.Structure and antioxidant activity relationships of isoflavonoids from dalbergia parviflora[J].Molecules,2014,19(2):2226-2237.
[16]Dueñas M,González-Manzano S,González-Paramás A,et al.Antioxidant evaluation of O-methylated metabolites of catechin,epicatechin and quercetin[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(2):443-449.
[17]Xiao J,Muzashvili T S,Georgiev M I.Advances in the biotechnological glycosylation of valuable flavonoids [J].Biotechnology Advances,2014,32(6):1145-1156.
[18]Zhou H C,Tam N F,Lin Y M,et al.Relationships between degree of polymerization and antioxidant activities:a study on proanthocyanidins from the leaves of a medicinal mangrove plant ceriops tagal[J].PloS One,2014,9(10):e107606.
[19]Mladěnka P,Zatloukalová L,Filipský T,et al.Cardiovascular effects of flavonoids are not caused only by direct antioxidant activity[J].Free Radical Biology and Medicine,2010,49(6):963-975.
[20]Ribeiro D,Freitas M,Tome S M,et al.Inhibition of LOX by flavonoids:a structure-activity relationship study[J].European Journal of Medicinal Chemistry,2014,72:137-145.
[21]Knaup B,Oehme A,Valotis A,et al.Anthocyanins as lipoxygenase inhibitors[J].Molecular Nutrition&Food Research,2009,53(5):617-624.
[22]Pauff J M,Hille R.Inhibition studies of bovine xanthine oxidase by luteolin,silibinin,quercetin,and curcumin[J].Journal of Natural Products,2009,72(4):725-731.
[23]Li Y,Frenz C M,Li Z,et al.Virtual and in vitro bioassay screening of phytochemic al inhibitors from flavonoids and isoflavones against xanthine oxidase and cyclooxygenase-2 forgout treatment[J].Chemical Biology&Drug Design,2013,81 (4):537-544.
[24]Özyürek M,Bektas,ogˇlu B,Güçlü K,et al.Measurement of xanthine oxidase inhibition activity of phenolics and flavonoids with a modified cupric reducing antioxidant capacity(CUPRAC)method[J].Analytica Chimica Acta,2009,636(1):42-50.
[25]Tayama Y,Sugihara K,Sanoh S,et al.Effect of tea beverages on aldehyde oxidase activity[J].Drug Metabolism and Pharmacokinetics,2011,26(1):94-101.
[26]Hamzeh-Mivehroud M,Rahmani S,Rashidi R,et al.Structure-based investigation of rat aldehyde oxidase inhibition by flavonoids[J].Xenobiotica,2013,43(8):661-670.
[27]Makino J,Nakanishi R,Kamiya T,et al.Luteolin suppresses the differentiation of THP-1 cells through the inhibition of NOX2 mRNA expression and the membrane translocation of p47 phox[J].Journal of Natural Products,2013,76(7):1285-1290.
[28]Steffen Y,Gruber C,Schewe T,et al.Mono-O-methylated flavanols and other flavonoids as inhibitors of endothelial NADPH oxidase[J].Archives of Biochemistry and Biophysics,2008,469(2):209-219.
[29]Ma J,Wen X,Mo F,et al.Effects of different doses and duration of iron supplementation on curing iron deficiency anemia:an experimental study[J].Biological Trace Element Research,2014,162(1-3):242-251.
[30]Budak H,Kocpinar E F,Gonul N,et al.Stimulation of gene expression and activity of antioxidant related enzyme in sprague dawley rat kidney induced by long-term iron toxicity[J].Comparative Biochemistry and Physiology Part C:Toxicology& Pharmacology,2014,166:44-50.
[31]Mladěnka P,Macáková K,Filipský T,et al.In vitro analysis of iron chelating activity of flavonoids[J].Journal of Inorganic Biochemistry,2011,105(5):693-701.
[32]Olennikov D N,Kashchenko N I,Chirikova N K.A novel HPLC-assisted method for investigation of the Fe2+-chelating activity of flavonoids and plant extracts[J].Molecules,2014,19 (11):18296-18316.
[34]Dowling S,Regan F,Hughes H.The characterisation of structural and antioxidant properties of isoflavone metal chelates [J].Journal of Inorganic Biochemistry,2010,104(10):1091-1098.
[35]Lushchak VI.Glutathione homeostasis and functions:potential targets for medical interventions[J].Journal of Amino Acids,2012,2012:736837-736863.
[36]Alamm M,Meerza D,Naseem I.Protective effect of quercetin on hyperglycemia,oxidative stress and DNA damage in alloxan induced type 2 diabetic mice[J].Life Sciences,2014,109(1):8-14.
[37]Park E S,Kang J C,Jang Y C,et al.Cardioprotective effects of rhamnetin in H9c2 cardiomyoblast cells underH2O2-induced apoptosis[J].Journal of Ethnopharmacology,2014,153(3):552-560.
[38]Jagetia G C,Reddy T K.Alleviation of iron induced oxidative stress by the grape fruit flavanone naringin in vitro[J].Chemico-Biological Interactions,2011,190(2):121-128.
[39]Li P,Jia J,Zhang D,et al.In vitro and in vivo antioxidant activities of a flavonoid isolated from celery(Apium graveolens L.var.dulce)[J].Food&Function,2014,5(1):50-56.
Research progress on the structure-activity relationship of flavonoid compounds based on different antioxidant mechanism
REN Hong1,ZHENG Shao-jie1,ZHANG Xiao-li1,LU Ke-ke1,WU Su-rui2,MING Jian1,3,4,*
(1.College of Food Science,Southwest University,Chongqing 400715,China;2.Kunming Edible Fungi Institute of All China Federation of Supply and Marketing Cooporatives,Kunming 650223;3.Chongqing Special Food Programme and Technology Research Center,Chongqing 400715,China;4.National Food Science and Engineering Experimental Teaching Center,Southwest University,Chongqing 400715,China)
Many studies confirm that many diseases are closely related to oxidative damage,such as cancer,diabetes,cardiovascular disease and atherosclerosis.Due to flavonoids with strong antioxidant activity,they are highly concerned by people.Its antioxidant activity and structure have a great relationship,such as hydroxyl number and location,degree of polymerization,glycoside bond structure.Therefore,based different antioxidant mechanisms,the structure of this flavonoid compounds were reviewed in order to provide a reference for the future to fully understand flavonoids and to develop functional foods or drugs.
flavonoids compound;antioxidant mechanism;structure-activity relationships;free radicals
TS201.4
A
1002-0306(2016)02-0384-05
10.13386/j.issn1002-0306.2016.02.070
2015-06-15
任红(1991-),女,硕士研究生,研究方向:食品化学与营养学,E-mail:670643177@qq.com。
*通讯作者:明建(1972-),博士,教授,研究方向:食品化学与营养学,E-mail:mingjian1972@163.com。
国家自然科学基金面上项目(31471576);中央高校基本科研业务费专项项目(XDJK2015D035);十二五国家科技支撑计划(2013BAD16B01)。

