响应面法优化油松花粉蛋白酶解工艺
范三红,杜静婷,王相帅(山西大学生命科学学院,山西太原030006)
响应面法优化油松花粉蛋白酶解工艺
范三红,杜静婷,王相帅
(山西大学生命科学学院,山西太原030006)
以油松花粉蛋白为原料,蛋白水解度为评价指标,对油松花粉蛋白酶解工艺进行研究。首次优选出碱性蛋白酶为最佳水解酶,然后在单因素实验的基础上,采用Plackett-Burman设计挑选出对油松花粉水解工艺有显著影响的三个因素:加酶量、pH和底物浓度。采用Box-Behnken中心组合实验及响应曲面分析法得到油松花粉蛋白水解的最优工艺条件为:加酶量0.04 g/g样品,pH11.1,底物浓度0.09 g/mL,酶解时间5 h,酶解温度50℃,油松花粉蛋白的水解度为79.07%。本文的研究为油松花粉多肽及其功能性食品的开发提供了理论基础。
油松花粉,蛋白,蛋白酶水解,响应面
油松又名松黄,泛指马尾松、油松、赤松、黑松和云南松等松属植物的雄性配子体,是我国传统食药兼用的花粉品种[1]。松花粉作为生命的遗传物质,含有丰富的蛋白质、微量元素、必需脂肪酸等营养成分及黄酮,多糖等生物活性物质[2-3],而且配比合理,有“微型营养库”之称[4],花粉内部的蛋白质含量为7%~35%,氨基酸占总量的20%左右[5]。现代药理药效研究表明油松花粉及其提取物具有抗衰老、抗疲劳、促进生长发育、调整机体代谢、增强非特异性免疫功能、清除羟自由基等功效[6-7],其保健和治疗作用已得到国内外广泛的认可和应用[8]。
通过对油松花粉蛋白的水解处理,可将蛋白酶解为多肽,有利于更好的开发油松花粉蛋白,有效提高油松花粉蛋白的利用率[9]。研究证明,将大分子的蛋白酶解成多肽以后,更有利于人体的吸收,使得油松花粉蛋白的功能特性得到充分体现,同时不破坏花粉原有营养价值[10]。尹树花,郭丽梅采用正交法优化了碱性蛋白酶水解油松花粉蛋白质工艺[11],并对两种碱性蛋白酶的水解效果进行了对比[12]。李升军等[13]把制备的油松花粉小肽加入化妆品中,初次研究了油松花粉在化妆品方面的应用。本实验利用PB因素筛选实验和响应面设计确定出了油松花粉的最佳酶解工艺条件,不仅准确度高,也为日后研究油松花粉多肽和开发油松花粉蛋白的功能性食品奠定了理论基础。
1 材料与方法
1.1材料与仪器
油松花粉蛋白实验室自制,纯度85.66%;酸性蛋白酶5万U/g、碱性蛋白酶20万U/g、木瓜蛋白酶50万U/g北京奥博星生物技术有限责任公司;磷酸一氢钠、磷酸二氢钠分析纯,天津化学试剂三厂;茚三酮分析纯,上海三爱思试剂有限公司。
HRHS24型电热恒温水浴锅青岛海尔医用低温科技有限公司;TG16A-WS型高速离心机武汉爱斯佩科学仪器有限公司;101-2AB型电热鼓风干燥箱天津市泰斯特仪器有限公司;JP-040ST型超声波清洗机深圳市洁盟清洗设备有限公司;868型酸度计美国奥利龙公司;JA1203N型电子天平上海精密科学仪器有限公司;SP-2000UV型紫外可见分光光度计上海光谱仪器有限公司。
1.2实验方法
1.2.1酶解工艺流程选择一定的底物浓度→水浴→调节pH→加酶→水浴锅水浴→煮沸灭酶→离心取上清液→测量水解度[14]。
1.2.2水解酶的筛选选取酸性蛋白酶、碱性蛋白酶、木瓜蛋白酶及其复合酶分别对油松花粉蛋白进行水解。计算蛋白水解度,并筛选出水解油松花粉蛋白的最佳水解酶。
1.2.3油松花粉蛋白水解度的单因素实验采用控制变量法,分别研究加酶量、pH、底物浓度、酶解时间、酶解温度五个因素对油松花粉蛋白水解度的影响[15]。
1.2.3.1加酶量在pH为11,底物浓度为0.06 g/mL样品,酶解时间为3 h,酶解温度为45℃,加酶量分别为0.01、0.02、0.03、0.04、0.05 g/g样品的条件下对油松花粉蛋白进行酶解。
1.2.3.2pH在加酶量为0.03 g/g样品,底物浓度为0.06 g/mL样品,酶解时间为3 h,酶解温度为45℃,pH分别为9、10、11、12、13的条件下对油松花粉蛋白进行酶解。
1.2.3.3底物浓度在加酶量为0.03 g/g样品,pH为11,酶解时间为3 h,酶解温度为45℃,底物浓度分别为0.02、0.04、0.06、0.08、0.10 g/mL的条件下对油松花粉蛋白进行酶解。
1.2.3.4酶解时间在加酶量为0.03 g/g样品,pH为11,底物浓度为0.06 g/mL样品,酶解温度为45℃,酶解时间分别为1、2、3、4、5 h的条件下对油松花粉蛋白进行酶解。
1.2.3.5酶解温度在加酶量为0.03 g/g样品,pH为11,底物浓度为0.06 g/mL样品,酶解时间为3 h,酶解温度分别为35、40、45、50、55℃的条件下对油松花粉蛋白进行酶解。
1.2.4Plackett-Burman筛选实验设计在单因素基础上,对加酶量、pH、底物浓度、酶解时间、酶解温度五个因素进行显著性筛选实验,选择对油松花粉蛋白水解度有显著影响的因子,进行后续的响应面实验。
1.2.5响应曲面实验设计在单因素实验和Plackett-Burman筛选实验的基础上,对所确定的因子进行Box-Behnken中心组合实验,确定出油松花粉水解的最优条件。
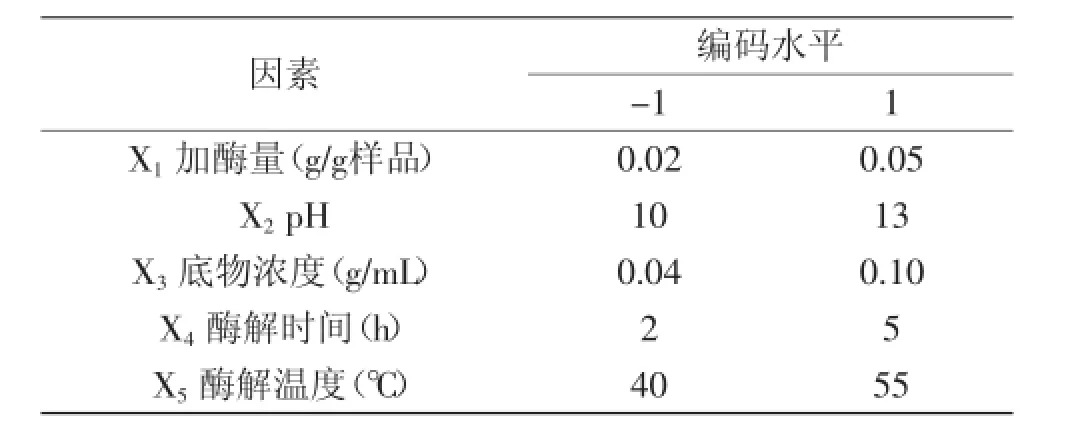
表1 Plackett-Burman实验因素和水平Table 1 Range of different factors investigated with Plackett-Burman
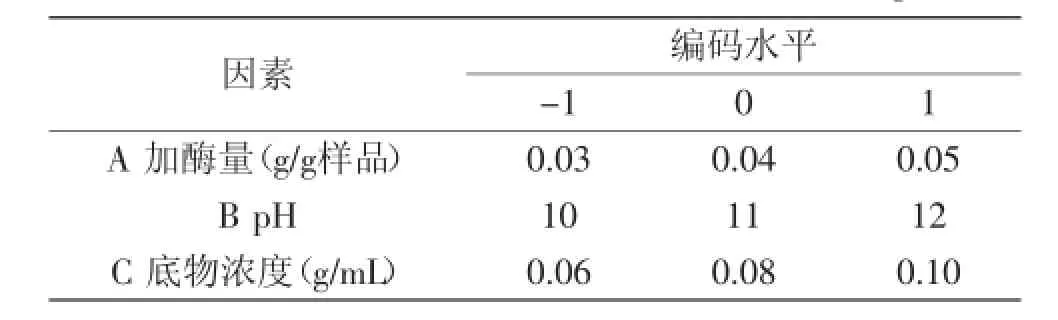
表2 Box-Behnken实验因素和水平Table 2 Factors and levels of Box-Behnken design
1.3水解度的测定和计算方法
采用茚三酮比色法测定水解度[16],首先将煮沸灭酶的油松花粉蛋白水解液离心取其上清液4 mL,再加蒸馏水4 mL,取稀释后的油松花粉蛋白水解液2 mL,加pH为8的缓冲溶液1.0 mL,茚三酮溶液1.0 mL,沸水浴加热10~15 min,冷却,在570 nm处测其吸光度值(蒸馏水做空白对照)。另取同样条件的原油松花粉蛋白溶液,在570 nm处测其吸光度值,按照如下公式计算油松花粉蛋白水解度。
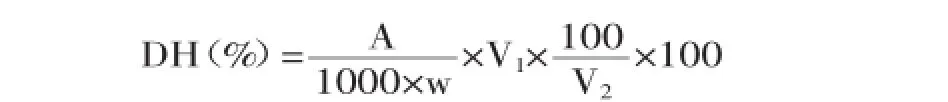
式中:A表示在标准曲线中查出的蛋白质的质量(μg);w表示样品质量(g);V1表示水解液的总体积(mL);V2表示显色时所稀释液的体积(mL)。
1.4数据统计分析
使用Minitab 15.0,Design Expert 8.0.6,Excel软件分析实验数据,并进行响应面设计。
2 结果与分析
2.1水解酶的筛选
由图1可以看到不同种类的酶和复合酶以及复合酶的比例对油松花粉蛋白水解度的影响趋势,油松花粉蛋白水解的结果由图1所示。单独选取碱性蛋白酶时,水解度最大。选取酸性蛋白酶、木瓜蛋白酶以及这三种酶复合水解时,油松花粉蛋白的水解度均有不同程度的降低。这可能是因为酶的专一性,实验中蛋白来源是由碱提酸沉法所提取,碱溶性蛋白居多,因而选择碱性蛋白酶时,油松花粉蛋白水解度最大[17]。
2.2油松花粉水解度的单因素实验结果
2.2.1加酶量对油松花粉水解度的影响由图2可以看出加酶量对油松花粉蛋白水解度的影响趋势随着加酶量的提高而逐渐增大,但在加酶量大于0.04 g/g样品后,水解度的增大趋势明显减小。这可能是因为加酶量在0.04 g/g样品之后,蛋白的水解程度达到最大,酶解反应已经充分,再增加酶也无法促进水解反应。考虑到节约材料,所以选择最佳加酶量为0.04 g/g样品。
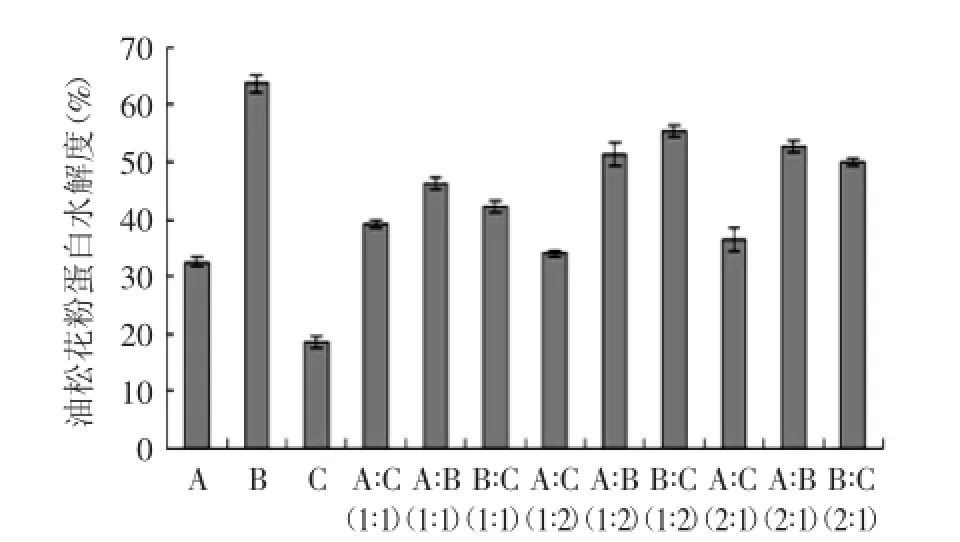
图1 不同种类的酶及其复合酶的不同比例对油松花粉蛋白水解度的影响Fig.1 Effect of different proportions of enzymes and different types of compound enzyme on the degree of hydrolysis of pine pollen
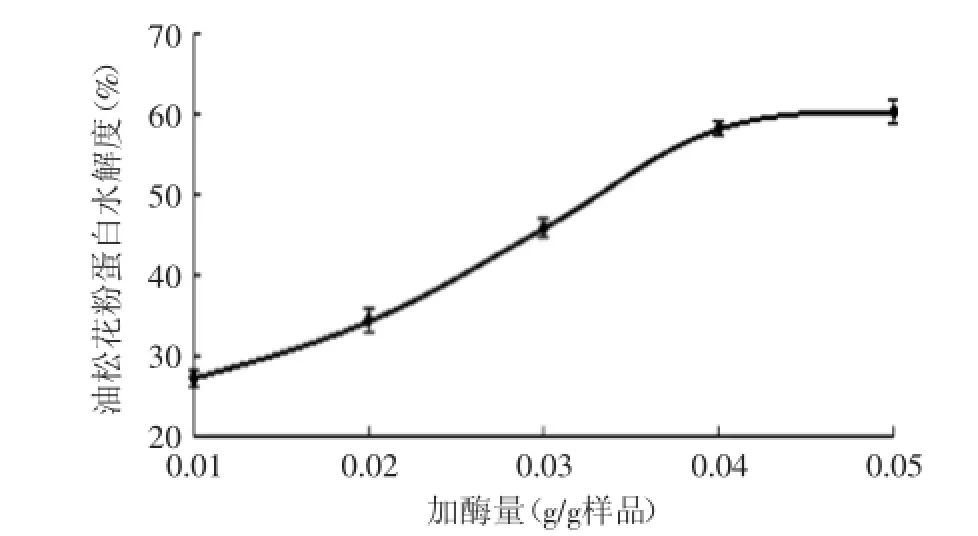
图2 加酶量对水解度的影响Fig.2 Effect of total enzyme dose on hydrolysis degree
2.2.2pH对油松花粉蛋白水解度的影响由图3可以看到pH对油松花粉蛋白水解度的影响趋势,随着pH的提高,水解度呈现先增大后减小的趋势,当pH 为11时,水解度达到最大。这可能是因为随着pH增大,逐渐接近碱性蛋白酶的最适pH,当pH继续增大,碱性太强,有可能酶的内部结构发生了变化,酶活性降低,使得水解度下降。
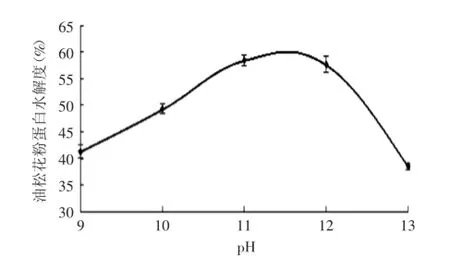
图3 pH对水解度的影响Fig.3 Effect of pH on hydrolysis degree
2.2.3底物浓度对油松花粉蛋白水解度的影响由图4可以看到底物浓度对油松花粉蛋白水解度的影响趋势,随着底物浓度的提高,水解度呈现先增大后减小的趋势,在底物浓度为0.08 g/mL时,水解度达到最大。这可能是因为在底物浓度过低时,油松花粉蛋白与水解酶的接触不是很充分,而随着底物浓度增大,水解反应逐渐充分。在底物浓度过大时,溶液浓度较高,阻碍了与酶的接触,使油松花粉蛋白水解度下降。

图4 底物浓度对水解度的影响Fig.4 Effect of substrate concentration on hydrolysis degree
2.2.4酶解时间对油松花粉蛋白水解度的影响由图5可以看到酶解时间对油松花粉蛋白水解度的影响趋势,在酶解的初期,随着酶解时间的增加,油松花粉蛋白水解度也增大,但是在4 h之后,水解度趋于稳定。这可能是因为随着酶解时间的增加,水解反应不断的进行使得水解度也不断增大,在4 h之后,蛋白的酶解反应基本已经充分,水解度不会有明显的增大。
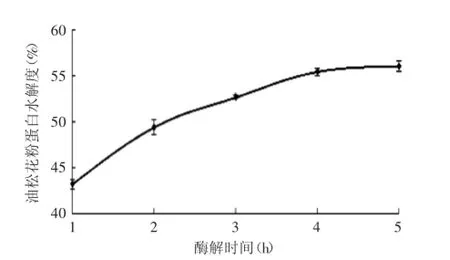
图5 酶解时间对水解度的影响Fig.5 Effect of time on hydrolysis degree
2.2.5酶解温度对油松花粉蛋白水解度的影响由图6可以看到酶解温度对油松花粉蛋白水解度的影响趋势,随着酶解温度的上升,水解度先增大后减小,在温度为50℃时达到最大。这可能是因为随着酶解温度的上升,水解酶的活性也在增大,促进了水解反应的进行。温度高于50℃时,酶的内部结构发生改变,酶活性下降,水解反应得到抑制。
2.3Plackett-Burman实验显著影响因子的确定
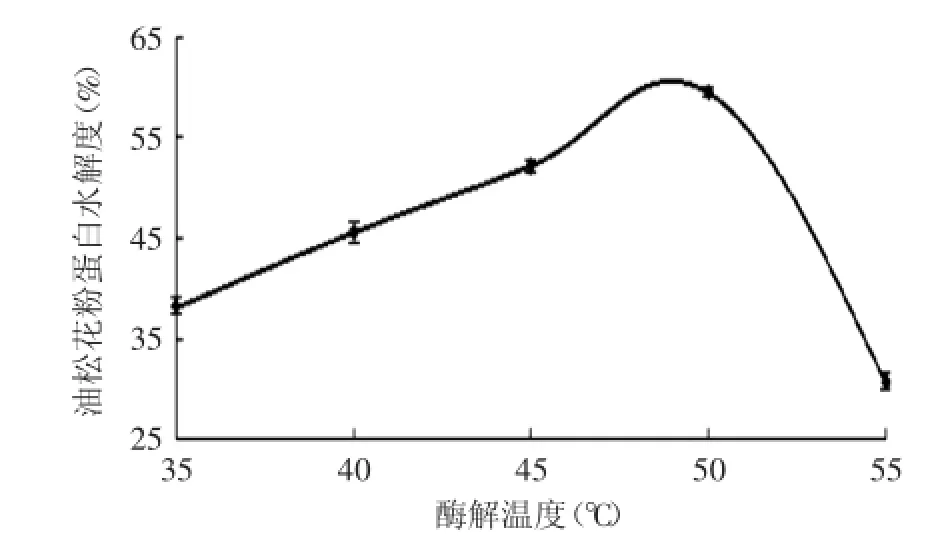
图6 酶解温度对水解度的影响Fig.6 Effect of temperature on hydrolysis
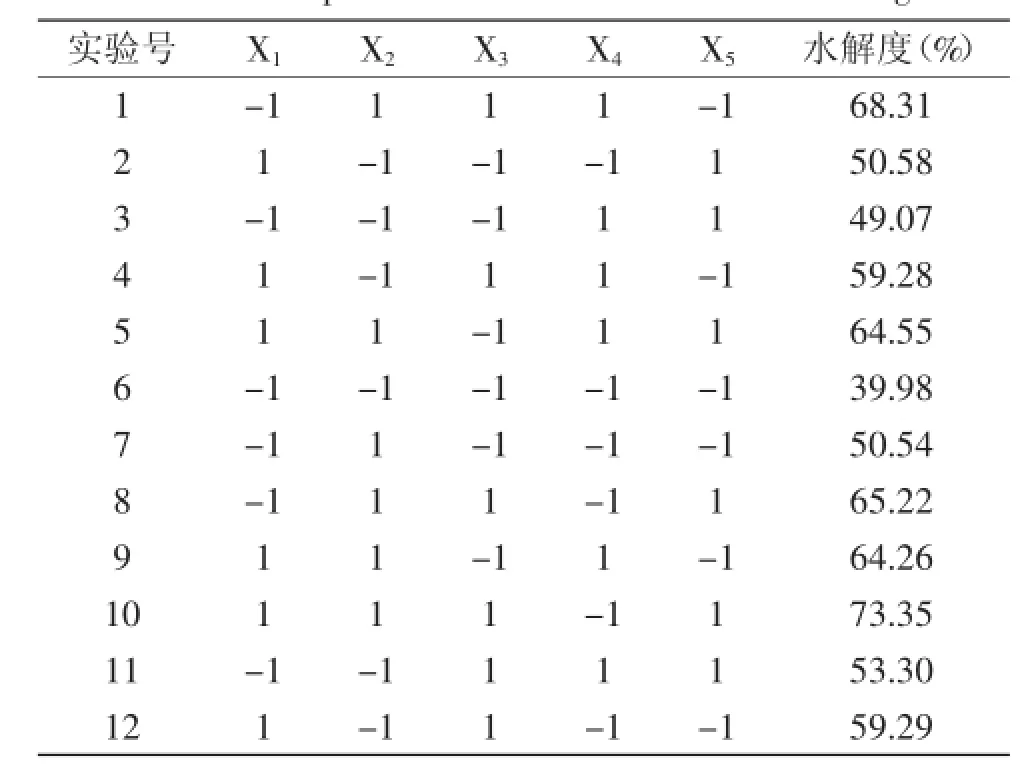
表3 Plackett-Burman Design实验结果Table 3 Response values of Plackett-Burman Design
2.3.1PB实验设计处理及响应值在单因素实验基础上,对加酶量、pH、底物浓度、酶解时间、酶解温度这五个因素进行Plackett-Burman实验,以油松花粉蛋白水解度为响应值,以此筛选出具有显著性影响的因素。Plackett-Burman Design实验结果见表3。2.3.2显著影响因素的确定利用Minitab 15.0软件油松花粉因素筛选实验进行分析,得到PB实验的回归模型方差分析和回归方程显著性检验表。
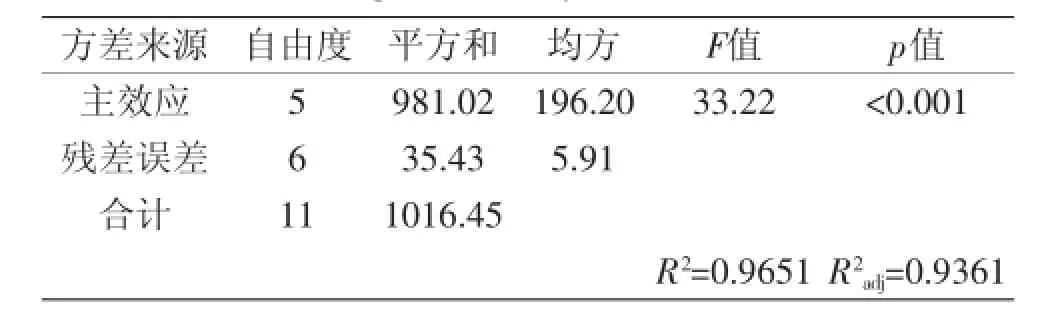
表4 回归模型方差分析表Table 4 Regression analysis of variance table
由表4可知,主效应的p<0.001,决定系数R2= 0.9651,说明实验所得的拟合回归方程达到显著水平;校正决定系数R2adj=0.9361,表明本实验的数据变异可以用此回归方程来解释,因此可以较好地确定关键影响因素。
由表5回归方程显著性检验表可知,因素A、B、C 的p值小于0.01,说明这三个因素对实验具有极显著的影响。因此,在油松花粉水解度的优化实验中,对A、B、C即加酶量、pH、底物浓度进行响应面实验设计。D、E分别选择酶解时间5 h,酶解温度50℃作为最优工艺条件。
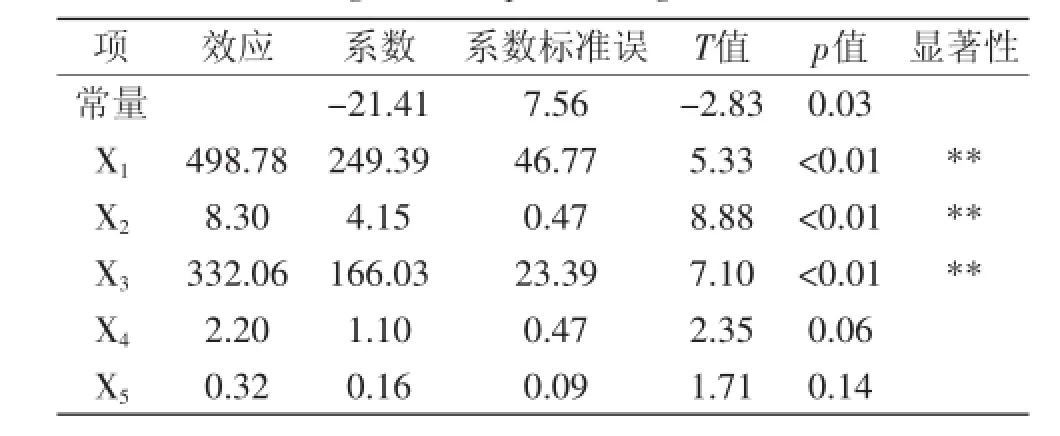
表5 回归方程显著性检验表Table 5 Regression equations significant test table
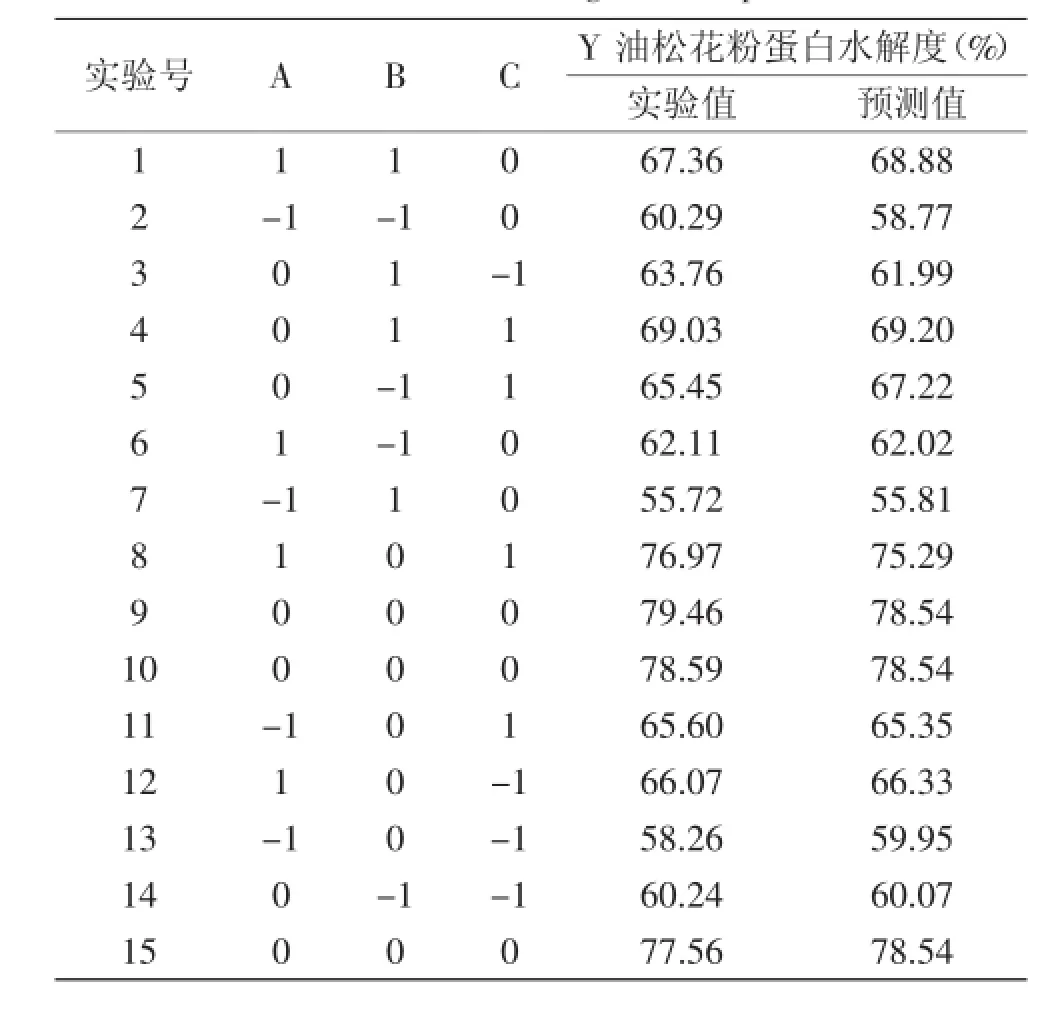
表6 Box-Behnken Design实验设计与结果Table 6 Box-Behnken Design and response values
2.4响应曲面实验设计对最佳工艺条件的确定
2.4.1Box-Behnken实验设计与结果以油松花粉蛋白水解度为响应,利用Minitab 15.0软件进行响应曲面设计,Box-Behnken Design实验设计与结果见表6。
对表6中数据进行回归分析,得到油松花粉蛋白水解度对温度、加酶量、时间的三元二次回归方程为:
Y=4.0800A+0.9752B+3.5900C-7.5308A2-9.6358B2-4.2808C2+2.4550AB-0.8900AC+0.0150BC+78.5376
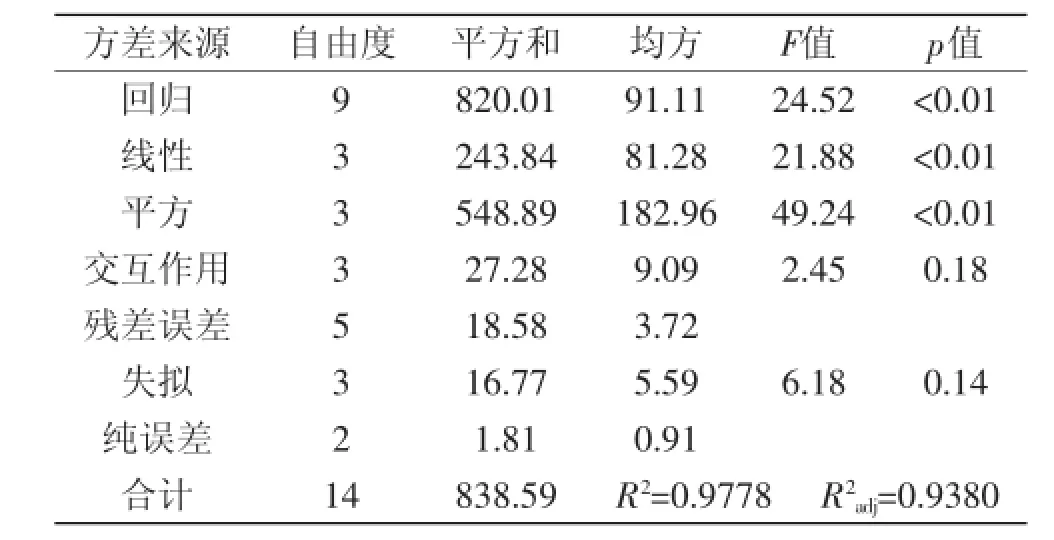
表7 回归方程方差分析Table 7 Analysis of variances for the fitted regression model
从回归系数方差分析(表7)可以看出,本实验所选的三元二次回归模型具有较好的显著性(p<0.01),各因素对油松花粉蛋白的线性关系也呈现极显著性(p<0.01),平方项对该模型具有极显著性(p<0.01),交互作用不具有显著性(p>0.05)。决定系数R2=0.9778,校正决定系数R2adj=0.9380,说明该模型能解释93.8%响应值的变化,从失拟项在p=0.14>0.05(不显著),说明可以利用该回归方程确定油松花粉蛋白的最佳水解度[17-19]。
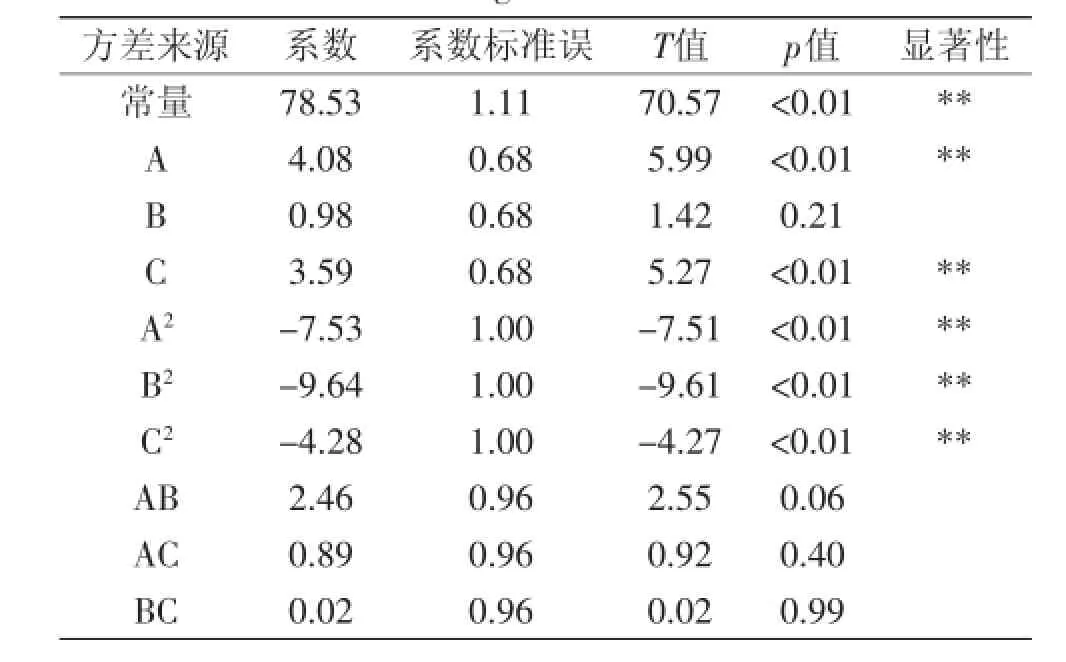
表8 回归系数显著性分析Table 8 Significance test for each regression coefficient of the fitted regression model
从回归系数显著性分析(表8)可以看出,A、C、A2、B2、C2这几个因素对油松花粉蛋白水解度的影响是极显著的(p<0.01),说明在该实验中,加酶量、底物浓度对油松花粉蛋白水解度有极显著影响,而从A2、B2、C2影响极显著也可以看出,它们对油松花粉蛋白水解度的影响是非线性的[20-21]。
2.4.2响应曲面分析与优化根据以上的分析利用Design Expert 8.0.6分别作出该响应面分析的曲面图形。图7~图9可以直观的分析出加酶量、pH、底物浓度对油松花粉蛋白水解度的影响。
加酶量和pH的交互作用对油松花粉水解度的影响由图7所示,加酶量在0.04~0.05 g/g样品之间,pH 在10.5~11.5时,油松花粉蛋白水解度存在最大值。加酶量和底物浓度的交互作用对油松花粉水解度的影响由图8所示,加酶量在0.04~0.05 g/g样品之间,底物浓度在0.08~0.10 g/mL时,油松花粉蛋白水解度存在最大值。pH和底物浓度的交互作用对油松花粉水解度的影响由图9所示,pH在10.8~11.2之间,底物浓度在0.08~0.10 g/mL时,油松花粉蛋白水解度存在最大值。

图7 加酶量和pH交互影响水解度的响应面图Fig.7 Response surface for the effects of total enzyme dose and pH on hydrolysis degree

图8 加酶量和底物浓度交互影响水解度的响应面图Fig.8 Response surface for the effects of total enzyme dose andsubstrate concentration on hydrolysis degree

图9 pH和底物浓度交互影响水解度的响应面图Fig.9 Response surface for the effects of pH and substrateconcentration on hydrolysis degree
利用Minitab 15.0,对油松花粉蛋白水解度工艺条件经行优化预测,得出理论最佳工艺条件为:加酶量为0.043 g/g样品,pH为11.091,底物浓度为0.089 g/mL,酶解时间5 h,酶解温度50℃,油松花粉蛋白水解度最大为80.029%。
2.4.3油松花粉蛋白水解工艺条件的验证与确定为了进一步验证响应面实验结论的准确性,同时考虑到实验操作的可行性及方便性,对预测的最佳实验条件进行修正:加酶量为0.04 g/g样品,pH为11.1,底物浓度为0.09 g/mL,酶解时间5 h,酶解温度50℃。按照此优化条件对油松花粉蛋白进行水解,实验重复3次并取平均值作为最后实验结果。据此得到油松花粉蛋白水解度为79.13%、78.99%、79.08%,平均蛋白水解度为79.07%,与预测值80.29%相差不大,说明本模型能较好的预测油松花粉蛋白水解度的实际效果,具有很好的应用价值。
3 结论
油松花粉蛋白的酶解工艺中,筛选出碱性蛋白酶为水解油松花粉蛋白质的最佳选择,加酶量、pH、底物浓度、酶解时间、酶解温度5个单因素中,加酶量、pH和底物浓度达到了极显著水平。对这3个因素进行优化分析,得出最佳水解工艺为加酶量0.04 g/g样品,pH11.1,底物浓度0.09 g/mL,酶解时间5 h,酶解温度50℃,在此条件下油松花粉水解度可达到79.07%。通过对油松花粉蛋白酶解工艺的优化能够对蛋白质提取的关键共性技术有理论与实际应用方面的指导意义,为促进油松花粉资源高值化利用和精深加工提供一定的技术支撑。
[1]田志环.松花粉与人体健康[J].解放军保健医学杂志,2007,9(4):255-256.
[2]Nergiz c,Donmez i.Chemical composition and nutritive value of pinus pinea L.seeds[J].Food Chemistry,2004,86:365-368.
[3]范三红,刘艳荣,杨民乐,等.油松花粉多糖分离纯化及结构分析的初步研究[J].食品科学,2009,30(15):127-129.
[4]Markovic-housley z,Degano m,Lamnad,et al.Crystalstructure of a hypoallergenic isoform of the major birch pollen allergen Bet v1 and its likely biological function as a plantsteroid carrier[J]. Journal of Molecular Biology,2003,325(1):123-133.
[5]Paul Ig.The allerg en profile of ash(Fraxinus excelsior)pollen:cross-reactivity with allerg ens from various plant species[J]. Clinical and Ex-perimental Allergy,2002,32(6):933-941.
[6]范三红,周立波.油松花粉多糖提取及其清除羟自由基活性研究[J].食品科学,2008,29(12):274-277.
[7]张俊刚,徐颖,蒋东升等,油松花粉对小鼠非特异性免疫功能及NK细胞活性的影响[J].中国卫生检验杂志,2010,20(1):30-31.
[8]范三红,王相帅,王亚云,等.油松花粉蛋白提取工艺的优化[J].食品工业科技,2013,34(22):246-249.
[9]尹树花,郭丽梅.碱性蛋白酶水解法制备油松花粉肽的研究[J].食品科技,2008,33(2):101-103.
[10]Wei H C,Cai Q Y,Rahn R O,et al.Inhibition of Uv light and fenton reaction induced oxdative DNA damage by the soybean isoflavone genistein[J].Carcinogen Sis,1996,17:73.
[11]尹树花,郭丽梅.碱性蛋白酶水解法制备油松花粉肽的研究[J].食品科技,2008,33(2):101-103.
[12]尹树花,郭丽梅.两种蛋白酶水解油松花粉蛋白的比较[J].现代食品科技,2007,23(11):68-70,74.
[13]李升军,冯韧,陈瑾,等.油松花粉小肽及多功能化妆品的制备[J].中国洗涤用品工业,2009(1):84-86.
[14]董新红,赵谋明,蒋跃明,等.超声波法在提取多糖类化合物中的应用研究[J].食品工业科技,2013,34(3):155-163.
[15]薛静玉,陈复生,丁长河.用响应面法优化碱性蛋白酶制备生物活性大豆肽的条件[J].河南红叶大学学报:自然科学版,2012,33(2):19-24.
[16]郭兴凤.蛋白质水解度的测定[J].中国油脂,2000,25(6):176-177.
[17]郑冬梅,李升福,孔保华,等.玉米蛋白水解条件的优化研究[J].食品科学,2002,23(8):52-56.
[18]胡筱波,徐明刚,刘志伟,等.响应面法优化油菜花粉谷蛋白酶解条件[J].食品科学,2007,28(7):117-121.
[19]张强,阚国仕,陈红漫,等.酶解玉米蛋白粉制备抗氧化肽[J].食品工业科技,2005,26(6):109-111.
[20]韩雅珊.食品化学实验指导[M].北京:中国农业大学出版社,1996.
[21]安金双,王迪,马士淇,等.响应面法优化灰树花中多糖超声波提取工艺的研究[J].食品研究与开发,2008,29(6):11-14.
Optimization of hydrolysis of Chinese pine pollen protein by response surface methodology
FAN San-hong,DU Jing-ting,WANG Xiang-shuai
(College of Life Science,Shanxi University,Taiyuan 030006,China)
With protein of Chinese pine pollen as the raw material protein hydrolysis degree as an evaluation index,this paper aimed to study the process conditions of pine pollen proteolysis.The alkaline protease was choosen as the bast hydrolase.On the basis of single factor experiment,the Plackett-Burman screening test was adopted to determine three factors(which signifcantly affect)significantly affecting hydrolysis of Chinese pine pollen as:total enzyme dose,pH and substrate concentration.Then,the hydrolysis process conditions of pine pollen protein was optimized by Box-Behnken center combination experiment and response surface methodology.Results showed that the optimum conditions for hydrolysis were as follows:enzyme concentration 0.04 g/g,pH11.1,substrate concentration 0.09 g/mL,enzymatic time 5 h,enzymatic temperature 50℃.Under the optimal conditions,the hydrolysis degree of Chinese pine pollen protein could reach 79.07%.This study provided a theoretical basis for the development of Chinese pine pollen peptides and functional foods.
pine pollen;protein;protease hydrolysis;response surface
TS201.1
A
1002-0306(2016)04-0236-06
10.13386/j.issn1002-0306.2016.04.039
2015-06-10
范三红(1963-),男,副教授,研究方向:食品科学,E-mail:fsh729@sxu.edu.cn。
山西省自然科学基金项目(2012011031-4);山西省高等学校高新技术产业化项目(20111003)。

