朱顶红的组培快繁技术
陈汉鑫,余松金,万学锋,郑春生,陈前程,杨宗锦
(福建省漳州市农业科学研究所,福建 漳州 363005)
朱顶红的组培快繁技术
陈汉鑫,余松金,万学锋,郑春生,陈前程,杨宗锦
(福建省漳州市农业科学研究所,福建 漳州 363005)
以朱顶红鳞茎盘为外植体,开展组培快繁技术研究。结果表明:最佳诱导培养基为MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1,诱导率为64.3%;合适的增殖培养基为MS+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1,增殖系数达5.62倍;合适的生根培养基为:1/2 MS+IBA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂6.0 g·L-1,生根率达90.0%;适宜的移栽基质为:泥炭土∶园土∶珍珠岩(体积比)=5∶1∶1,移栽成活率可达93.6%。
朱顶红;鳞茎盘;组织培养
朱顶红(Amaryllisvittata)又名孤挺花、百枝莲、喇叭花,为石蒜科朱顶红属多年生草本植物[1],原产于中南美洲,其杂交种在热带亚热带地区广泛种植。朱顶红花枝亭亭玉立,4~6朵喇叭形花朵着生于顶端,给人华贵之感,叶片狭长如君子兰,即使在无花期也有很高的观赏价值。其性喜温暖湿润,阳光不过于强烈的环境,稍耐寒,在我国华南地区可全年露地栽培[2]。朱顶红一般通过分球繁殖,但繁殖效率很低,无法满足生产与市场的需要[3],而且长期的无性繁殖容易积累和传播病毒。因此,通过组培快繁技术是规模化生产朱顶红以满足市场需求的主要途径。
1 材料与方法
1.1 试验材料
供试材料为2~3年生、已开花的朱顶红鳞茎所附生的小鳞茎。
1.2 方法
1.2.1 外植体处理及诱导培养基筛选 将小鳞茎在阳光下晾晒2~3 h以控干表面的水分,然后剥除外层干枯的鳞片,切除根部,冲洗干净。在超净工作台,用70%的酒精浸泡30 s,再用0.1%的升汞(加2~3滴吐温-80)消毒8 min,用无菌水冲洗4次后,用无菌滤纸吸干残余的水分。然后,切除消毒过的鳞茎上端鳞片,留下直径1.5 cm左右、基部1 cm左右的鳞片及鳞茎盘。在无菌条件下,将鳞茎盘4分切后接入诱导培养基。
设5种培养基(处理):①MS、②MS+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1、③MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1、④ MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1、⑤ MS+6-BA 4.0 mg·L-1+NAA 0.1 mg·L-1,所有培养基均加入蔗糖30 g·L-1,琼脂6.0 g·L-1,pH 5.8。每处理接50瓶(每瓶接1个)。培养条件为温度26~28 ℃,光照强度为2000 lx(下同)。30 d后统计诱导率及对诱导出的小鳞茎生长状况进行观察。
1.2.2 继代培养 将初代培养诱导的朱顶红小鳞茎的上半部分切除,带有鳞茎盘的下半部分切成2块,接入增殖培养基。增殖培养基以MS为基本培养基,蔗糖30 g·L-1,琼脂6.0 g·L-1,pH 5.8,添加BA(1.0、2.0、3.0 mg·L-1)及NAA(0.1、0.2、0.3 mg·L-1)采用L9(32)进行正交试验,每个处理接20瓶,每瓶接5块鳞茎盘。接种30 d后统计增殖系数及观察小鳞茎生长状况。
1.2.3 生根培养 将继代增殖长出的小鳞茎(直径≥0.8 cm)分离,接种到不同的生根培养基中。以1/2MS为基本培养基,蔗糖20 g·L-1,琼脂6.0 g·L-1,pH 5.8。添加IBA(0.1、0.5、1.0 mg·L-1)及NAA(0.1、0.5、1.0 mg·L-1)采用L9(32)进行正交试验,每个处理接20瓶,每瓶接5株,重复3次。40 d后统计生根率及观察根系生长状况。
1.2.4 移植试验 将具3条根以上、带3~4片叶、且鳞茎直径≥0.8 cm的鳞茎,进行适应性炼苗10 d后,将有生根的鳞茎取出,并用水冲洗根部残留的培养基,用1000倍的多菌灵浸泡根部1 min,然后移入不同配比的基质中(园土∶珍珠岩=5∶1、泥炭土∶珍珠岩=5∶1、泥炭土∶园土∶珍珠岩=5∶1∶1、泥炭土∶园土∶珍珠岩=1∶5∶1),移栽后做好田间管理,保持温度20~28 ℃,湿度85%~90%。定期喷水、杀菌、喷肥。60 d后观察统计植株的成活率及其生长状况。
1.3 数据统计方法
应用Excel软件对试验数据进行方差分析,用新复极差法进行平均数的多重比较。
2 结果与分析
2.1 不同培养基对鳞茎诱导的影响
将朱顶红外植体接入不同MS诱导培养基中,7 d后鳞茎盘开始膨大,鳞片伸长并向外开张,接种后15 d左右在2鳞片之间出现小球状体。从表1可看出,BA浓度对外植体小鳞片的形成有明显影响,BA质量浓度在0~2 mg·L-1范围内,诱导率随浓度升高而升高,且长势良好;当BA质量浓度为3~4 mg·L-1时,其诱导率反而下降,且小鳞茎的叶片有畸形,因此,高浓度的BA不利于小鳞茎的诱导。以③号培养基,即MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖30 g·L-1,+琼脂6.0 g·L-1为最佳诱导培养基,诱导率为64.3%,且长势良好。

表1 不同培养基对朱顶红鳞茎诱导的影响
*:外植体数=接种外植体数-污染外植体数。
2.2 植物生物调节剂种类及浓度组合对鳞茎增殖的影响
将鳞茎盘的下半部分切成2块接入9种组合继代培养基中,3 d后鳞片便开始萌动,10 d左右露白,20 d左右可以形成直径为0.5 cm的小鳞茎,多数的外植体最内层鳞片由四周向中心愈合生长,形成一个新的小鳞茎。但有的在最外层鳞片的基部外侧也会形成小鳞茎。从表2各因子水平均值可看出,添加BA在一定的范围内(0~2.0 mg·L-1),增殖系数随浓度升高而增加;而随着BA质量浓度继续升高(3.0 mg·L-1),增殖系数反而下降,小鳞茎芽有玻璃化现象,并出现叶片畸形;而添加一定浓度的NAA(0~0.3 mg·L-1)对增殖系数影响也是先升高后下降,同时一定浓度的NAA能提高小鳞茎的质量。方差分析结果(表3)表明:BA对增殖系数影响最大,达到极显著水平;NAA对增殖系数影响次之,达显著水平。综上表明处理5,即MS+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1为最佳增殖培养基,增殖系数最大,且小鳞茎生长良好,叶片颜色亮绿。

表2 不同培养基对朱顶红鳞茎增殖的影响
*:括号内数字为植物生长调节剂质量浓度(mg·L-1),K值为各浓度水平均值;R为极差。下同。

表3 不同处理增值系数的方差分析
*:**为差异极显著,*为差异显著。下同。
2.3 植物生物调节剂种类及浓度组合对鳞茎生根的影响
将小鳞茎接入9种组合生根培养基后,20 d左右小鳞茎增粗长壮成为球状的鳞茎,上部叶片开始伸长并转绿,底部产生白色的根。从表4可看出:添加IBA在一定的浓度范围内(0~0.5 mg·L-1),生根率随浓度升高而增加;而随着IBA浓度继续升高(1.0 mg·L-1),生根率反而下降;说明高浓度的IBA对朱顶红小鳞茎的生根起抑制作用。NAA对生根率影响不明显,但会促进产生细毛须根。方差分析结果(表5)表明,IBA、NAA对生根率影响均未达显著水平,由直观分析表明最佳生根培养基为处理5,即:1/2 MS+IBA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂6.0 g·L-1,生根率最高,达90.0%,且根粗壮。
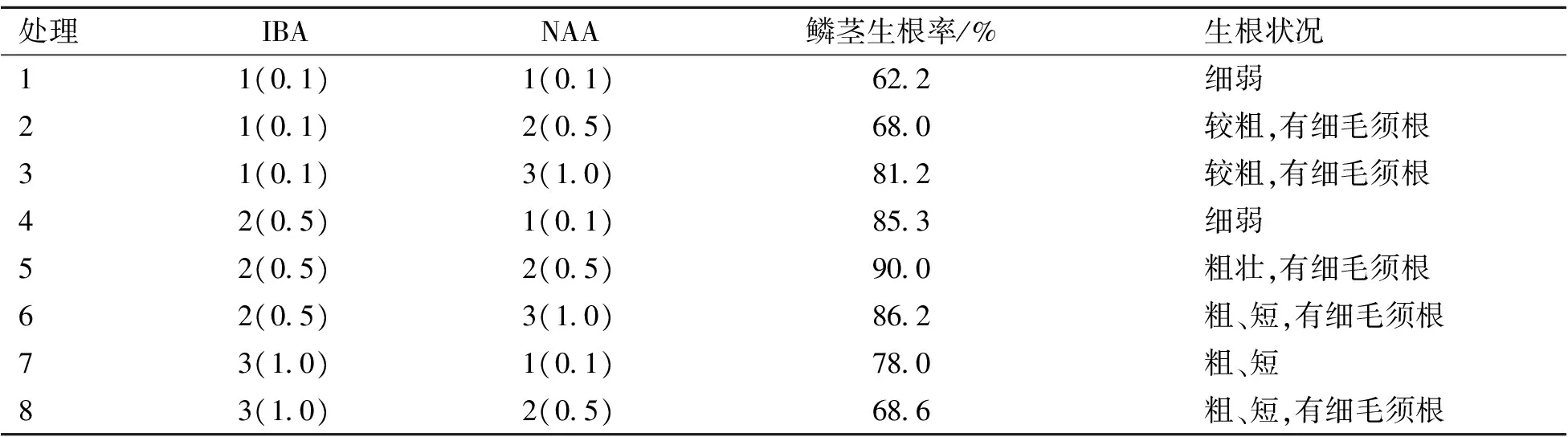
表4 不同培养基对朱顶红鳞茎生根的影响

表4(续)

表5 不同植物生长调节剂处理生根率的方差分析
*:-为差异不显著。
2.4 不同栽培基质对朱顶红鳞茎移栽成活率的影响
从表6可看出,移栽基质对移栽成活率存在极显著差异。多重比较结果表明,处理3移栽成活率最高,极显著于其他组合。因此,最佳移栽基质为处理3,即:泥炭土∶园土∶珍珠岩=5∶1∶1,移栽成活率可达93.6%,且叶色浓绿,鳞茎较大,根系发达。

表6 不同栽培基质对朱顶红鳞茎移栽成活的影响
*:同列不同大写字母为差异极显著;不同小写字母为差异显著。
3 结论与讨论
以朱顶红鳞茎盘为外植体开展组培恢复技术研究,最终筛选出最佳诱导培养基为:MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1,诱导率为64.3%;增殖培养基为MS+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1+蔗糖30 g·L-1+琼脂6.0 g·L-1,增殖系数达5.62倍;生根培养基为:1/2 MS+IBA 0.5 mg·L-1+NAA 0.5 mg·L-1+蔗糖20 g·L-1+琼脂6.0 g·L-1,生根率达90.0%;移栽基质为:泥岩土∶园土∶珍珠岩(体积比)=5∶1∶1,移栽栽成活率达93.6%。
在植物组织培养中,选择合适的外植体材料是组织培养成功的关键。在朱顶红组织培养中,许多学者用鳞茎为外植体[4-6]都取得了良好的效果,娄晓鸣等[7]指出鳞茎诱导出不定芽最适合的部位是鳞茎下部。而在试验过程中,笔者也发现带有鳞茎盘的鳞片大部分能长出小鳞茎,而不带鳞茎盘的鳞片都没有萌动。
细胞分裂素在朱顶红鳞茎芽的诱导及小鳞茎的增殖过程中均起重要作用,并且在诱导及增殖过程中,BA质量浓度均以2.0 mg·L-1为宜,当BA浓度过高时,会使朱顶红出现不同程度的玻璃化芽。在朱顶红组培过程中发现,随着继代次数的增多,个别鳞茎芽出现玻璃化的现象,出现这一现象可能与培养基中植物生长调节剂或培养条件(如:光照强度、培养温度等)有关。而鳞茎芽一旦出现玻璃化,只能丢弃。因此,如何克服玻璃化现象,有待进一步研究。
朱顶红组培苗移栽成活率的高低与栽培基质本身的保水、保肥及透气性有关。泥炭土∶园土∶珍珠岩=5∶1∶1的混合基质具有较强的的透气性和保水性[8],有利于朱顶红根系的生长,移栽成活率最高。而园土由于易板结成块,透气性差。因此,园土比例过高时,其移栽成活率相对较低。
[1]韦三立.花卉组织培养[M].北京:中国林业出版社,2001.
[2]刘燕.花卉学[M].北京:中国林业出版社,2003.
[3]邵素娟,史益敏.朱顶红小鳞茎切割繁殖及其影响因素[J].上海交通大学学报:农业科学版,2008(2):5-8.
[4]孙红梅,宋利娜.大红朱顶红鳞茎不定芽的诱导[J].中国农学通报,2010,26(14):247-250.
[5]朱旭东,田松青.朱顶红的组织培养[J].江苏农业科学,2006(2):56-57.
[6]张松,达克东,曹辰兴,等.朱顶红离体培养快速繁殖体系及胚状体发生[J].园艺学报,2002,29(3):285-287.
[7]娄晓鸣,周玉珍,孔贤,等.杂交朱顶红鳞茎不定芽诱导研究[J].安徽农业科学,2009,37(34):16769-16770.
[8]张庆霞,金伊洙.设施园艺[M].北京:化学工业出版社,2009:65.
Study on Tissue Culture and Rapid Propagation Techniques forAmaryllisvittata
CHEN Han-xin,YU Song-jin,WAN Xue-feng,ZHENG Chun-sheng,CHEN Qian-cheng,YANG Zong-jin
(ZhangzhouAgricultureScienceInstitute,Zhangzhou363005,Fujian,China)
The tissue culture forAmaryllisvittatawas conducted using its basal bulbs as explants.The results showed that the optimal shoot-inducing medium was MS+6-BA 2.0 mg·L-1+NAA 0.1 mg·L-1+sucrose 30 g·L-1+agar 6.0 g·L-1,with inducement rate up to 64.3%.The optimal shoots multiplication culture medium was MS+6-BA 2.0 mg·L-1+NAA 0.2 mg·L-1+sucrose 30 g·L-1+agar 6.0 g·L-1,with multiplication coefficient of 5.62 times.The optimal rooting culture medium was 1/2 MS+IBA 0.5 mg·L-1+NAA 0.5 mg·L-1+sucrose 20 g·L-1+agar 6.0 g·L-1,with rooting rate up to 90.0%.The optimal transplant medium was peat soil∶garden soil∶perlite (V/V)=5∶1∶1,with survival rate up to 93.6%。
Amaryllisvittata;basal bulb;tissue culture
2015-10-07;
2015-12-06
漳州市农科所自然基金项目(ZN201402)
陈汉鑫(1978—),男,福建诏安人,福建省漳州市农业科学研究所副研究员,从事组织培养与设施栽培技术研究。E-mail:zzchxe@163.com。
10.13428/j.cnki.fjlk.2016.03.035
S682.2+5
A
1002-7351(2016)03-0170-04

