局部恢复水氮供应对玉米根系氮素吸收与分配的影响
牛晓丽,胡田田,张富仓,王 丽,刘 杰,冯璞玉,杨硕欢,宋 雪
(西北农林科技大学水利与建筑工程学院/旱区农业水土工程教育部重点实验室/中国旱区节水农业研究院,陕西杨凌 712100)
局部恢复水氮供应对玉米根系氮素吸收与分配的影响
牛晓丽,胡田田,张富仓,王 丽,刘 杰,冯璞玉,杨硕欢,宋 雪
(西北农林科技大学水利与建筑工程学院/旱区农业水土工程教育部重点实验室/中国旱区节水农业研究院,陕西杨凌 712100)
【目的】验证水分或养分胁迫后恢复供应显著提高根系吸收能力,且局部水分或氮素供应有效刺激供应区根系吸收的补偿效应,为进一步揭示水氮双重胁迫后局部恢复供应条件下影响根系氮素吸收能力的因素以及玉米各器官氮素分配状况提供依据。【方法】采用分根技术,水培模拟局部根区水氮同时恢复供应,其中以聚乙二醇6000(PEG 6000)模拟营养液的渗透势,并用相应的供氮水平模拟氮素胁迫。试验设置4个水氮双重胁迫(也即4个局部恢复供应)处理:正常供应水氮、轻度水氮胁迫、中度水氮胁迫和重度水氮胁迫。双重胁迫6 d后一半根区恢复正常供应,于处理后0、1、3、5、7、9 d连续动态监测各根区根系氮素吸收速率、含氮量以及氮素累积量。【结果】水氮双重胁迫后局部恢复供应,持续胁迫区根系吸收速率、含氮量以及氮素累积量均显著小于恢复供应区(P<0.05)。1—3 d时,轻度和中度胁迫处理持续胁迫区根系氮素吸收速率比恢复供应区分别减小38.2% 和48.7%;7—9 d时分别减小84.9%和86.4%。对于恢复供应区,局部水氮同时恢复供应1 d内,根系氮素吸收速率较前期胁迫明显增大,且在0—1 d和7—9 d时,经中度及其以下胁迫程度时,根系氮素吸收速率显著大于对照(P<0.05),产生根系氮素吸收能力的补偿效应,但 3—7 d 时消失。而且,恢复供应区根系含氮量和氮素累积量分别于1 d和5 d后恢复到对照水平,导致植株氮素生产效率最终与对照无显著差异。另外,各处理地上部氮素来自15N肥料的分配比例显著小于对照(P<0.05),且随胁迫程度而逐渐减小,恢复供应区根系则有相反的规律,持续胁迫区根系表现为,轻度胁迫与对照无明显差异(P>0.05),中度和重度胁迫显著大于对照和轻度胁迫(P<0.05),且3—9 d时,中度和重度胁迫间无明显差异(P>0.05)。【结论】前期中度以下程度(水分-0.4 MPa+氮素1 mmol·L-1)的水氮双重胁迫后局部恢复供应,恢复供应区根系氮素吸收速率在时间和空间上均可得到恢复,产生根系氮素吸收的部分补偿效应,但这种补偿效应与恢复供应的时间有关(轻度胁迫为1 d,中度胁迫为7 d);玉米各器官氮素分配比例与胁迫程度和局部恢复供应时间有关。该研究可为调节植物与土壤环境的相互作用,充分挖掘植物自身对环境变化的适应潜力提供理论依据。
局部恢复水氮供应;胁迫程度;局部恢复供应时间;根系氮素吸收速率;补偿效应;玉米
0 引言
【研究意义】在自然生态系统中,土壤养分的分布往往是不均一的,存在着空间和时间上的动态变化[1-3]。植物根系系统在长期进化过程中对养分的非均匀分布形成了各种可塑性反应,包括形态可塑性和生理可塑性等[4-6],以获取更多的土壤养分。另一方面,关于新近提出的作物根区局部灌溉高效节水技术的研究表明,局部灌溉可以有效提高灌溉区根系的吸收功能,刺激根系水分和养分吸收能力的补偿效应[7-8]。因此,在水分和养分同时局部供应条件下,研究影响根系吸收能力的因素对进一步调控植物和土壤环境的相互作用具有重要的理论意义。【前人研究进展】研究表明,根系形态上的可塑性一般表现为根系在养分富集区的大量增殖,而生理上的表现主要有养分富集区内根系养分吸收速率的增加[9-12]。在土壤养分发生变化时,根系生理反应通常发生在形态反应之前[13-15],而且根系生理可塑性的变化程度与养分斑块的分布、大小、浓度、持续时间以及植物本身的养分状态密切相关[2,16-17]。而且,这种生理补偿效应还与水分胁迫的时期、胁迫历时、胁迫程度和器官形成时期有关[7,18-20]。水分和养分是相互作用、相互影响、密不可分的一个整体,土壤水分的非均匀分布导致养分空间有效性的变化。而且,养分离子向根表面的质流和扩散也依赖于根系的水分吸收[21],提高根系水分吸收能力有利于植物从土壤中吸收养分[22]。有研究还发现,前期水分或氮素亏缺的植物恢复水分或氮素供应后,根系的吸收能力快速增加,甚至恢复到对照水平[18,23-24]。李瑞等[25-26]研究发现前期水分胁迫后局部恢复供应能够刺激恢复供应区根系生长和水分吸收产生补偿效应。可见,影响根系吸收能力的因素不仅与胁迫程度、胁迫时间等有关,还与胁迫前植物的水分或养分状况有关。【本研究切入点】以往对根系养分吸收能力影响因素的研究多集中于水分或养分等单一指标均匀胁迫条件下,在氮素非均匀供应条件下养分吸收速率影响因素的研究虽取得了一些进展[5,27-29],但局部灌溉条件下养分吸收速率的影响因素研究尚不多见[7],其不同根区氮素吸收分配方面的研究更少,且缺乏对水氮同时局部供应的综合考虑,因此难于进一步调控局部供应条件下植物与土壤环境的相互作用。【拟解决的关键问题】基于以上考虑,本文以水培玉米进行分根试验,两侧根区经受水氮双重胁迫6 d后,一半根区恢复水氮供应,另一半根区维持原来的胁迫水平,采用同位素示踪技术动态监测不同根区氮素吸收速率,研究水氮双重胁迫程度和局部恢复供应时间对根系氮素吸收与分配的影响,以期为充分挖掘作物自身对土壤环境的适应潜力奠定理论基础。
1 材料与方法
1.1供试材料
采用分根法于2014年3—6月进行玉米水培试验,供试品种为“奥玉3007”。玉米幼苗在沙盘中催芽和培养,待第3片真叶长出时,选取长势基本一致的幼苗,剪掉种子根,将其余根系均等分为2部分,移栽至自制的分根装置中。玉米幼苗培养条件、分根装置具体参数以及营养液的组成见参考文献[19]。缓苗6 d(此时玉米幼苗5—6片真叶)后进行试验处理。
1.2试验处理
试验处理分为两个阶段:两侧根系均水氮双重胁迫的预处理阶段和局部根系恢复水氮供应的正式处理阶段。预处理阶段,采用PEG 6000模拟水分胁迫,并用相应的供氮水平模拟氮素胁迫,设对照(两侧根系均正常供应水氮,无PEG+4 mmol·L-1N)、轻度水氮胁迫(水分胁迫-0.2 MPa+氮素胁迫2 mmol·L-1)、中度水氮胁迫(水分胁迫-0.4 MPa+氮素胁迫 1 mmol·L-1)和重度水氮胁迫(水分胁迫-0.6 MPa+氮素胁迫0 mmol·L-1)4个水氮胁迫水平。预处理持续6 d后开始正式处理:一侧根系维持原来的水氮胁迫水平(持续胁迫区);另一侧根系恢复正常的水氮供应(恢复供应区),即不加PEG 6000,同时供应4 mmol·L-1的同位素标记的15N(15N丰富度为 10.14%)。设3次重复。
1.3测定项目和方法
在正式处理0,1,3,5,7,9 d时,采集各处理的植株样品,并将玉米植株分为地上部和两侧根系3部分,测定各部分的干物重、全氮含量和15N丰度。
干物重(g)测定:植物样在105℃的烘箱中杀青30 min后在75℃下烘至恒重,用万分之一天平称量各部分的干物重。
全氮含量(%)和15N丰度(%)的测定:将经杀青烘干制备的植物样邮寄至美国加利福尼亚大学戴维斯分校稳定性同位素分析室,用PDZ Europa 20-20型同位素质谱仪(Sercon公司,英国柴郡)测定植物15N丰度,并用KJELTEC 2300型全自动凯氏定氮仪(Foss公司,瑞典)测定植物含氮量。
1.4数据处理和分析
为了区分作物对不同根区氮素的吸收情况,采用15N同位素示踪技术区分恢复供应区和持续胁迫区根系氮素吸收速率。试验采用了15N-Ca(NO3)2进行示踪,15N肥料应用在恢复供应区。
正常供应区根系的氮素吸收速率(Inon-stressed)计算:

式中,Mnon-stressed是恢复供应区根系的总干重(RDM)(g),ΔNnon-stressed是恢复供应区某时间段的吸氮量(mg),Δt是计算的时间段(h)。
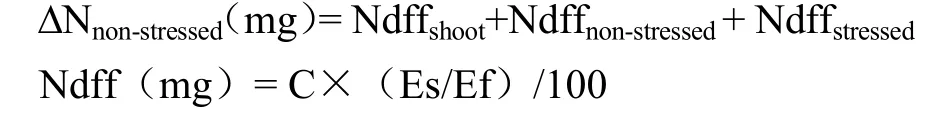
C(mg)=植株某部位全氮含量(%)×植株某部位干物重(g)×1000
式中,Ndffshoot,Ndffnon-stressed,Ndffstressed分别代表地上部及正常供应区和持续胁迫区根系吸收氮素中来自15N肥料的氮量;C代表植株相应部分氮素累积量(mg);Ef和Es分别代表标记肥料和植株相应部分中15N原子百分超(%),由植株和肥料的15N丰度减去氮元素天然丰度(0.365%)。
持续胁迫区根系的氮素吸收速率(Istressed)计算:
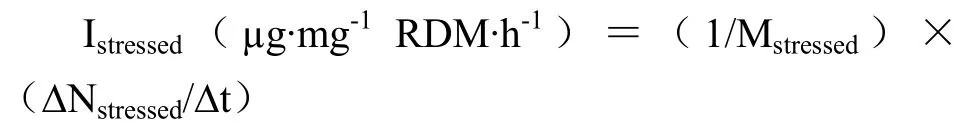
式中,Mstressed是持续胁迫区根系的总干重(RDM)(g),ΔNstressed是持续胁迫区某时间段的吸氮量(mg),Δt是计算的时间段(h)。
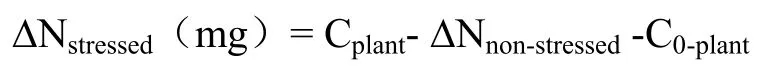
式中,Cplant代表正式处理一定时间后整个植株氮素累积量,C0-plant代表正式处理以前整个植株氮素累积量。
用SPSS17.0统计分析软件对试验数据进行方差分析与多重比较。方差分析用单因素方差分析方法,多重比较用 Duncan法进行。用 SigmaPlot10.0和Microsoft Excel 2010软件进行图和表的制作。
2 结果
2.1胁迫程度和局部恢复水氮供应时间对根系氮素吸收的影响
2.1.1根系氮素吸收速率 从表1可以看出,不同处理玉米各根区根系氮素吸收速率的变化规律明显不同。对照条件下,各处理阶段两侧根区根系氮素吸收速率无明显差异(P>0.05)。轻度和中度胁迫条件下有类似的变化规律,0—1 d时两侧根系无显著差异(P >0.05),表明前期水氮同时胁迫后恢复局部供应1 d对同一处理的不同根区根系氮素吸收速率未产生明显影响。局部恢复供应1 d后,持续胁迫区根系吸收速率均显著小于恢复供应区(P<0.05),且减小程度随胁迫程度和胁迫持续时间而增大,1—3 d时,轻度和中度胁迫根系氮素吸收速率比恢复供应区分别减小38.2%和48.7%;7—9 d时分别减小84.9%和86.4%。说明同一处理不同根区的氮素吸收速率与水分和氮素的供应状况有关,正常供应水氮可明显改善作物根系对氮素的吸收,增大水氮双重胁迫程度或延长局部恢复时间均显著影响持续胁迫区根系氮素吸收能力。
局部水氮双重恢复供应能有效提高恢复供应区根系氮素吸收能力,但与胁迫程度和恢复供应时间有关(表1)。轻度和中度胁迫处理在0—1 d时,恢复供应区和持续胁迫区根系氮素吸收速率分别为 1.425、1.613和1.064、0.978 μgN·mg-1RDM·h-1,达到甚至高于对照(P<0.05);重度胁迫较对照减小 36.4%(P <0.05),说明水氮胁迫程度≤中度胁迫水平(水分胁迫-0.4 MPa+氮素胁迫1 mmol·L-1)时,局部恢复供应能提高恢复供应区根系氮素吸收速率,有效刺激恢复供应区根系氮素吸收的补偿效应。随着恢复供应时间的延长,轻度和中度胁迫处理恢复供应区根系氮素吸收速率较对照显著降低(轻度胁迫1—5 d和中度胁迫1—7 d)(P<0.05),甚至低于重度胁迫处理(3 —5 d)(P<0.05)。说明局部水氮同时恢复供应条件下,恢复供应时间为1 d时有利于提高两侧根系氮素吸收能力,刺激补偿效应的发生,超过1 d补偿效应消失。然而,在7—9 d时,轻度和中度胁迫处理恢复供应区根系氮素吸收速率较对照显著增大(P<0.05),而持续胁迫区分别仅占对照的44.4%和22.3%,说明延长局部恢复供应时间可使玉米根系对局部水氮恢复供应产生明显的适应性,但不利于持续胁迫区根系吸收氮素。

表1 局部水氮恢复供应条件下玉米不同根区根系的氮素吸收速率Table 1 Root N inflow rates in both sub-roots under partial water and nitrogen resupplies (μgN·mg-1RDM·h-1)
2.1.2根系氮素含量 图1表明,水氮双重胁迫6 d使根系氮素含量显著降低(P<0.05),且3个胁迫处理之间无显著差异。在监测时间内,各处理持续胁迫区根系氮素含量均明显小于对照(P<0.05),3个胁迫程度较对照分别减少38.9%—51.9%,35.3%—52.0% 和26.4%—50.5%。处理1 d直至9 d,轻度、中度和重度胁迫处理持续胁迫区根系含氮量之间无显著差异(P>0.05);除处理1 d时重度胁迫两根区无明显差异(P>0.05)外,其它均表现为,持续胁迫区根系氮素含量较恢复供应区显著减小(P<0.05)。表明水氮双重胁迫会使根系氮素含量明显降低,局部恢复水氮供应明显增大恢复供应区根系氮素含量,但持续胁迫区则未随胁迫程度而变。
局部水氮同时恢复供应能显著提高恢复供应区氮素含量,但与水氮双重胁迫程度和恢复供应时间有关(图1)。局部恢复供应开始(0 DAT)时,各处理两侧根系氮素含量均较对照显著降低(P<0.05)。恢复供应1 d时,各处理恢复供应区根系氮素含量较对照分别降低 11.6%、16.8%和 32.2%(图1-B);轻度胁迫处理恢复供应3—7 d(图1-C)、中度和重度胁迫恢复供应5—7 d(图1-D),恢复供应区根系含氮量与对照无显著差异(P>0.05);9 d时,轻度和重度胁迫处理根系氮素含量显著高于对照(P<0.05),增幅分别为 25.0%和 25.3%(图1-F)。说明恢复供应区根系氮素含量达到对照水平的时间随水氮双重胁迫程度增大而推迟,延长局部恢复供应时间明显增大恢复供应区根系氮素含量。

图1 局部水氮同时恢复供应对不同根区根系含氮量的影响Fig.1 Effect of partial water and nitrogen resupplies on N content in each sub-root
2.1.3根系氮素累积量 局部水氮恢复供应条件下,持续胁迫区根系氮素累积量随胁迫程度和恢复供应时间的变化规律与根系氮素含量类似,显著小于对照(P <0.05),且3个胁迫处理之间无显著差异(P>0.05)(图2)。
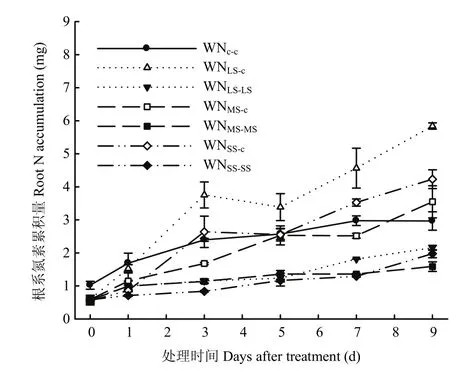
图2 局部水氮同时恢复供应条件下不同根区根系氮素累积量的动态变化Fig.2 Time courses of N accumulation in each sub-root under partial water and nitrogen resupplies
局部水氮恢复供应显著提高恢复供应区根系氮素累积量,但受胁迫程度影响(图2)。恢复供应 1 d时,轻度胁迫处理恢复供应区根系氮素累积量与对照无显著差异(P>0.05);中度和重度胁迫处理较对照显著减小(P<0.05),分别占对照的69.9%和56.5%。恢复供应3 d时,轻度胁迫处理较对照显著增大57.9% (P<0.05);重度胁迫处理恢复到对照水平;中度胁迫处理较对照减小29.5%(P<0.05),5 d后恢复到对照水平。表明水氮双重胁迫后恢复局部供应能够维持甚至增大根系的氮素累积量,即使前期持续6 d重度胁迫后局部恢复充分供应仍能使根系氮素累积量完全恢复。
局部恢复供应时间显著影响恢复供应区根系氮素累积量的变化(图2)。对照随恢复供应时间平稳增大;轻度胁迫从恢复供应开始增幅明显增大,1 d时的绝对值达到对照水平,3 d后显著大于对照(P<0.05);中度胁迫,局部恢复供应后,氮素累积量明显增大,但增幅小于轻度胁迫(P<0.05),5 d后有所减小,7 d后持续增大,9 d时与对照持平;重度胁迫,局部恢复供应1 d后快速增大,3 d时绝对值恢复到对照水平,且显著大于中度胁迫(P<0.05),之后有所减小,5 d后又继续增大,显著大于对照(P<0.05),在7和9 d时,分别较对照增大20.7%和49.7%。
2.2局部水氮同时恢复供应对玉米地上部干重和氮素累积量的影响
图3-A表明,前期胁迫6 d(局部水氮恢复供应0 d)时,各处理地上部干重均较对照显著减小(P<0.05),且减小幅度随胁迫程度而增大。局部水氮恢复供应后,各处理地上部干重不断增大,但增大幅度因胁迫程度而变,恢复供应0—3 d时,中度和重度胁迫增大幅度显著大于轻度胁迫(P<0.05),但三者均显著小于对照(P<0.05),3 d后,轻度胁迫快速增大,且显著大于中度和重度胁迫(P<0.05),5 d后,其增大幅度甚至超过对照水平,但9 d时其绝对值仍显著小于对照(P<0.05)。可见,前期水氮胁迫明显影响地上部干物质累积,即使局部水氮恢复供应仍不能恢复到对照水平。
从图3-B可以看出,前期胁迫6 d后,各处理地上部氮素累积量均显著小于对照(P<0.05)。局部水氮恢复供应后,轻度胁迫快速增大,5 d后增大幅度显著大于对照和其他处理(P<0.05),但其绝对值显著小于对照(P<0.05)。0—5 d时,中度和重度胁迫均较对照和轻度胁迫明显减小(P<0.05),但二者之间无明显差异(P>0.05),7 d后,中度胁迫显著大于重度胁迫(P<0.05)。
2.3局部水氮同时恢复供应下氮素累积量在玉米各器官中的分配
表2可以看出,各处理玉米地上部氮素累积量分配比例远大于根系,且随处理时间的延长,对照各器官氮素累积量分配比例相对稳定,而其他处理表现为地上部氮素累积量分配比例逐渐减小,恢复供应区根系显著增大,轻度和中度胁迫处理的持续胁迫区根系变化幅度相对较小,且远小于恢复供应区根系(P<0.05),重度胁迫处理的持续胁迫区根系随处理时间推移有明显增大的趋势。
表2表明处理时间为0 d(前期水氮双重胁迫6 d)时,轻度胁迫条件下,各器官氮素累积量的分配比例与对照无明显差异(P>0.05),中度和重度胁迫地上部显著小于对照(P<0.05),恢复供应区和持续胁迫区根系则显著大于对照(P<0.05),说明水氮双重胁迫程度大于轻度胁迫水平(水分胁迫-0.2 MPa+氮素胁迫2 mmol·L-1)时明显影响地上部氮素累积量分配比例,有效促进根系氮素吸收。1 d、5 d和9 d时一致表现为,轻度、中度和重度胁迫处理的地上部氮素累积量的分配比例显著小于对照(P<0.05);恢复供应区根系显著大于对照(P<0.05),且在9 d时,恢复供应区根系氮素累积量分配比例随胁迫程度而增大;轻度胁迫处理的持续胁迫区根系显著小于对照(P<0.05),中度和重度胁迫较对照明显增大(P<0.05),且重度胁迫显著大于中度胁迫(P<0.05)。说明水氮双重胁迫后局部恢复供应条件下,各器官氮素累积量分配比例与水氮双重胁迫程度有关,胁迫程度越大,地上部分配越小,根系分配增大。
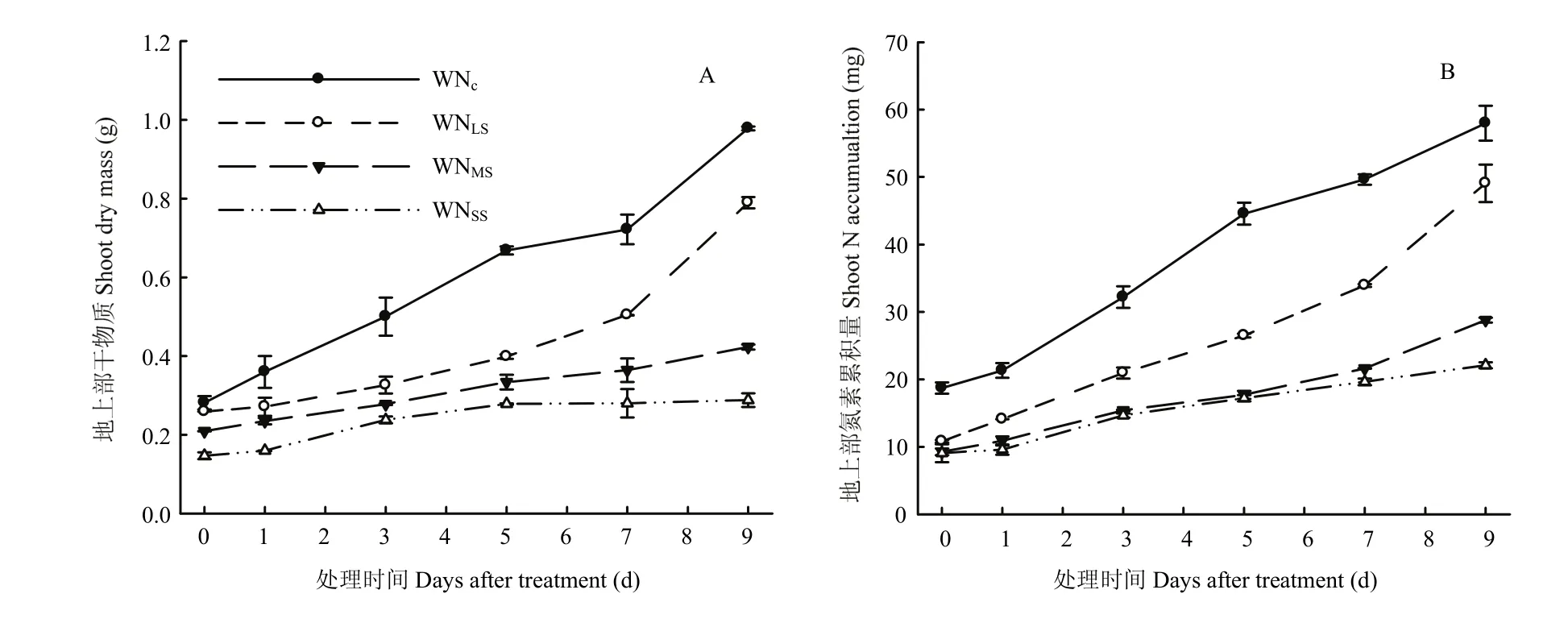
图3 各处理玉米地上部干物质(A)以及氮素累积量(B)的动态变化Fig.3 Dynamics of shoot dry mass and N accumulation in maize in all treatments
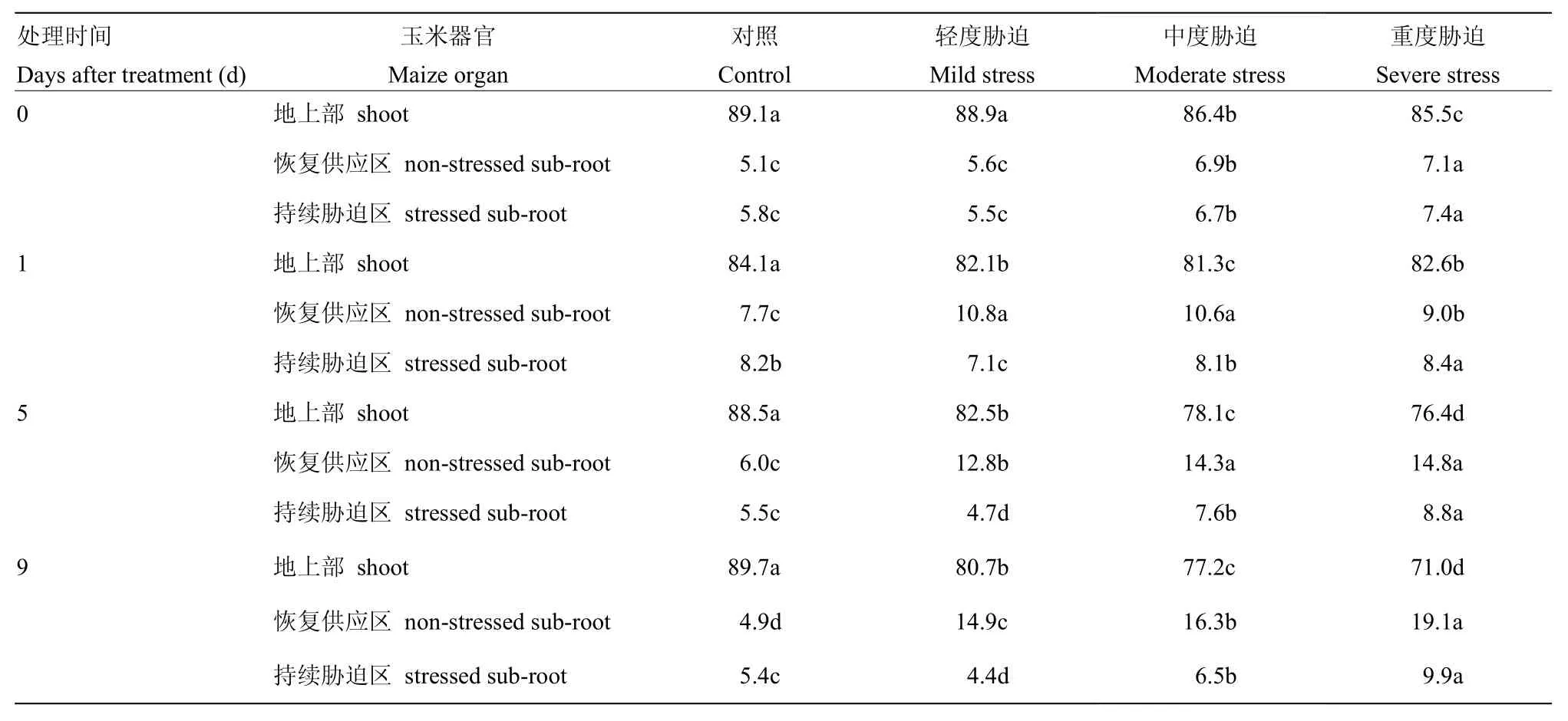
表2 局部水氮同时恢复供应条件下,各处理玉米氮素累积量在不同器官的分配百分数Table 2 Percentage of N accumulation in different organs in all treatments under partial water and nitrogen resupplies (%)
2.4局部水氮同时恢复供应下玉米氮素来自15N肥料的积累量在各器官中的分配
2.4.1玉米各器官原子百分超的动态变化 从图 4可以看出,各处理15N原子百分超均表现为恢复供应区根系(应用15N的根区)>地上部>持续胁迫区根系(P<0.05),说明恢复供应区将吸收的氮素优先留给自己,其次才向地上部及持续胁迫区根系运输;也说明不同根区根系之间通过地上部进行氮素的迁移交换。
玉米各部位的15N原子百分超与胁迫程度和局部恢复供应时间有关(图4)。恢复供应区根系15N原子百分超表现为轻度和中度胁迫从处理开始即显著大于对照(P<0.05),重度胁迫1 d后也较对照明显增大(P<0.05),且增加幅度与胁迫程度和处理时间有关,5 d时,轻度、中度和重度胁迫分别较对照增大55.2%,36.7%和25.2%,9 d时分别增大34.9%,18.2% 和33.2%。轻度、中度和重度胁迫处理持续胁迫区根系15N原子百分超均显著大于对照(P<0.05),且随处理时间延长,与对照差异逐渐增大;9 d时重度胁迫处理的持续胁迫区根系15N原子百分超增加幅度(295.4%)显著大于轻度和中度胁迫(254.9%和246.0%)(P<0.05),地上部15N原子百分超随胁迫程度而减小。说明增加局部根区胁迫程度和延长胁迫持续时间明显促进植物体内氮素的再分配。
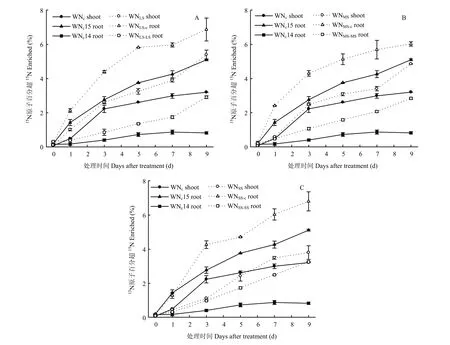
图4 各处理玉米各部位15N原子百分超的动态变化Fig.4 Dynamics of15N enriched in different maize parts in all treatments
2.4.2玉米氮素来自15N肥料的积累量在各器官中的分配 同一处理下,玉米各器官间的氮素来自15N肥料的分配比例差异显著(表3),地上部远大于恢复供应区(P<0.05),后者又显著大于持续胁迫区根系(P<0.05),说明玉米吸收的绝大部分氮素分配在地上部,根系分配的氮素较小,其中恢复供应区根系分配更多。
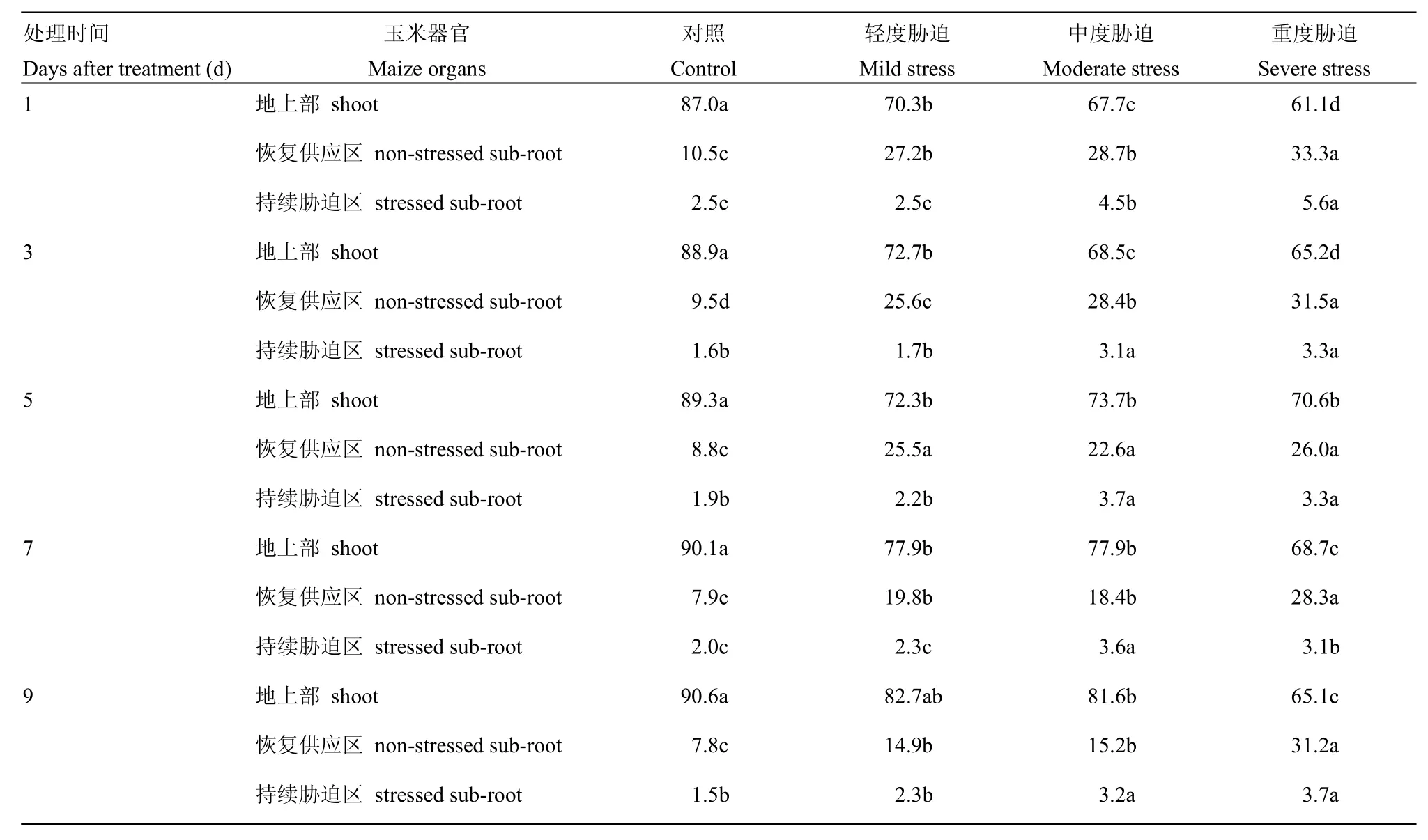
表3 局部水氮同时恢复供应条件下,各处理不同器官氮素来自15N肥料分配比例(%)Table 3 Percentage of15N-fertilizer-N allocation in different organs for all treatments under partial water and nitrogen resupplies
表3表明,玉米各器官氮素来自15N肥料的分配比例与局部恢复供应时间有关。对照条件下,处理1 —9 d,各器官氮素来自15N肥料的分配比例基本稳定,地上部、恢复供应区和持续胁迫根系分别为87.0%—90.6%、10.5%—7.8%和 1.5%—2.5%。随处理时间推移,轻度和中度胁迫处理地上部氮素来自15N肥料的分配比例逐渐增大,恢复供应区根系持续减小,但显著大于持续胁迫区根系(P<0.05),持续胁迫区根系在处理1—3 d明显减小,3 d以后基本稳定;重度胁迫处理表现为,处理1—5 d,地上部氮素来自15N肥料的分配比例逐渐增大,恢复供应区根系持续减小,5 d后地上部逐渐减小,恢复供应区根系有增大的趋势,持续胁迫区根系变化规律与轻度和中度胁迫处理类似。轻度、中度和重度胁迫处理相比,增减幅度较大的时间段有明显差异。轻度胁迫条件下,与处理5 d时相比,处理9 d时地上部氮素来自15N肥料的分配比例大幅度增大;中度胁迫条件下,处理5 d时明显增大;重度胁迫条件下,处理3 d时有较大的增长幅度,但明显小于轻度和中度胁迫处理(P<0.05)。各处理恢复供应区根系大幅度减小的时间段与地上部大幅度增大的时间段相同。说明随局部恢复供应时间的延长,玉米氮素分配重心向地上部转移,胁迫程度不同其向地上部分配程度以及开始向地上部大量转移的时间不同。随胁迫程度增大,氮素分配重心向地上部转移的时间提前,且与持续胁迫区根系相比,氮素分配重心更多的转向恢复供应区根系,局部恢复供应3 d后持续胁迫区氮素分配比例基本稳定。
表3还可以看出,玉米各器官氮素来自15N肥料的分配比例与水氮双重胁迫程度有关。轻度、中度和重度胁迫地上部氮素来自15N肥料的分配比例显著小于对照(P<0.05),且随胁迫程度而逐渐减小,恢复供应区根系则有相反的规律。持续胁迫区根系表现为轻度胁迫与对照无明显差异(P>0.05),中度和重度胁迫显著大于对照和轻度胁迫(P<0.05),且 3—9 d时,中度和重度胁迫间无明显差异(P>0.05)。可见,与对照相比,各胁迫处理条件下,玉米各器官氮素来自15N肥料的分配比例均是根系明显增大,地上部明显减小,增大水氮双重胁迫程度可使地上部氮素向根系再分配,且分配到恢复供应区根系的氮素始终大于持续胁迫区根系,且水氮双重胁迫程度大于轻度胁迫水平时,持续胁迫区根系分配比例趋于稳定。
2.5局部水氮同时恢复供应对玉米氮素生产效率的影响
表4表明,前期水氮双重胁迫6 d局部恢复供应9 d后,轻度、中度和重度胁迫处理的地上部干物重较对照均表现出减小的规律;根系干物重达到甚至大于对照水平;地上部和根系含氮量与对照无显著差异(P>0.05),并且地上部和整株氮素生产效率也达到对照水平。说明前期轻度、中度、重度3种水氮双重胁迫程度下局部恢复正常供应一定时间时不会影响植株氮素生产效率,但增加胁迫程度会显著降低地上部干物质积累。

表4 局部水氮同时恢复供应对玉米氮素吸收和利用的影响Table 4 Effect of partial water and nitrogen resupplies on accumulation and use of nitrogen by maize
3 讨论
本研究表明,局部水氮恢复供应条件下,持续胁迫区根系氮素吸收速率、含氮量以及氮素累积量均显著低于恢复供应区,根系氮素吸收速率的降低程度随胁迫程度和恢复供应时间而增大,但根系含氮量和氮素累积量不受水氮双重胁迫程度和恢复供应时间影响(表1,图1,2)。在局部水分或养分胁迫条件下,胁迫区根系水分吸收能力和根系生长均显著低于供应区[19,30-32],这可能是造成胁迫区根系氮素吸收能力减小的一个重要原因。持续胁迫区根系氮素吸收速率随水氮双重胁迫程度而逐渐减小,这可能是由胁迫程度影响水分和氮素有效性引起的,轻度胁迫条件下,较高的蒸腾作用促使氮素从木质部导管向地上部运输,进而维持根系养分吸收速率[33];重度胁迫严重影响植物的蒸腾作用、光合作用、干物质累积以及养分离子向根表迁移的质流和扩散过程,降低根系吸收面积和能力[34]。然而,持续胁迫区根系含氮量以及累积量不随胁迫程度而变化,且随恢复供应时间变化幅度也较小。造成这种情况的原因可能在于:首先,恢复正常供应区增大了的根系氮素吸收速率可以维持一定的氮素吸收(表1)。其次,氮素是植物体内转移性很强的元素,可以根据生长生理需要发生转移与再分配(表3)[35],从而维持胁迫区域根系中一定的含氮量。另外,增大胁迫程度会大大降低地上部生长而相对促进根系生长(表4),导致重度胁迫下地上部对氮素的总需求量减少,从而使其根系维持较高的氮素含量与累积量。本研究发现,局部恢复供应条件下,持续胁迫区根系氮素累积量所占的百分数随胁迫程度显著增加(表2),从植物氮素吸收分配的角度进一步解释了胁迫条件下根系生长增大,这是植物对水氮胁迫的一种适应机制。
不同生境下植物产生一系列的适应性机制,表现在根系上的明显特征是其生长、吸收和代谢呈现出“补偿效应”,这是植物对非均一、多变环境适应的结果,也是作物抵御水分或养分胁迫、维持一定产量的生理基础[36-38]。前人研究指出,根系能从局部水分或养分有效区域吸收水分或养分,而且其吸收速率大大超过全部根区供应水分或养分时的速率,刺激供应区根系生长和吸收能力,从而产生补偿效应[7,9,19,30,41],且水分或养分胁迫后恢复供应,根系吸收能力也较恢复供应前明显增大[23-24,39-40],但并未考虑产生这种根系吸氮补偿效应的影响因素。本研究发现,水氮双重胁迫程度为轻度(水分胁迫-0.2 MPa+氮素胁迫 2 mmol·L-1)和中度(水分胁迫-0.4 MPa+氮素胁迫 1 mmol·L-1)胁迫水平,局部恢复供应1 d或7 d时才产生根系氮素吸收能力的补偿效应,增大胁迫程度和延长局部恢复供应时间补偿效应均消失(表1)。这说明玉米根系经受一定程度的水分和养分胁迫后恢复供应,对根系的吸收能力起到了刺激作用,引起根系氮素吸收的补偿效应,使得恢复供应区根系含氮量和氮素累积量达到甚至超过对照水平(图1,2)。本研究中水、氮协同作用强化了这种植物对环境变化的适应机制。然而,增大水氮同时胁迫程度(重度胁迫处理),补偿效应不复存在(表1)。笔者之前的研究表明,-0.6 MPa局部水分胁迫处理严重影响了根系的长度、面积以及水分吸收能力[19,30]。在-0.6 MPa胁迫的基础上,同时施加氮素胁迫,根系吸收能力仍旧无法恢复到对照水平。进一步研究发现,轻度(水分胁迫-0.2 MPa+氮素胁迫 2 mmol·L-1)和中度(水分胁迫-0.4 MPa+氮素胁迫1 mmol·L-1)胁迫虽能有效刺激恢复供应区根系产生氮素吸收能力的补偿效应,增加恢复供应区根系氮素累积量(表1,图2),但处理1—9 d时地上部干物重与氮素累积量始终较对照明显减小(图3),试验结束时均无法恢复到对照水平;在试验期间,轻度胁迫处理地上部干重和氮素累积量增长幅度明显大于中度胁迫(P<0.05),甚至在 5—9 d时较对照也明显增大(P<0.05)。可见,一定的水氮胁迫后恢复局部供应仍无法完全补偿水氮双重胁迫对作物生长以及养分吸收的影响,前期水氮双重胁迫后局部恢复供应仅起到部分补偿作用,但适度降低胁迫程度有利于补偿效应的发挥。
本研究表明,局部水氮同时恢复供应对恢复供应区根系氮素吸收能力的刺激作用与恢复供应时间有关。局部水氮同时恢复供应后,恢复供应区根系氮素吸收速率1 d内即可恢复甚至超过对照水平,但是,随着恢复供应时间延长,恢复供应区根系氮素吸收速率较对照显著降低(表1)。局部供应条件下,根系生长和水分吸收的时效性决定了根系养分吸收能力随时间而变化[19,30]。可能是因为在恢复供应的早期阶段,生理反应较形态反应更敏感[13-14],从而使得恢复供应区根系氮素吸收能力迅速增加。延长恢复供应时间,其生理、解剖和形态变化共同决定了根系对养分的吸收[42]。另一方面,可能与植物本身养分状态有关[6,43-44]。LAINÉ等[45]研究发现,植物氮素含量与根系氮素吸收速率存在负相关关系。本试验处理3 d后根系氮素含量和累积量达到和超过对照水平,明显改善了植物的氮素营养状况,这也可能是引起根系氮素吸收速率降低的原因。其生理机制需进一步研究。
本研究表明,作物体内的氮素分配情况与水氮双重胁迫程度以及局部恢复供应时间有关。与对照相比,轻度、中度和重度胁迫处理根系氮素分配比例明显增大(P<0.05),地上部明显减小(P<0.05)。恢复供应区根系较持续胁迫区根系明显增大,其增加幅度随水氮双重胁迫程度而逐渐增大。其原因可能在于,水氮双重胁迫明显影响地上部与根系以及两个1/2根区根系间的干物质分配比例,为了维持作物体内一定的碳氮平衡,各器官的氮素分配比例需与干物质分配相匹配[46]。局部供应条件下,作物处于水氮非充分供应状态,而一定的水氮胁迫会促使干物质向根系的分配比例增大,胁迫程度越大分配比例也越大(表2,表3)。水分胁迫持续增加明显抑制胁迫区根系生长,供应区根系长度和面积相对促进,这就增大了两个根区氮素分配比例的差距[30]。
4 结论
(1)局部水氮同时恢复供应条件下,持续胁迫区根系吸收速率、含氮量以及氮素累积量均较恢复供应区显著降低,且根系氮素吸收速率降低程度随胁迫程度和恢复供应时间而增大,但根系含氮量和氮素累积量未受影响;
(2)前期水氮双重胁迫后局部恢复水氮供应可有效刺激恢复供应区产生根系吸氮能力的补偿效应,且与胁迫程度以及局部恢复供应时间有关,临界胁迫程度为≦水分-0.4 MPa+氮素1 mmol·L-1,局部恢复供应的时间应为1 d或7 d,但该补偿效应并不能使地上部干物质以及氮素累积量恢复到对照水平,仅起到部分补偿效果,适度降低胁迫程度(即轻度胁迫水平:水分胁迫-0.2 MPa+氮素胁迫2 mmol·L-1)更有利于补偿效应的发挥,增加胁迫程度或延长恢复供应时间补偿效应均消失,但根系含氮量和氮素累积量均能达到甚至超过对照水平;
(3)与对照相比,局部恢复水氮供应的根系氮素分配比例明显增大,地上部明显减小,且增减幅度随胁迫程度而增大;同时恢复供应区根系分配比例显著大于持续胁迫区根系,且增加幅度随局部恢复供应时间延长而增大;
(4)前期水氮同时胁迫后恢复局部供应,植株氮素生产效率达到对照水平,增强水氮同时胁迫程度对植株氮素生产效率无影响,但显著降低地上部干物重,可见,局部恢复供应前水氮胁迫程度对作物生长有明显的影响。因此,在实际应用水分和养分局部供应时应充分考虑局部供应前土壤的水分和养分状况。
本试验为分根水培试验所得到的结果,可能与田间条件不完全一致,在大田条件下影响根系氮素吸收能力的因素还需进一步研究,而且,关于局部恢复水氮供应提高恢复供应区根系氮素吸收速率的内在机制以及作物对水氮胁迫的忍耐程度与时间,还需进一步深入探索。
References
[1] CAIN M L,SUBLER S,EVANS J P,FORTIN M J. Sampling spatial and temporal variation in soil nitrogen availability. Oecologia,1999,118(4): 397-404.
[2] FRANSEN B,BLIJJENBERG J,DE KROON H. Root morphological and physiological plasticity of perennial grass species and the exploitation of spatial and temporal heterogeneous nutrient patches. Plant and Soil,1999,211(2): 179-189.
[3] PRASOLOVA N V,XU Z H,SAFFIGNA P G,DIETERS M J. Spatial-temporal variability of soil moisture,nitrogen availability indices and other chemical properties in hoop pine (Araucaria cunninghamii) plantations of subtropical Australia. Forest Ecology and Management,2000,136(1/3): 1-10.
[4] CAHILL JR JF,MCNICKLE G G. The behavioral ecology of nutrient foraging by plants. Annual Review of Ecology,Evolution,and Systematics,2011,42: 289-311.
[5] WANG L,MOU P P,JONES R H. Nutrient foraging via physiological and morphological plasticity in three plant species. Canadian Journal of Forest Research,2006,36(1): 164-173.
[6] MOU P,JONES R,TAN Z,BAO Z,CHEN H. Morphological and physiological plasticity of plant roots when nutrients are both spatially and temporally heterogeneous. Plant and Soil,2013,364(1/2): 373-384.
[7] HU T T,KANG S Z,LI F S,ZHANG J H. Effects of partial root-zone irrigation on the nitrogen absorption and utilization of maize. Agricultural Water Management,2009,96(2): 208-214.
[8] 胡田田,康绍忠. 局部灌水方式对玉米不同根区土-根系统水分传导的影响. 农业工程学报,2007,23(2): 11-16. HU T T,KANG S Z. Effects of localized irrigation model on hydraulic conductivity in soil-root system for different root-zones of maize. Transactions of the Chinese Society of Agricultural Engineering,2007,23(2): 11-16. (in Chinese)
[9] HODGE A. The plastic plant: Root responses to heterogeneous supplies of nutrients. New Phytologist,2004,162(1): 9-24.
[10] ROBINSON D. The responses of plants to non-uniform supplies of nutrients. New Phytologist,1994,127(4): 635-674.
[11] YANO K,KUME T. Root morphological plasticity for heterogeneous phosphorus supply in Zea mays L. Plant Production Science,2005,8(4): 427-432.
[12] LI H,MA Q,LI H,ZHANG F,RENGEL Z,SHEN J. Root morphological responses to localized nutrient supply differ among crop species with contrasting root traits. Plant and Soil,2014,376(1/2): 151-163.
[13] BURNS I G. Short- and long-term effects of a change in the spatial distribution of nitrate in the root zone on N uptake,growth and root development of young lettuce plants. Plant,Cell & Environment,1991,14(1): 21-33.
[14] VAN VUUREN M,ROBINSON D,GRIFFITHS B. Nutrient inflow and root proliferation during the exploitation of a temporally and spatially discrete source of nitrogen in soil. Plant and Soil,1996,178(2): 185-192.
[15] 王庆成,程云环. 土壤养分空间异质性与植物根系的觅食反应. 应用生态学报,2004,15(6): 1063-1068. WANG Q C,CHENG Y H. Response of fine roots to soil nutrient spatial heterogeneity. Chinese Journal of Applied Ecology,2004,15(6): 1063-1068. (in Chinese)
[16] FITTER A H. Architecture and biomass allocation as components of the plastic response of root systems to soil heterogeneity//Caldwell M M,Pearcy R W. Exploitation of Environmental Heterogeneity by Plants. Academic,San Diego,1994,305-323.
[17] HODGE A,ROBINSON D,GRIFFITHS B S,FITTER A H. Nitrogen capture by plants grown in N-rich organic patches of contrasting size and strength. Journal of Experimental Botany,1999,50(336): 1243-1252.
[18] 刘展鹏. 模拟干旱胁迫及复水条件下玉米生长补偿效应[D]. 南京:河海大学,2007. LIU Z P. Research on compensatory effects of growth under simulated water stress and rewatering on maize[D]. Nanjing: Hohai University,2007. (in Chinese)
[19] 牛晓丽,胡田田,刘亭亭,吴雪,冯璞玉,刘杰,李康,张富仓. 适度局部水分胁迫提高玉米根系吸水能力. 农业工程学报,2014,30(22): 80-86. NIU X L,HU T T,LIU T T,WU X,FENG P Y,LIU J,ZHANG F C. Appropriate partial water stress improves maize root absorbing capacity. Transactions of the Chinese Society of Agricultural Engineering,2014,30(22): 80-86. (in Chinese)
[20] SAMPATHKUMAR T,PANDIAN B J,MAHIMAIRAJA S. Soil moisture distribution and root characters as influenced by deficit irrigation through drip system in cotton-maize cropping sequence. Agricultural Water Management,2012,103(103): 43-53.
[21] BARBER S A,WALKER J M,VASEY E H. Mechanisms for the movement of plant nutrients from the soil & fertilizer to the plant root. Journal of Agricultural and Food Chemistry,1963,11(3): 204-207.
[22] GLOSER V,ZWIENIECKI M A,ORIANS C M,HOLBROOK N M. Dynamic changes in root hydraulic properties in response to nitrate availability. Journal of Experimental Botany,2007,58(10): 2409-2415.
[23] WIJESINGHE D,HUTCHINGS M. The effects of spatial scale of environmental heterogeneity on the growth of a clonal plant: An experimental study with Glechoma hederacea. Journal of Ecology,1997,85(1): 17-28.
[24] JACKSON R B,CALDWELL M M. Kinetic responses of Pseudoroegneria roots to localized soil enrichment. Plant and Soil,1991,138(2): 231-238.
[25] KEMBEL S W,KROON H D,CAHILL J F,MOMMER L. Improving the scale and precision of hypotheses to explain root foraging ability. Annals of Botany,2008,101(9): 1295-1301.
[26] DE LA ROCHA C L,TERBRÜGGEN A,HOHN S,VÖLKER C. Response to and recovery from nitrogen and silicon starvation in Thalassiosira weissflogii: Growth rates,nutrient uptake and C,Si and N content per cell. Marine Ecology Progress Series,2010,412: 57-68.
[27] NIWA K,HARADA K. Physiological responses to nitrogen deficiency and resupply in different blade portions of Pyropia yezoensis f. narawaensis (Bangiales,Rhodophyta). Journal of Experimental Marine Biology and Ecology,2013,439(439): 113-118.
[28] 李瑞,胡田田,牛晓丽,代顺冬,王旭东. 局部水分胁迫对玉米根系生长的影响. 中国生态农业学报,2013,21(11): 1371-1376. LI R,HU T T,NIU X L,DAI S D,WANG X D. Effect of partial root-zone drought stress on root growth of maize. Chinese Jounal of Eco-Agriculture,2013,21(11): 1371-1376. (in Chinese)
[29] 李瑞,胡田田,牛晓丽,代顺冬,王旭东. 局部水分胁迫对玉米根系导水率的影响. 西北农林科技大学学报: 自然科学版,2014,42(2): 61-64. LI R,HU T T,NIU X L,DAI S D,WANG X D. Effect of partial water stress on root hydraulic conductivity of maize. Journal of Northwest A&F University: Nature Science Edition,2014,42(2): 61-64. (in Chinese)
[30] NIU X L,HU T T,ZHANG F C,FENG P Y. Severity and duration of osmotic stress on partial root system: Effects on root hydraulic conductance and root growth. Plant Growth Regulation,2016: 79(2): 177-186.
[31] CARVAJAL M,COOKE D T,CLARKSON D T. Responses of wheat plants to nutrient deprivation may involve the regulation of water-channel function. Planta,1996,199(3): 372-381.
[32] LI H B,ZHANG F S,SHEN J B. Contribution of root proliferation in nutrient-rich soil patches to nutrient uptake and growth of maize. Pedosphere,2012,22(6): 776-784.
[33] HOOYMANS J. The influence of the transpiration rate on uptake and transport of potassium ions in barley plants. Planta,1969,88(4): 369-371.
[34] GREENWAY H,KLEPPER B. Phosphorus transport to the xylem and its regulation by water flow. Planta,1968,83(2): 119-136.
[35] 胡田田,康绍忠,李志军,张富仓. 局部湿润方式下玉米对不同根区氮素的吸收与分配. 植物营养与肥料学报,2009(1): 105-113. HU T T,KANG S Z,LI Z J,ZHANG F C. Uptake and allocation of nitrogen from different root zones of maize under local irrigation. Plant Nutrition and Fertilizer Science,2009(1): 105-113. (in Chinese)
[36] 梁爱华,马富裕,梁宗锁,慕自新. 旱后复水激发玉米根系功能补偿效应的生理学机制研究. 西北农林科技大学学报: 自然科学版,2008,36(4): 58-64. LIANG A H,MA F Y,LIANG Z S,MU Z X. Studies on the physiological mechanism of functional compensation effect in maize root system induced by rewatering after draught stress. Journal of Northwest A&F University: Nature Science Edition,2008,36(4): 58-64. (in Chinese)
[37] YOUNG E B,BERGES J A,DRING M J. Physiological responses of intertidal marine brown algae to nitrogen deprivation and resupply of nitrate and ammonium. Plant Physiology,2009,135(4): 400-411.
[38] RICHARD-MOLARD C,KRAPP A,BRUN F,NEY B,DANIELVEDELE F,CHAILLOU S. Plant response to nitrate starvation is determined by N storage capacity matched by nitrate uptake capacity in two Arabidopsis genotypes. Journal of Experimental Botany,2008,59(4): 779-791.
[39] ASSENG S,RITCHIE J,SMUCKER A,ROBERTSON M. Root growth and water uptake during water deficit and recovering in wheat. Plant and Soil,1998,201(2): 265-273.
[40] SIEMENS J A,ZWIAZEK J J. Effects of water deficit stress and recovery on the root water relations of trembling aspen (Populus tremuloides) seedlings. Plant Science,2003,165(1): 113-120.
[41] PONI S,TAGLIAVINI M,NERI D,SCUDELLARI D,TOSELLI M. Influence of root pruning and water stress on growth and physiological factors of potted apple,grape,peach and pear trees. Scientia Horticulturae,1992,52(3): 223-236.
[42] FERNANDES A M,SORATTO R P,GONSALES J R. Root morphology and phosphorus uptake by potato cultivars grown under deficient and sufficient phosphorus supply. Scientia Horticulturae,2014,180: 190-198.
[43] BASSIRIRAD H,CALDWELL M M,BILBROUGH C. Effects of soil temperature and nitrogen status on kinetics of15NO3-uptake by roots of field-grown Agropyron desertorum (Fisch. ex Link) Schult. New Phytologist,1993,123(3): 485-489.
[44] GROSSMAN J D,RICE K J. Evolution of root plasticity responses to variation in soil nutrient distribution and concentration. Evolutionary Applications,2012,5(8): 850-857.
[45] LAINÉ P,OURRY A,BOUCAUD J. Shoot control of nitrate uptake rates by roots of Brassica napus L.: Effects of localized nitrate supply. Planta,1995,196(1): 77-83.
[46] AGRELL D,OSCARSON P,LARSSON C M. Translocation of N to and from barley roots: Its dependence on local nitrate supply in split-root culture. Physiologia Plantarum,1994,(3): 467-474.
(责任编辑 杨鑫浩)
Effects of Partial Water and Nitrogen Resupplies on Maize Root Nitrogen Absorbing Capacity and Distribution
NIU Xiao-li,HU Tian-tian,ZHANG Fu-cang,WANG Li,LIU Jie,FENG Pu-yu,YANG Shuo-huan,SONG Xue
(College of Water Resources and Architectural Engineering/Key Laboratory of Agricultural Soil and Water Engineering in Arid and Semiarid Areas of Ministry of Education/Institute of Water-saving Agriculture in Arid Areas of China,Northwest A&F University,Yangling 712100,Shaanxi)
【Objective】Water and nitrogen (N) resupplies can significantly enhance root absorbing capacity. Partial water and N supplies can stimulate the compensation effect of root absorbing capacity at the non-stressed sub-root zone. The objective of this study is to identify the dynamics and influencing factors of the compensation effect of maize roots (Zea mays L. hybrid cv. Aoyu No.3007) N absorbing capacity under partial resupply after previous water and N stresses.【Method】With the split-root technology,a hydroponic experiment was conducted to analyze the root zone water and N stresses,where the water stress was stimulated by the osmotic potential of a nutrient solution (PEG 6000) and N stress was stimulated by different N levels. There were three water and N stress levels,i.e.,mild,moderate,severe water and N stresses and a control treatment (CK,both sides of the root zone supplied with sufficient water and N). The root N inflow rate,N content and accumulation of each root zone were measured at 0,1,3,5,7 and 9 d of resupplying water and N in half of root-zone 6 d after water and N stresses.【Result】Compared with non-stressed sub-root,the root N inflow rate,N content and accumulation in stressed sub-root were significantly decreased under partial resupply after water and N stresses. During 1-3 days after treatment (DAT),the root N inflow rate in stressed sub-root reduced by 38.2% and 48.7%,respectively,and was 84.9% and 86.4% lower than that in non-stressed sub-root. For non-stressed sub-root,partial water and N resupplies significantly enhanced the root N inflow rate compared with previous water and N stresses during 0-1 DAT. When water and N stresses did not exceed moderate stress level,partial water and N resupplies significantly increased root N inflow rate compared with control treatment during 0-1 and 7-9 DAT. However,during 3-7 DAT,the root N inflow rate was similar to or lowers than control treatment. The root N content and accumulation in mild and moderate stress treatments returned to control level at 1 and 5 DAT,respectively,which resulted in similar plant N use efficiency to control treatment. Moreover,partial water and N resupplies significantly increased the percentage of15N-fertilizer-N allocation in shoot compared with control treatment,and the increment reduced with the severity of water and N stresses. For non-stressed sub-root,the percentage of15N-fertilizer-N allocation showed a reverse trend. For mild stress treatment,the percentage of15N-fertilizer-N allocation of stressed sub-root had no significant difference compared with that of control treatment. The percentage of15N-fertilizer-N allocation of stressed sub-root at moderate and severe stress treatments was significantly higher than that of control treatment,at 3-9 DAT,although there was no significant difference between moderate and severe stress treatments.【Conclusion】When previous water and N stresses did not exceed moderate stress level,the compensation effect of root N absorbing capacity in the non-stressed sub-root can be effectively stimulated by partial water and N resupplies. The compensation effect was affected by the severity and duration of the water and N stresses. Percentage of15N-fertilizer-N allocation in different organs is closely related to the severity and duration of the water an N stresses. Thus,the above conclusion provides theoretical supports for regulating the interaction between plants and soil environment and making use of the potential plant response to soil water and nutrient stresses.
partial water and nitrogen resupplies; stress severity; duration of partial resupply; root N inflow rate; root compensatory effect; maize
2016-01-22;接受日期:2016-06-03
国家自然科学基金(51079124)、国家“863”计划(2011AA100504)、中央高校基本科研业务费专项(QN2011067)、教育部高等学校创新引智计划(B12007)
联系方式:牛晓丽,Email:niuxiaoli88@126.com。通信作者胡田田,Email:hutiant@nwsuaf.edu.cn。通信作者张富仓,Email:zhangfc@nwsuaf.edu.cn

