龙岩市某规模化猪场猪伪狂犬病病毒及抗体检测
吴志伟,戴爱玲,2*,范克伟,2,方来杉,江丹丹,卢马英,黄元华
(1.龙岩学院生命科学学院,福建龙岩 364000; 2.福建省生猪疫病防控工程技术研究中心, 福建龙岩 364000)
龙岩市某规模化猪场猪伪狂犬病病毒及抗体检测
吴志伟1,戴爱玲1,2*,范克伟1,2,方来杉1,江丹丹1,卢马英1,黄元华1
(1.龙岩学院生命科学学院,福建龙岩 364000; 2.福建省生猪疫病防控工程技术研究中心, 福建龙岩 364000)
为了掌握龙岩市某规模化猪场猪群伪狂犬病病毒(PRV)感染情况,用PCR检测发病猪病料中PRV gE基因, 进行测序及遗传进化分析;同时应用ELISA方法检测该场母猪、不同日龄商品猪血清中gE和gB抗体水平。结果表明,从3头发病猪病料中均扩增到1 755 bp特异性条带,对该基因遗传进化分析表明,本次发病为PRV变异株感染引起。血清中gE和gB抗体水平检测结果显示,母猪免疫(gB)抗体水平较高,gB抗体阳性率为100%,但不能阻止PRV感染,转阳率为20%;15日龄~55日龄商品猪具有较高水平的母源抗体,55日龄商品猪略有下降,70日龄商品猪 gB抗体阳性率下降为20%,但15日龄~80日龄的商品猪gE抗体阳性率为0;而90日龄以上的商品猪存在不同程度的PRV感染,90日龄gE抗体阳性率为20%;150日龄和170日龄的gE抗体阳性率都为100%。本次检测结果可为该场猪伪狂犬病的防控措施的制定与实施提供参考。
猪伪狂犬病病毒;聚合酶链反应;序列分析;酶联免疫吸附试验;抗体检测
猪伪狂犬病(Porcine pesudorabies,PR)是由猪伪狂犬病病毒(Porcine pesudorabies virus,PRV)引起的一种高度接触性传染病,可引起妊娠母猪流产、产死胎、木乃伊、公猪不育,新生仔猪神经症状、呕吐、腹泻等症状,且病死率高,断奶仔猪和育肥猪表现出呼吸道症状[1]。猪是PRV的主要宿主和传染源,PRV可通过空气以及乳汁和精液传播,健康猪与病猪、带毒猪直接接触可感染本病,猪感染PRV后,免疫系统受到损害易继发其他疾病。本病广泛分布于世界各地,已有50多个国家和地区报道该病的流行,对我国养猪业也构成很大的威胁。
2014年4月,龙岩市某存栏500头母猪的规模化猪场65 kg~70 kg的猪出现体温升高、呼吸困难、精神沉郁、厌食等症状,个别猪有撞栏、角弓反张症状。母猪和产房小猪、保育猪正常。对3头发病猪进行剖检,可见全身淋巴结有不同程度的肿胀、出血;扁桃体水肿、化脓、溃疡;脾脏有散落的白色坏死灶,肝脏表面有许多白色坏死灶;肺脏边缘部分肉变;剖开脑颅腔,发现脑膜充血、脑脊液增多,初步诊断为疑似PRV感染。为了掌握该猪场PRV感染情况,我们应用PCR方法对发病猪的脑等病料组织样品进行PRV gE基因检测,进行基因序列分析,同时应用ELISA方法对该场母猪、不同日龄商品猪进行PRV gE抗体和gB抗体的检测,以期为进一步防控措施的制定提供依据。
1 材料与方法
1.1材料
1.1.1样品来源脑、脾脏等病料组织采集于龙岩市某规模化猪场发病猪。血清样本采用随机采样的方法对该猪场母猪和不同日龄商品猪进行采血,包括母猪15、24、31、45、55、70、80、90、110、130、150、170、200 d等不同日龄的商品猪,前腔静脉采血,每头采3 mL~4 mL,共采集85份血样,常规方法分离血清,4℃保存备用。该猪场母猪的伪狂犬病疫苗免疫程序采取每年4次全场统一的免疫方式,使用某进口品牌 PRV Bartha-k61 弱毒疫苗,仔猪出生滴鼻免疫(国产疫苗),50日龄进行二次免疫(国产疫苗)。该猪场在此次发病前的多次检测均为PRV阴性。
1.1.2主要试剂pMD18-T vector,TIANGEN生化科技公司产品;RPMI1640培养基,GBICO公司产品;dNTPs、DNA Marker DL 2 000、蛋白酶K、Universal Genomic DNA Extraction Kit、LATaqDNA 聚合酶、2×GC buffer I、rTaqDNA聚合酶、EcoRⅠ限制性内切酶、ApaLⅠ酶、DNA凝胶回收试剂盒,宝生物工程(大连)有限公司产品;猪伪狂犬病病毒gE和gB抗体检测试剂盒,北京(IDEXX)元亨生物科技有限公司产品。
1.1.3主要仪器设备台式高速冷冻离心机,Thermo Hybaid公司产品;MyCyclerPCR、GelDoc XR紫外凝胶成像系统,Bio-Rad公司产品;Thermo酶标仪,美国赛默飞公司产品。
1.2方法
1.2.1引物设计与合成参照GenBank中发表的伪狂犬病病毒gE基因序列,利用Primer Premier 5.0 软件,设计一对引物,用于扩增gE全长基因,gE-QC-F:5′-ATGCGGCCCTTTCTG-3′,gE-QC-R:5′-CGGTTCTCCCGGTATTTAAGC-3′,扩增产物大小为1 755 bp。引物由上海英骏生物技术有限公司合成。
1.2.2病毒DNA的提取及PCR扩增根据TaKaRa公司Universal Genomic DNA Extraction Kit试剂盒说明书,从发病猪的脑组织中提取总DNA,以其为模板,利用上述引物扩增PRV gE基因。PCR反应体系总体积25 μL:DNA模板2 μL,2×GC buffer I 12.5 μL,dNTP 4 μL,上、下游引物各1 μL,LATaq酶0.25 μL,用ddH2O补至 25 μL。 PCR程序: 94℃ 5 min;94℃ 1 min, 65.7℃ 50 s, 72℃ 2 min, 35 个循环; 72 ℃ 10 min。PCR产物用10 g/L琼脂糖凝胶电泳检测。
1.2.3gE基因的克隆与序列分析将目的基因经胶回收后克隆至pMD18-T载体中,送Invitrogen公司进行序列测定,利用生物学分析软件DNA Star 7.1将获得的基因序列与GenBank中登录的其他PRV参考株的gE基因序列进行比对,分析其序列特征。
1.2.4血清学检测参考猪伪狂犬病病毒gE和gB抗体检测试剂盒说明书检测血清样品中的gE抗体和gB抗体水平。二种抗体的判定标准一致,当S/N值≥0.7表示抗体阴性(-);0.6≤S/N值<0.7表示可疑(±);S/N值<0.6表示抗体阳性(+)。当gE抗体为阴性时,gB抗体检测结果反映的是疫苗免疫后产生的抗体。
2 结果
2.1PCR检测及序列分析结果
以提取的3头发病猪脑组织DNA为模板进行PCR扩增,结果从3份病料中均扩增到1 755 bp左右的特异性条带,与预期长度相符(图1)。将PCR产物切胶回收后连接于pMD18-T载体中送Invitrogen公司测序,通过DNA Star软件将测得的基因序列(FJLY-ZP,登录号:KU175223)与GenBank中登录的其他8株PRV gE基因核苷酸序列进行比对,结果FJLY-ZP株与其他参考株核苷酸序列同源性在97.5%~99.6%,特别是与4株PRV变异株(HeN1、HNXX、JY及Xiang A)的核苷酸同源性较高,最高达到99.6%(图2);FJLY-ZP株gE核苷酸序列在2个部位存在3个连续碱基的插入,分别是第142 bp~144 bp位GAC的插入以及1 488 bp~1 490 bp位CGA的插入(图3);遗传进化分析表明,FJLY-ZP株与4株PRV变异株位于一个相对独立的分支中,表明FJLY-ZP株为PRV变异株,而与其他分离株亲缘关系相对较远(图4)。

M.DNA标准DL 2 000;1~3.目的片段
2.2血清抗体检测结果
PRV抗体检测结果见表1。从表1可见, 15日龄~80日龄的PRV gE抗体均为阴性;母猪有20%的PRV gE抗体转阳。商品猪90日龄后开始出现PRV gE抗体转阳,阳性率逐渐上升,其中90日龄抗体阳性率为20%,110日龄阳性率为80%,130日龄阳性率为20%,150日龄和170日龄的抗体阳性率都为100%,200日龄的抗体阳性率为80%。总体血清PRV gE抗体平均阳性率为27.1%。从S/N平均值可以看出,90日龄以后PRV gE抗体水平呈逐渐上升趋势,表明该猪场母猪、90日龄以后的中大猪已经不同程度上受到PRV gE感染。
对PRV gE抗体阴性猪进行PRV-gB抗体检测,结果见表2。母猪gB抗体阳性率为100%,抗体平均值也比较高, S/N平均值为0.05。 15日龄~55日龄商品猪gB抗体主要是母源抗体,处于较高水平,抗体水平在55日龄略有下降。70日龄商品猪开始gB抗体阳性率下降为20%;70日龄以后,即使PRV gE抗体阴性猪,gB抗体水平也不高,S/N平均值处于0.6左右。表明母猪经常规免疫后获得了较高水平的免疫抗体,仔猪的母源抗体水平在55日龄后出现明显下降。

图2 gE基因核苷酸序列及推导氨基酸的同源性比较

图3 PRV gE基因部分核苷酸序列比对结果

图4 变异株与经典株gE氨基酸系统进化分析
3 讨论
本研究中的3头发病猪的脑组织样品经PCR检测,均在1 755 bp左右有特异性条带,且与预期设计长度相符。将PCR产物的测序结果与GenBank中登录的其他8株PRV gE基因核苷酸序列进行比对,结果表明FJLY-ZP株与其他参考株gE基因核苷酸序列同源性在97.5%~99.6%,说明gE基因具有高度的保守性。通过核苷酸序列比对结果发现,FJLY-ZP株gE核苷酸序列在2个部位存在3个连续碱基的插入,分别是第142 bp-144 bp位GAC的插入及1 488 bp-1 490 bp位CGA的插入,其中142 bp-144 bp位GAC的插入在主要抗原表位区内,这部位核苷酸序列的变化可能会影响病毒粒子的毒力及gE基因的功能,而1 488 bp-1 490 bp位CGA的插入不在主要抗原表位区内,并且和毒株HNXX China、JY China、HeN1、Xiang A China处于不同的进化分支,这一特点与An T Q等[2]发现的伪狂犬病病毒新毒株氨基酸变异位点具有相似之处,这表明该猪场当前的PRV流行毒株与以前的PRV分离毒株相比,发生了一定程度的变异。但这部位核苷酸序列的变化是否会影响病毒粒子的毒力及gE基因的功能,还有待于进一步的研究分析。遗传进化分析结果表明,FJLY-ZP株与4株PRV变异株位于一个相对独立的分支中,表明FJLY-ZP株为PRV变异株,而与其他分离株亲缘关系相对较远。赵鸿远等[3]研究证实PRV变异株为近年国内主要流行的病毒株,且形成一个相对独立于经典株的新分支。
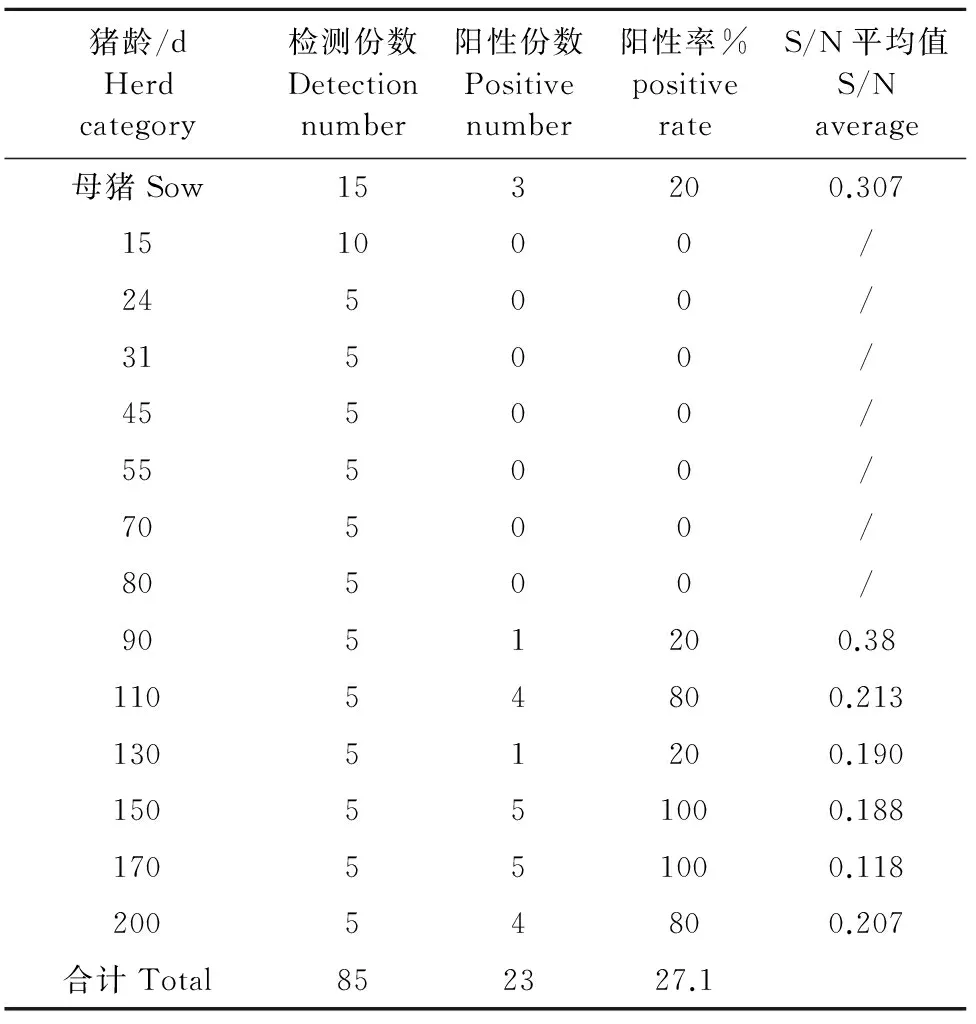
表1 猪伪狂犬病病毒gE抗体检测结果
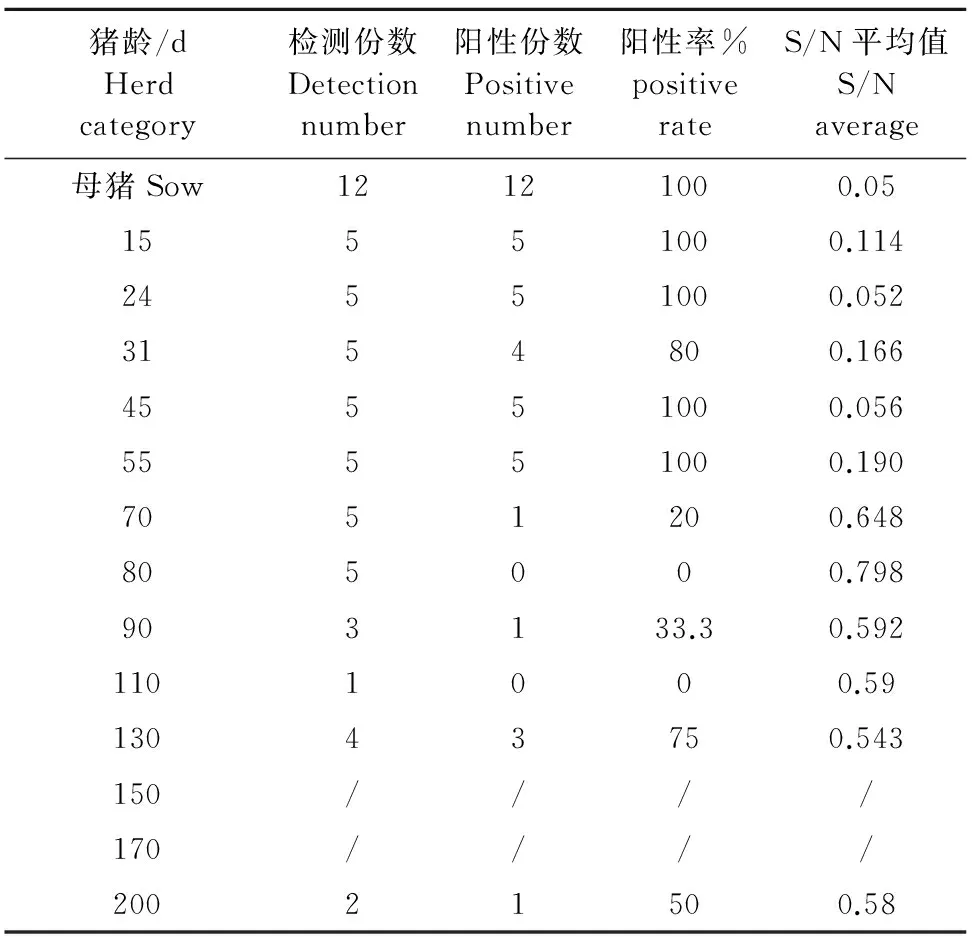
表2 猪伪狂犬病病毒gB抗体检测结果
该场母猪和不同日龄商品猪的血清学检测结果表明,母猪和育肥中后期的猪群存在一定程度的PR野毒抗体转阳的现象,商品猪抗体水平在55日龄略有下降[4],从70日龄开始gB抗体阳性率出现较为明显的下降,但与孟庆利等[5]对仔猪伪狂犬病病毒抗体消长规律的研究结果有一定差异。本研究结果表明母猪经多次免疫后获得了较高水平的免疫抗体,但不能阻止隐性感染,部分母猪出现PRV gE抗体转阳现象[6]。该猪场以前的常规检测均为PRV gE抗体阴性,本次检测结果表明该场感染了PRV,且为变异毒株。据报道自2011年我国华北地区发生PRV阴性猪群出现快速转阳后,河南、安徽、山东、浙江、上海以及江西等多地陆续发生该情况[7-8]。
2012年6月以来,笔者所在研究所监测发现龙岩市一些正常免疫的阴性规模化猪场出现PRV感染上升情况。华中农业大学动物疫病诊断中心对分离的PRV最新流行HNBA、HNXX等毒株的TK、gB、gC和gE基因与经典伪狂犬病病毒毒株比较,发现多个碱基的标志性突变和连续缺失,这些突变和缺失有可能会导致流行性毒株的毒力或抗原性改变[9]。
本次发病猪场的母猪采取每年4次的伪狂犬疫苗免疫,商品猪出生滴鼻免疫,仔猪55日龄左右进行伪狂犬疫苗二免,疫苗免疫可以抑制或减轻临床症状的发生,给哺乳仔猪提供良好的免疫保护,同时减少排毒量、缩短排毒时间,减少潜伏感染和反复感染的机会,并减少病毒传播机会[10],2014年以前的定期监测均为PRV抗体阴性猪场。本场检测表明母猪免疫抗体处于较高水平,只有部分母猪出现PRV gE抗体转阳现象,在临床上母猪未出现流产、死胎现象,新生仔猪也没有出现呕吐、四肢划动等典型神经症状[11]。仔猪55日龄左右进行伪狂犬疫苗免疫, 90日龄开始出现PRV gE抗体转阳现象,只有抗体水平低的65 kg~70 kg的中大猪出现较为典型的伪狂犬病临床症状。笔者认为造成猪场PRV转阳主要有三个方面,一方面该猪场所在县的PRV血清调查结果表明该县2013年-2014年PRV抗体阳性率由30.4%上升为50.8%[12],表明伪狂犬病在该县流行,有一定的感染压力;另一方面可能与本场商品猪免疫程序不合理,猪群处于较长的免疫抗体空白期有一定的关系;其三,也可能与流行变异毒株和经典毒株的基因差异引起毒力及对疫苗保护力有差异有一定关系[13],这些方面还需进一步的研究。
[1]杨志远,韩春华,林健,等.某规模化猪场猪伪狂犬病的诊断[J].中国畜牧兽医,2013(12):185-189.
[2]An T Q,Peng J M,Tian Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].Emerg Infect Dis,2013,19:1749-1755.
[3]赵鸿远,彭金美,安同庆,等.猪伪狂犬病病毒变异株的分离鉴定及其gE基因的分子特征[J].中国预防兽医学报,2014(7):506-509.
[4]戴爱玲,凌明发,杨小燕,等.某规模化猪场猪伪狂犬gE和gB抗体的检测与分析[J].安徽农业科学,2014,42(32):11324-11325.
[5]孟庆利,徐利,石国魁,等.仔猪伪狂犬病抗体消长规律的研究[J].养猪,2014(1):96.
[6]陈磊,张鲁安,李岩,等.猪伪狂犬病研究进展[J].动物医学进展,2004,25(5):51-55.
[7]张显浩,陈瑞爱,李冰,等.2012年—2013年我国集约化猪场猪伪狂犬病病毒感染情况的调查[J].动物医学进展,2015,36(3):133-136.
[8]王科文,刘文峰,刘忠行,等.现阶段我国猪伪狂犬病的控制重点探讨[J].养猪,2014(3):89-90.
[9]张青占.变异猪伪狂犬病毒的分离鉴定及生物学特性分析[D].北京:中国农业科学院研究生院,2013.
[10]杨文萍,顾真庆,孙海凤,等.伪狂犬病毒流行毒株的抗原性和血清中和特性分析[J].畜牧与兽医,2014(10):11-14.
[11]刘明亚,陈闻,李玉峰.猪瘟和伪狂犬抗体水平对疫苗免疫的影响[J].畜牧与兽医,2010,42(2):68-70.
[12]范克伟,戴爱玲,吴志伟,等. 闽西南地区部分规模化猪场猪伪狂犬野毒感染的血清流行病学调查[J].安徽农业大学学报, 2016, 43(1): 1-5.
[13]吕素芳,郭广君,魏凤,等. 猪伪狂犬病病毒 gE-/gI-/TK-多基因缺失活疫苗对猪的安全性与免疫效力研究[J].动物医学进展,2014,35(4):1-5.
Detection of Pseudorabies Virus and Its Antibodies in One Intensive Pig Farm of Longyan City
WU Zhi-wei1,DAI Ai-ling1,2,FAN Ke-wei1,2,FANG Lai-shan1,JIANG Dan-dan1,LU Ma-ying1,HUANG Yuan-hua1
(1.College of Life Sciences,Longyan University,Longyan,Fujian,364000,China;2.PigDiseasePreventionandControlEngineeringResearchCenterofFujianProvince,Longyan,Fujian,364000,China)
In order to understand the situation of pseudorabies in one intensive pig farm of Longyan,the primers were designed to amplify the gE gene of pseudorabies virus in tissue samples of pigs.The gE gene was sequenced and analyzed.At the same time,the gE and gB antibodies of sows and different ages of pigs were detected by ELISA.The results showed that aim band of 1 755 bp was amplified,and the analysis of its sequences and phylogenetic relationship showed the pseudorabies of the 3 pigs was caused by pseudorabies virus variant. Serum test results showed that the antibody level of gB in sows was high,the gB antibody positive rate is 100%,but which can not prevent sows from infection.The positive rate of pseudorabies in sows is 20%.The maternal antibodies against pseudorabies virus in pigs from 15 d to 55 d were high,but the titer decreased slightly after 55 days,and the positive rate decreased 20% in 70 d.The positive rate of the gE antibodies in pigs from 15 d to 80 d was 0. But the gE antibodies became positive in pigs after 90 d, the gE antibody positive rate was 20% in 90 d; and the gE antibody positive rate were 100% in 150 d and 170 d.The results provided references for the control of the pseudorabies in the intensive pig farms.
Pseudorabies virus; PCR; sequence analysis; ELISA; antibody detection
2015-05-22
福建省“大学生创新创业训练计划”项目(S20141016);福建省科技平台项目(2014N2011)
吴志伟(1994-),男, 福建漳州人,本科,主要从事预防兽医学研究。*通讯作者
S852.659.1
A
1007-5038(2016)08-0070-05

