基于异喹啉生物碱质谱裂解规律推断博落回茎中的生物碱△
余坤,左姿,卿志星,杨鹏,曾建国,2*
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128)
·基础研究·
基于异喹啉生物碱质谱裂解规律推断博落回茎中的生物碱△
余坤1,左姿1,卿志星1,杨鹏1,曾建国1,2*
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程研究中心,湖南 长沙 410128)
目的:快速分析博落回茎中的生物碱成分。方法:应用高效液相色谱-四级杆飞行时间质谱对博落回茎的生物碱进行分析,根据一级质谱的分子离子和二级质谱的碎片离子,结合博落回中异喹啉类生物碱的质谱裂解规律,推断博落回茎中的生物碱结构。结果:从博落回茎中推断出11个生物碱的结构,分别为木兰箭毒碱(Magnocurarine,1),网脉番荔枝碱(Reticuline,2),金黄紫堇碱(Scoulerine,3),轮环藤酚碱(Cyclanoline,4),13-甲氧基小檗碱(13-methoxyberberine,5),四氢巴马丁(Tetrahydropalmatine,6),原阿片碱(Protopine,7),别隐品碱(Allocryptopine,8),N-甲基氢化小檗碱(N-methylcanadine,9),血根碱(Sanguinarine,10),白屈菜红碱(Chelerythrine,11),其中化合物1~6及9首次在博落回中报道。结论:经验证,基于异喹啉生物碱质谱裂解规律推断博落回茎中生物碱的方法可行。
高效液相色谱-四级杆飞行时间质谱;生物碱;博落回
博落回Macleayacordata(Willd.)R.Br.是罂粟科博落回属植物,主要分布在中国的长江中下游地区[1]。博落回具有抗菌[2]、抗炎[3]、杀虫[4]、保肝[5]、抗肿瘤[6-7]、促动物生长[8]、净化水土和防止水土流失[9-10]的作用。据报道[11-12],博落回中含有血根碱、白屈菜红碱、原阿片碱、别隐品碱等多种异喹啉类生物碱,这些生物碱主要属于苯并菲啶、二氢苯并菲啶、普罗托品、原小檗碱、N-甲基四氢原小檗碱等六大类,而生源合成途径中的苄基异喹啉、四氢原小檗碱、阿朴芬类生物碱却很少报道[13]。博落回中的研究对象主要是果荚,根和叶也有研究,而茎的研究相对较少,但茎占据了植物体大部分的生物量。因此,有必要对博落回茎进行研究。近年来,高效液相色谱-四级杆飞行时间质谱(HPLC-Q-TOF-MS/MS)由于具有快速、准确和所需样品量少等优点,逐渐用于分析和鉴定植物中的化学成分[14-15]。利用HPLC-Q-TOF-MS/MS可以获得化合物的精确分子量和二级碎片信息来推断化合物的结构,还可以对选择性分离某些成分提供帮助。卿志星等[16]对博落回中九大类生物碱的质谱裂解规律进行了总结,本实验在此基础上,用HPLC-Q-TOF-MS/MS对博落回茎中生物碱进行分析,从中鉴定出11个生物碱成分,其中7个首次在博落回中报道。
1 仪器与试药
1290 HPLC串联6530 Q-TOF/MS(美国Agilent公司),ML204/02型精密天平[梅特勒-托利多仪器(上海)有限公司],乙腈、甲酸(色谱纯,Merck),甲醇(色谱纯,安徽时联特种溶剂股份有限公司),水为Milli-Q超纯水。博落回原料来自国家中药材生产(湖南)技术中心,经湖南农业大学曾建国教授鉴定为博落回Macleayacordata(Willd.)R.Br.的茎。原阿片碱、别隐品碱、血根碱、白屈菜红碱对照品为实验室自制。
2 方法与结果
2.1 样品的制备
取1.0 g博落回干燥茎粉末,100 mL甲醇70 ℃回流提取1 h,过滤,滤液过0.22 μm滤膜,待用。
2.2 色谱条件
色谱柱:XAqua C8柱(150 mm×2.1 mm,5 μm);流动相A为0.2%甲酸-水,流动相B为乙腈;梯度洗脱:0→8min,5%→30%B;8→15 min,30%→45%B;15→21 min,45%→75%B;流速:0.4 mL·min-1;检测波长:230 nm;进样量:2 μL;柱温:30 ℃。
2.3 质谱条件
ESI离子源,采用正离子检测模式;干燥气温度300 ℃;干燥气体积流量:8 L·min-1;雾化气压力:3.8×106Pa;鞘气温度:350 ℃;鞘气体积流量:12 L·min-1;毛细管电压:3500 V;锥孔电压:100 V;扫描范围m/z120~1200;二级裂解电压20~45 eV。
3 结果与讨论
从博落回茎提取物总离子流图(见图1)中选择了30余个峰进行二级质谱分析,最终推断出11个生物碱结构(见表1),包括2个苄基异喹啉类生物碱(1,2),2个四氢原小檗碱类生物碱(3,6),2个N-甲基四氢原小檗碱(4,9),1个原小檗碱类生物碱(5),2个普罗托品类生物碱(7,8),2个苯并菲啶类生物碱(10,11),其中1~6以及9首次在博落回中报道。
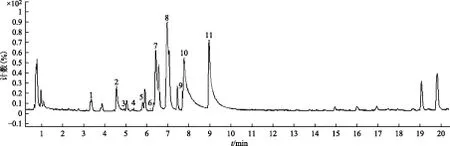
注:木兰箭毒碱(Magnocurarine,1),网脉番荔枝碱(Reticuline,2),金黄紫堇碱(Scoulerine,3),轮环藤酚碱(Cyclanoline,4),13-甲氧基小檗碱(13-methoxyberberine,5)四氢巴马丁(Tetrahydropalmatine,6),原阿片碱(Protopine,7),别隐品碱(Cryptopine,8),N-甲基氢化小檗碱(N-methylcanadine,9),血根碱(Sanguinarine,10),白屈菜红碱(Chelerythrine,11)。图1 博落回茎总离子流图
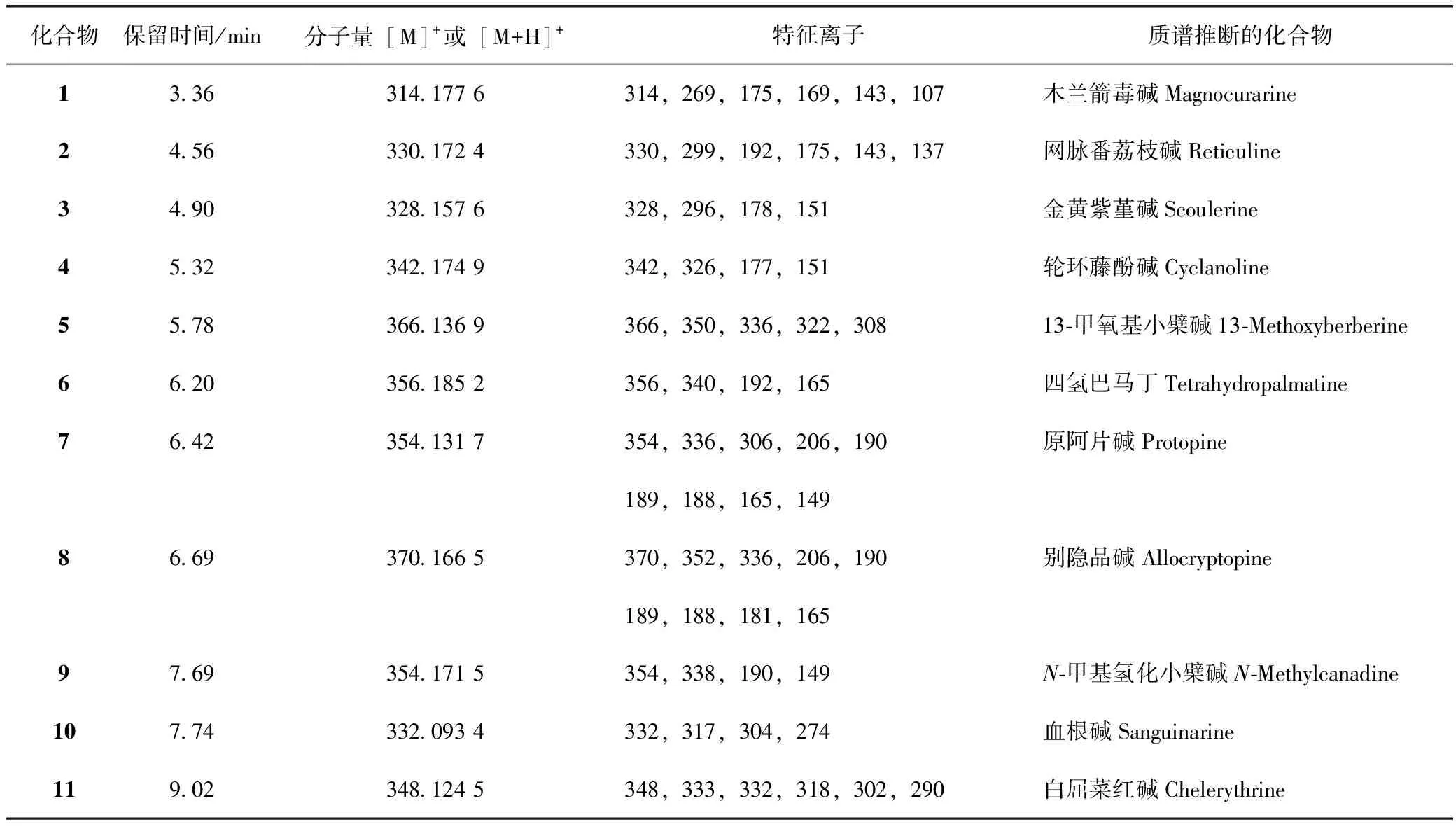
表1 博落回茎中被鉴定的11个生物碱
3.1 苄基异喹啉类生物碱的解析
化合物1和2的质谱图在m/z230以下出现丰度较大的碎片离子,表明化合物母核发生了裂解,且这两个化合物分别丢失[NH(CH3)2]+、[NH2CH3]+的碎片,形成m/z269和m/z299的碎片峰,这与苄基异喹啉类生物碱的质谱裂解规律[16](①容易发生α裂解,形成m/z相对较小的碎片;②易失去(CH3)2NH或者CH3NH2,从而形成[M-45]+、[M-31]+的碎片峰)相符合。因此推断化合1和2属于苄基异喹啉类生物碱。化合物1的碎片离子m/z269发生α和β裂解分别产生m/z175和m/z107的碎片峰,m/z175继续失去1分子CH3OH形成m/z143的子离子峰,推测碎片离子m/z175的结构中存在一个相邻的甲氧基和羟基,根据博落回中异喹啉生物碱的生源合成途径将OH和OCH3分别定位在R5和R6位。
化合物2发生α裂解形成较高丰度的m/z192和m/z137碎片峰,而其碎片离子m/z299发生α裂解则生成m/z175产物离子。m/z175进一步失去1分子CH3OH生成m/z143,表明该化合物中有相邻的甲氧基和羟基存在,结合博落回中苄基异喹啉生物碱的生源合成途径将OH和OCH3分别定位于R5和R6位。综上所述,化合物1和2的结构分别确定为木兰箭毒碱和网脉番荔枝碱,这与文献报道相符合[17-18]。化合物1和2的裂解方式见图2。
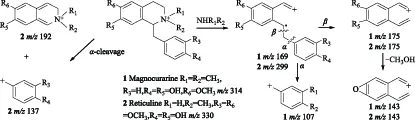
图2 化合物1和2的质谱裂解途径
3.2 普罗托品类生物碱的解析
化合物7和8在m/z230以下出现很多丰度较高的二级碎片,表明母核发生裂解。此外,都形成了[M-H2O]+的碎片,表明7和8都失去了1分子H2O。这与博落回中普罗托品类生物碱的质谱裂解规律[16](①普罗脱品类生物碱不存在大π共轭系统,母核容易断裂;②母核容易失去1分子H2O形成闭合四元环)相符合,因此,推断化合物7和8属于普罗托品类生物碱。化合物7的碎片离子峰m/z336失去1分子CO和2个H形成m/z306的碎片峰,推测碎片离子m/z336的结构中含有一个亚甲二氧基,根据博落回中异喹啉类生物碱的生源合成途径将亚甲二氧基定位在R3和R4位;此外,化合物7直接发生逆狄尔斯-阿德尔(RDA)裂解和α裂解形成m/z206、149、190和165等丰度很高的碎片离子峰,碎片离子m/z206进一步失去1分子H2O或1个OH形成m/z188或m/z189的碎片峰。
化合物8的碎片离子峰m/z352失去1分子CH4形成m/z336的碎片峰,推测碎片离子m/z352的结构中存在邻二甲氧基,结合博落回中异喹啉类生物碱的生源合成途径将邻二甲氧基定位在R1和R2位。化合物8直接发生RDA和α裂解生成m/z206、m/z165、m/z190和m/z181的碎片离子峰,碎片离子峰m/z206进一步失去1分子H2O或1个OH形成m/z188或m/z189的碎片峰,这与文献报道一致[19],因此,推测化合物7和8分别为原阿片碱和别隐品碱。化合物7和8的裂解方式如图3。
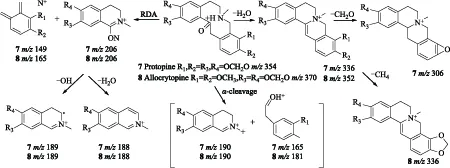
图3 化合物7和8的质谱裂解途径
3.3 N-甲基四氢原小檗碱类生物碱的解析
化合物4和9在m/z230以下存在丰度较高的碎片离子峰,表明母核发生裂解。此外,没有[M-H2O]+、[M-NH(CH3)2]+、[M-NH2CH3]+等特征碎片离子峰出现,但都出现了[M-CH4]+的碎片离子峰,根据博落回中生物碱质谱裂解规律[16],推断化合物4和9属于N-甲基四氢原小檗碱。化合物4的碎片离子峰m/z192和m/z151是母核裂解的结果,碎片离子峰m/z192继续失去了1个CH3形成m/z177;化合物4失去氮上的甲基及相邻的氢形成更稳定的碎片离子峰m/z326。
化合物9中,丰度较高的m/z190、m/z149是母核裂解形成的,而m/z338则是化合物9失去氮上的甲基及相邻的氢形成双键。综上所述,化合物4和9分别确定为轮环藤酚碱、N-甲基氢化小檗碱[17,20]。化合物4和9的裂解方式如图4。
3.4 四氢原小檗碱类生物碱的解析
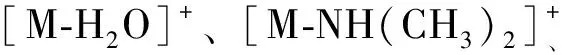
化合物6的碎片离子峰m/z192和165是母核直接裂解的结果;碎片离子峰m/z340是化合物6失去1分子CH4形成的,推测化合物6的结构中存在邻二甲氧基,结合博落回中异喹啉类生物碱的生源合成途径将邻二甲氧基定位在R1和R2位。综上所述,化合物3和6确定为金黄紫堇碱和四氢巴马丁,这与文献报道符合[20-21]。化合物3和6的裂解方式如图5。
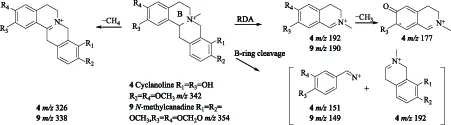
图4 化合物4和9 的裂解途径
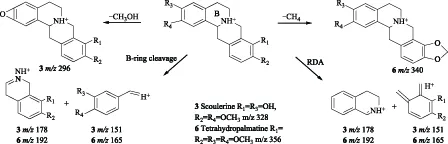
图5 化合物3和6 的裂解途径
3.5 原小檗碱类生物碱的解析
化合物5的碎片离子峰都在m/z300以上,表明母核很稳定,可能为苯并菲啶类生物碱或者原小檗碱类生物碱[16]。化合物5的裂解方式有两种:分子离子失去1分子CH4,形成m/z350的碎片峰,推测化合物5中存在邻二甲氧基,结合博落回中异喹啉类生物碱的生源合成途径将邻二甲氧基定位在R1和R2位。m/z350继续失去1分子CO和2个H形成m/z320的碎片离子,推测碎片离子m/z350上存在亚甲二氧基,结合博落回中异喹啉类生物碱的生源合成途径将亚甲二氧基定位在R3和R4位。另一方面,化合物5失去2个CH3形成m/z336的碎片离子,推测化合物5中存在邻二甲氧基,碎片离子m/z336继续失去1分子CO 形成m/z308的碎片峰,表明碎片离子m/z336中存在邻二甲氧基。综上所述,参考文献[19],化合物5确定为13-甲氧基小檗碱。化合物5的裂解方式如图6。
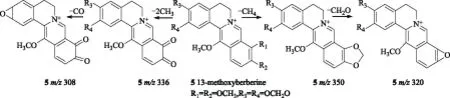
图6 化合物5的质谱裂解途径
3.6 苯并菲啶类生物碱的解析
化合物10和11的碎片离子峰都在m/z 230以上,只有一些小的碎片的丢失,故推断其为苯并菲啶类生物碱[16]。化合物10中,m/z304 是分子离子失去1分子CO形成的,推测分子离子中存在亚基二氧基。m/z274是m/z304失去1分子CO和2个H,这表明碎片离子m/z304的结构中存在一个亚基二氧基。m/z 317则是分子离子失去1个CH3的结果。
化合物11中,碎片离子峰m/z333、318是分子离子相继失去2个CH3形成的,表明分子离子的结构中存在邻二甲氧基,结合博落回中异喹啉类生物碱的生源合成途径,将邻二甲氧基定位在R3和R4位。碎片离子m/z332则由m/z333失去1个H的结果;m/z332继续失去1分子CO和2个H形成m/z302,这表明碎片离子m/z332的结构中存在亚基二氧基,结合博落回中异喹啉类生物碱的生源合成途径将亚甲二氧基定位在R1和R2位上;m/z 318则是m/z333丢失了1个CH3的结果。综上所述,化合物10和11分别确定为血根碱和白屈菜红碱[22]。化合物10和11的裂解方式如图7。
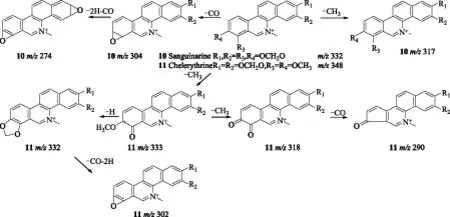
图7 化合物10和11的质谱裂解途经
4 验证实验
本实验所推断的化合物数量较多,但是本实验室没有全部化合物的对照品,因此,选取了原阿片碱、别隐品碱、血根碱、白屈菜红碱4个生物碱对照品进行验证(见图8)。结果表明,这4种生物碱分别与本次实验中推断的化合物7、8、10和11一致,这表明基于异喹啉类生物碱质谱裂解规律推断博落回中生物碱结构准确、可行。
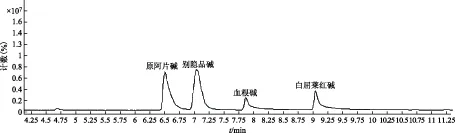
图8 4种生物碱对照品的总离子流图
5 总结与展望
目前,博落回药用资源主要以果荚为主,而果荚的生物量比较少,茎占据了大部分的生物量,但是茎却没有被充分利用,这在一定程度上造成药材资源的浪费。本实验用HPLC-Q-TOF-MS/MS对博落回茎中的生物碱进行分析,鉴定了博落回茎中六大类共计11个生物碱结构,其中化合物1~6及9共7个生物碱成分在博落回中首次报道,这对于博落回中化学成分的挖掘具有一定意义,并且对博落回茎作为药用资源的利用提供了依据。另外,本研究利用HPLC-Q-TOF-MS/MS结合博落回中异喹啉类生物碱的质谱裂解规律,不但可以对已知化合物结构进行推断,同时,也可以对新化合物结构进行初步判定,这将对博落回中新化合物的分离提供指导。
[1] 江苏新医学院.中药大辞典:下册[M].上海:上海科技出版社,1977:2286.
[2] 李静,范家佑,郁建平,等.血根碱酊剂体外抗真菌初步研究[J].山地农业生物学报,2011,30(4):348-351.
[3] 方成堃,吴晨晖,向荣,等.博落回提取物防治断奶仔猪腹泻效果研究[J].湖南饲料,2010(5):35-38.
[4] 任可,任向辉.北方地区博落回乙醇粗提物对两种蚜虫的毒力测试[J].安徽农业科学,2011,39(29):18355-18356.
[5] 肖俐,易键,赵静,等.博落回提取物对大鼠急性酒精性肝损伤的保护作用[J].中南药学,2011,9(7):485-489.
[6] 庞建新,马仁强,刘兰梅,等.博落回总碱对肝癌细胞的毒性作用和体内抗肿瘤作用[J].第一军医大学学报,2005,25(3):325-328.
[7] 樊淑莲,焦峰.博落回总生物碱对动物移植性肿瘤的作用研究[J].陕西肿瘤医学,2000,8(3):174.
[8] 蔡鹏,孙志良,曾建国,等.不同剂量博落回提取物对断奶仔猪生长性能的影响[J].中国畜牧兽医,2010,30(5):41-43.
[9] 邹序安,龙正权.博落回的生物学特性与生态价值[J].福建林业科技,2009,36(3):244-247.
[10] 易婷,申婷婷,李小明,等.Fention/SBR组合工艺处理博落回提取废水研究[J].环境科学学报,2010,30(5):959-964.
[11] 周浓林.博落回根化学成分及其活性成分研究[D].秦皇岛:河北科技师范学院,2012.
[12] 胡之璧,徐垠,冯胜初,等.博落回果实中有效成分的研究[J].药学学报,1979,17(9):535.
[13] Zulak K G,Cornish A,Daskalchuk T E,et al.Gene transcript and metabolite profiling of elicitor-induced opium poppy cell cultures reveals the coordinate regulation of primary and secondary metabolism[J].Planta,2007,225(5):1085-1106.
[14] Hu Y,Jiang P,Wang S,et al.Plasma pharmacochemistry based approach to screening potential bioactive components in Huang-Lian-Jie-Du-Tang using high performance liquid chromatography coupled with mass spectrometric detection[J].J Ethnopharmclol,2012,141(2):728-735.
[15] Wang X,Liu X,Xu X,et al.Screening and identification of multiple constituents and their metabolites of Fangji Huangqi Tang in rats by ultra-high performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry basing on coupling data processing techniques[J].J Chromatogr B,2015,985:14-28.
[16] 卿志星,程辟,曾建国,等.博落回中生物碱质谱裂解规律研究进展[J].中草药,2013,44(20):2929-2938.
[17] Qing Z X,Cheng P,Liu X B,et al.Systematic identification of alkaloids in Macleayamicrocarpa fruits by liquid chromatography tandem mass spectrometry combined with the isoquinoline alkaloids biosynthetic pathway[J].J Pham Biomed Anal,2015,103:26-34.
[18] Zhang Y,Shi Q,Shi P,et al.Characterization of isoquinoline alkaloids,diterpenoids and steroids in the Chinese herb Jin-Guo-Lan(TinosporasagittataandTinosporacapillipes)by high-performance liquid chromatography/electrospray ionization with multistage mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(15):2328-2342.
[19] Jeong E K,Lee S Y,Yu S M,et al.Identification of structurally diverse alkaloids inCorydalisspecies by liquid chromatography/electrospray ionization tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2012,26(15):1661-1674.
[20] Liu Q,Zhou B,Wang X,et al.Establishment of a search library about benzylisoquinoline alkaloids based on selective separation on the binaphthyl column and standard analysis on C18column[J].J Se PSci,2012,35(23):3317-3325.
[21] Ding B,Zhou T,Fan G,et al.Qualitative and quantitative determination of ten alkaloids in traditional Chinese medicineCorydalisyanhusuoWT Wang by LC-MS/MS and LC-DAD[J].J Pham Biomed Anal,2007,45(2):219-226.
[22] Qing Z X,Cheng P,Liu X B,et al.Structural speculation and identification of alkaloids inMacleayacordatafruits by high-performance liquid chromatography/quadrupole-time-of-flight mass spectrometry combined with a screening procedure[J].Rapid Commun Mass Spectrome,2014,28(9):1033-1044.
IdentificationofAlkaloidsinMacleayacordataStemsBasedonMassFragmentationRulesofIsoquinolineAlkaloids
YU Kun1,ZUOZi1,QINGZhixing1,YANGPeng1,ZENGJianguo1,2*
(1.Collegeofpharmacy,HunanUniversityofChineseMedicine,Changsha410208,China;2.HunanAgriculturalUniversity,NationalandProvincialUnionEngineeringResearchCenterfortheVeterinaryHerbalmedicineresourcesandinitiative,Changsha410128,China)
Objective:To study alkaloids in stem ofMacleayacordata.Methods:The methanol extract ofM.cordatastem was analyzed with High Performance Liquid Chromatography-Quardrupole/Time of Flight-Mass spectrometry,alkaloids was identified by the molecular ions of mass spectrometry and the fragment ions of MS/MS spectrometry combined with mass fragmentation rules of isoquinoline alkaloids.Results:11 alkaloids were elucidated,which were magnocurarine(1),reticuline(2),scourlerine(3),cyclanoline(4),13-methoxyberberine(5),tetrahydropalmatine(6),protopine(7),allocryptopine(8),N-methylcanadine(9),sanguinarine(10),chelerythrine(11),compounds1-6and9were reported inM.cordatafor the first time.Conclusion:The method to identify alkaloids inM.cordatastems based on mass fragmentation rules of isoquinoline alkaloids is feasible.
High Performance Liquid Chromatography-Quardrupole/Time of Flight-Mass spectromery;alkaloids;Macleayacordata
2015-10-27)
国家科技支撑计划项目(2012BAI29B04)
*
曾建国,教授,研究方向:中药资源与开发;Tel:(0731)84673824,E-mail:ginkgo@world-way.net
10.13313/j.issn.1673-4890.2016.3.009

