pH区带逆流色谱结合制备液相分离制备大黄根化学成分△
孙常磊,王召平,孙兆林,耿岩玲,李佳,杨鹏
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;3.济南三峰生物工程有限责任公司,山东 济南 250014)
pH区带逆流色谱结合制备液相分离制备大黄根化学成分△
孙常磊1,2,王召平1,孙兆林1,耿岩玲2*,李佳1,杨鹏3
(1.山东中医药大学 药学院,山东 济南 250355;2.山东省分析测试中心,山东 济南 250014;
3.济南三峰生物工程有限责任公司,山东 济南 250014)
目的:运用pH区带逆流色谱和制备液相分离制备大黄根的化学成分。方法:本研究以石油醚-乙酸乙酯-甲醇-水(1∶1∶1∶1)作为溶剂系统,上相加入10 mmol·L-1三氟乙酸(TFA)作为固定相,下相加入20 mmol·L-1NaOH作为流动相,转速为850 r·min-1,流速为2 mL·min-1,检测波长为254 nm,进行初步分离;尾吹液经制备液相进一步分离。结果:从750 mg大黄根粗提物中经一次pH区带逆流色谱分离得到反式桂皮酸(2) 85.8 mg和3个蒽醌类化合物:大黄酸(1)34.9 mg,芦荟大黄素(3)52.5 mg和大黄素(4)50.4 mg;经制备液相分离得到大黄酚(5)215.4 mg和大黄素甲醚(6)26.8 mg。经HPLC分析,其纯度分别为95.46%、97.28%、94.75%、95.02%、98.84%、98.12%。结论:大黄根中的化学成分具有有机酸的性质,可以运用pH区带逆流色谱进行分离,特别是与制备液相相结合,实现了不同酸性强度化合物的快速制备分离。
pH区带逆流色谱;制备液相;大黄;化学成分
大黄属于蓼科(Polygonaceae)大黄属(Rheum)多年生草本植物。《中华人民共和国药典》收载了掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim.ex Balf.和药用大黄RheumofficinaleBaill.。大黄味苦、性寒,归脾、胃、大肠、肝、心包经。具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄之功效[1]。其主要药效成分包括大黄素(emodin)、大黄素甲醚(physcion)、芦荟大黄素(aloe-emodin)、大黄酚(chrysophanol)、大黄酸(rhein)等1,8-二羟基蒽醌类衍生物[2]。现代药理学研究表明,大黄还具有保肝、利胆、强心、降压、抗肿瘤、抗高脂血症、免疫调节、清除自由基等功能[3-4]。鉴于大黄生物活性的多样性和药物来源复杂性,建立一种高效的分离大黄根中药效成分的方法,对于阐明其生物活性和作用机制,以及制订大黄质量控制标准都具有十分重要的意义。本研究建立了pH区带逆流色谱结合制备液相分离制备大黄根中化学成分的方法。经一次分离,得到6个高纯度化合物,即反式桂皮酸、大黄酸、大黄素、芦荟大黄素、大黄酚和大黄素甲醚。
1 仪器与材料
1.1 仪器
TBE-300B高速逆流色谱仪(上海同田生物技术有限公司),该分离系统包括多层聚四氟乙烯螺旋管(直径2.6 mm,分离体积300 mL)、TBP5002泵、8823B紫外检测器(北京宾达英创科技有限公司)和3057-11记录仪(重庆川仪总厂有限公司);Waters 2695高效液相色谱系统(配有光电二极管阵列检测器(PDA)和自动进样装置,美国Waters公司);普源高效液相色谱系统(配有紫外检测器,北京普源精电科技有限公司)。
1.2 材料
石油醚、乙酸乙酯、甲醇、三氟乙酸(TFA)和氢氧化钠等均为分析纯(国药集团化学试剂有限公司),溶解和pH区带逆流色谱溶剂系统用水为去离子水;高效液相色谱和制备液相色谱用甲醇为色谱纯(山东禹王实业有限公司),流动相的水为娃哈哈纯净水(杭州娃哈哈集团有限公司)。
大黄药材购于甘肃省,经山东中医药大学李佳教授鉴定为蓼科(Polygonaceae)大黄属(Rheum)植物掌叶大黄RheumpalmatumL.的干燥根。
2 方法
2.1 总蒽醌制备
1.0 kg大黄根粉末,用20% H2SO4和三氯甲烷按体积比1∶5混合,加热回流提取3次,每次提取2 h。过滤并合并提取液,减压回收溶剂得到粗提物。将三氯甲烷粗提物用等体积5% NaOH溶液萃取3次,合并萃取液用20% H2SO4调节pH为2左右,将酸化后的溶液用三氯甲烷萃取3次,减压回收三氯甲烷得大黄根的粗提物约30 g,用于pH区带逆流色谱分离[5]。
2.2 两相溶剂系统和样品溶液的制备
pH区带逆流色谱的溶剂系统为石油醚-乙酸乙酯-甲醇-水(1∶1∶1∶1),总体积为2 L,按比例将各种溶剂置于分液漏斗中混合,震荡后充分静置使其分层。使用之前分取上下相,其中上相中加入10 mmol·L-1TFA作为固定相,下相中加入20 mmol·L-1NaOH作为流动相,超声除去气泡,备用。
取750 mg大黄根的粗提物,用加入TFA的上相和不加NaOH的下相各10 mL超声溶解作为样品溶液。
2.3 分离和鉴定
2.3.1 pH区带逆流色谱分离过程 上相(固定相)以20 mL·min-1的流速高速注入高速逆流色谱仪的螺旋管中,待出口流出一定量的液体(约50 mL),将上述溶解好的样品溶液从进样圈注入到高速逆流色谱仪中,启动仪器,将转速调节为850 r·min-1,待转速稳定后,以2 mL·min-1的流速泵入流动相,同时开启检测器和记录仪,检测器的检测波长设置为254 nm,待有组分从出口流出时开始手动收集馏分,平均每5 min收集1管,待分离结束,用压缩空气吹出螺旋管中的液体,计算固定相的保留率。
2.3.2 制备液相色谱分离过程 pH区带逆流色谱的尾吹液经减压浓缩后,用适量的甲醇溶解,样品浓度约为30 mg·mL-1,根据大黄根粗提物的HPLC分析条件确定尾吹液中混合组分的制备液相条件:色谱柱为YMC-Pack ODS-A(250 mm ×10 mm,5 μm),甲醇-水(85∶15)为流动相,流速为3 mL·min-1,柱温为25 ℃,检测波长为254 nm,进样体积为250 μL,制备得到高纯度的大黄酚和大黄素甲醚。
2.3.3 HPLC分析和结构鉴定 大黄根粗提物以及经pH区带逆流色谱和制备液相分得的各组分分别用HPLC进行分析。色谱柱为YMC-Pack ODS-A(250 mm×4.6 mm,5 μm);检测波长为254 nm;流动相为甲醇(A)-水(B),梯度洗脱[0~20 min,60%~100%(A),20~30 min,100%~100%(A)];流速为1.0 mL·min-1;进样量为20 μL。pH区带逆流色谱和制备液相色谱所分得的各组分的化学结构根据ESI-MS和1H-NMR谱学数据进行鉴定。
3 结果与讨论
3.1 HPLC条件的优化
本研究考察了甲醇-水、乙腈-水、甲醇-0.1%磷酸水溶液和乙腈-0.1%磷酸水溶液等作为流动相时,大黄根粗提物中各成分的分离效果。经测试发现,当采用甲醇-水进行梯度洗脱[0~20 min,60%~100%(A);20~30 min,100%~100%(A)];流速为1.0 mL·min-1时,各成分能够实现基线分离,如图1所示。
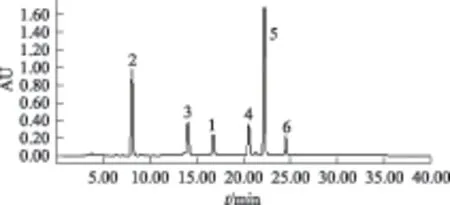
注:1.大黄酸;2.反式桂皮酸;3.芦荟大黄素;4.大黄素;5.大黄酚;大黄素甲醚。图1 大黄根粗提物的HPLC图
pH区带逆流色谱溶剂系统的选择不仅要求能够提供合适的KD值,而且要求对样品有较好的溶解性[6]。根据本实验室的分离经验[7],结合大黄化学成分的极性和溶解性,本研究选择石油醚-乙酸乙酯-甲醇-水作为溶剂系统。另外,考虑到蒽醌类化合物的弱酸性,需要用强碱作为洗脱碱,因此,选用TFA作为保留酸,NaOH作为洗脱碱进行分离。我们考察了如下几个溶剂系统:①石油醚-乙酸乙酯-甲醇-水(1∶1∶1∶1),上相加10 mmol·L-1TFA,下相加10 mmol·L-1NaOH;②石油醚-乙酸乙酯-甲醇-水(1∶1∶1∶1),上相加10 mmol·L-1TFA,下相加20 mmol·L-1NaOH;③石油醚-乙酸乙酯-甲醇-水(4∶6∶5∶5),上相加10 mmol·L-1TFA,下相加10 mmol·L-1NaOH;④石油醚-乙酸乙酯-甲醇-水(4∶6∶5∶5);上相加10 mmol·L-1TFA,下相加20 mmol·L-1NaOH。相比较而言,溶剂系统②和溶剂系统④能够提供较为合适的KD值。经实验测试发现,溶剂系统④并没有体现出较好的分离效果,反而增加了分离的时间,而溶剂系统②能够在较短的时间内完成分离,且分离效果没有太大差别,综合考虑选择溶剂系统②[石油醚-乙酸乙酯-甲醇-水(1∶1∶1∶1),上相加10 mmol·L-1TFA,下相加20 mmol·L-1NaOH]进行大黄根中化学成分的分离。经一次分离,从750 mg大黄根粗提物中分离得到反式桂皮酸(2)85.8 mg和3个蒽醌类化合物:大黄酸(1)34.9 mg,芦荟大黄素(3)52.5 mg和大黄素(4)50.4 mg,分离效果如图2所示。

图2 大黄根粗提物的pH区带逆流色谱图
3.2 制备HPLC条件的优化
根据3.1中选定的分析条件,分别考察了甲醇-水(80∶20)、甲醇-水(85∶15)和甲醇-水(90∶10)3个比例的流动相条件,经测试发现,当甲醇-水(85∶15)时,分离效果较好,能够实现基线分离且进样量可以扩大到250 μL,制备效果如图3所示。

图3 pH区带逆流色谱尾吹组分的制备液相分析图
3.3 化合物的纯度检测
利用优化好的液相色谱条件对分得的各组分(反式桂皮酸、大黄酸、芦荟大黄素、大黄素、大黄酚、大黄素甲醚)进行检测,纯度分别为95.46%、97.28%、94.75%、95.02%、98.84%、98.12%,分析结果及相应的结构式如图4所示。
3.4 化合物的结构鉴定
化合物1:ESI-MSm/z:283[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:7.36(1H,d,J=8.0 Hz,H-7),7.69(1H,d,J=8.0 Hz,H-5),7.78(1H,dd,J=8.0 Hz,8.0 Hz,H-6),7.68(1H,s,H-2),8.05(1H,s,H-4)。以上数据和文献[5]报道的基本一致,确定化合物1为大黄酸。

图4 从大黄根中分离得到化合物的HPLC图
化合物2:ESI-MSm/z:147[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:7.82(1H,d,J=16.0 Hz,H-7),6.44(1H,d,J=16.0 Hz,H-8),7.58(2H,m,H-2,H-6),7.42(3H,m,H-3,H-4,H-5)。以上数据和文献[8]报道的基本一致,确定化合物2为反式桂皮酸。
化合物3:ESI-MSm/z:269[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:4.71(2H,s,-CH2-OH),7.32(1H,d,J=8.0 Hz,H-7),7.78(1H,d,J=6.0 Hz,H-5),7.73(1H,dd,J=8.0,6.0 Hz,H-6),7.82(1H,s,H-4),7.37(1H,s,H-2)。以上数据和文献[5]报道的基本一致,确定化合物3为芦荟大黄素。
化合物4:ESI-MSm/z:269[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:2.42(3H,s,-CH3),6.59(1H,d,J=2.0 Hz,H-2),7.26(1H,d,J=2.0 Hz,H-4),7.07(1H,d,J=2.0 Hz,H-6),7.52(1H,d,J=2.0 Hz,H-5)。以上数据和文献[5]报道的基本一致,确定化合物4为大黄素。
化合物5:ESI-MSm/z:253[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:2.45(3H,s,-CH3),7.12(1H,s,H-2),7.63(1H,s,H-4),7.31(1H,d,J=8.0 Hz,H-7),7.64(1H,dd,J=8.0,8.0 Hz,H-6),7.80(1H,d,J=8.0 Hz,H-5)。以上数据和文献[5]报道的基本一致,确定化合物5为大黄酚。
化合物6:ESI-MSm/z:283[M-H]-;1H-NMR(DMSO-d6,400 MHz)δ:2.45(3H,s,-CH3),3.92(3H,s,-OCH3),6.71(1H,d,J=2.4 Hz,H-7),7.12(1H,s,H-2),7.31(1H,d,J=2.4 Hz,H-5),7.64(1H,s,H-4),7.80(1H,d,J=8.0 Hz,H-5)。以上数据和文献[9]报道的基本一致,确定化合物6为大黄素甲醚。
4 小结
本研究应用pH区带逆流色谱技术分离出大黄根中酸性较强的化合物(反式桂皮酸、大黄酸、芦荟大黄素和大黄素);对于酸性较弱的化合物(大黄酚和大黄素甲醚),通过制备HPLC进行了分离。从而实现了pH区带逆流色谱与制备HPLC的结合,建立了一种快速、高效制备分离大黄根中化学成分的方法。这种结合技术同样适合其他类化合物的分离与制备。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2015:23-24.
[2] 高亮亮.唐古特大黄、药用大黄和掌叶大黄的化学成分和生物活性研究[D].北京:北京协和医学院,2012.
[3] 罗培,徐象珍,谭正怀.大黄游离蒽醌致泻作用机制研究[J].中药药理与临床,2013,29(3):88-90.
[4] 范妙璇,赵海誉,王一涛.中药大黄现代药理学研究与中西医结合的应用[J].中国医药指南,2009,7(8):41-43.
[5] Tong S Q,Yan J H.Large-scale separation of hydroxyanthraquinones fromRheumpalmatumL.by pH-zone-refining counter-current chromatography[J].J Chromatogr A,2007,1176(1):163-168.
[6] Ito Y.Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].J Chromatogr A,2005,1065(2):145-168.
[7] 吴秋霞,孙常磊,王晓,等.高速逆流色谱分离制备大黄化学成分[J].山东科学,2015,28(1):1-6.
[8] 张修朋,秦辉,杨芳,等.黄素馨化学成分及其抗氧化活性[J].中国中药杂志,2014,39(11):2029-2033.
[9] Guo S Y,Feng B,Zhu R N,et al.Preparative isolation of three anthraquinones fromRumexjaponicusby high-speed counter-current chromatography[J].Molecules,2011,16(2):1201-1210.
SeparationandPurificationofAnthraquinonesfromRootofRheumpalmatumL.bypH-Zone-refiningCounter-currentChromatographyandPreparativeHPLC
SUN Changlei1,2,WANGZhaoping1,SUNZhaolin1,GENGYanling2*,LIJia1,YANGPeng3
(1.CollegeofPharmacy,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;2.ShandongAnalysisandTestCenter,Jinan250014,China;3.SanfengBiologicalEngineeringTechnologyCo.Ltd.,Jinan250014,China)
Objective:To separate and purify the compounds from the root ofRheumpalmatumL. by pH-zone-refining counter-current chromatography and preparative HPLC.Methods:The solvent system used in this separation was petroleum-ether-ethyl acetate-methanol-water (1∶1∶1∶1). 10 mmol·L-1TFA was added to the upper phase as stationary phase and 20 mmol·L-1NaOH was added to the lower phase as mobile phase. The revolution speed is 850 r·min-1and the flow rate is 2 mL·min-1. The effluent was continuously monitored by a UV monitor at 254 nm. The make-up fluid was further separated by preparative HPLC.Results: From 750 mg extract ofRh.palmatumL. root, 85.8 mg cinnamic acid (2) and three anthraquinones 34.9 mg rhein (1), 52.5 mg aloe-emodin (3) and 50.4 mg emodin (4) were obtained in a single run. And 215.4 mg of chrysophanol and 26.8 mg of physcion were obtained by the preparative HPLC. The purities of these compounds are 95.46%, 97.28%, 94.75%, 95.02%, 98.84% and 98.12% analyzed by HPLC.Conclusion:The compounds ofRh.palmatumL. root as weakly acidic compounds could be separated by pH-zone-refining counter-current chromatography. When combined with the preparative HPLC, an efficient method has been established for the separation of these compounds.
pH-Zone-refining counter-current chromatography; preparative HPLC;RheumpalmatumL.; compounds
2015-07-07)
山东省科技发展计划项目(2014GZX219003)
*
耿岩玲,副研究员,硕士,研究方向:天然产物研究与开发;Tel:(0531)82605319,E-mail:gengyanling@126.com
10.13313/j.issn.1673-4890.2016.5.003

