共轭亚油酸对C2C12肌细胞生脂和生肌分化的影响
齐仁立 王 琪 王 敬 杨飞云 刘作华 黄金秀
(重庆市畜牧科学院,农业部养猪科学重点实验室,养猪科学重庆市市级重点试验室,荣昌402460)
共轭亚油酸对C2C12肌细胞生脂和生肌分化的影响
齐仁立王琪*王敬杨飞云刘作华黄金秀**
(重庆市畜牧科学院,农业部养猪科学重点实验室,养猪科学重庆市市级重点试验室,荣昌402460)
本研究分析了共轭亚油酸(CLA)对C2C12肌细胞生脂转分化和生肌分化的影响。分别培养并诱导C2C12鼠源肌细胞生脂转分化和正常的生肌分化,同时分别使用终浓度为50 μmol/L的c9,t11-CLA和t10,c12-CLA处理细胞,并设对照组,取生脂转分化第10天和生肌分化第8天的细胞用于实时定量PCR检测,观察c9,t11-CLA和t10,c12-CLA对C2C12肌细胞不同分化的影响。结果表明:1)与对照组相比,c9,t11-CLA促进了C2C12肌细胞的生脂转分化,显著增加了细胞内甘油三酯(TG)含量(P<0.05),显著上调了细胞内脂肪酸合成酶(FAS)、CCAAT增强子结合蛋白α(C/EBPα)、过氧化物酶体增殖剂激活受体γ(PPARγ)和脂肪酸结合蛋白4(FABP4)基因的表达水平(P<0.05);与对照组相比,t10,c12-CLA则抑制了C2C12肌细胞的生脂转分化,显著减少了细胞内TG含量(P<0.05),显著下调了细胞内C/EBPα、PPARγ和FABP4基因的表达水平(P<0.05)。免疫印迹杂交结果显示FAS和FABP4的蛋白质表达水平也发生了与基因表达相一致的变化。2)与对照组相比,t10,c12-CLA抑制了C2C12肌细胞的生肌分化,显著减少了细胞内肌管数/细胞数(P<0.05),显著下调了细胞内肌细胞生成素(MYOG)和成肌分化抗原(MYOD)基因的表达水平(P<0.05);与对照组相比,c9,t11-CLA则显著上调了细胞内MYOG基因的表达水平(P<0.05),对C2C12肌细胞的生肌分化有一定程度的促进作用。免疫印迹杂交结果显示MYOG和MYOD的蛋白质表达水平也发生了与基因表达相一致的变化。以上结果表明,CLA对动物骨骼肌细胞的正常生肌分化和生脂转分化都具有重要的调节作用。
共轭亚油酸;C2C12肌细胞;生脂;生肌;分化
由于哺乳动物的肌肉细胞和脂肪细胞源于共同的多能间充质干细胞,生肌细胞在特定条件下可以转分化为脂肪细胞或脂肪细胞样细胞,而脂肪细胞也可以转分化为肌肉细胞[1-3]。生脂转分化的肌细胞会失去生肌能力并获得脂肪细胞的特性,细胞内大量产生和沉积脂肪,表达脂肪细胞特异性基因及其编码蛋白。
共轭亚油酸(conjugated linoleic acid,CLA)是一类含有共轭双键的亚油酸异构体,具有复杂的生理作用,包括促生长、抗肿瘤、抗氧化和抗肥胖等[4-6]。CLA的抗肥胖作用包括抑制脂肪细胞分化、减少细胞内脂肪生成和沉积、诱导脂肪细胞凋亡等[7]。c9,t11-CLA和t10,c12-CLA是2种主要的CLA异构体,通常情况下二者的生理作用有很大差异。t10,c12-CLA对脂肪细胞的抗脂肪生成作用较为强烈,而c9,t11-CLA的作用则较弱[8-9]。有报道认为c9,t11-CLA能够改善脂肪细胞对胰岛素的敏感性,增加动物肌内脂肪的生成和沉积[10-11]。此外,CLA对于动物肌肉的生长和发育也有一定影响[12]。肌细胞的生脂转分化是与正常的脂肪细胞生脂分化或肌细胞生肌分化不同的分子事件,但目前关于CLA对肌细胞生脂转分化的影响还不清楚。
本研究培养了C2C12肌细胞系并分别诱导其生脂和生肌分化,在此基础上分别使用c9,t11-CLA和t10,c12-CLA处理细胞,研究2种CLA异构体对C2C12肌细胞生脂转分化以及正常生肌分化的影响。相关研究结果将会有助于我们更好地理解动物肌肉与脂肪之间转化的机理。
1 材料与方法
1.1试验材料
C2C12鼠源肌细胞系购自于中科院上海细胞库;DMEM培养基、DMEM-F12培养基、胎牛血清和马血清均购自于Life公司;c9,t11-CLA、t10,c12-CLA、油红O染料和吉姆萨染料均购自于Sigma-Aldrich公司;RNAiso Plus RNA试剂盒、cDNA合成试剂盒和SYBR Premix Ex TaqTMⅡ荧光定量PCR试剂盒均购自于TaKaRa公司;免疫荧光染色和免疫印迹杂交(Western blotting)试验用脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)、脂肪酸合成酶(fatty acid synthetase,FAS)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的一抗和二抗均购自于CST公司,肌细胞生成素(myogenin,MYOG)和成肌分化抗原(myogenic differentiation antigen,MYOD)的抗体购自于Santa Cruz公司。
1.2试验方法
1.2.1细胞培养与诱导分化
复苏冻存的C2C12肌细胞,接种于DMEM-F12培养基(含10%胎牛血清)中培养。待细胞密度达到90%以上时传代,传代后的细胞接种于6孔板用于不同目的的诱导分化。正常生肌分化的细胞使用DMEM培养基(含2%马血清)培养8~10 d。生脂转分化的细胞使用DMEM-F12培养基(含10%胎牛血清)培养,待细胞密度达到70%时在培养基中加入生脂诱导物[1 μmol/L地塞米松、5 μg/mL胰岛素和0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)]培养2 d,更换为只含有胰岛素的培养基再培养2 d,更换为正常培养基继续培养4~6 d[2,11]。生脂转分化的细胞和正常生肌分化的细胞在开始诱导分化的同时分别加入c9,t11-CLA和t10,c12-CLA(终浓度为50 μmol/L),每个处理3个重复,并设对照组。
1.2.2油红O染色和吉姆萨染色
油红O染色用于观察C2C12肌细胞内脂肪生成情况。取生脂转分化一定时间的细胞,弃掉培养基并用磷酸缓冲盐(phosphate buffer saline,PBS)漂洗3次,然后用4%多聚甲醛固定15 min。细胞固定后,用PBS漂洗3次,然后用油红O染色液在37 ℃条件下染色30 min。染色后的细胞用60%的异丙醇溶液迅速漂洗1次,再用PBS漂洗3次,倒置显微镜下拍照观察。拍照后用100%异丙醇提取细胞内的油红O,用紫外分光光度计在540 nm下读取吸光度,用于计算细胞内甘油三脂(TG)的含量。
吉姆萨染色用于观察C2C12肌细胞的生肌分化状态。取生肌分化一定时间的细胞,弃掉培养基并用PBS漂洗3次,然后用4%多聚甲醛固定15 min。细胞固定后,用PBS漂洗3次,然后用吉姆萨染色液在室温条件下染色2 min。染色后的细胞用去离子水漂洗3次,倒置显微镜下观察拍照,并统计典型的多核细胞(肌管)数量,计算肌管数/细胞数。
1.2.3RNA提取和实时定量PCR
取生脂转分化第10天和生肌分化第8天的细胞用于RNA提取和实时定量PCR检测。使用RNAiso Plus RNA试剂盒提取细胞中的总RNA,核酸定量仪检测RNA的浓度,1%琼脂糖凝胶电泳检测RNA完整性。使用反转录试剂盒将总RNA反转录为cDNA。使用Step One实时定量PCR系统(ABI公司)检测相关基因的表达水平,GAPDH为内参基因,2-△△CT法计算基因的相对表达量。实时定量PCR的反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火35 s,循环次数40次。PCR引物由生工生物工程(上海)有限公司设计合成,序列见表1。
1.2.4免疫荧光染色
使用免疫荧光染色法检测生脂转分化细胞中FABP4基因的表达情况和生肌分化细胞中MYOG基因的表达情况。取相应的细胞爬片放置于35 mm细胞培养皿中,PBS漂洗3次;4%的多聚甲醛溶液固定细胞30 min,PBS漂洗3次;再用0.2% Triton X-100通透细胞10 min,PBS漂洗3次;用5%牛血清白蛋白(bovine serum albumin,BSA)溶液封闭细胞30 min并用PBS漂洗5次;用相应的一抗(鼠源Anti-FABP4或者Anti-MYOG一抗)在4 ℃条件下孵育细胞过夜,然后用PBS漂洗3次;再用对应的二抗(辣根过氧化物酶标记羊抗鼠二抗)室温孵育2 h(避光);然后用4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole dihydrochloride,DAPI)溶液染细胞核5 min;最后用倒置荧光显微镜观察并照相。

表1 实时定量PCR引物
1.2.5免疫印迹杂交
使用RIPA蛋白裂解液(碧云天公司)提取不同处理的细胞内总蛋白。使用BCA蛋白浓度检测试剂盒(天根公司)检测样品总蛋白浓度。10%的十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行蛋白质分离(60 V,4 h),然后转印到0.22 μm聚偏氟乙烯(poly vinylidene fluoride,PVDF)膜(Millipore公司)上;转印完的PVDF膜用5%的脱脂牛奶溶液室温封闭2 h,然后使用相应的一抗(鼠源Anti-FAS、Anti-FABP4、Anti-MYOG和Anti-MYOD一抗)溶液4 ℃孵育过夜;Tris缓冲生理盐水和吐温20(tris-buffered saline and Tween 20,TBST)溶液漂洗干净后使用二抗(辣根过氧化物酶标记羊抗鼠二抗)溶液室温孵育1 h;最后用增强化学发光(enhanced chemiluminescence,ECL)试剂(Millipore公司)和自动发光曝光仪进行拍照分析。GAPDH作为内参抗体。
1.3数据统计分析
使用SPSS 19.0统计软件(IBM公司)进行数据统计和分析,组间差异采用单因素方差分析(one-way ANOVA)。P<0.05为差异显著。
2 结果与分析
2.1C2C12肌细胞的生脂和生肌分化
试验观察到生脂转分化的C2C12肌细胞逐渐变为圆形,细胞内出现大量脂滴并且逐渐融合为大脂滴;免疫荧光染色显示生脂转分化的细胞大量表达脂肪特异蛋白FABP4(图1)。上述结果说明C2C12肌细胞已经转分化为具有生脂能力的脂肪细胞(或脂肪细胞样细胞)。生肌分化的C2C12肌细胞有序排列并逐渐融合,形成多核细胞,并最终形成大量的肌管;免疫荧光染色显示生肌分化的细胞大量表达肌肉特异蛋白MYOG(图2)。

图1 生脂转分化的C2C12肌细胞(分化第10天)
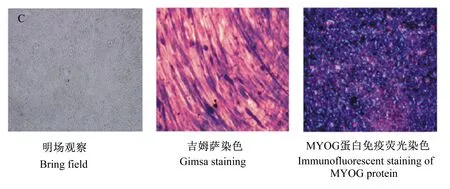
图2 生肌分化的C2C12肌细胞(分化第8天)
2.2CLA对C2C12肌细胞生脂转分化的影响
两种CLA异构体对C2C12肌细胞生脂转分化的影响见图3。与对照组相比,c9,t11-CLA促进了C2C12肌细胞的生脂转分化,增加了细胞内的脂肪沉积,c9,t11-CLA组细胞内TG含量增加了83%(P<0.05);c9,t11-CLA组细胞内的FAS、CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)、过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptors γ,PPARγ)、FABP4基因的表达水平均显著上调(P<0.05),而脂肪酸转运蛋白1(fatty acid transport protein 1,FATP1)基因的表达水平则无显著变化(P>0.05)。与对照组相比,t10,c12-CLA则抑制了C2C12肌细胞的生脂转分化,减少了细胞内的TG含量(P<0.05),显著下调了C/EBPα、PPARγ和FABP4基因的表达水平(P<0.05)。免疫印迹杂交结果显示FAS和FABP4的蛋白质表达水平也发生了与基因表达相一致的变化。
2.3CLA对C2C12肌细胞生肌分化的影响
2种CLA异构体对C2C12肌细胞生肌分化的影响见图4。与对照组相比,t10,c12-CLA抑制了C2C12肌细胞的生肌分化,显著减少了肌管数/细胞数(P<0.05),显著下调了MYOG和MYOD基因的表达水平(P<0.05)。与对照组相比,c9,t11-CLA则显著提高了细胞内MYOG基因的表达水平(P<0.05),对C2C12肌细胞的生肌分化有一定程度的促进作用。免疫印迹杂交结果显示MYOG和MYOD的蛋白质表达水平也发生了与基因表达相一致的变化。
3 讨 论
研究发现,生肌细胞在特定生理条件下或者药物刺激下可以转分化为脂肪细胞或者骨细胞[1-3]。反之,脂肪细胞和骨细胞也可以转分化为肌细胞。与正常的分化相比,肌细胞和脂肪细胞之间转分化的物质代谢基础和分子调控机制有很大差异,目前还未完全清楚。一方面,肌细胞的生脂转分化影响了机体的能量蓄积和利用,过度的脂肪蓄积还会导致炎症损伤、胰岛素抵抗和糖尿病等代谢症;肌细胞和脂肪细胞之间转化的失衡对于肌肉的正常生理功能也会造成影响。另一方面,肌细胞的适度生脂转分化对于提高动物肌内脂肪含量和提升动物的肉品质具有一定的帮助作用。
A.细胞油红O染色(100倍放大);B.细胞内TG含量;C.生脂基因的相对表达水平(1:脂肪酸合成酶;2:CCAAT增强子结合蛋白α;3:过氧化物酶体增殖剂激活受体γ;4:脂肪酸结合蛋白4;5:脂肪酸转运蛋白1);D.生脂因子蛋白质表达水平。数据柱形标注不同字母代表差异显著(P<0.05)。
A. Oil red O staining cells (100 times magnification); B. intracellular TG content; C. relative expression levels of adipogenic genes (1:FAS, 2:C/EBPα, 3:PPARγ, 4:FABP4, 5:FATP1); D. protein expression levels of adipogenic factors. Data columns with different letters mean significant difference (P<0.05).
图3CLA对C2C12肌细胞生脂转分化的影响
Fig.3Effects of conjugated linoleic acid on the adipogenic trans-differentiation of C2C12 myoblasts
体内和体外试验中CLA都表现出较强的抗脂肪生成能力,但不同CLA异构体的作用差异较大。研究认为t10,c12-CLA能够显著抑制人和动物的体脂沉积,抑制前体脂肪细胞分化为成熟脂肪细胞,诱导脂肪细胞凋亡,阻碍细胞内脂肪酸的酯化。与之相比,c9,t11-CLA的作用较为温和,对于脂肪细胞的影响较弱[7-8]。此外,研究报道认为CLA能够调控动物体内脂肪的异位沉积,一方面减少脂肪组织沉积,另一方面增加肌内脂肪含量[13]。与脂肪细胞上的研究结果相似,本试验结果表明t10,c12-CLA对于C2C12肌细胞的生脂转分化和脂肪沉积同样具有极强的抑制作用,而c9,t11-CLA则促进了C2C12肌细胞的生脂转分化和脂肪沉积。
关于CLA对动物肌肉生长和发育的研究也有不同的报道。有研究认为CLA有益于肌肉的生长和发育,可增加骨骼肌中线粒体的含量[14],减少肌细胞的炎症反应并可改善由于高脂饲粮摄入引起的小鼠肌肉损伤[15-17]。课题组前期在猪上的试验研究发现饲粮补充CLA混合物能够显著增加猪背最长肌肉块的重量[12]。但是,关于CLA对骨骼肌细胞的增殖和分化影响的报道甚少。有试验发现c9,t11-CLA能够促进C2C12肌细胞的增殖和生肌分化,而t10,c12-CLA则起到相反的作用[18]。Hommelberg等[19]也证实了t10,c12-CLA能抑制骨骼肌细胞的分化,并降低葡萄糖转运蛋白4(glucose transporter-4,GLUT4)基因的表达水平。本研究结果同样发现t10,c12-CLA抑制了C2C12肌细胞的生肌分化,但c9,t11-CLA则对生肌分化有轻微的促进作用。这些试验结果表明CLA对于肌细胞的影响是多方面的,既能保护肌细胞由于氧化应激和炎症反应带来的损伤,又对肌细胞的增殖分化具有调节作用。

A.细胞吉姆萨染色(200倍放大);B.细胞内肌管数分析;C.生肌基因的相对表达水平(1:肌细胞生成素;2:成肌分化抗原;3:成肌调节因子5);D.生肌因子蛋白质表达水平。数据柱形标注不同字母代表差异显著(P<0.05)。
A. Giemsa staining cells (200 times magnification); B. intracellular myotube number analysis; C. relative expression levels of myogenic genes (1:MYOG, 2:MYOD, 3:MYF5); D. protein expression levels of myogenic factors. Data columns with different letters mean significant difference (P<0.05).
图4CLA对C2C12肌细胞生肌分化的影响
Fig.4Effects of conjugated linoleic acid on the myogenic differentiation of C2C12 myoblasts
研究发现CLA的不同异构体表现出的生理作用差异较大,但是其具体原因还不完全清楚。推测可能是由于以下原因:1)不同CLA异构体的代谢速率和代谢产物不同。比较而言,t10,c12-CLA更易于参与β氧化,而c9,t11-CLA更易于在体内蓄积[20]。c9,t11-CLA主要代谢形成C20∶3共轭脂肪酸及其衍生物,而t10,c12-CLA可以代谢形成C16∶2和C18∶3共轭脂肪酸及其衍生物[21]。花生四烯酸、前列腺素和凝血恶烷等多不饱和脂肪酸的代谢产物又能发挥不同的生物学作用。2)不同CLA异构体及其代谢产物直接作为细胞信号分子激活或抑制的转录调控因子及信号传导通路不同。如t10,c12-CLA可以激活核转录因子κB,而c9,t11-CLA则不能激活该转录因子,进而对下游诸多功能基因的影响也会存在巨大的差异[19]。
总结本试验的结果,可以认为CLA对肌细胞和脂肪细胞之间的转化具有调控作用,但是不同CLA异构体的作用具有差异。这些结果对相关疾病的治疗以及提高动物产品品质等有一定的帮助。
4 结 论
c9,t11-CLA能够促进C2C12肌细胞的生脂转分化,而t10,c12-CLA则抑制了C2C12肌细胞的生脂转分化。此外,t10,c12-CLA抑制了C2C12肌细胞的生肌分化,而c9,t11-CLA则发挥了一定的促进作用。
[1]TEBOUL L,GAILLARD D,STACCINI L,et al.Thiazolidinediones and fatty acids convert myogenic cells into adipose-like cells[J].The Journal of Biological Chemistry,1995,270(47):28183-28187.
[2]ASAKURA A,RUDNICKI M A,KOMAKI M.Muscle satellite cells are multipotential stem cells that exhibit myogenic,osteogenic,and adipogenic differentiation[J].Differentiation,2001,68(4/5):245-253.
[3]SINGHN K,CHAE H S,HWANG I H,et al.Transdifferentiation of porcine satellite cells to adipoblasts with ciglitizone[J].Journal of Animal Science,2007,85(5):1126-1135.
[4]LARSEN T M,TOUBRO S,ASTRUP A.Efficacy and safety of dietary supplements containing CLA for the treatment of obesity evidence from animal and human studies[J].Journal of Lipid Research,2003,44(12):2234-2241.
[5]MACDONALD H B.Conjugated linoleic acid and disease prevention:a review of current knowledge[J].Journal of the American College of Nutrition,2000,19(Suppl.2):111S-118S.
[6]HUANG J X,QI R L,CHEN X L, et al.Improvement in the carcass traits and meat quality of growing-finishing Rongchang pigs by conjugated linoleic acid through alteredgene expression of muscle fiber types[J].Genetics and Molecular Research,2014,13(3): 7061-7069.
[7]CHUNG S,BROWN J M,SANDBERG M B,et al.Trans-10,cis-12 CLA increases adipocyte lipolysis and alters lipid droplet-associated proteins:role of mTOR and ERK signaling[J].Journal of Lipid Research,2005,46(5):885-895.
[8]DECLERCQ V,ZAHRADKA P,TAYLOR C G.Dietaryt10,c12-CLA but notc9,t11 CLA reduces adipocyte size in the absence of changes in the adipose renin-angiotensin system infa/faZucker rats[J].Lipids,2010,45(11):1025-1033.
[9]LIN Y G,KREEFT A,SCHUURBIERS J A E,et al.Different effects of conjugated linoleic acid isomers on lipoprotein lipase activity in 3T3-L1 adipocytes[J].The Journal of Nutritional Biochemistry,2001,12(3):183-189.
[10]PARK Y,STORKSON J M,ALBRIGHT K J,et al.Evidence that thetrans-10,cis-12 isomer of conjugated linoleic acid induces body composition changes in mice[J].Lipids,1999,34(3):235-241.
[11]ZHOU X,LI D F,YIN J D,et al.CLA differently regulates adipogenesis in stromal vascular cells from porcine subcutaneous adipose and skeletal muscle[J].Journal of Lipid Research,2007,48(8):1701-1709.
[12]QI R L,CHEN Y,PENG H,et al.Conjugated linoleic acid supplementation during late gestation and lactation of sows affects myofiber type in their litters[J].Livestock Science,2015,178:322-329.
[13]JIANG Z Y,ZHONG W J,ZHENG C T,et al.Conjugated linoleic acid differentially regulates fat deposition in backfat and longissimus muscle of finishing pigs[J].Journal of Animal Science,2010,88(5):1694-1705.
[14]VAUGHAN R A,GARCIA-SMITH R,BISOFFI M,et al.Conjugated linoleic acid or omega 3 fatty acids increase mitochondrial biosynthesis and metabolism in skeletal muscle cells[J].Lipids In Health And Disease,2012,11:142.
[15]LARSEN A E,CAMERON-SMITH D,CROWE T C.Conjugated linoleic acid suppresses myogenic gene expression in a model of human muscle cell inflammation[J].The Journal of Nutrition,2008,138(1):12-16.
[16]LARSEN A E,CROWE T C.Effects of conjugated linoleic acid on myogenic and inflammatory responses in a human primary muscle and tumor coculture model[J].Nutrition and Cancer,2009,61(5):687-695.
[17]LEE S R,JO E,KHAMOUI A V,et al.Resistance training and CLA/n-3 administration improve myofiber size and myogenic capacity in high fat diet-fed mice[J].The FASEB Journal,2013,27(7):1093.
[18]LEE J H,TACHIBANA H,MORINAGA Y,et al.Modulation of proliferation and differentiation of C2C12 skeletal muscle cells by fatty acids[J].Life Sciences,2009,84(13/14):415-420.
[19]HOMMELBERG P H H,PLAT J,REMELS A H V,et al.Trans-10,cis-12 conjugated linoleic acid inhibits skeletal muscle differentiation and GLUT4 expression independently from NF-κB activation[J].Molecular Nutrition & Food Research,2010,54(12):1763-1772.
[20]MARTIN J C,GRÉGOIRE S,SIESS M H,et al.Effects of conjugated linoleic acid isomers on lipid-metabolizing enzymes in male rats[J].Lipids,2000,35(1):91-98.
[21]SÉBÉDIO J L,ANGIONI E,CHARDIGNY J M,et al.The effect of conjugated linoleic acid isomers on fatty acid profiles of liver and adipose tissues and their conversion to isomers of 16∶2 and 18∶3 conjugated fatty acids in rats[J].Lipids,2001,36(6):575-582.
*Contributed equally
**Corresponding author, professor, E-mail: short00@163.com
(责任编辑李慧英)
Effects of Conjugated Linoleic Acid on Adipogenic and Myogenic Differentiation of C2C12 Myoblasts
QI RenliWANG Qi*WANG JingYANG FeiyunLIU ZuohuaHUANG Jinxiu**
( Chongqing Academy of Animal Sciences, Key Laboratory of Pig Industry Sciences, Ministry of Agriculture,Chongqing Key Laboratory of Pig Industry Sciences, Rongchang 402460, China)
This study was conducted to evaluated the effects of conjugated linoleic acid (CLA) on adipogenic trans-differentiation and myogenic differentiation of C2C12 myoblasts. Eitherc9,t11-CLA ort10,c12-CLA (the final concentration was 50 μmol/L) was used to treat the C2C12 mouse origin myoblasts which were cultured and induced adipogenic trans-differentiation and normal myogenic differentiation, respectively. And set the control group. The C2C12 myoblasts adipogenic trans-differentiation on the tenth day and myogenic differentiation on the eighth day were used for real-time quantitative PCR detection, and to observed the effects ofc9,t11-CLA andt10,c12-CLA on different differentiation of C2C12 myoblasts. The results showed as follows: 1) compared with the control group,c9,t11-CLA promoted adipogenic trans-differentiation of C2C12 myoblasts, significantly increased the intracellular triglycerides (TG) content and up-regulated intracellular genes expression levels of the fatty acid synthetase (FAS), CCAAT/enhancer binding protein α (C/EBPa), peroxisome proliferators-activated receptors γ (PPARγ) and fatty acid binding protein 4 (FABP4) (P<0.05). Compared with the control group,t10,c12-CLA inhibited the adipogenic trans-differentiation of C2C12 myoblasts, significantly decreased the intracellular TG content and down-regulated intracellular genes expression levels ofC/EBPa,PPARγandFABP4 (P<0.05). The results of Western blotting showed that protein expression levels of FAS and FABP4 also changed as same as the gene expression levels. 2) Compared with the control group,t10,c12-CLA inhibited the myogenic differentiation of C2C12 myoblasts, significantly decreased the intracellular myotube numbers/cell numbers and down-regulated intracellular genes expression levels of myogenin (MYOG) and myogenic differentiation antigen (MYOD) (P<0.05). Compared with the control group,c9,t11-CLA significantly down-regulated gene expression level ofMYOG(P<0.05) and promoted the myogenic differentiation of C2C12 myoblasts to some degree. The results of Western blotting showed that protein expression levels of MYOG and MYOD also changed as same as the gene expression levels. All these results suggest that CLA has important regulation on normal myogenic differentiation and adipogenesis trans-differentiation of skeletal muscle cells in animals.[ChineseJournalofAnimalNutrition, 2016, 28(9):2778-2785]
conjugated linoleic acid; C2C12 myoblasts; adipogenic; myogenic; differentiation
10.3969/j.issn.1006-267x.2016.09.016
2016-03-03
国家“973”计划项目(2012CB124702);国家自然科学基金(31302055);重庆市畜牧科学院基本科研业务(14441)
齐仁立(1982—),男,河南南阳人,助理研究员,博士,从事动物脂肪代谢相关研究。E-mail: qirenli1982@163.com
S811.2
A
1006-267X(2016)09-2778-08
*同等贡献作者
**通信作者:黄金秀,研究员,E-mail: short00@163.com

