诱导大豆抗胞囊线虫病和根腐病的生防细菌研究
闫继辰 王媛媛 朱晓峰 刘晓宇 陈立杰 段玉玺

摘要[目的]筛选诱导大豆抗胞囊线虫病和根腐病的生防细菌,挖掘高效的新型微生物代谢物种衣剂。[方法]从诱导抗性角度,以大豆胞囊线虫和大豆根腐病菌为靶标,通过对2 400株细菌发酵液包衣大豆种子处理、大田和温室盆栽试验,筛选诱导大豆抗胞囊线虫病和根腐病的生防细菌。[结果]获得Sneb152、Sneb572、Sneb877、Sneb1076、Sneb1401和Sneb1499共6株对病原物具有诱抗活性的生防细菌,6株生防细菌均可诱导大豆抗胞囊线虫病,抑制率超过74.98%,且能显著促进大豆生长,增产效果明显;菌株Sneb572和Sneb1076对大豆根腐病也有一定防效。[结论]优良诱抗生防菌株Sneb572和Sneb1076用于处理大豆种子前景广阔。
关键词 生防菌;大豆胞囊线虫病;根腐病;促生长;诱导抗性
中图分类号 S435.651 文献标识码 A 文章编号 0517-6611(2016)09-134-06
Abstract[Objective]To screen the biocontrol bacterium inducing soybean cyst nematode and soybean root rot diseases,and to find highefficient new microbial metabolites seed coatings.[Method]From the aspect of induced resistance,soybean cyst nematode and soybean root rot pathogen were used as the targets.A total of 2 400 coating soybean seeds were processed in bacteria fermentation liquid.[Result]After field and greenhouse screening,6 strains of biocontrol bacteria (Sneb152,Sneb572,Sneb877,Sneb1076, Sneb1499 and Sneb1401) were obtained,which had resistance activity to the pathogen.The 6 strains of biocontrol bacteria could all induce soybean cyst nematode with the inhibition rate being more than 74.98%.They could significantly promote the growth of soybean and had obvious yield increasing effect.Besides,strains Sneb572 and Sneb1076 also had certain control effects on soybean root rot.[Conclusion]Sneb572 and Sneb1076 have broad application prospects in soybean seed treatment.
Key words Biocontrol bacteria; Soybean cyst nematode; Root rot disease; Growth promotion; Induced resistance
连作大豆通常减产幅度在15%~30%[1],减产的原因是多种因素综合作用导致的,以土壤中的病原物威胁最大[2]。大豆根部病害首要的是大豆胞囊线虫病,其次是幼苗根腐病菌等。大豆胞囊线虫(Heterodera glycines)病是由大豆胞囊线虫(SCN)侵染引起的,是危害世界大豆生产的重要病害之一,具有分布广、传播途径多、休眠体存活时间长、危害严重等特点,是一种极难防治的土传病害,给大豆生产造成严重损失。目前,该病在许多大豆主产国如美国、巴西、阿根廷和中国等都有发生[3]。该病一般造成大豆减产10%~20%,严重时减产70%~90%甚至绝产[4]。由于大豆胞囊线虫病的危害,致使大豆根部受损,致根部次生菌侵染,加重根腐病的危害。大豆根腐病是严重影响大豆苗期生长的一种土传病害[5],由于其传播速度快、分布广泛、危害性大、毁灭性强、防治困难,已被列为大豆生产中毁灭性病害之一[6-7],严重影响了大豆的质量和产量,其造成的产量损失一般在 10%~30%,严重时达50%~60%甚至绝产[8]。大豆根腐病是由多种土壤习居菌复合侵染引起的,主要为尖孢镰孢菌(Fusarium oxysporum)、禾谷镰孢菌(F.graminearum)、燕麦镰孢菌(F.avenaoeum)、茄腐镰孢菌(F.solani)、半裸镰孢菌(F.semitectum)、终极腐霉菌(Pythium ultimum)和立枯丝核菌(Rhizoctonia solani)[9]。發病普遍的是由疫霉菌、镰刀菌引起的根腐病,少部分是由腐霉菌侵染及立枯丝核菌引起,重茬使大豆根腐病加重,致其防治更加困难[5,10]。近 20 年来,我国各省也分别对大豆根腐病进行了报道[9-12]。
种衣剂是20世纪60年代发展起来的一类农药,多采用杀菌剂或高毒杀线剂,用其包衣种子不但可防治病虫害、增加产量,而且可增加植物抗逆性、节约成本[13]。种衣剂在大豆上已得到广泛应用[12,14-15],对大豆根腐病和胞囊线虫有一定的防治效果,但部分种衣剂效果不理想。某些高毒的杀虫剂由于环境问题被逐渐禁用,从而促使人们必须找到替代高毒农药的新产品。生物种衣剂是一种新的选择,笔者选用真菌发酵液包衣处理大豆种子,挖掘高效的新型微生物代谢物种衣剂,探索了利用微生物代谢物和诱导抗性防控大豆根腐病的新途径。
1 材料与方法
1.1 材料
1.1.1 供试菌株。2 400株细菌由沈阳农业大学北方线虫研究所提供。
1.1.2 根腐病原菌。尖孢镰刀菌、茄腐镰刀菌均由沈阳农业大学北方线虫研究所提供。
1.1.3 供试品种,大豆品种:辽豆15,由辽宁省农业科学院大豆研究所提供。
1.1.4 种衣剂。商品种衣剂商品名为BFA,为中财盛世(北京)生物科技发展有限公司内蒙古莫旗分公司产品。其主要成分为生物体制剂“BFA”结合先进菌种。标准代号:Q/CHS03-2001。
1.2 方法
1.2.1 诱导大豆抗根部病害的生防细菌初筛试验。
1.2.1.1 材料准备。2 400株细菌在蛋白胨牛肉膏(NA)液体培养基中发酵5 d。筛选出的生防菌发酵液采用1∶70的种子量进行种子包衣处理,以不包衣为空白对照(CK),干燥后装袋并编号备用。
1.2.1.2 田间布置。
在辽宁省康平县进行试验,每个处理行长为5.00 m,行距为0.65 m,处理间隔为1.00 m。以不包衣为空白对照(CK)。试验田为连作大豆田,土壤为大豆胞囊线虫病和大豆根腐病田间自然发病土。
1.2.1.3 田间调查。
在大豆播种后35 d(大豆苗期),每个处理随机取5株苗。取样时先去掉表土(0~5 cm),将植株连根挖出,保持根系完整,先计数根上胞囊数量,然后放入取样袋中封存,写好标签带回实验室。测定项目:胞囊抑制率、大豆根腐病病情指数、根腐病防效。根腐病病级分级按0~5的6级分类法进行(表1)。
病情指数=(病情指数×该级指数)/(调查株数×最高病级)×100
根腐病防效=(对照病情指数-处理病情指数)/对照病情指数×100%
胞囊抑制率=(对照胞囊数-处理胞囊数)/对照胞囊数×100%
1.2.2 诱导大豆抗根部病害的生防细菌复筛试验。
1.2.2.1 材料准备。
初步筛得的细菌在NA液体培养基中发酵5 d。筛选出的生防菌发酵液采用1∶70的种子量进行种子包衣处理,BFA按照使用说明包衣大豆作为对照,干燥后装袋并编号备用。
1.2.2.2 田间布置。在辽宁省康平县进行5次重复试验,每个处理行长为5.00 m,行距为0.65 m,处理间隔为1.00 m。以不包衣为空白对照(CK),以商品种衣剂BFA为平行对照。试验田为连作大豆田,土壤为大豆胞囊线虫病和大豆根腐病田间自然发病土。
1.2.2.3 田间调查取样。
在大豆播种后35 d(大豆苗期),每个处理随机取5株苗。取样时先去掉表土(0~5 cm),将植株连根挖出,保持根系完整,先计数根上胞囊数量,然后放入取样袋中封存,写好标签带回实验室。测定项目:胞囊抑制率、大豆根腐病病情指数、根腐病防效、根长、苗高、根部鲜重、地上部鲜重和出苗率。同时于大豆成熟期,各處理随机选取5株大豆,测定其单株大豆株高、单株荚数、单株粒数和百粒重。
出苗率=出苗总数/播种种子总数×100%
1.2.3 生防细菌诱导大豆抗根部病害的室内验证试验。
1.2.3.1 发酵液包衣对大豆种子萌发的影响试验。
将试验所需的培养皿进行高压蒸汽灭菌,备用。每份取100粒大豆种子,使用直径为90 cm的培养皿,在其底部垫上大小合适的灭菌圆形滤纸,用无菌水湿润后,均匀放入经种衣剂包衣处理的种子,每皿放入20粒种子,每个处理5次重复。同时设空白对照。盖上培养皿盖,置于温度为(28±1)℃、相对湿度为85%的恒湿培养箱中培养。7 d后记录发芽率并测量芽长和根长,计算种子活力指数[16]。
发芽率=第7天发芽的种子数/供试种子数×100%
种子活力指数(VI)=(芽长+根长)×发芽率
1.2.3.2 生防细菌促进大豆生长试验。
采用室内盆栽处理,取无大豆胞囊线虫的土和细沙,165 ℃干热灭菌2 h,通风冷却2 d后,将土、沙按体积比2∶1的比例混合均匀,装入16 cm×16 cm黑色塑料钵中。用生防菌发酵液包衣大豆,待种子阴干后播种。每钵播种3粒包衣好的大豆种子,以无菌水为对照,5次重复。30 d后,将植株取出,保持根系完整。用流水将根部泥土洗净,并用滤纸吸干,测量单株大豆的株高、主根长、地上部分鲜重和地下部分鲜重。
1.2.3.3 生防细菌诱导大豆抗胞囊线虫试验。采用室内盆栽处理,取无大豆胞囊线虫的土和细沙,165 ℃干热灭菌2 h,通风冷却2 d后,将沙、土按体积比2∶1的比例混合均匀,装入16 cm×16 cm黑色塑料钵中。用生防菌发酵液包衣大豆,待种子阴干后播种。每钵播种3粒包衣好的大豆种子,以无菌水为对照,5次重复。待豆苗长至2片子叶时,每钵留苗1颗,接种2 000条大豆胞囊线虫2龄幼虫(J2)。30 d后,将植株取出,保持根系完整。用流水将根部泥土洗净,用滤纸吸干并计根内线虫数和线虫抑制率。同时将根系用流水清冲洗,滤纸吸干根表水分,称量根鲜重。采用次氯酸钠-酸性品红染色法进行根内线虫的染色,在体式显微镜下观察记录根内各虫态线虫数量。
线虫抑制率=(对照线虫数-处理线虫数)/对照线虫数×100%
1.2.3.4 生防细菌诱导大豆抗大豆根腐病试验。
用高粱米对镰孢菌分离菌株进行扩繁。将100 g高粱米置于500 mL三角瓶中,用水浸泡过夜后弃水,高压灭菌 1 h。选取PDA培养基上活化2~3 d的供试尖孢镰刀菌和茄腐镰菌菌丝尖端部分,用直径为8 mm的打孔器采集菌片,接种至上述高粱米表面,28 ℃培养7~10 d。待镰孢菌菌丝长满高粱米培养物后,将其粉碎成粉末状备用。盆栽致病性测定试验在 28 ℃恒温温室内进行,先将盆栽土于121 ℃湿热灭菌90 min,再按照2%质量比混合镰孢菌于高粱米粉末并置于已灭菌的0.5 L盆栽盆中,每盆播入5粒大豆。30 d时记录根腐病发病级别,计算病情指数[17]。
1.2.3.5 系统性诱导抗性试验。
参照裂根法[18]验证生防菌诱导大豆产生对大豆胞囊线虫病和大豆根腐病的系统抗性。大豆在室内生长到2叶期,将大豆根系按照垂直方向从中间分成两部分,并且分别标注诱导部分和应答部分,然后将两部分根分开放入新的营养钵中。在诱导部分接种5 mL生防菌发酵液或灭活生防菌发酵液,应答部分不接种。空白对照中,诱导部分接种无菌水。为了防止生防菌在两部分根中发生污染,每一个营养钵底部都用单独的托盘隔离放置。接种生防菌28 d后,在每株大豆的应答部分接种2 000条J2和大豆根腐病原菌1×105个/mL的孢子悬浮液。3 d后,取出应答部分根系,然后对根系进行染色,计数根系内侵染的J2数量和线虫抑制率;5 d后,取出应答部分根系,测定病情指数和防治效果。
1.3 数據处理 应用Excel和SPSS软件对数据进行处理和分析。
2 结果与分析
2.1 诱导大豆抗根部病害的生防细菌初筛试验结果
通过初次大田试验,从2 400株细菌中筛选出6株细菌,分别为Sneb152、Sneb572、Sneb877、Sneb1076、Sneb1401和Sneb1499(图1),该6株生防菌均能显著提高大豆抗胞囊线虫病(抑制率超过74.98%)和大豆根腐病(防效超过22.22%)。
2.2 诱导大豆抗根部病害的生防细菌复筛试验结果
2.2.1 大田促进生长试验结果。
通过三地大田复筛试验,苗期的调查结果(表1)显示,BFA促进植株增高的效果不及对照,与对照相比,生防细菌Sneb1401促进植株增高的效果最好,Sneb1076和Sneb572次之;BFA促进植株增高的效果与对照相当,与对照相比,生防细菌Sneb1401促进植株根系增长的效果最好,Sneb572、Sneb877和Sneb152次之;BFA促进地上部分鲜重增加的效果与对照相当,与对照相比,生防细菌Sneb877促进植株增高的效果最好,Sneb1076和Sneb1499次之;BFA促进根系鲜重增加的效果不及对照,与对照相比,生防细菌Sneb152促进根系鲜重增加的效果最好,Sneb1499、Sneb572和Sneb1401次之;BFA促进出苗的效果优于对照,与BFA相比,生防细菌Sneb877促进出苗的效果最好,Sneb1076、Sneb1499和Sneb572次之。综上,与对照和BFA相比,生防细菌Sneb1401促进植株增高、植株根系增长、地上部分鲜重增加、根系鲜重增加和出苗效果最显著,而Sneb877、Sneb1076、Sneb572、Sneb1499和Sneb152次之。
2.2.2 生防细菌诱导大豆抗胞囊线虫和根腐病的大田试验结果。
由表2可知,BFA在抑制胞囊作用方面的效果显著优于对照,与BFA相比,生防细菌Sneb572在抑制胞囊作用方面的效果最好,Sneb1076和Sneb877次之;BFA在抑制根腐病作用方面的效果不及对照,与BFA相比,生防细菌Sneb1401在抑制根腐病作用方面的效果最好,Sneb572、Sneb877和Sneb1076次之。综上,与对照和BFA相比,生防菌普遍具有显著促进植株出苗作用,生防细菌Sneb572在抗胞囊线虫病和根腐病原菌的作用方面具有最显著效果。生防细菌Sneb1076、Sneb877和Sneb1401在抗胞囊线虫病和根腐病原菌的作用方面同样具有显著效果。
2.2.3 生防细菌对大豆产量构成的影响。
通过对大田成熟期大豆的调查,结果(表3)表明,BFA促进植株增高的效果显著优于对照,与BFA相比,生防细菌Sneb152促进植株增高的效果最好,Sneb1401和Sneb1499次之;BFA促进单株豆荚数增长的效果显著优于对照在辽宁省康平县的试验田,与BFA相比,生防细菌Sneb1076促进单株豆荚数增长的效果最好,Sneb877和Sneb152次之;BFA促进单株豆粒数增长的效果显著优于对照在辽宁省康平县的试验田,与BFA相比,生防细菌Sneb877促进单株豆粒数增长的效果最好,Sneb1076次之;BFA促进百粒豆粒鲜重增加的效果与对照相当,与BFA相比,生防细菌Sneb1401促进单株豆粒数增长的效果最好,Sneb1076、Sneb1499、Sneb152和Sneb572次之。综上,与对照和BFA相比,在大豆成熟期生防细菌普遍促进植株增长效果显著,而生防细菌仅有Sneb152、Sneb1401和Sneb1499具有促进植株增长的作用。生防细菌Sneb1076在促进植株单株夹数和单株粒数增长、百粒重鲜重增加方面效果最显著,Sneb877、Sneb152、Sneb1401、Sneb1499和Sneb572次之。
2.3 生防细菌诱导大豆抗根部病害的室内试验验证结果
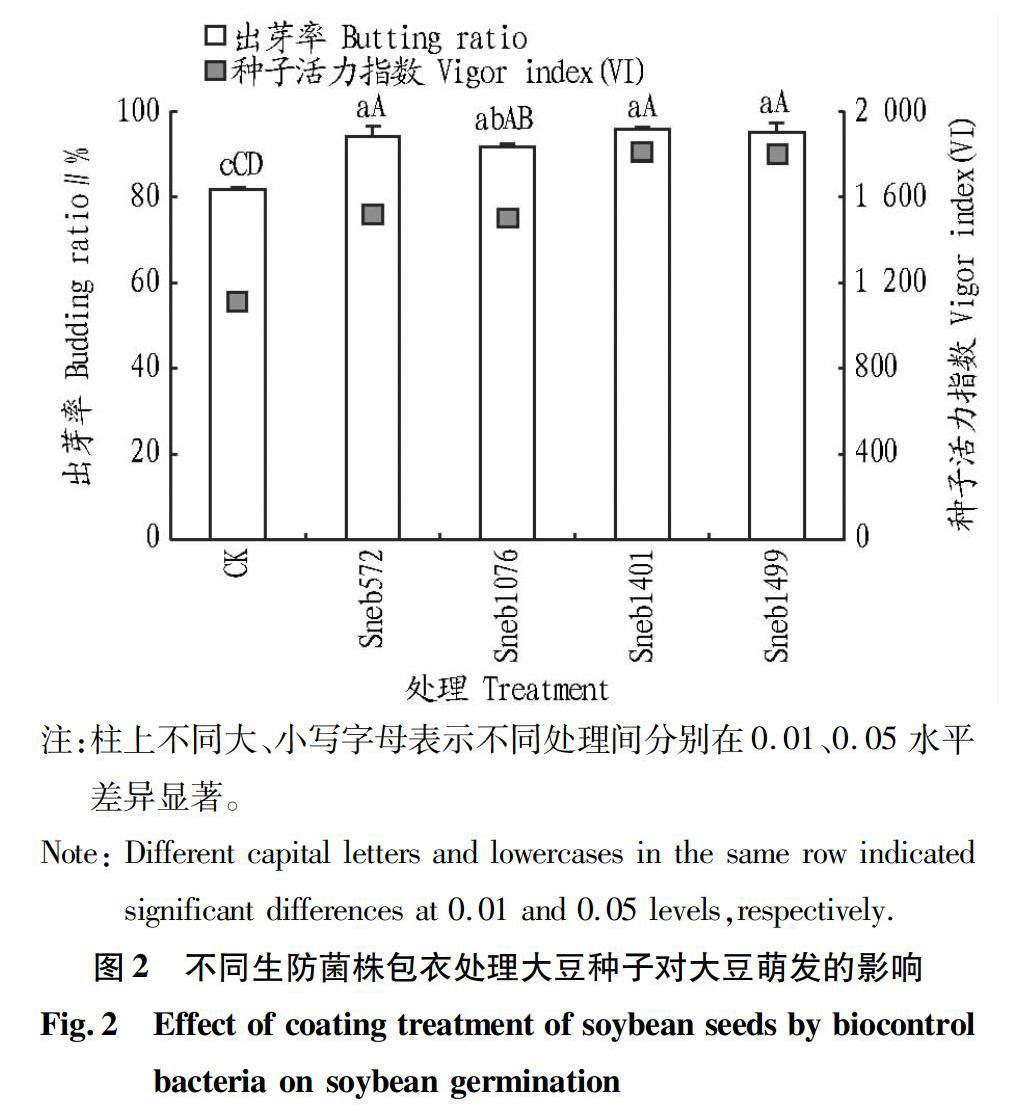
2.3.1 促进大豆种子萌发的试验结果。通过室内生防菌发酵液包衣大豆种子发芽试验,结果(图2)表明,与对照相比,Sneb572、Sneb1076、Sneb1401和Sneb1499都具有显著促进大豆种子发芽率和种子活力指数的作用。综上,与对照相比,生防细菌Sneb1401促进大豆种子发芽率和种子活力效果最显著,Sneb1499和Sneb572次之。
2.3.2 生防细菌促进大豆生长的试验结果。
通过室内盆栽试验,结果(表4)表明,与对照相比,4株生防菌均具有显著促进株高和根长增加的作用;在地上部分重方面和根重方面,与对照相比,Sneb1076和Sneb1499生防菌株都能显著促进植株鲜重增加。综上,与对照相比,生防细菌Sneb1499在促进植株增高、根系增长、地上部分鲜重增加和根系鲜重增加方面效果最显著,Sneb1401、Sneb1076和Sneb572次之。
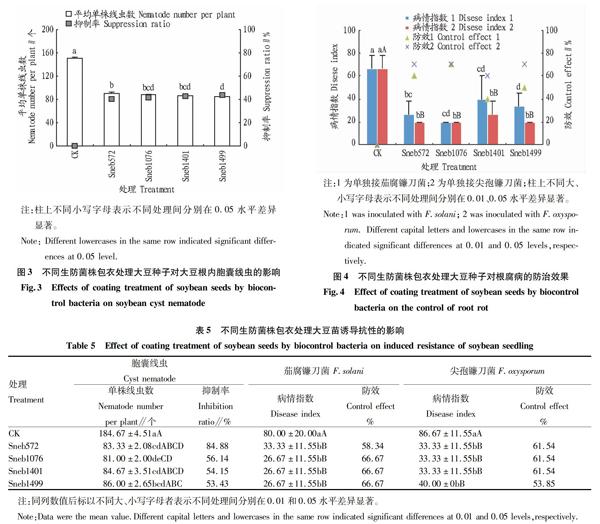
2.3.3 生防细菌诱导大豆抗胞囊线虫的试验结果。通过室内抗胞囊线虫病试验,结果(图3)表明,与对照相比,在抗胞囊线虫病方面4株生防细菌可显著促进大豆抗大豆胞囊线虫。Sneb1499促进大豆防效最高达43.71%。综上,与对照和菌剂相比,生防细菌Sneb1499抑制胞囊线虫作用效果最显著,Sneb1401和Sneb1076次之。
2.3.4 生防细菌诱导大豆抗大豆根腐病的试验结果。
通过室内抗根腐病试验,结果(图4)表明,与对照相比,在抗根腐病原菌尖孢镰刀菌和茄腐镰刀菌方面,4株生防菌都显著促进大豆抗病,其中
Sneb572和Sneb1076对茄腐镰刀菌和尖孢镰刀菌的防效高达70.00%。综上,与对照相比,生防菌皆对茄腐镰刀菌和尖孢镰刀菌有显著抗性。
2.3.5 系统性诱导抗性试验结果。
通过室内系统性诱导抗性试验,结果(表5)表明,应答根系与空白根系相比,生防细菌对线虫抑制率超过50.90%,其中Sneb572对线虫的抑制率高达84.88%;生防细菌对茄腐镰刀菌的防效超过58.34%。综上,与对照相比,生防细菌Sneb572诱导大豆抗胞囊线虫以及对茄腐镰刀菌和尖孢镰刀菌的防治效果最显著,Sneb1076、Sneb1401和Sneb1499次之。
3 结论与讨论
该研究从2 400株细菌中筛选出6株生防细菌Sneb152、Sneb572、Sneb877、Sneb1076、Sneb1401和Sneb1499,采用这6株菌处理大豆种子,均能显著提高大豆抗胞囊线虫病和大豆根腐病的抗性;经过第2年复筛试验,结果表明,与对照和BFA种衣剂相比,Sneb152、Sneb572、Sneb877、Sneb1076、Sneb1401和Sneb1499不仅能显著提高大豆抗胞囊线虫病和大豆根腐病的抗性,还具有促进根系增长、提高生物学产量的作用,并且在不同地区重复中均保持稳定效果;室内功能验证结果表明,Sneb572、Sneb1076、Sneb1401和Sneb1499均具有显著诱导大豆抗茄腐镰刀菌、尖孢镰刀菌和大豆胞囊线虫效果,可促进大豆发芽和增長,并且通过裂根试验证明筛选出的生防菌对大豆胞囊线虫和大豆根腐病具有系统性诱导抗性。综合上述结果,获得的Sneb572和Sneb1076生防菌株发酵液具有显著地系统诱导大豆抗胞囊线虫病和大豆根腐病、显著地促进大豆生长和增产等作用,这与黄姗姗等[19]的研究结果相似,该2株优良诱抗生防菌株对大豆种子处理具有良好的应用前景,对其鉴定、复配和发酵条件及机制还有待于进一步研究。
参考文献
[1]鞠会艳,韩丽梅,王树起.邻苯二甲酸和丙二酸对大豆根腐病病原菌的化感作用[J].吉林农业科学,2002,27(5):38-40.
[2]何志鸿,刘忠堂,许艳丽,等.大豆重迎茬减产的原因及农艺对策研究:重迎茬大豆减产的主要原因[J].黑龙江农业科学,2003(2):1-4.
[3]段玉玺.植物线虫学[M].北京:科学出版社,2011.
[4]陈立杰,王媛媛,朱晓峰,等.大豆胞囊线虫病生物防治研究进展[J].沈阳农业大学学报,2011,42(4):393-398.
[5]李春杰,许艳丽,赵志权,等.木霉颗粒剂对大豆根腐病的防治作用[J].大豆科学,2009,28(3):499-506.
[6]张淑珍,王维峰,西芳,等.大豆抗疫霉根腐病机制的研究进展[J].大豆科学,2001,20(4):290-294.
[7]张红骥,XUE A G,ZHANG J X,等.尖镰孢菌和禾谷镰孢菌引起的大豆根腐病生物防治研究[J].大豆科学,2011,30(1):113-118.
[8]徐佳,王士强,张兴梅.生物制剂拌种对盆栽大豆根腐病防效及土壤酶的影响[J].黑龙江八一农垦大学学报,2008,20(5):21-24.
[9]马汇泉,辛惠普.大豆根腐病病原菌种类鉴定及其生态学研究[J].黑龙江八一农垦大学学报,1998(2):115-121.
[10]袁军,孙福在,田宏先,等.防治马铃薯环腐病有益内生细菌的分离和筛选[J].微生物学报,2002,42(3):270-274.
[11]沈崇尧,苏彦纯.中国大豆疫霉菌的发现及初步研究[J].植物病理学报,1991,21(3):298.
[12]张全党,郭庆元,白丽艳,等.防治大豆根腐病的种子处理用药筛选[J].新疆农业科学,2009,46(1):106-111.
[13]何迎春,高必达.立枯丝核菌的生物防治[J].中国生物防治,2001,16(1):31-34.
[14]陈立杰,万传浩,朱晓峰,等.Snea253生物种衣剂防治大豆胞囊线虫的研究[J].大豆科学,2011,30(1):459-462.
[15]杜春梅,李海燕,李晓明,等.HND1生物种衣剂防治大豆胞囊线虫药效研究[J].大豆科学,2009,28(6):1126-1129.
[16]ABDULBAKI A A,ANDERSON J D.Vigour determination in soybean seed by multiple criteria[J].Crop Sci,1973,13:630-633.
[17]魏巍,许艳丽,张思佳,等.大豆根腐病原镰孢菌种群多样性DGGE 分析及其致病性研究[J].植物病理学报,2013,43(5):500-508.
[18]MARTINUZ A,SCHOUTEN A,SIKORA R A.Postinfection development of Meloidogyne incognita on tomato treated with the endophytes Fusarium oxysporum strain Fol62 and Rhizobium etli strain G12[J].BioControl,2013,58:95-104.
[19]黄姗姗,段玉玺,陈立杰,等.诱导大豆抗逆细菌的筛选及分子鉴定[J].大豆科学,2011,30(2):205-210.

