氢气和一氧化碳还原氧化铜实验反应机理的探究
唐辉 封享华 李朝碧 武小玲
摘要:探究实验分别测定了氢气和一氧化碳还原氧化铜实验中氧化亚铜的产率。结果表明:氧化亚铜的产率随加热过程呈现先增大后减小的趋势。氧化亚铜的存在对实验观察和判断有一定的影响。实验时使用带防风罩的酒精灯进行加热,并适当加大通气速率及减少氧化铜的用量,有利于缩短反应时间。
关键词:氢气;一氧化碳;还原氧化铜;反应机理;实验探究
文章编号:1005–6629(2016)9–0057–03 中图分类号:G633.8 文献标识码:B
1 问题的提出
中学化学教学中涉及木炭还原氧化铜[1]、氢气还原氧化铜[2]、一氧化碳还原氧化铜[3]等多个氧化铜还原实验。关于这些实验的反应机理,大学《无机化学》教科书及有关化学手册中难以见到相关的介绍,在包括期刊在内的其他中文文献中,氢气还原氧化铜、一氧化碳还原氧化铜的反应机理也未见报道,对于木炭还原氧化铜实验的反应机理,钱亚兵[4]等人在2002年发表的文献中有(1)~(2)式的表达,但没有给出确切的产物中存在Cu2O的实验佐证,更无中间产物Cu2O变化规律的研究报道。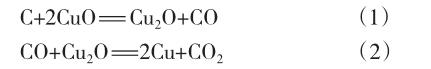
由于中学教师对该实验的反应机理认知来源不足,导致教师和学生仅按中学教科书中的反应方程式去理解这些反应,认为实验中Cu(Ⅱ)的还原产物仅为单质铜。该实验的反应究竟是一步完成?还是存在着(1)~(2)式类似的反应机理?中间产物Cu2O的产率有多高?产率随加热过程有何变化规律?Cu2O的存在是否会影响实验现象的观察和判断?这些问题在一些中学教师的认知中,可能是不够清晰的。
上述问题解决的关键是要有恰当的Cu2O的分析方法,课题组在提出了新的Cu2O分析方法的基础上,通过测定反应过程中Cu2O的产率,着重研究了氢气、一氧化碳还原氧化铜实验中,中间产物Cu2O的产率随加热时间的变化规律,并试图全面阐明上述问题。这些问题的解决有助于中学教师了解这些反应的反应机理,认清反应的基本规律,澄清错误的认识,有助于实验教学的成功。
2 实验部分
2.1 仪器与试剂
仪器:电子天平、酒精灯、硬质试管、铁架台、恒温鼓风干燥箱、50mL烧杯
试剂:CuO、Zn粒、草酸、浓硫酸、浓盐酸、EDTA、氢氧化钠、KSCN(以上均为分析纯试剂)、蒸馏水
2.2 实验方法
CO、H2的制取方法:CO采用浓硫酸在加热条件下催化草酸分解并用氢氧化钠除去二氧化碳来制备;H2的制取则采用Zn粒与稀硫酸反应。通过调节反应条件使CO与H2的生成的气流速率相近,并与通常的演示实验的状况相当。
CO、H2还原CuO的实验方法:称取m(CuO)(约1.2g)于一支洁净干燥的硬质试管(试管质量先称量)底部,均匀铺平,固定在铁架台上,将CO或H2通入试管底部,一段时间后点燃酒精灯加热,并开始计时,一定时间后停止加热,冷却,称量产物及试管的总质量,计算产物总质量m(产物),产物用于测定Cu2O的含量。实验重复三次,实验数据为三次实验的平均值。
2.3 Cu2O含量的分析方法
将冷却后的产物从试管中倒于滤纸上,用玻璃棒混合均匀,取m(样品)(0.2g)于50mL烧杯,加入7.0mL 6.0 mol·L-1盐酸,搅拌溶解,直到无黑色固体(约需4~5min)。将溶液过滤至另一50mL烧杯中,然后用10mL 0.6 mol·L-1盐酸少量多次洗涤滤纸。快速搅拌下,在滤液中缓慢加入浓度为0.15 mol·L-1 EDTA,浓度为1.4 mol·L-1 NaOH的混合溶液25.0mL,再用1.4 mol·L-1 NaOH溶液调节到EDTA沉淀消失,并保证pH处于3.5~5.5范围内(pH试纸检验),加入1.0mL 5.0 mol·L-1 KSCN溶液。此时,溶液中出现白色沉淀,陈化24小时。过滤,用蒸馏水洗涤,将滤纸置于103~105℃恒温箱中干燥2小时,称量,得到m(CuSCN)(过滤前,滤纸先称量)。

3 实验结果与讨论
3.1 CO、H2还原CuO实验产物中Cu2O的测定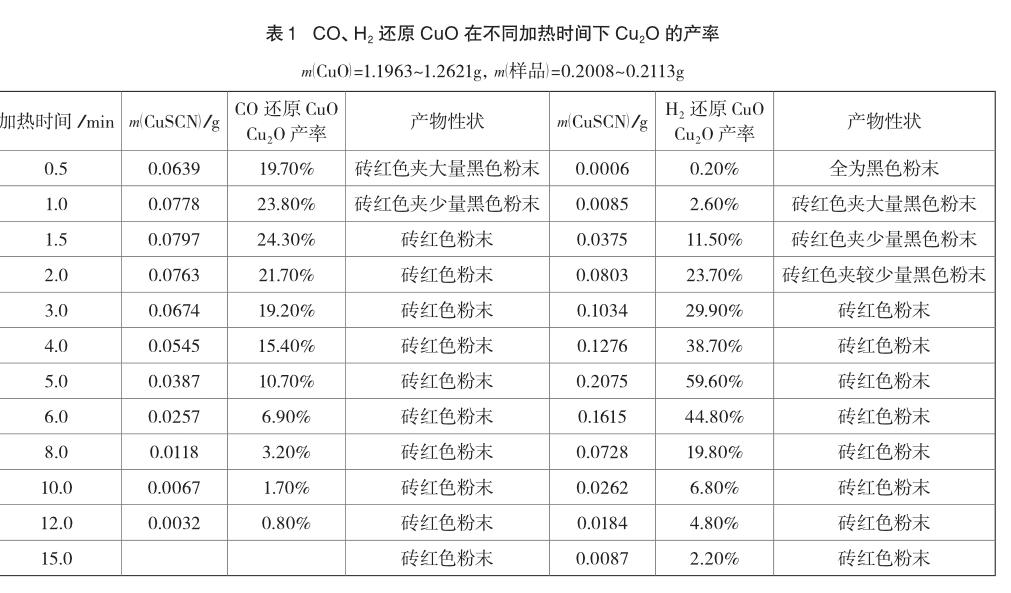
表1的数据表明,无论是CO还是H2还原CuO的实验,产物中均检测到了Cu2O的存在,且Cu2O的产率都呈现先增大后减小的趋势;加热过程中,物质的性状也呈现相似的规律,随加热时间的增加黑色粉末含量逐渐减少,直到看不到黑色,以后看到的都是砖红色粉末,但砖红色逐渐变得更明亮(Cu2O含量越来越少,单质Cu越来越多)。因此,Cu2O在产物中的存在,会在一定程度上对实验现象的观察和判断有影响。
两个实验也有差异,CO还原CuO实验中黑色消失时的加热时间是1.5min,Cu2O产率最大(24.3%)时的加热时间为1.5min,而H2还原CuO的实验中,黑色消失的加热时间是3.0min,Cu2O产率最大(59.6%)时的加热时间为5.0min。因此,在相近的实验条件下,CO还原CuO的速率明显高于H2还原CuO的速率。
3.2 CO、H2还原CuO的反应机理
鉴于中文文献中难于查到这两个反应的反应机理,现推测如下:
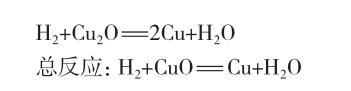
3.3 热力学分析
为能更深入了解实验反应过程的特征,利用文献[5]数据对反应的焓变及吉布斯自由能变进行了计算,结果列于表2。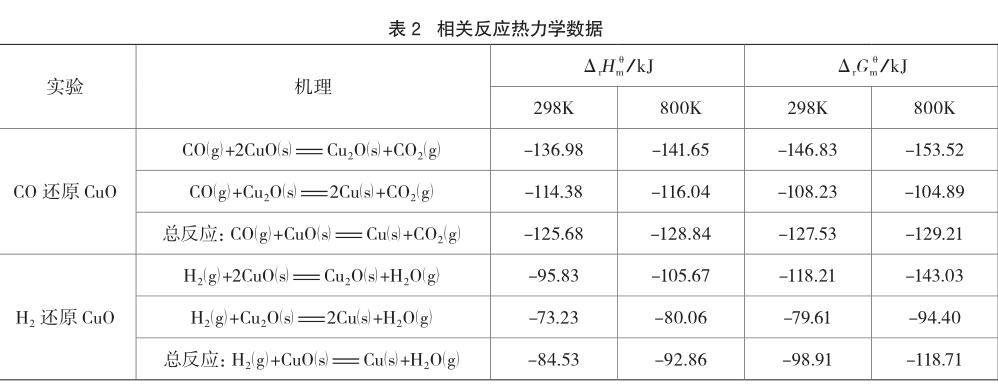
数据表明,无论温度为298K还是800K时,氢气、一氧化碳还原氧化铜的各步骤及总反应均为放热放应。这意味着加热过程中反应体系的温度,应当高于加热器供热所能达到的温度。实验采用的普通酒精灯,其供热温度在573~773K,因此,表2中列出了800K时的热力学数据。
表2表明,CO还原CuO的放热量要高于H2还原CuO反应的放热量,这可能就是CO还原CuO比H2还原CuO速率要快的原因之一。因为放热越多,体系升温快,体系温度越高,反应速率越大。
表2还表明,CO还原CuO及H2还原CuO的各步骤及总反应的ΔrGmθ均为负值,说明这些反应都能自发进行,但前者的自发趋势比后者大。
4 教学建议
中学教学中,通常要求演示实验在5min内完成,且现象明显。从表1数据可知,5min时虽然可以看到黑色氧化铜的消失,但产物亮度不够,不便于学生准确判断。原因是此时产物并非只有单质铜,还有含量不低的Cu2O,加热5min时,H2还原CuO实验产物中Cu2O产率甚至高达59.6%,显然将这时的产物认定为单质Cu,有误导学生之嫌。而要将Cu2O绝大部分转化,则需要10余分钟的加热时间。
建议改用带防风罩的酒精灯(供热温度可达673~873K),以提高反应温度,加快固-气传质速率,提高反应速率,缩短反应时间,特别是H2还原CuO的实验,更应如此。此外,加大气体的通气速率及减少CuO用量也是缩短反应时间的措施。
参考文献:
[1]周公平.关于单质碳还原氧化铜的反应产物探讨[J].化学教学,2003,(7):18.
[2]熊言林,魏先文.土红色物质是氧化亚铜还是铜[J].化学教育,2006,(2):59~60.
[3]钱胜.一氧化碳还原氧化铜实验中几个不容忽视的问题[J].实验教学与仪器,2008,24(4):30~31.
[4]钱亚兵,鲍正荣.炭还原氧化铜实验研究[J].实验教学与仪器,2003,(9):15~17.
[5] J. A. Dean主编.魏俊发等译.兰氏化学手册[M].北京:科学出版社,2003.

