不同感染性指标在血流感染早期诊断中的应用价值
潘亚萍, 沈继录, 徐元宏, 王中新
·论著·
不同感染性指标在血流感染早期诊断中的应用价值
潘亚萍, 沈继录, 徐元宏, 王中新
目的 探讨降钙素原(PCT)、C反应蛋白(CRP)、白细胞(WBC)计数、中性粒细胞(NEU)绝对数、NEU比率在早期辅助诊断血流感染(BSI)中的临床应用价值。方法 回顾性分析2013年1月-2015年5月安徽医科大学第一附属医院的住院患者中送检血培养并同时检测PCT、CRP和血常规的患者1 835例。按血培养结果将患者分为血培养阳性组和血培养阴性组,比较两组中PCT、CRP、WBC、NEU和NEU比率的水平变化,并绘制受试者工作特征(ROC)曲线评价各指标的诊断价值。结果 血培养阳性患者189例,革兰阴性菌109株(57.7%),革兰阳性菌60株(31.7%),念珠菌20株(10.6%)。血培养阳性组PCT、CRP、WBC、NEU和NUE比率的中位数分别为6.04 ng/mL、90.00 mg/L、10.00×109/L、8.22×109/ L、0.857 1;血培养阴性组PCT、CRP、WBC、NEU和NUE比率的中位数分别为0.31 ng/mL、38.52 mg/L、8.96×109/ L、6.33×109/L、0.769 8。血培养阳性组的各项结果均明显高于血培养阴性组(P<0.05)。革兰阴性细菌组患者血清PCT 9.12(1.57~32.38)ng/mL明显高于革兰阳性细菌组2.62(1.00~12.90) ng/mL(P<0.05)和念珠菌组1.40(0.67~12.88) ng/mL(P<0.05),且肠杆菌科细菌患者的PCT值11.45(2.20~37.58) ng/mL明显高于不发酵糖革兰阴性杆菌1.93(0.70~13.37)ng/mL(P<0.05)。细菌组的CRP 92.17(45.11~151.08) mg/L明显高于念珠菌组56.65(23.32~101.05)mg/L(P<0.05),且革兰阳性细菌组CRP 93.93(46.67,147.86) mg/L高于念珠菌组(P<0.05)。以血培养阳性为阳性标准绘制ROC曲线,PCT、CRP、WBC、NEU和NUE比率的AUC分别为0.793、0.662、0.555、0.591和0.665(P<0.05),对BSI均有一定诊断价值,其中PCT、CRP 和NUE比率的诊断价值最大。结论 PCT、CRP可作为BSI的辅助诊断指标,PCT水平对BSI的早期诊断价值更高。早期检测PCT和CRP可以及时帮助BSI患者判断病原菌类型,及早治疗改善预后。
血流感染; 降钙素原; C反应蛋白; 中性粒细胞比率
血流感染(bloodstream infections,BSI)是一种严重的全身感染性疾病,病原微生物在循环血液中呈一过性、间歇性或持续性存在,对机体所有脏器造成严重损害,甚至导致死亡。
近年,BSI的患病率有所增加。全球每年约发生20万例BSI,病死率为20 %~50 %,是最严重的感染性疾病之一[1]。及时正确的治疗可以有效降低BSI患者的病死率[2-3]。血培养是诊断BSI的金标准,但其阳性率低,耗时长,往往延误最佳的诊治时机。因此,寻找早期且特异性高的感染性标志物对于早期辅助诊断和及时治疗BSI 至关重要。本文主要探讨降钙素原(PCT)、C 反应蛋白(CRP)、白细胞计数(WBC)、中性粒细胞计数(neutrophil, NEU)、NEU比率在早期辅助诊断BSI中的应用价值。
1 材料与方法
1.1 材料
1.1.1 材料来源 回顾性分析2013年1月-2015年5月安徽医科大学第一附属医院的住院患者中疑似BSI送检血培养并同时检测PCT、CRP和血常规的患者1 835例(剔除同一患者反复送检)。按血培养结果分为血培养阳性组和血培养阴性组,亚组分析中将血培养阳性组又分为革兰阳性细菌组、革兰阴性细菌组和念珠菌组。每组记录采血当日PCT、CRP、WBC、NEU、NEU比率检测结果。
1.1.2 仪器 BACTEC FX全自动血培养仪(BD,USA);VITEK 2-Compact全自动微生物分析系统(BioMerieux, France); Microscan Walk Away 96全自动微生物鉴定系统(SIEMENS,German);mini-VIDAS全自动免疫荧光分析仪(BioMerieux,France);Modular DPP(Roche, Switzerland);XE2100全自动血液分析仪(Sysmex, Japan)。
1.1.3 试剂 PCT 采用VIDAS-BRAHMAS PCT检测试剂盒(BioMerieux, France);CRP采用德赛诊断CRP试剂盒(Diasys, German)。血清PCT采用免疫荧光法检测,检测范围0.05~200.00 ng/ mL,<0.05 ng/mL按0.05计算,>200.00 ng/mL按200计算,PCT>0.5 ng/mL为阳性标准。CRP检测采用免疫比浊法,以CRP>5.0 mg/L为阳性标准。NEU比率>0.70为阳性标准。
1.2 方法
1.2.1 数据分析 采用SPSS 20.0软件进行数据分析,非正态分布计量资料以中位数和四分位间距[ M ( P25,P75) ]表示,两组间比较采用Mann-Whitney检验,3组及3组以上比较采用Kruskal-Wallis 检验。使用受试者工作特征(receiver operating characteristic, ROC)曲线曲线下面积(area under curve, AUC)评价各指标的诊断性能,以P<0.05为差异有统计学意义。
2 结果
2.1 基本情况
2013年1月-2015年5月共收集1 835例住院患者疑似BSI送检血培养并同时检测PCT、CRP和血常规者。1 835例患者中男1 008例,女827例,年龄中位数为44岁。血培养阳性189例(单瓶凝固酶阴性葡萄球菌血培养阳性报警视为阴性),检出率为10.3 %。其中革兰阴性菌共109株,占57.7 %;革兰阳性菌60株,占31.7 %,念珠菌20例,占10.6 %。血培养阳性和阴性两组间,年龄和性别差异无统计学意义(P>0.05)。不同科室之间血培养阳性检出率有一定差异,其中ICU血培养阳性率最高(20.6 %),儿科阳性率最低(4.7 %),见表1。

表11 835例患者的临床分布特征Table1 Demographic and clinical characteristics of 1 835 patients in the study
2.2 BSI对不同检测结果的影响
血培养阳性患者的PCT、CRP、WBC、NEU和NUE 比率的结果均高于阴性患者(P<0.05)。血培养阳性中革兰阴性菌组、革兰阳性菌组和念珠菌组患者的PCT中位数分别为9.12、2.62和1.40 ng/mL,革兰阴性菌组患者的PCT结果明显高于革兰阳性菌组(Z=-2.034,P<0.05)和念珠菌组(Z=-1.907,P<0.05)。3组患者CRP的中位数分别为90.00、93.93和56.65 mg/ L,细菌组CRP结果明显高于念珠菌组(Z=-2.157,P<0.05),且革兰阳性菌组CRP结果明显高于念珠菌组(Z=-2.289,P<0.05)。3组患者的WBC、NEU、NEU 比率结果比较差异均无统计学意义(P>0.05)。见表2。表3显示不同病原菌感染者的PCT、CRP检测结果有一定差异,其中肠杆菌科细菌感染患者的PCT为11.45(2.20~37.58) ng/ mL明显高于不发酵糖革兰阴性杆菌1.93(0.70~13.37) ng/mL,P<0.05。
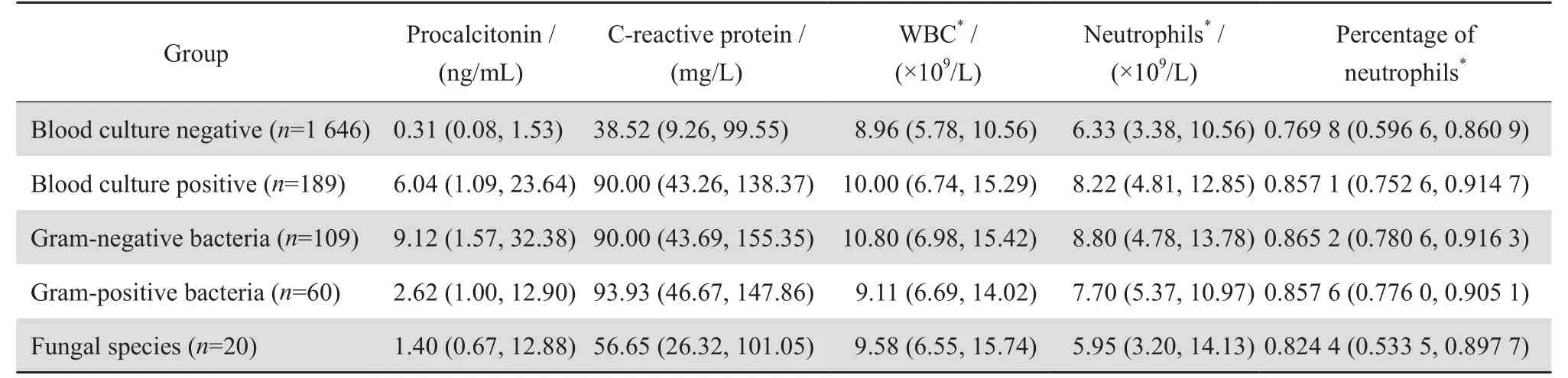
表2 血培养结果与PCT、CRP、WBC、NEU、NEU 比率检测结果Table2 Results of blood culture in terms of procalcitonin, C-reactive protein, WBC, neutrophils count and percentage
2.3 不同检测结果在BSI早期诊断中的价值
以血培养阳性为阳性标准绘制ROC曲线(图1),PCT、CRP、WBC、NEU和NUE 比率的AUC分别为0.793(95 % CI:0.758~0.827)、0.662(95 % CI: 0.617~0.706)、0.555(95 % CI:0.508~0.601)、0.591(95 % CI: 0.545~0.637)和0.665(95 % CI: 0.608~0.702),对BSI均有一定诊断价值(P <0.05),其中PCT的诊断性能最佳,其次为CRP和NUE 比率。表4中不同检测结果的临床诊断界值与血培养结果的分布显示,单项检测中PCT诊断BSI的特异度最高(59.8 %),CRP的灵敏度最高(89.9 %),PCT、CRP和NEU比率三者联合检测明显提高了诊断BSI的特异度(71.6 %)和准确度(71.1 %)。ROC曲线上,PCT在临界值为1.06 ng/mL时灵敏度(77.0 %)和特异度(70.1 %)均较高,CRP在临界值为58.95 mg/L时的灵敏度(66.1 %)和特异度(61.5 %)均较高。在特异度分别为50 %、75 %、90 %时PCT和CRP的截断(cut-off)值和灵敏度见表5,在相同的特异度时PCT的灵敏度均高于CRP。

表3 189例血培养阳性标本细菌种类分布及PCT和CRP的检测结果Table3 Levels of procalcitonin and C-reactive protein in terms of pathogens from 189 cases of bloodstream infection

图1 PCT、CRP、WBC、NEU 和 NUE 比率的ROC曲线Figure 1 ROC curve of procalcitonin (PCT), C-reactive protein (CRP), white blood cell count (WBC), neutrophils count (NEU) and percentage of NEU for predicting bloodstream infection
3 讨论
BSI是导致危重患者死亡的主要原因之一。近年来,随着广谱抗生素和激素的广泛使用,BSI的患病率逐年增高。对于BSI患者而言,早期识别病原菌的种类,针对性地进行足量的抗感染治疗,对预后至关重要。血培养虽为诊断BSI的金标准,但其检测周期长、阳性率低,往往延误了最佳的治疗时机,血培养的假阳性率为0.6 %~6.0 %[4],且多为定植菌的污染,很难去判定。因此,需要一些快速提示BSI及感染病原菌类型的实验室指标,为早期准确抗感染治疗提供可靠的依据。近年研究显示,多种炎性因子如PCT、CRP、IL-6、内毒素等对评价感染的诊断和预后有一定的临床意义[5-7]。

表4 PCT、CRP 和 NEU 比率的临床截断值Table4 Clinical cut-off values of procalcitonin, C-reactive protein and neutrophils percentage
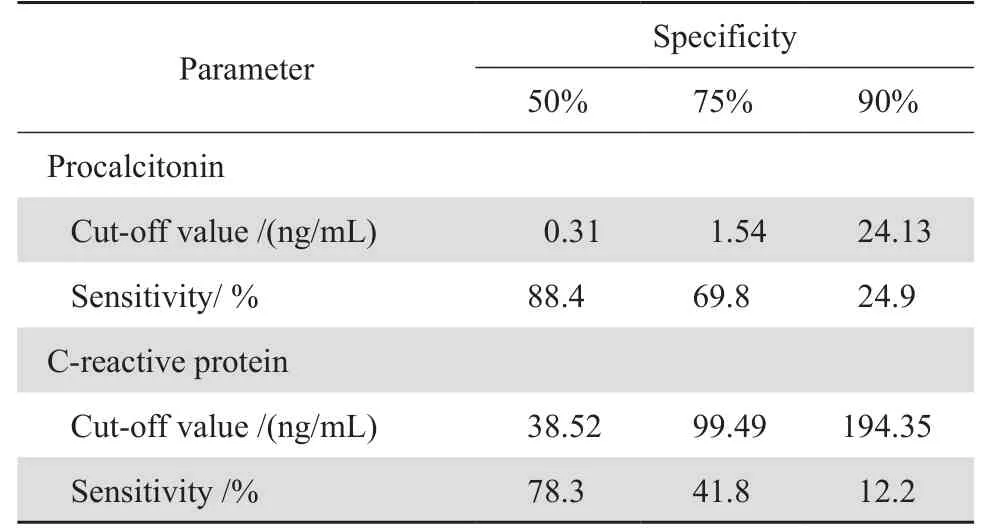
表5 不同特异度时PCT和CRP的敏感度和临床截断值Table5 Sensitivity and cut-off values for procalcitonin and C-reactive protein in differentiating bloodstream infection from blood culture negative cases at fixed specificity
PCT由甲状腺C细胞分泌产生,是无激素活性的降钙素前体。在正常生理状态下,健康人血液中浓度非常低(0.05 ng/mL),但在炎性刺激特别是细菌感染/脓毒症状态下,机体各个组织、多种细胞类型均可产生PCT并释放入血液循环系统[8]。因此PCT成为感染早期辅助诊断的重要检测指标。CRP为肝细胞合成的急性时相反应蛋白,是评价感染的常用炎性指标。WBC、NEU、NEU比率均为血常规检测项目,是炎症性疾病辅助诊断的最传统指标,但用于诊断感染时特异性很低。
本研究的1 835例住院患者中,血培养阳性患者189例,阳性率仅为10.3 %,血培养的阳性率受采血时间、采血量等多种因素影响,采血前使用抗生素、感染菌为苛养菌或生长缓慢的病原菌[9]也会造成血培养的结果为假阴性。不同科室间血培养阳性检出率有一定差异,其中ICU血培养阳性率最高为20.6 %,这一结果同LODES等[10](20 %)和FITTING等[11](23 %)的研究结果相一致。这可能是因为ICU患者病情严重,免疫力低下,更易受到病原菌的侵袭而导致BSI的发生。血培养阳性患者中,革兰阴性菌和阳性菌所占比例分别为57.7 %、31.7 %;念珠菌占10.6 %,提示念珠菌已成为BSI的重要致病菌之一,实验室应加强对BSI中念珠菌的检测和鉴定。
不同病原菌感染的发病过程、病死率不同,革兰阴性菌导致的脓毒症较革兰阳性菌脓毒症的病理过程更加严重、病情进展更加迅速,病死率更高[12],念珠菌感染的治疗难度和病死率均比细菌高[13]。因此,尽早确定BSI病原菌的类型及时准确治疗,对于改善预后极为重要。本研究中,革兰阴性菌感染患者PCT结果明显高于阳性菌和念珠菌,这一结果同国外学者的研究结果相一致[14-16]。这可能与革兰阴性菌产生内毒素有关,DANDONA等[17]研究提示内毒素在诱导相应细胞分泌PCT 过程中起重要作用。革兰阴性菌中,肠杆菌科细菌感染患者的PCT值明显高于不发酵糖革兰阴性杆菌的PCT值, LELI等[14]也得出了同样的结果。本研究还发现细菌组的CRP值明显高于念珠菌组,特别是革兰阳性菌组患者CRP值明显高于念珠菌组患者,且差异均具有统计学意义。这给临床通过快速检查确定病原菌种类提供了参考。
本研究中,PCT、CRP、WBC、NEU及NEU 比率水平在血培养阳性患者中明显升高。ROC曲线分析结果显示,血常规的3个参数(WBC、NEU、NEU比率)诊断价值均较低,AUC均为0.5~0.7,其中NEU比率的AUC最高,达0.665,其灵敏度、特异度均为3个参数中最高。CRP的ROC曲线AUC为0.662,诊断BSI的灵敏度和特异度分别为89.9 %和18.7 %,虽然其缺乏一定的特异性,但它是感染和炎症非常灵敏的指标[18]。PCT诊断BSI具有较高的灵敏度(85.2 %)和特异度(59.8 %),其AUC值为0.793,对于早期诊断BSI有很大的价值,这一结果同JEONG等[15](AUC=0.76)和KIM等[19](AUC=0.77)研究结果基本一致。研究显示,PCT诊断BSI的价值优于CRP和NEU 比率,这一结果和国内外研究结果一致。
本研究同时发现,14.8 %血培养阳性患者PCT值并未升高,这可能是因为药物因素的影响,有文献报道高浓度的头孢他啶可减少大鼠PCT的产生[20],牛磺酸可影响婴幼儿体外循环下PCT的释放[21];也可能是污染菌造成血培养假阳性或者患者处于感染早期,PCT水平尚未发生变化。血培养阴性患者中仍有40.2 % PCT>0.5 ng/mL,这主要是因为PCT水平受系统性炎性反应综合征、创伤、神经内分泌肿瘤等多种因素的影响[22]。因此,当PCT和血培养结果不一致时,还应结合临床症状及其他检测进行判定。
综上所述,PCT、CRP、WBC、NEU和NUE比率对BSI均有一定的辅助诊断价值,其中血清PCT水平对BSI的早期辅助诊断价值更高。早期检测PCT和CRP可以及时帮助BSI患者判断病原菌类型,在血培养结果出来前指导经验性使用抗生素,提高BSI患者早期治疗的有效性,降低其病死率,更能减少临床抗生素的不合理使用。
[1]周庭银, 倪语星, 王明贵, 等. 血流感染实验诊断与临床诊治[M]. 2版.上海:上海科学技术出版社, 2014: 3-4.
[2]LEVY MM, DELLINGER RP, Townsend SR, et al. The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis[J]. Intensive Care Med, 2010, 36(2): 222-231.
[3]DELLINGER RP, LEVY MM, CARLET JM, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008[J]. Intensive Care Med,2008, 34(1): 17-60.
[4]HALL KK, LYMAN JA. Updated review of blood culture contamination [J]. Clin Microbiol Rev, 2006, 19(4): 788-802.
[5]LOONEN AJ, DE JAGER CP, TOSSERAMS J, et al. Biomarkers and molecular analysis to improve bloodstream infection diagnostics in an emergency care unit[J]. PLoS One,2014, 9(1): e87315.
[6]VINCENT JL, DONADELLO K, SCHMIT X. Biomarkers in the critically ill patient: C-reactive protein[J]. Crit Care Clin,2011, 27(2): 241-251.
[7]SCHUETZ P, ALBRICH W, MUELLER B. Procalcitonin for diagnosis of infection and guide to antibiotic decisions:past,present and future[J]. BMC Med, 2011, 9(107): 1-9.
[8]ASSICOT M, GENDREL D, CARSIN H, et al. High serum procalcitonin concentrations in patients with sepsis and infection[J]. Lancet, 1993, 341(8844): 515-518.
[9]GRACE CJ, LIEBERMAN J, PIERCE K, et al. Usefulness of blood culture for hospitalized patients who are receiving antibiotic therapy[J]. Clin Infect Dis, 2001, 32(11): 1651-1655.
[10]LODES U, BOHMEIER B, LIPPERT H, et al. PCR-based rapid sepsis diagnosis effectively guides clinical treatment in patients with new onset of SIRS[J]. Langenbecks Arch Surg,2012, 397(3): 447-455.
[11]FITTING C, PARLATO M, ADIB-CONQUY M, et al. DNAemia detection by multiplex PCR and biomarkers for infection in systemic inflammatory response syndrome patients[J]. PLoS One, 2012, 7(6): e38916.
[12]PHUA J, KOAY ES, LEE KH. Lactate, proealeitonin,and amino-terminal pro-B-type natriuretie peptide versus cytokine measurements and clinical severity scores for prognostication in septic shock[J]. Shock, 2008, 29(3): 328-333.
[13]ALMIRANTE B, RODRFGUEZ D, PARK BJ, et al. Epidemiology and predictors of mortality in cases of Candida bloodstream infection:results from population-based surveillance, barcelona, Spain, from 2002 to 2003[J]. J Clin Microbiol, 2005, 43(4): 1829-1835.
[14]LELI C, FERRANTI M, MORETTI A, et al. Procalcitonin levels in gram-positive, gram-negative, and fungal bloodstream infections[J]. Dis Markers, 2015: 701480.
[15]JEONG S, PARK Y, CHO Y, et al. Diagnostic utilities ofprocalcitonin and C-reactive protein for the prediction of bacteremia determined by blood culture[J]. Clinica Chimica Acta, 2012, 413(21-22): 1731-1736.
[16]KIM KE, HAN JY. Evaluation of the clinical performance of an automated procalcitonin assay for the quantitative detection of bloodstream infection[J]. Korean J Lab Med, 2010, 30(2):153-159.
[17]DANDONA P, NIX D, WILSON MF, et al. Procaleitonin increase after endotoxin injection in normal subjects[J]. J Clin Endocrinol Metab, 1994, 79(6): 1605-1608.
[18]SCHUTTRUMPF S, BINDER L, HAGEMANN T, et al. Utility of procalcitonin concentration in the evaluation of patients with malignant diseases and elevated C-reactive protein plasma concentrations[J]. Clin Infect Dis, 2006, 43(4): 468-473.
[19]KIM MH, LIM G, KANG SY, et al. Utility of procalcitonin as an early diagnostic marker of bacteremia in patients with acute fever[J]. Yonsei Med J, 2011, 52(2): 276-281.
[20]张智洁, 刘勇, 孙继梅, 等. 头孢他啶影响大鼠降钙素原产生机制的初步研究[J]. 中华医院感染学杂志, 2007, 17(2):129-133.
[21]马超, 赵春玉, 王元祥, 等. 牛磺酸对婴幼儿体外循环术下血浆降钙素原的影响及意义[J]. 中国当代医药, 2010, 17(24):9-13.
[22]MEISNER M. Update on procalcitonin measurements[J]. Ann Lab Med, 2014, 34(4): 263-273.
Utility of procalcitonin, C-reactive protein, white blood cell count, neutrophils count and percentage in early diagnosis of bloodstream infection
PAN Yaping, SHEN Jilu, XU Yuanhong, WANG Zhongxin.
(Department of Laboratory Medicine, the First Affiliated Hospital of Anhui Medical University, Hefei 230032, China)
Objective To evaluate the utility of procalcitonin (PCT), C-reactive protein (CRP), white blood cell count (WBC),neutrophils (NEU) and percentage of neutrophils in predicting the bloodstream infections (BSIs) which were confrmed by blood culture (BC). Methods A retrospective analysis was made on 1 835 inpatients with concurrent laboratory test results of PCT, CRP,routine blood tests and blood culture from January 2013 to May 2015 in the First Affliated Hospital of Anhui Medical University. The patients were assigned to positive blood culture group or negative blood culture group. PCT, CRP, WBC, NEU and NEU percentage levels were compared between the two groups. Each parameter was evaluated for its performance in predicting bacterial BSI in terms of receiver operating characteristic (ROC) curve. Results A total of 189 patients showed positive BCs, including 109(57.7%) gram-negative cases, 60 (31.7%) gram-positive cases and 20 (10.6%) fungal cases. In BC-positive group, the median value of PCT, CRP, WBC, NEU and NEU percentage was 6.04 ng/mL, 90.00 mg/L, 10.00×109/L, 8.22×109/L and 0.857 1,respectively. in BC-negative group, the median value of PCT,CRP, WBC, NEU and NEU percentage was 0.31 ng/mL, 38.52 mg/L, 8.96×109/L, 6.33×109/L and 0.769 8, respectively. ThePCT, CRP, WBC, NEU and NEU percentage of BC-positive group were all signifcantly higher than those of BC-negative group (P<0.05). The PCT concentration of gram-negative cases [9.12 (1.57-32.38) ng/mL] was signifcantly higher than that of gram-positive cases [2.62 (1.00-12.90) ng/mL, P<0.05] and fungal cases [1.40 (0.67-12.88) ng/mL, P<0.05]. The PCT value for predicting Enterobacteriaceae bacteria [11.45 (2.20- 37.58) ng/mL] was significantly higher than that for non-fermentative bacteria [1.93(0.70-13.37) ng/mL, P<0.05]. The CRP concentration of bacteria group [92.17 (45.11-151.08) mg/L] was signifcantly higher than that of fungal [56.65 (23.32-101.05)] mg/L, P<0.05]. The area under the receiver operating characteristic curves (ROC-AUCs) of PCT, CRP, WBC, NEU and NEU percentage for discriminating BC positive from BC negative cases were 0.793, 0.662, 0.555, 0.591 and 0.665, respectively. PCT, CRP and NEU percentage were relatively more useful in early diagnosis of bloodstream infection. Conclusions Both PCT and CRP can be used to support the diagnosis of BSI. PCT level has shown higher utility in early diagnosis of BSI. Early assay of PCT and CRP is helpful for BSI patients to know the pathogen, receive timely treatment and improve outcome.
bloodstream infection; procalcitonin; C-reactive protein; percentage of neutrophils
R515.3
A
1009-7708 ( 2016) 05-0571-07
10.16718/j.1009-7708.2016.05.008
2015-09-22
2015-11-11
国家自然科学基金项目(81171618)。
安徽医科大学第一附属医院检验科,合肥 230032。
潘亚萍(1990—),女,硕士研究生,主要从事临床细菌学检验、细菌耐药性监测和耐药机制研究。
沈继录,E-mail:shenjilu@126.com。

