DBU/甘油/CO2反应过程及动力学
张猛,鲁厚芳,梁斌,刘颖颖,郝晓刚
(1四川大学化学工程学院,四川 成都 610065;2四川大学新能源与低碳技术研究院,四川 成都 610065;3太原理工大学化学工程系,山西 太原 030024)
DBU/甘油/CO2反应过程及动力学
张猛1,2,鲁厚芳1,2,梁斌1,2,刘颖颖2,郝晓刚3
(1四川大学化学工程学院,四川 成都 610065;2四川大学新能源与低碳技术研究院,四川 成都 610065;3太原理工大学化学工程系,山西 太原 030024)
1,8-二氮朵双环[5.4.0]十一碳-7-烯(DBU)-甘油溶液作为一种新型溶剂,具有低热容、高沸点等优点,目前被广泛研究应用于化学合成和产物分离等。本文考察了不同摩尔比的DBU-甘油溶液吸收CO2效果,测定了不同摩尔比的DBU-甘油溶液吸收CO2反应过程中体系的黏度变化,研究了DBU-甘油溶液吸收CO2反应的动力学。结果表明,在反应温度25℃、CO2气体流速为238mL/min的条件下,DBU与甘油摩尔比为0.49~1的溶液对CO2的吸收量可在120min的反应时间内达到10.88g/100g溶液;DBU与甘油摩尔比为0.49∶1和1.12∶1的溶液在吸收 CO2后体系的黏度显著增大,而 DBU与甘油摩尔比为 0.11∶1和 3.43∶1的溶液在吸收 CO2后
1,8-二氮朵双环[5.4.0]十一碳-7-烯;甘油;二氧化碳;黏度;反应动力学
绿色化学反应因其具有高效、经济且对环境不造成有害影响等特点,已成为当前化学与化工研究的热点之一。大多数化学合成与分离中需要使用有机溶剂,分离有机溶剂时需要消耗大量能量,而且许多有机溶剂具有挥发性,使用过程中容易对环境造成污染[1]。因此,寻找高效节能且对环境友好的新型溶剂体系对绿色化学的实现具有重要的现实意义。
JESSOP等[2]发现脒类或胍类与醇混合形成的溶液,能与酸性气体(如 CO2、SO2)反应并发生极性转变,由分子化合物转变为离子化合物,而该离子化合物在通入惰性气体(如N2)或被加热后又能释放出酸性气体并重新回到分子化合物状态[3-4]。这类溶剂不仅挥发性低,而且能够通过温和条件下酸性气体的吸收和解吸实现极性的转变,从而可以使反应与分离通过相转移耦合,减少溶剂的使用和分离能耗,具有环境友好的特点[2]。
转极性溶剂有很多方面的应用。在分离方面,转极性溶剂可应用于大豆油的萃取分离[5];在生物质转化中,转极性溶剂可以作为高效反应介质用于纤维素酯的合成以及三酰基甘油酯的转酯化[6-8]。此外,由于转极性溶剂结合CO2的化学键键能是传统离子液体结合 CO2的两倍之多且对 CO2吸收容量大,即使在常压下也能够有效地吸收 CO2[9],故亦被应用于CO2的捕集。
1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)是转极性溶剂中使用较多、相对廉价的一种有机碱[10],可以作为酯交换反应生产生物柴油的催化剂[11],反应后生物柴油相残留的DBU和甘油可以通过通入CO2生成极性的离子化合物从甲酯相分离出来,使甲酯相得到净化,从而避免水洗除杂产生大量的废水以及蒸馏操作带来的高能耗。甘油是生物柴油生产过程中的副产物,具有沸点高不易挥发的特点。随着全球生物柴油的大量生产,过量的廉价甘油急需找到出路。利用 DBU、甘油溶液捕集CO2是一种新思路。富丽娟等[12]研究了DBU、甘油和CO2形成的离子化合物的组成、结构及稳定性。深入研究DBU、甘油和CO2反应过程及其动力学,可以对此类转极性溶剂的广泛应用提供重要的基础。本文对DBU、甘油体系吸收CO2的反应过程及动力学进行了研究,旨在探讨此反应过程特性及反应速率。
1 实验部分
1.1 原料及仪器
DBU(99%,上海贝合化工,水分含量0.15%)装入试剂瓶存于干燥器内备用。CO2(99%,成都市东风气体)用硅胶柱干燥,甘油(99.5%,成都市科龙试剂,水分含量0.23%)。低温恒温水浴(郑州长城科工贸)、质量流量控制器(北京七星华创电子)、自动水分滴定仪(上海安亭电子仪器),ML分析天平(梅特勒-托利多仪器),平氏黏度仪(大连分析仪器)。
1.2 实验方法
将装有一定比例DBU-甘油溶液的100 mL单口圆底烧瓶置于低温恒温水浴内,磁力搅拌。CO2流经硅胶柱干燥后再经质量流量控制器进入烧瓶,经内径为3mm的通气管通入溶液底部,未反应的CO2气体经出口端的质量流量控制器离开体系,反应过程中通过质量流量控制器记录进出口的 CO2流量,通过积分计算出不同时刻体系吸收的CO2质量,当体系进出口端的CO2流量差值<2 mL/min时,认为吸收反应已经达到了平衡。
1.3 计算公式
由于DBU与CO2以1∶1的摩尔比进行反应,所以DBU的转化率可以通过式(1)进行计算。

2 结果与讨论
DBU、甘油和 CO2存在如式(2)~式(4)所示反应[13]。OSTONEN等[14]研究发现,在甘油过量的DBU-甘油溶液中,CO2只与甘油分子的一个伯羟基发生反应,而在DBU过量的DBU-甘油溶液中,CO2主要与甘油分子中的2个或者3个羟基发生反应。富丽娟等[12]的进一步研究表明,在DBU与甘油摩尔比为3∶1、反应温度为50℃的条件下,DBU/甘油/CO2的反应中仲羟基几乎没有发生反应,也即式(4)几乎没有发生,反应以式(2)和式(3)为主,DBU/甘油/CO2反应中只有一个伯羟基参与反应形成的离子化合物的摩尔分数约为0.66,甘油中两个伯羟基都参与反应形成的离子化合物的摩尔分数约为0.34。在甘油过量的条件下,DBU优先反应甘油的一个伯羟基,随着 DBU浓度变大,才会发生反应式(3)。
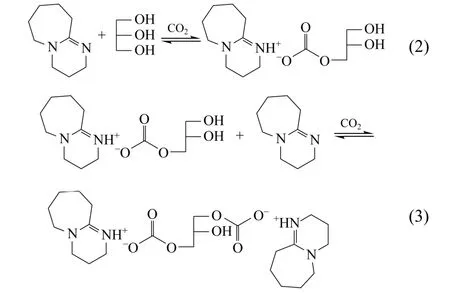

2.1 DBU/甘油/CO2的反应过程
DBU和甘油能够很好地互溶,DBU-甘油溶液吸收CO2是气液反应,研究液相与气相的反应过程需考虑气相在液相的物理吸收。OSTONEN等[14]研究发现在50℃、常压下CO2在DBU和甘油中的溶解度都非常低,分别为1.14%和0.10%。DBU和甘油的混合溶液吸收CO2过程放热显著[14],低温有利于化学吸收的进行。本文首先研究了较低温度15~45 ℃下CO2分别在DBU和甘油中的物理吸收,结果见表1。
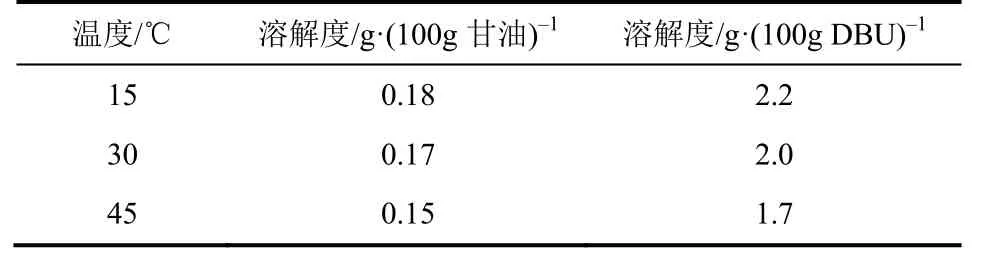
表1 CO2在甘油和DBU中的溶解度
从表1中可以看出,在15~45℃下,CO2在甘油中的溶解度较低,均小于0.2%,在DBU中的溶解度约为2%,温度对其影响较小。
2.1.1 搅拌强度和CO2流速对DBU-甘油溶液吸收CO2的影响
搅拌强度和CO2流速是影响气液接触的重要因素,对此反应传质会产生直接的影响。为了确定消除扩散的影响,分别考察了不同搅拌转速以及不同CO2气体流速对DBU转化率的影响。
采用DBU与甘油摩尔比为0.11∶1的溶液,搅拌转速从450r/min到950r/min逐渐增大,在25 ℃下分别测定了不同搅拌转速下DBU的转化率(表2)。每组实验重复3次,误差范围为0.32%~2.57%。
由表2可以看出,随着搅拌增强,DBU转化率逐渐增加,超过一定程度后,转化率趋于稳定。这是由于增大搅拌强度可以促进气液两相的混合,使通入的CO2气泡破碎形成更小的气泡,增大了CO2与 DBU-甘油溶液的接触面积,进而强化气液两相间的传质,提高传质速率,促进反应的进行。当搅拌转速增大到575r/min之后,高于575r/min转速后继续增大搅拌强度,DBU转化率的增加很小(<2.83%),此时搅拌对气泡破碎的影响不再明显。因此,当搅拌转速大于575r/min后搅拌对DBU转化率的影响可以忽略。
此外,通过改变CO2气体流速研究了DBU转化率的变化。图1是在25℃、825r/min搅拌转速下CO2在不同流速条件下 DBU与甘油摩尔比为0.11∶1溶液中DBU的转化率随时间变化曲线。
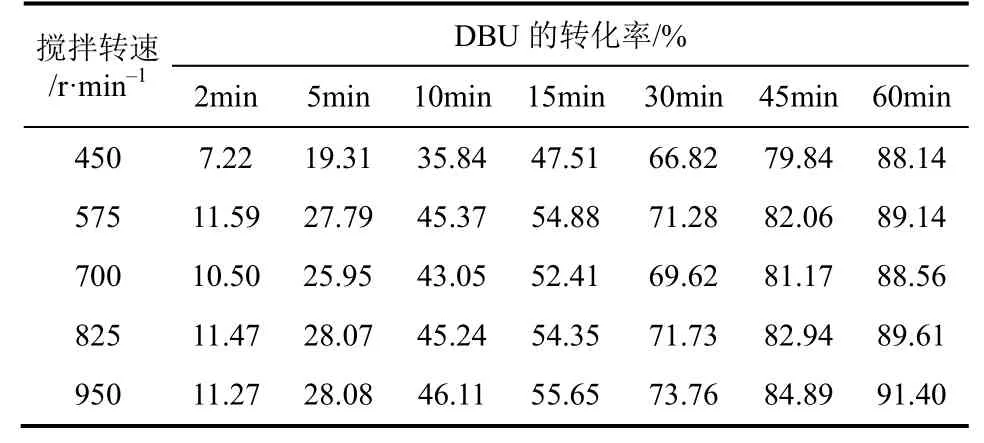
表2 不同搅拌转速下不同反应时刻DBU的转化率

图1 不同CO2气体流速下DBU转化率随时间的变化曲线
从图 1可以看出,随着 CO2气体流速从40mL/min增加至238 mL/min,反应相同时间DBU的转化率逐渐增大。当CO2气体流速从238 mL/min继续增加至555 mL/min时,反应相同时间DBU的转化率差别很小(<3%),即当CO2气速大于238 mL/min后继续增大 CO2气体流速对吸收反应的影响可以忽略,可以认为此时传质的影响已经消除。
2.1.2 黏度对DBU-甘油溶液吸收CO2的影响
在DBU-甘油溶液吸收CO2过程中,随着反应的进行,生成的离子化合物量增加,体系的黏度会逐渐发生变化。首先研究了DBU和甘油及其不同组成下溶液的黏度。
由表 3可以看出,甘油的黏度远远高于 DBU的黏度,当甘油中加入DBU后,随着DBU含量的增加,溶液的黏度先逐渐增大,再逐渐降低。
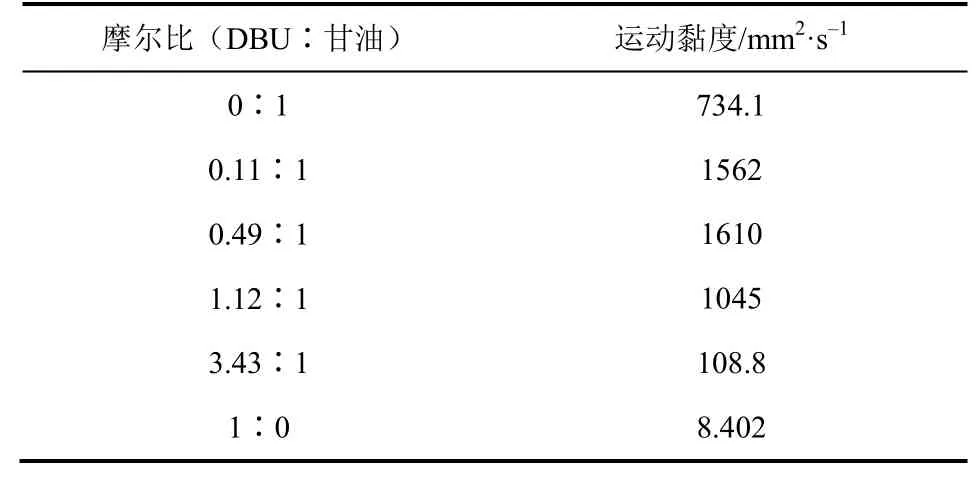
表3 不同摩尔比的DBU-甘油溶液的黏度(25 ℃)
随着 DBU与甘油摩尔比从 0.11∶1增加到1.12∶1,混合后的DBU-甘油溶液黏度均大于纯甘油的黏度,这是由于强碱性的 DBU与弱酸性的甘油发生相互作用[15],产生了结合甘油质子氢的DBU正离子和失去一个质子氢的甘油负离子[式(5)],正负离子间的相互吸引力大于甘油分子与甘油分子相互作用力以及DBU分子与DBU分子相互作用力,从而混合溶液的黏度高于甘油黏度;当 DBU与甘油摩尔比提高至0.49∶1后,继续增加DBU含量,混合溶液的黏度开始逐渐降低,此时,由于体系中DBU量逐渐增多直至超过反应计量比,DBU作为溶剂稀释了混合溶液,使得结合甘油质子氢的DBU正离子和失去一个质子氢的甘油负离子的相互作用减弱,致使混合溶液黏度逐渐降低。

DBU-甘油溶液吸收CO2后会生成离子化合物,体系的黏度会进一步发生变化,对反应也可能产生影响。测定了不同组成的DBU-甘油溶液吸收CO2后体系黏度随CO2吸收量的变化曲线,结果见图2。
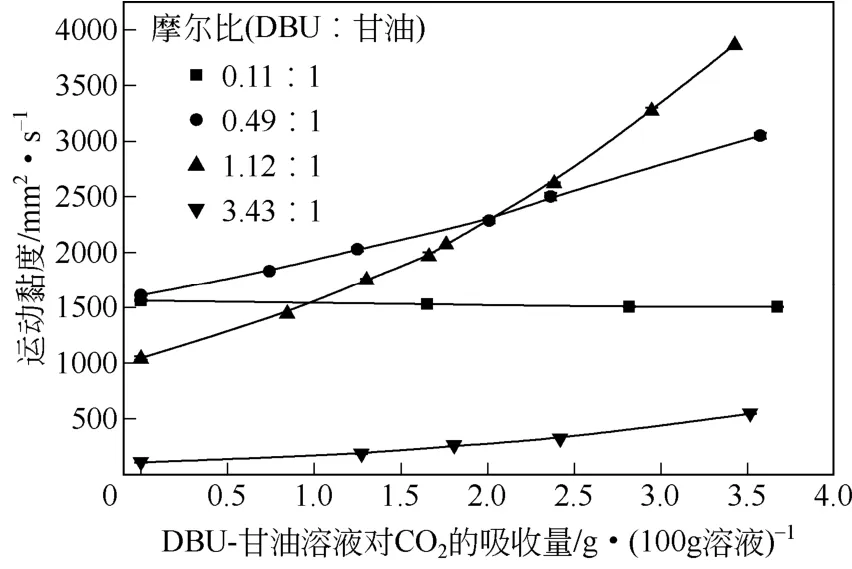
图2 不同摩尔比DBU-甘油溶液吸收CO2后溶液黏度(25℃)随吸收量的变化
从图2可以看出,DBU与甘油摩尔比为0.11∶1的溶液中,体系黏度随CO2吸收量的增加无显著变化。当DBU与甘油的摩尔比分别为0.49∶1、1.12∶1和3.43∶1时,随着CO2的吸收量增加,体系的黏度逐渐增大。这是由于在同一CO2吸收量下,随着体系 DBU含量的升高,生成的离子化合物在体系内所占比例逐渐增大,而实验发现 DBU和甘油黏度小于产物离子化合物的黏度,离子化合物含量提高对溶液黏度的影响逐渐显著,体系黏度不断增加。在DBU与甘油摩尔比为3.43∶1的溶液中,生成的离子化合物的摩尔含量小(<8.0%),大量低黏度的DBU(8.402mm2/s)起到了稀释溶液的作用,所以混合溶液黏度增加较小,而在DBU与甘油摩尔比分别为0.49∶1、1.12∶1的DBU-甘油溶液体系吸收CO2后生成的离子化合物所占比例高,体系黏度随着CO2吸收量的增加而显著增大。此外实验发现,当DBU与甘油摩尔比增至10∶1时,通入CO2后体系2min内迅速产生白色沉淀,体系的黏度不易测定,因此后续过程只考察了体系是液体时的情况。
为了进一步研究体系黏度的变化对 DBU-甘油溶液吸收CO2效果的影响,图3给出了DBU和甘油摩尔比分别为0.11∶1和0.49∶1的溶液吸收CO2时DBU转化率随时间变化曲线。
由图3可以看出,在30min内,相同时刻两个组成下的 DBU转化率十分接近,30min可以达到70%左右,30min后,在DBU和甘油摩尔比为0.49∶1的溶液中,DBU转化率随时间增加越来越缓慢,60min后体系吸收CO2十分困难,此时DBU转化率达到78.64%,而此时DBU和甘油摩尔比为0.11∶1的溶液中DBU转化率仍在不断升高,60min时达到89.52%。这是因为DBU、甘油和CO2反应生成的离子化合物黏度远远高于DBU和甘油的黏度,且同一反应时刻DBU和甘油摩尔比为0.49∶1的溶液中生成的离子化合物的含量大于 DBU和甘油摩尔比为0.11∶1的溶液中离子化合物的含量。随着反应的进行,两组DBU-甘油溶液中DBU和甘油不断减少,产物逐渐增多,结合图2,DBU和甘油摩尔比为 0.49∶1的溶液体系的黏度远远大于DBU和甘油摩尔比为0.11∶1的溶液,搅拌越来越困难,不利于溶液对CO2的吸收。
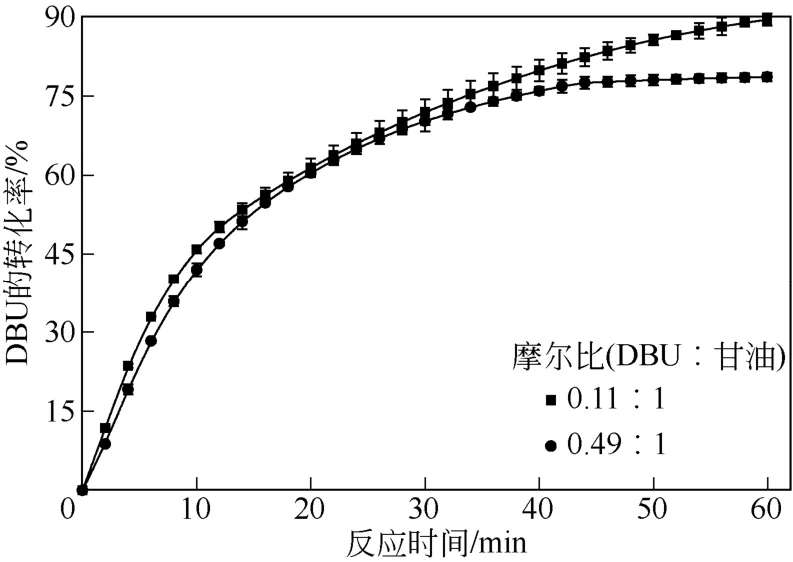
图3 不同组成DBU-甘油溶液吸收CO2时DBU转化率随时间的变化曲线
DBU-甘油溶液的黏度变化不仅影响 CO2吸收速率,还会影响CO2吸收效果。表4是DBU和甘油的摩尔比分别为 0.11∶1、0.49∶1、1.12∶1、1.81∶1、4.15∶1的DBU-甘油溶液在相同反应条件下对CO2的吸收量。

表4 不同浓度的DBU-甘油溶液吸收CO2的量
从式(2)~式(4)可知,理论上每吸收1mol CO2消耗1mol DBU,1mol甘油能够和3mol CO2完全反应。从表4可以看出,溶液对CO2的化学吸收能力分别远大于DBU和甘油对CO2物理吸收能力。当DBU和甘油的摩尔比小于1.81∶1时,不足以使甘油的3个羟基完全反应,理论上化学吸收的CO2不超过DBU的物质的量,结合DBU、甘油与CO2的反应方程式可以看出,DBU-甘油溶液吸收CO2过程只发生了反应式(2)。当DBU和甘油的摩尔比达到4.15∶1时,120 min后体系吸收的CO2物质的量大于甘油的物质的量,根据反应方程式可以看出,反应式(2)已经进行完全,并进一步发生反应式(3)。
理论上完全反应时,DBU和甘油摩尔比分别为0.11∶1、0.49∶1、1.12∶1、1.81∶1、4.15∶1时,每 100g溶液能够吸收 CO2的质量分别为 4.45g、12.95g、18.78g、21.68g和18.25g。而实际反应120min后,CO2的吸收量均低于理论值。当体系中 DBU与甘油摩尔比为0.11∶1时,由于吸收CO2后体系黏度变化不大,120min后吸收的CO2等于DBU摩尔数,反应进行得较为彻底。随着DBU与甘油摩尔比从0.49∶1逐渐升高至1.12∶1、1.81∶1,吸收CO2后体系黏度增加显著,不利于吸收反应的进行,所以CO2的吸收量低于理论化学反应量,体系黏度越高,影响越显著。当摩尔比增加至4.15∶1时,空间位阻作用使得甘油的3个羟基完全反应十分困难,120min并不能使反应进行彻底,因而CO2的吸收量也低于理论化学反应量。
2.2 DBU/甘油/CO2反应动力学
设DBU/甘油/CO2反应的速率方程见式(6)。

在CO2分压不变、甘油大量过量的条件下,可以假设甘油浓度不变,因此得到式(7)、式(8)。
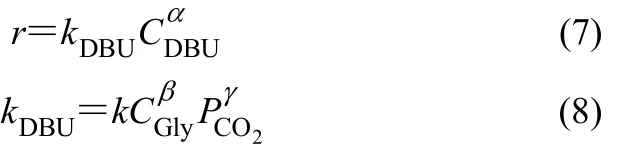
对式(8)两边求对数,则有式(9)。

2.2.1 DBU的反应级数
采用 825r/min搅拌转速、238mL/min的 CO2气体流速,研究 DBU的反应级数,此时可认为扩散影响已消除。分别考察了常压不同温度下(20℃、25℃、30℃、35℃)DBU与甘油摩尔比为0.11∶1时DBU-甘油溶液对CO2吸收情况(图4)。
从图4可以看出,随着温度从20℃升高到35℃,同一时刻DBU的转化率显著提高。
假设反应速率对 DBU浓度呈一级反应,应有式(10)。

将图 4中数据进行拟合,可以得到反应时间 t与ln[1/(1-xDBU)]的关系(图5和表5)。
由图5和表5可以看出,ln[1/(1-xDBU)]与时间t呈良好的线性关系,反应速率常数随温度升高逐渐增大。这表明,在实验条件下 DBU浓度对反应速率符合一级关系,提高温度可以有效提高反应速率。
根据阿累尼乌斯定律[式(11)],利用表 5的结果,进行数据拟合求取反应的活化能,结果如图 6所示,得到的活化能E=40.44kJ/mol。

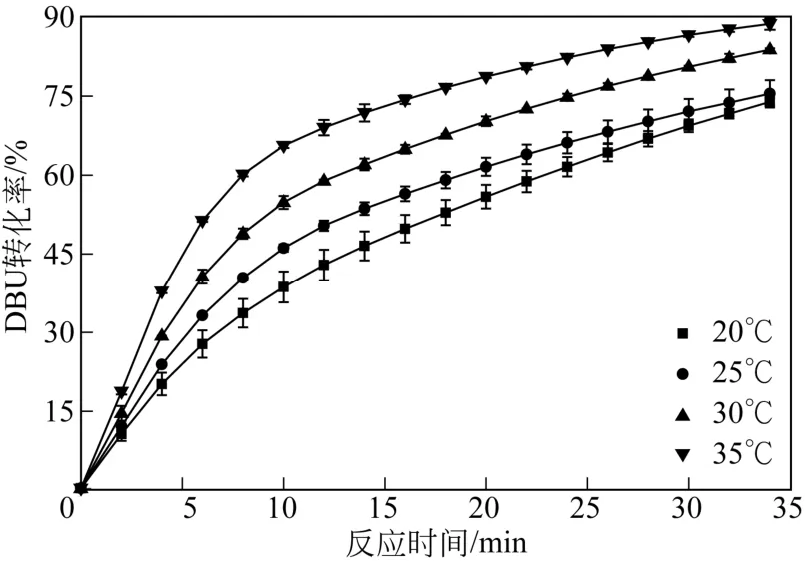
图4 不同温度下DBU转化率随时间变化曲线

图5 反应时间t与ln[1/(1-xDBU)]的关系

表5 不同温度下的反应速率常数

图6 反应速率常数与温度的关系
2.2.2 CO2分压对DBU/甘油/CO2反应的影响
CO2在 DBU和甘油体系中的吸收与其分压有关,为了研究反应速率与CO2浓度的关系,实验通过往CO2中加入氮气的方式改变CO2分压,考察了不同CO2分压下DBU的转化率。在825r/min搅拌转速、25 ℃反应温度下,考察DBU与甘油摩尔比为0.11∶1时DBU-甘油溶液对CO2吸收情况,结果见图7。

图7 不同CO2分压下DBU的转化率曲线
从图7可以看出,随着CO2的分压从0.070MPa减小到0.015MPa,同一时刻DBU的转化率显著降低,一方面,CO2分压越低,它在DBU和甘油中的溶解度越低[14],这导致液相中的CO2浓度也越低,因此降低了反应速率;另一方面,氮气作为惰性气体,有促进DBU/甘油/CO2形成的离子化合物解吸的作用,阻碍了吸收反应的进行[13]。
根据式(10),对图7中的数据进行拟合,结果见图8和表6。
根据不同分压下反应速率常数kDBU,代入式(9)中,由于DBU与甘油的摩尔比为0.11∶1,甘油大大过量,其浓度在体系中可以认为基本不变,因此β ln(CGly)+lnk可视为常数,将lnkDBU与lnPCO2作图,可以得到斜率γ即为该反应中CO2的反应级数,结果如图9所示。
从图9可以看出,lnkDBU与lnPCO2的线性关系较好,斜率近似为0.5,因此反应对CO2的分压可视为0.5级。此外根据图9和式(9)可得截距,即得式(12)、式(13)。

即 k1=0.22。
故甘油大大过量时,DBU/甘油/CO2反应速率常数k1在25℃时为0.22min-1·MPa-0.5,反应的速率方程为

表6 不同CO2分压下的反应速率常数

图8 不同CO2分压下反应时间t与ln[1/(1-xDBU)]的关系

图9 反应速率常数与CO2分压的关系
3 结 论
本文对20~35℃下DBU-甘油溶液吸收CO2进行研究,考察了不同浓度的DBU、甘油溶液吸收特点及吸收效果。结果表明,吸收CO2后溶液黏度会发生变化,CO2吸收量小于3.5g/100g溶液时,DBU与甘油摩尔比为0.49∶1和1.12∶1的溶液黏度显著增大,远远高于混合溶液的初始黏度,而DBU与甘油摩尔比为0.11∶1和3.43∶1的溶液在吸收CO2后黏度变化较小;在25℃、CO2流速为238mL/min,吸收 120 min,DBU与甘油摩尔比为 0.49∶1的DBU-甘油溶液对CO2的吸收量可达到10.88g/100g溶液。动力学研究表明,在20~35℃温度范围内,甘油大大过量条件下,DBU/甘油/CO2反应中DBU的反应级数为1,CO2的反应级数为0.5,反应速率常数在25℃时为0.22min-1·MPa-0.5,反应的活化能为40.44kJ/mol。
符 号 说 明
CDBU——DBU的浓度,mol/L
CGly——甘油的浓度,mol/L
k——反应速率常数
kDBU——DBU的反应速率常数,min-1;
nCO2——体系化学吸收的CO2的物质的量,mol
nDBU——体系中DBU的物质的量,mol
PCO2——CO2的分压,MPa
r——反应速率,mol/(L·min)
[1] JESSOP P G. Switchable solvents as media for synthesis and separations [J]. Aldrichimica Acta,2015,1:18.
[2] JESSOP P G,HELDEBRANT D J,LI X W,et al. Green chemistry:reversible nonpolar-to-polar solvent[J]. Nature,2005,436(7054):1102-1102.
[3] HELDEBRANT D J,KOECH P K,ANG M T C,et al. Reversible zwitterionic liquids,the reaction of alkanol guanidines,alkanol amidines,and diamines with CO2[J]. Green Chemistry,2010,12(4):713-721.
[4] HELDEBRANT D J,KOECH P K,RAINBOLT J E,et al. 10th International Conference on Greenhouse Gas Control Technologies[C]. Amsterdam Netherlands:GALE J,HENDRIKS C,TURKENBERG W,2011:216-223.
[5] PHAN L,BROWN H,WHITE J,et al. Soybean oil extraction and separation using switchable or expanded solvents[J]. Green Chemistry,2009,11(12):2061-2061.
[6] SALIU F,ORLANDI M. In situ alcoholysis of triacylglycerols by application of switchable-polarity solvents. A new derivatization procedure for the gas-chromatographic analysis of vegetable oils[J]. Analytical and Bioanalytical Chemistry,2013,405(26):8677-8684.
[7] XUE D,MU Y,MAO Y,et al. Kinetics of DBU-catalyzed transesterification for biodiesel in the DBU-ethanolswitchable-polarity solvent[J]. Green Chemistry,2014,16(6):3218-3223.
[8] YANG Y,XIE H,LIU E. Acylation of cellulose in reversible ionic liquids[J]. Green Chemistry,2014,16(6):3018-3023.
[9] PRIVALOVA E,NURMI M,MARNON M,et al. CO2removal with‘switchable' versus ‘classical' ionic liquids[J]. Separation and Purification Technology,2012,97:42-50.
[10] FENG X,SHEN L,WANG R,et al. Synthesis and application of DBU[J]. Chemical Industry and Engineering Progress,2013,1:034.
[11] TAYLOR J E,BULL S D,WILLIAMS J M. Amidines,isothioureas,and guanidines as nucleophilic catalysts[J]. Chemical Society Reviews,2012,41(6):2109-2121.
[12] 富丽娟,刘颖颖,鲁厚芳,等. 醇羟基反应活性与 DBU/C3-醇/CO2离子化合物稳定性[J]. 化工学报,2015,66(10):4163-4169.
[13] ANUGWOM I,MAKI-ARVELA P,VIRTANEN P,et al. Switchable ionic liquids(SILs)based on glycerol and acid gases[J]. RSC Advances,2011,1(3):452-457.
[14] OSTONEN A,SAPEI E,UUSI-KYYNY P,et al. Measurements and modeling of CO2solubility in 1,8-diazabicyclo-[5.4.0]-undec-7-eneglycerol solutions[J]. Fluid Phase Equilibria,2014,374:25-36.
[15] MUNSHI M K,GADE S M,MANE M V,et al. 1,8-Diazabicyclo[5.4.0] undec-7-ene (DBU):a highly efficient catalyst in glycerol carbonate synthesis[J]. Journal of Molecular Catalysis A:Chemical,2014,391:144-149.
Reaction progress and kinetics of CO2with glycerol in the presence of DBU
ZHANG Meng1,2,LU Houfang1,2,LIANG Bin1,2,LIU Yingying2,HAO Xiaogang3
(1College of Chemical Engineering,Sichuan University,Chengdu 610065,Sichuan,China;2Institute of New Energy and Low-carbon Technology,Sichuan University,Chengdu 610065,Sichuan,China;3Taiyuan University of Technology,Taiyuan 030024,Shanxi,China)
1,8-diazabicyclo[5.4.0] undec-7-ene(DBU)/glycerol solution used as a new solvent,which has low heat capacity and high boiling point,has been widely studied in chemical synthesis and product separation. The absorption of CO2at different ratios of DBU/glycerol solutions was investigated. It is shown that the amount of CO2absorbed in this solution could reach 10.88g/100g within 120min at 25℃ under atmospheric pressure,0.49∶1 of the molar ratio of DBU to glycerol and 238mL/min of the flow rate of CO2. The viscosity of the solution at different ratios during reaction was also measured. It increased with the increase of time and the amount of DBU when the molar ratio of DBU and glycerol was 0.49∶1 and 1.12∶1. But, when the molar ratio of DBU to glycerol was 0.11∶1 and 3.43∶1,the viscosity of the solution changed a little. Furthermore,the kinetics of carbon dioxide binding by DBU/glycerol solution was studied. The reaction rate of DBU/glycerol/CO2can be expressed asat 25℃ without the effect of agitation under atmospheric pressure when glycerol is excessive. The activation energy of the reaction is 40.44kJ/mol.
DBU;glycerol;carbon dioxide;viscosity;reaction kinetics
O 643.12
A
1000-6613(2016)10-3078-08
10.16085/j.issn.1000-6613.2016.10.010
2016-02-01;修改稿日期:2016-03-01。
国家自然科学基金重点项目(21336008)、国家自然科学基金面上项目(21476150)、教育部博士点基金(20130181130006)及山西省煤基重点科技攻关项目(MD2014-09)。
张猛(1990—),男,硕士研究生。联系人:刘颖颖,博士,助理研究员,研究方向为化工过程新工艺开发。E-mail liuyingying@scu.edu.cn。
体系的黏度变化较小。25℃、常压下,在消除扩散影响,甘油大大过量时,DBU/甘油/CO2反应的速率方程为,反应的活化能为40.44kJ/mol。

