舒肝解郁胶囊对抑郁模型大鼠脑内5-HT、DA及其代谢产物水平的影响
傅锦华,刘勇
(1.湖南省脑科医院精神科,湖南长沙410007;2.中南大学湘雅二医院精神卫生研究所,湖南长沙410011)
舒肝解郁胶囊对抑郁模型大鼠脑内5-HT、DA及其代谢产物水平的影响
傅锦华1,刘勇2
(1.湖南省脑科医院精神科,湖南长沙410007;2.中南大学湘雅二医院精神卫生研究所,湖南长沙410011)
目的研究舒肝解郁胶囊对抑郁模型大鼠脑内5-HT、DA及其代谢产物水平的影响。方法将28只雄性SD大鼠随机分成正常对照组、模型组、舒肝解郁组、氟西汀组四组;采用慢性轻度不可预见性应激(CUMS)结合孤养方式建立抑郁大鼠模型,舒肝解郁组和氟西汀组大鼠于造模同时分别给予舒肝解郁胶囊和氟西汀干预;用库仑阵列电化学高效液相色谱法分别检测大鼠内侧前额叶皮质(mPFC)及海马CA3区5-HT、DA及其代谢产物的含量。结果应激21 d后,模型组与正常对照组比较,大鼠mPFC区5-HT、5-羟吲哚乙酸(5-HIAA)、DA和高香草酸(HVA)的浓度均显著降低,差异有统计学意义(P<0.01),海马CA3区5-HT、DA和5-HIAA的浓度均显著降低,差异有统计学意义(P<0.05);与模型组比较,舒肝解郁组和氟西汀组可显著增加大鼠mPFC区5-HT、DA和HVA浓度,差异有统计学意义(P<0.01或P<0.05),海马CA3区5-HT、DA和5-HIAA浓度显著升高,差异有统计学意义(P<0.05)。结论舒肝解郁胶囊能增强抑郁模型大鼠中枢5-HT和DA神经递质系统的功能,这可能是其抗抑郁作用的神经生化机制之一。
舒肝解郁胶囊;抑郁症;慢性轻度不可预见性应激;5-羟色胺;多巴胺;贯叶金丝桃;刺五加
〔Abstract〕Objective To evaluate the effect of Shugan Jieyu(SGJY)capsules on 5-HT,DA and their metabolites in the brain of depression model rats.M ethods Twenty-eight male SD rats were randomly divided into normal control group,model group,SGJY group and fluoxetine group.We established the depression ratmodels with the method of chronic unpredictable mild stress(CUMS)and separate feeding.The SGJY group anf fluoxetine group were intervened with SGJY capsule and fluoxetine.The 5-HT,DA and their metabolites levels in medial prefrontal cortex(mPFC)and hippocampal CA3 areas were detected by HPLCECD method.Results After 21 days'stress,compared with the control group,the levels of 5-HT,5-hydroxyindoleacetic acid(5-HIAA),DA and homovanillic acid(HVA)in themPFC of depression model rats were significantly decreased(P<0.01),and the levels of 5-HT,5-HIAA and DA in hippocampal CA3 area were significantly decreased(P<0.05).Compared with model group,the levels of 5-HT,DA and HVA in themPFC of fluoxetine and SGJY groups were significantly increased(P<0.01 or P<0.05),and the levels of 5-HT,DA and 5-HIAA in hippocampal CA3 area were significantly increased(P<0.05).Conclusion The SGJY capsule could increase the function level of DA and 5-HT neurotransmitter systems in mPFC and hippocampus areas of depression model rats.
〔Keywords〕SGJY capsules;depression;chronic unpredictablemild stress;5-HT;DA;Hypericum perforatum;acanthopanax senticosus
临床上,抑郁症是一种最常见的情感性精神障碍,被形象地称作“心灵感冒”,它具有高发病性、高复发性、高致残率和高自杀率的四高特点,给家庭和社会带来了沉重的精神和经济负担,已成为了全球性的主要精神卫生问题。由于抑郁症的发病机制十分复杂,至今尚未完全阐明。单胺类递质失衡假说是其重要的发病机制之一,该假说认为脑内单胺类神经递质系统功能失衡是导致抑郁症的主要原因,主要表现为相关脑区去甲肾上腺素(norepinephrine,NE)、5-羟色胺(5-hydroxytryptamine,5-HT)和多巴胺(dopamine,DA)等神经递质的合成释放减少[1]。舒肝解郁胶囊是第一个被SFDA批准治疗轻中度抑郁的中药新药,其组成是贯叶金丝桃和刺五加,金丝桃素是“圣.约翰草”的活性成分,而“圣.约翰草”为已在世界各国得到广泛使用的非处方抗抑郁药物,其抗抑郁机制之一是通过抑制突触前膜对NE、5-HT和DA的再摄取,使突触间隙内三种神经递质浓度增加或抑制单胺氧化酶和儿茶酚胺氧位甲基转移酶,减少NE、5-HT和DA神经递质的代谢,间接增加它们的浓度[2]。鉴于此,本研究采用慢性轻度不可预见性应激(chronic unpredictable mild stress,CUMS)结合孤养建立抑郁大鼠模型,以抗抑郁西药氟西汀为阳性对照药物,采用库仑阵列电化学高效液相色谱法(HPLC)检测比较舒肝解郁胶囊对抑郁模型大鼠内侧前额叶皮质(medial prefrontal cortex,mPFC)和海马CA3区神经递质5-HT、DA及其代谢产物5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA),3,4-二羟基苯乙酸(3,4-hihydroxyphenylacetic acid,DOPAC)、高香草酸(homovanillic acid,HVA)的含量,从舒肝解郁胶囊对中枢神经递质水平的影响来探讨其抗抑郁作用机制。
1 材料与方法
1.1材料
1.1.1实验动物雄性SD大鼠购自上海斯莱克景达有限公司,SPF级,体质量180~200 g,动物房温度维持在21~23℃,采用12 h昼夜节律(8:00~20:00),所有实验在9:00-17:00点时间段进行,整个实验期间动物自由饮水和进食。
1.1.2药品和试验试剂药品:舒肝解郁胶囊(成都康弘药业有限公司,批号:110602;),氟西汀(美国礼来公司,批号:L01962;),0.5%的羧甲基纤维素钠,生理盐水。试剂:5-HT、5-HIAA,DA、DOPAC、HVA,1-庚烷磺酸钠、一水合柠檬酸、柠檬酸三钠、乙二胺四乙酸二钠(EDTA)均购自Sigma公司,甲醇,为色谱级;高氯酸、焦亚硫酸钠及其他试剂均为国产AR级;实验用水为超纯水。
1.1.3试验器材ESA Model 5600A-HPLC系统;检测器:ESA Model Coularray Electrochemical Detector-4;电极:ESA Model 6210 four channel cell;582型泵;软件:ESA Software Version;以上均为美国惠泽(ESA)公司产品。Sigma-2K15超速低温离心机,德国Sigma公司;AG285电子分析天平,瑞士梅特勒公司。
1.2方法
1.2.1动物分组及模型的建立适应性饲养大鼠3 d,将28只大鼠,随机均分为4组:(1)正常对照组(C组);(2)模型组(M组);(3)舒肝解郁组(Shuganjieyu,S组);(4)氟西汀组(Fluoxetine,F组)。除C组合笼饲养及不给于任何刺激外,其它三组大鼠均单笼饲养。参照Willner等[3]的方法,以慢性不可预见性应激结合孤养建立抑郁动物模型。在21 d内随机给与模型组、舒肝解郁组及氟西汀组三组大鼠慢性刺激,包括:断水24 h、禁食24 h、震荡160次/min,5 min、45℃环境(5 min)、4℃冰水游泳(5 min)、束缚2 h、昼夜颠倒(24 h)、夹尾1 min、电击足底(电压35 V,每隔50 s刺激1次,每次持续10 s,共30次)等应激因子。每日给予1种刺激,每种刺激累计使用2~3次。正常对照组和模型组中的大鼠从试验开始起即灌服等剂量的0.5%的羧甲基纤维素钠悬浮液,连续21 d,而舒肝解郁组和氟西汀组中的大鼠从试验开始起即分别接受用0.5%的羧甲基纤维素钠悬浮液配制的舒肝解郁胶囊和氟西汀分别为150 mg/(kg·d)和1.54 mg/(kg·d),相当于60 kg成人等效量,连续灌服21 d。
1.2.2样本采集应激21 d后,第22天各组大鼠断头处死,在冰上迅速剥离大脑,置于预冷的PBS缓冲液中浸泡5 min,参考大鼠脑部的解剖图谱[4],随即在冰面上迅速分离出大鼠内侧前额叶皮质(mPFC)及海马CA3组织,分装于冷冻管中,置于液氮中保存备测。
1.2.3色谱测定用标准液和蛋白沉淀工作液的配制精密称取5-HT、5-HIAA、DA、DOPAC和HVA标准品各1~5 mg,分别溶于10~50 mL超纯水中,浓度为105μg/L,用于上述神经递质的标准品储备液。标准品储备液配置后迅速分装好并置于-70℃冰箱避光保存。实验前使用超纯水将以上标准品储备液稀释成不同浓度梯度的混和标准液。以0.1 mol/L的高氯酸溶液(含EDTA 0.04%、焦亚硫酸钠0.04%)作为蛋白沉淀工作液。该液与混合标准液置于4℃冰箱可保存2周左右,使用前采用超声脱气并用0.22μm滤膜过滤。
1.2.4脑组织匀浆样本制备从液氮中取出脑组织并称质量,在每100 mg脑组织中准确加入1 mL预冷的蛋白沉淀工作液,及时在冰浴下快速玻璃匀浆,紧接着于4℃下14 000 g离心15 min,留取上清液20μL,以0.22μm针头过滤器过滤后即可进样分析。
1.2.5色谱条件色谱柱型号:ESA HR-80(4.6 mm×80 mm);预柱型号:ESA MD-150(3.2 mm× 150 mm);流动相:柠檬酸三钠69.40 mmol/L、含一水合柠檬酸63.51 mmol/L、EDTA 0.13 mmol/L、1-庚烷磺酸钠1.3 mmol/L、甲醇6%的混合液,pH 3.0;4通道库仑电化学检测电势为:-150 mV、100 mV、 300 mV、500 mV;液相流速:0.8 mL/min;样品进样量:20μL;色谱柱温:30℃。
1.2.6统计学处理用SPSS 16.0统计软件进行统计分析,各组数据均以“均数±标准误”(Mean±SEM)来表示。统计处理采用单因素方差分析(ANOVA);若存在差异,则需进行两两比较,采用Levene检验方法进行方差齐性检验,方差齐时采用Post Hot方法检验,方差不齐时用Tamhane's T2方法检验。P<0.05为差异具有统计学意义。
2 结果
2.1抑郁模型大鼠mPFC区5-HT、DA及其代谢产物浓度的变化
结果显示,模型组与正常对照组比较,大鼠mPFC区的5-HT、5-HIAA、DA和HVA的浓度均显著降低,差异具有统计学意义(P<0.01),DOPAC浓度无显著变化,差异无统计学意义(P>0.05);与模型组比较,舒肝解郁组和氟西汀组大鼠mPFC区的5-HT、DA和HVA的浓度显著升高,差异具有统计学意义(P<0.01或0.05),DOPAC和5-HIAA浓度差异无统计学意义(P>0.05);舒肝解郁组和氟西汀组两组对照,大鼠mPFC区各神经递质浓度差异无统计学意义(P>0.05);见表1。
表1 各组大鼠mPFC区5-HT、DA及其代谢产物的浓度(n=7,±s,ng/mL)
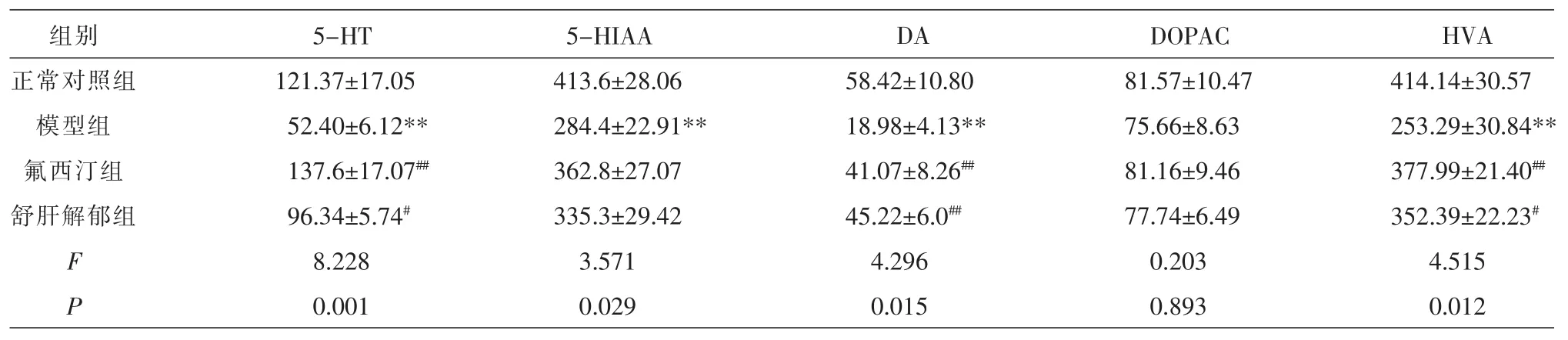
表1 各组大鼠mPFC区5-HT、DA及其代谢产物的浓度(n=7,±s,ng/mL)
注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01,#P<0.05。
组别正常对照组模型组氟西汀组舒肝解郁组FP 5-HT 121.37±17.05 52.40±6.12** 137.6±17.07##96.34±5.74#8.228 0.001 5-HIAA 413.6±28.06 284.4±22.91** 362.8±27.07 335.3±29.42 3.571 0.029 DA 58.42±10.80 18.98±4.13** 41.07±8.26##45.22±6.0##4.296 0.015 DOPAC 81.57±10.47 75.66±8.63 81.16±9.46 77.74±6.49 0.203 0.893 HVA 414.14±30.57 253.29±30.84** 377.99±21.40##352.39±22.23#4.515 0.012
2.2抑郁模型大鼠海马CA3区5-HT、DA及其代谢产物的浓度变化
研究结果显示,模型组与正常对照组比较,大鼠海马DA、5-HT和5-HIAA的浓度均显著降低,差异具有统计学意义(P<0.05),而DOPAC和HVA浓度差异无统计学意义(P>0.05);与模型组比较,舒肝解郁组和氟西汀组大鼠海马DA、5-HT和5-HIAA浓度显著升高,差异具有统计学意义(P<0.05),而DOPAC和HVA浓度差异无统计学意义(P>0.05);舒肝解郁组和氟西汀组两组之间比较,大鼠海马各神经递质浓度均无显著性差异(P>0.05),见表2。
3 讨论
许多研究发现应激是抑郁症重要发病因素,故本研究采用CUMS结合孤养建立抑郁大鼠模型,该模型被广泛应用于抗抑郁药物作用机制的研究。本课题组在前面的行为学研究结果显示[5],CUMS结合孤养建立的抑郁动物模型建模成功,舒肝解郁胶囊同氟西汀一样能有效改善抑郁模型大鼠的抑郁症状,具有抗抑郁作用,疗效与氟西汀相当。
表2 各组大鼠海马CA3区5-HT、DA及其代谢产物的浓度(n=7,±s,ng/mL)
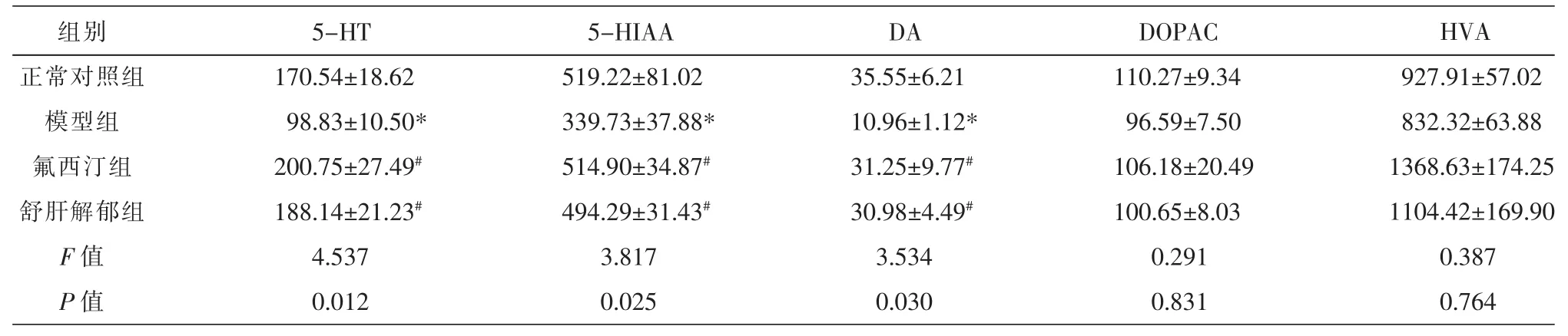
表2 各组大鼠海马CA3区5-HT、DA及其代谢产物的浓度(n=7,±s,ng/mL)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
组别正常对照组模型组氟西汀组舒肝解郁组F值P值5-HT 170.54±18.62 98.83±10.50* 200.75±27.49#188.14±21.23#4.537 0.012 5-HIAA 519.22±81.02 339.73±37.88* 514.90±34.87#494.29±31.43#3.817 0.025 DA 35.55±6.21 10.96±1.12* 31.25±9.77#30.98±4.49#3.534 0.030 DOPAC 110.27±9.34 96.59±7.50 106.18±20.49 100.65±8.03 0.291 0.831 HVA 927.91±57.02 832.32±63.88 1368.63±174.25 1104.42±169.90 0.387 0.764
前额叶皮质、海马CA3是调节情绪及情绪反应的重要神经解剖基础[6]。前额叶皮质是情绪中枢通路的重要环节之一,是应激时易累及损伤的主要靶区[7]。研究发现在应激反应中,尤其是海马的CA3区是一个对应激极度敏感的亚区,慢性应激能引起海马CA3区神经元萎缩和丢失及抑制齿状回颗粒细胞的形成[8],海马神经元结构和功能损伤可能是抑郁症发病的主要原因之一。
5-HT和DA是中枢神经系统中重要的兴奋性神经递质,5-HIAA是5-HT的代谢产物,DOPAC和HVA是DA的代谢产物。脑内的5-HT、DA神经递质浓度的变化与抑郁症的发生密切相关,抑郁症的发病可能与神经递质的浓度变化或各神经递质之间的稳态失衡有关[9-10]。最新研究发现[11]认为血清单胺类神经递质及其代谢产物可反映大脑单胺类神经递质的平衡状态,其水平变化可作为抑郁症诊断生物标志的一个重要参考指标。Oqendo MA等[12]研究证实抑郁症患者多伴有5-HT含量下降,抑郁症及自杀行为的神经生物学基础主要是5-HT系统异常。动物实验发现[13]CUMS抑郁模型大鼠前额叶皮质及海马CA3区的DA和5-HT水平显著降低,而且研究也发现[14]其代谢产物在海马CA3区的浓度也显著降低。
Malberg JE等[15]发现长期抗抑郁药可增加体内5-HT浓度,并能促进海马神经发生,逆转海马神经元的凋亡,海马神经的可塑性增强,从而促进抑郁症患者的恢复和症状缓解,如临床上使用的抗抑郁药物氟西汀可以通过抑制5-HT再摄取来发挥抗抑郁效应。许多研究[9,16]表明具有抗抑郁作用的中药,能提高脑组织一种或多种单胺类神经递质和(或)其代谢产物来发挥抗抑郁作用。姚迪等[17]研究发现舒肝解郁饮的抗抑郁机制与调节脑内单胺类神经递质5-HT、NE、DA及其代谢物的含量有关。张庆建等[18]发现高浓度的金丝桃黄酮可能通过升高脑垂体和脑干中的5-HT、DA、NE浓度而产生抗抑郁作用。动物实验研究[19-20]发现刺五加提取物能提高抑郁模型大鼠5-HT和NE表达水平。
本研究结果显示:模型组与正常对照组比较,大鼠mPFC区5-HT、5-HIAA和DA、HVA的浓度均显著降低,而DOPAC浓度无显著差异;舒肝解郁胶囊和氟西汀干预21 d后与对照组比较,神经递质浓度无显著性差异,而与模型组比较,5-HT和DA、HVA浓度显著升高,以上结果表明CUMS结合孤养的抑郁模型大鼠mPFC区可能存在5-HT和DA递质系统的功能减退及DA系统HVA代谢途径受阻;而舒肝解郁胶囊和氟西汀治疗后能提高抑郁模型大鼠mPFC区5-HT和DA递质系统功能,改善DA的HVA代谢通路活性。同时模型组与正常对照组比较发现大鼠海马DA、5-HT和5-HIAA浓度显著降低,舒肝解郁胶囊和氟西汀治疗21 d后与模型组比较,大鼠海马DA、5-HT和5-HIAA浓度明显升高,与正常对照组比较无显著性差异,说明CUMS结合孤养的抑郁模型大鼠海马DA神经递质生成不足,5-HT递质系统的功能明显减退;提示舒肝解郁胶囊治疗和氟西汀一样可提高抑郁模型大鼠海马DA的生成并增强5-HT递质系统功能。
综上所述,抑郁模型大鼠mPFC和海马CA3区5-HT和DA递质系统功能减退;舒肝解郁胶囊治疗可增强抑郁模型大鼠上述脑区5-HT和DA递质系统的功能,通过重新调节上述神经递质水平而达到抗抑郁作用。
[1]López-Muñoz F,Alamo C.Monoaminergic neurotransmission:the history of the discovery of antidepressants from 1950s until today[J].Curr Pharm Des,2009,15(14):1 563-1 586.
[2]江开达,周东丰,等.精神病学[M].北京:人民卫生出版社,2005.
[3]Willner P.Validity,reliability and utility of the chronic mild stress model of depression:a 10-year review and evaluation[J]. Psychopharmacology(Berl),1997,134(4):319-329.
[4]George P,Charles W.The rat brain in stereotaxic coordinates. 2005,Amsterdam:Elsevier Academic Press.
[5]傅锦华,刘勇,王清勇,等.舒肝解郁胶囊对抑郁模型大鼠海马神经元凋亡及脑组织caspase-3蛋白表达的影响[J].中南大学学报(医学报),2012,37(12):1 198-1 204.
[6]Packard MG,Knowlton BJ.Learning and memory functions of the Basal Ganglia[J].Annu Rev Neurosci,2002,25:563-593.
[7]Bruce S,McEwen.Protective and damaging effects of stress mediators:central role of the brain[J].Dialogues in clinical neuroscience,2006,8(4):367-381.
[8]郑晖,杨权.慢性应激对海马结构和功能的影响[J].国外医学精神病学分册.2001,28(3):161-165.
[9]张玲,王丽娜,于波,等.抑郁平胶囊对CMUS大鼠脑内单胺类神经递质的影响[J].中医药学报,2011,39(3):36-38.
[10]罗海鸥,杨明会,赵宏,等.抑郁症患者神经递质脑超慢涨落图分析[J].军医进修学院学报,2011,32(4):347-348.
[11]和昱辰,张波,瞿玮,等.血清单胺类神经递质及其代谢产物在重度抑郁症及抑郁共病焦虑障碍诊断中的应用[J].第三军医大学学报,2014,36(8):806-810.
[12]Oqendo MA,Placidi GP,Malone KM,et al.Positron emission tomography of regional brain metabolic responses to a serotonergic challenge and lethality of suicide attempts in major depression[J]. Arch Gen Psychiatry,2003,60(1):14-22.
[13]Leyton M,Paquette V,Gravel P,et al.α-[11C]methyl-tryptophan trapping in the orbital and ventral medial prefrontal cortex of suicide attempters[J].Eur.Neuropsychopharmacol,2006,16(3):220-223.
[14]Dulawa SC,Holick KA,Gundersen B,et al.Effects of chronic fluoxetine in animal models of anxietyand depression[J].Neuro psychopharmacology,2004,29(7):1 321-1 330.
[15]Malberg JE,Eisch AJ,Nestler EJ,et a1.Chronic antidepressant treatment increases neurogenesis in adult rat hippocampus[J]. Neurosci,2000,20(24):9 104-9 110.
[16]安磊,田燕,李静,林原,等.小补心汤总黄酮对慢性应激小鼠脑内单胺递质水平的影响[J].大连医科大学学报,2011,33(3):208-210.
[17]姚迪,胡欣妍,苏兴国,等.舒肝解郁饮对抑郁大鼠脑组织单胺类神经递质及其代谢产物的影响[J].吉林大学学报(医学版),2007,33(4):704-707.
[18]张庆建,赵毅民,杨明,等.黄酮类化合物对中枢神经系统的作用[J].中国中药杂志,2001,26(8):511-513.
[19]黄德彬,刘晓海.刺五加注射液对衰老模型大鼠学习记忆障碍及海马单胺类神经递质的影响[J].湖北民族学院学报(医学版),2008,25(3):1-4.
[20]ZHU L,ZHANG R,LI T L.Effects of Acanthopanax on Learning and Memory and Monoamine Neurotransmitters in Hippocampus of sleep deprived rats[J].Chinese Journal of experimental Traditional Medical Formulae,2012,18(4):219-223.
(本文编辑杨瑛)
Effect of Shugan Jieyu Capsules on 5-HT,DA and their M etabolites in the Brain of Depression M odel Rats
FU Jinhua1,LIU Yong2
(1.Department of Psychiatry,Brain Hospital of Hunan Province,Changsha,Hunan 410007,China;2.Mental Health Institute,Second Xiangya Hospital,Central South University,Changsha,Hunan 410011,China)
R285.5
A
doi:10.3969/j.issn.1674-070X.2016.06.012
2015-09-14
傅锦华,女,博士,副主任医师,研究方向:精神病的药理研究。

