骨髓间充质干细胞条件膜微粒对心脏成纤维细胞的影响
陈棉,王珏,耿志敏,潘璐璐,金增游,贾连红,卢家程,黄念念,褚茂平
(1.温州医科大学附属台州医院 儿科,浙江 台州 317000;2.温州医科大学附属第一医院 心胸外科,浙江 温州 325015;3.温州医科大学附属第一医院 儿科,浙江 温州 325015;4.温州医科大学附属第二医院育英儿童医院 儿童心脏中心,温州医科大学 心脏发育与转化医学研究所,浙江 温州 325027)
·论著·
骨髓间充质干细胞条件膜微粒对心脏成纤维细胞的影响
陈棉1,王珏2,耿志敏3,潘璐璐4,金增游3,贾连红3,卢家程3,黄念念3,褚茂平4
(1.温州医科大学附属台州医院儿科,浙江台州317000;2.温州医科大学附属第一医院心胸外科,浙江温州325015;3.温州医科大学附属第一医院儿科,浙江温州325015;4.温州医科大学附属第二医院育英儿童医院儿童心脏中心,温州医科大学心脏发育与转化医学研究所,浙江温州325027)
目的:探讨体外缺氧条件下骨髓间充质干细胞(MSCs)凋亡膜微粒(MSC-MPs)对心脏成纤维细胞(CFs)增殖、迁移和胶原合成的影响。方法:提取SD大鼠MSCs,在缺氧低营养条件下培养,收集上清液并提取MSC-MPs,用MSC-MPs刺激大鼠CFs,用CCK-8和划痕实验分别检测CFs增殖和迁移,qRT-PCR检测CFs中I型胶原、III型胶原、血管平滑肌肌动蛋白(α-SMA)、波型蛋白和纤连蛋白的合成情况。结果:CFs被MSC-MPs刺激后,与对照组比较,其增殖能力明显增加(P<0.05),迁移能力无明显变化(P>0.05),I型胶原、III型胶原、波型蛋白和纤连蛋白合成增加(均P<0.05)。结论:体外缺氧条件下MSC-MPs可促进CFs的增殖和胶原合成能力,而对CFs的迁移能力无明显影响。
骨髓间充质干细胞;膜微粒;心脏成纤维细胞;增殖;迁移;胶原合成
缺血性心脏病已成为危害人类健康的第一大杀手。研究发现,骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)可明显改善心肌梗死后心功能,减小梗死面积[1],但其作用机制仍不明确。研究发现MSCs移植到梗死心肌部位可分化为心肌样细胞[2],MSCs可旁分泌一些细胞因子影响心肌或血管的存活和再生[3]。本课题组前期研究发现,MSCs在体外模拟机体缺血缺氧环境的条件下可产生骨髓间充质干细胞膜微粒(MSC-MPs),进而促进梗死心肌的血管再生[4]。本研究体外模拟机体缺血缺氧环境,观察移植的MSC-MPs对心脏成纤维细胞(cardiac fibroblast,CFs)生物学性状的影响,为临床应用提供理论依据。
1 材料和方法
1.1 动物和试剂
1.1.1 实验动物:雄性SD大鼠,4~6周龄(60~80 g)2只,出生3 d以内的乳鼠20只,由温州医科大学实验动物中心提供[SCXK(浙)2010-0044号]。
1.1.2 主要试剂:IMDM培养基(Gibco公司),高糖DMEM培养基(Gibco公司),胎牛血清(Gibco公司),胰酶(Sigma公司),Braford蛋白定量试剂盒(碧云天生物技术研究所),CCK-8试剂盒(日本同仁化学公司),反转录试剂盒Prime-ScriptTMreagent kit(TaKaRa公司),6孔板、96孔板(美国Costar公司),荧光染料SYBR Green real time PCR master mix(TOYOBO公司),所有引物由TaKaRa公司设计合成,引物序列见表1。

表1 引物序列
1.2 方法
1.2.1 MSC-MPs的提取:取4~6周龄SD大鼠,颈椎脱臼处死后,提取股骨和胫骨骨髓腔中的干细胞,详细方法见文献[5]。第4代MSCs培养至80%融合时,改变培养条件为无血清、低氧(94% N2、5% CO2和1% O2),72 h后收集细胞培养的上清液,提取MSC-MPs,详细方法见文献[4]。采用Braford蛋白定量试剂盒测定MSC-MPs的浓度。
1.2.2 心脏成纤维细胞的提取及培养:取1~3 d新生SD大鼠(乳鼠),用75%乙醇淹没消毒皮肤2次。无菌条件下用眼科剪开胸,剔出心脏,用眼科剪将心脏剪碎转移至放有玻璃搅拌子的玻璃瓶中,加入配置的胰酶心肌细胞消化液10 mL,37 ℃水浴消化。收集后续的心脏组织消化悬液3~4管50 mL离心管后,1 000 r/min离心10 min,弃上清,用含10% FBS的DMEM培养液重悬细胞。差速贴壁40~60 min。贴壁细胞为CFs,24 h后换液,培养并进行传代,详细方法见文献[6]。取第2代细胞进行实验。
1.2.3 分组方法:实验分为对照组(无MSC-MPs)、低剂量组(2.5 μg/mL MSC-MPs)、中剂量组(5 μg/mL MSC-MPs)、高剂量组(10 μg/mL MSC-MPs)。
1.2.4 CCK-8法检测细胞增殖能力:将对数生长期的CFs接种于96孔板,待细胞生长至70%融合时,加入膜微粒,12 h后,每孔加入10 μL CCK-8试剂,避光保存于培养箱2 h后用酶标仪检测OD值,实验重复3次。
1.2.5 细胞划痕实验检测细胞迁移能力:用记号笔在6孔板背后画线,将对数生长期的CFs接种于6孔板,待细胞生长至70%融合时,垂直于背后的横线划痕,用PBS洗涤细胞去除划下的细胞,加入MSCMPs,按0、6、12 h取样,倒置显微镜下拍照,实验重复3次。
1.2.6 qRT-PCR实验检测细胞胶原合成能力:将对数生长期的CFs接种于6孔板,待细胞生长至70%融合时,加入MSC-MPs,12 h后采用qRT-PCR的方法检测CFs中I型胶原、III型胶原、α-SMA、波型蛋白和纤连蛋白的mRNA的表达情况。步骤如下,按Trizol说明书操作步骤提取CFs RNA,然后按反转录试剂盒操作说明书转录成cDNA,再采用特异性引物扩增DNA,内参照加入GAPDH引物进行扩增,引物序列见表1。PCR反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸34 s,读板,40个循环。具体操作均按说明书进行。
1.3 统计学处理方法 用SPSS16.0统计软件进行分析。计量资料用±s表示,多个样本均数间的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 MSC-MPs促进CFs增殖 CFs中加入MSC-MPs后,低、中和高剂量组的OD值均较对照组增大,差异有统计学意义(n=3,P<0.05),并且随MSC-MPs浓度升高OD值有升高趋势,见图1。
2.2 MSC-MPs对CFs的迁移能力无影响 细胞划痕实验结果显示各实验组CFs迁移能力较对照组无明显增加,差异无统计学意义(P>0.05),见图2。
2.3 MSC-MPs促进CFs的胶原合成 提取各组CFs的RNA,qRT-PCR结果显示中剂量组和高剂量组的I型胶原、III型胶原、波形蛋白和纤连蛋白较对照组表达增加(P<0.01或P<0.05),而α-SMA无明显增加,低剂量组的波型蛋白和纤连蛋白较对照组有所增加(P<0.05),见图3。

图1 MSC-MPs促进CFs增殖

图2 MSC-MPs对CFs迁移能力的影响(×200)
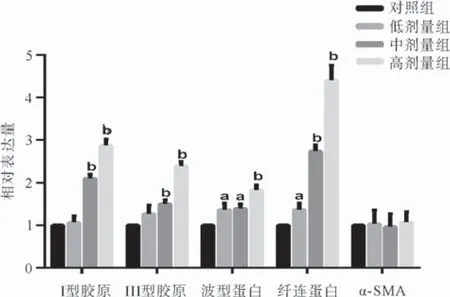
图3 MSC-MPs促进CFs的胶原合成
3 讨论
哺乳动物心脏中CFs和心肌细胞占主要部分[7]。成年哺乳动物心肌梗死后,心肌细胞几乎无增殖能力,而此时CFs在维持正常的心脏功能方面发挥重要作用。CFs可与内皮细胞之间进行信号传递[8],促进血管新生,可迁移至心梗部位进行胶原的合成及沉积[9],并表达可收缩蛋白,进而修复梗死组织。本课题组前期研究结果表明,MSCs凋亡后产生的MSC-MPs可促进血管新生,进而提高心肌梗死大鼠的心功能[4],然而其作用机制研究仍不够全面。本研究体外模拟机体缺血缺氧环境,发现MSCs凋亡产生的MSC-MPs对CFs的生物学性状产生重要影响。
心肌梗死后,CFs向梗死部位的定向迁移对损伤心肌的修复有重要作用,研究发现白三烯[10]、趋化因子如IL-1[11]和心肌营养素-1(cardiotrophin-1)[12]可促进CFs的定向迁移。在本实验结果中,MSC-MPs对CFs的迁移能力无明显影响。心肌梗死发生后早期,CFs在心梗区大量增殖,可在一定程度上修复损伤心肌。已经发现成纤维细胞生长因子-2、血管紧张素 II和血小板源生长因子(platelet derived growth factor,PDGF)可以促进梗死部位CFs的增殖[13-15],而MAPK通路对CFs增殖可产生抑制作用[15]。本研究发现MSC-MPs可促进CFs的增殖能力,所以我们推测在MSC-MPs中或许存在上述可以促进CFs增殖的物质。
心梗早期CFs产生大量细胞外基质蛋白(如胶原和纤连蛋白等)修复损伤心肌[16],并且可通过产生MMPs及其抑制剂调节基质蛋白的沉积和降解。目前对细胞外基质的产生及其调节机制仍不明确,主要发现转化生长因子-β、纤维生长因子-2[17]和PDGF[15]可通过调节血管紧张素 II通路促进梗死部位CFs的胶原合成能力[18],盐皮质激素受体信号通路[19]也可促进CFs的胶原合成。本实验结果发现,在CFs中加入MSC-MPs 12 h时,CFs的I型胶原、III型胶原、波型蛋白和纤连蛋白表达增加,而对α-SMA的产生无明显影响,MSC-MPs中的何种物质促进CFs基质蛋白的合成及其作用机制仍有待进一步研究。总之,本研究在一定程度上解释了MSC-MPs改善心肌梗死后心功能的一些机制,并为临床应用提供理论基础。
[1] HOUTGRAAF J H, DE JONG R, KAZEMI K, et al. Intracoronary infusion of allogeneic mesenchymal precursor cells directly after experimental acute myocardial infarction reduces infarct size, abrogates adverse remodeling, and improves cardiac function[J]. Circ Res, 2013, 113(2): 153-166.
[2] WANG T, SUN S, WAN Z, et al. Effects of bone marrow mesenchymal stem cells in a rat model of myocardial infarction[J]. Resuscitation, 2012, 83(11): 1391-1396.
[3] ZHAO J J, LIU X C, KONG F, et al. Bone marrow mesenchymal stem cells improve myocardial function in a swine model of acute myocardial infarction[J]. Mol Med Rep,2014, 10(3): 1448-1454.
[4] 耿志敏, 王珏, 范鸿洋, 等. 骨髓间充质干细胞膜微粒促进大鼠心肌梗死后血管新生[J]. 中国病理生理杂志, 2015, 31(8): 1371-1375.
[5] 毛晨熙, 陆地, 孙成超. Mir-193通过细胞周期相关蛋白调控大鼠骨髓间充质干细胞的增殖能力[J]. 中国病理生理杂志, 2014, 30(4): 645-650.
[6] 王珏, 黄伟聪, 郑亮承, 等. Microrna-24对心肌梗死后心肌细胞凋亡的调控作用[J]. 中国病理生理杂志, 2013, 29(4): 590-596.
[7] BAUDINO T A, CARVER W, GILES W, et al. Cardiac fi-broblasts: friend or foe[J]. Am J Physiol Heart Circ Physiol,2006, 291(3): H1015-1026.
[8] MURAKAMI M, SIMONS M. Fibroblast growth factor regulation of neovascularization[J]. Curr Opin Hematol, 2008,15(3): 215-220.
[9] LOPEZ B, GONZALEZ A, DIEZ J. Role of matrix metalloproteinases in hypertension-associated cardiac fibrosis[J]. Curr Opin Nephrol Hypertens, 2004, 13(2): 197-204.
[10] BLOMER N, PACHEL C, HOFMANN U, et al. 5-Lipoxygenase facilitates healing after myocardial infarction[J]. Basic Res Cardiol, 2013, 108(4): 367.
[11] MITCHELL M D, LAIRD R E, BROWN R D, et al. IL-1beta stimulates rat cardiac fibroblast migration via MAP kinase pathways[J]. Am J Physiol Heart Circ Physiol, 2007,292(2): H1139-1147.
[12] FREED D H, CHILTON L, LI Y, et al. Role of myosin light chain kinase in cardiotrophin-1-induced cardiac myofibroblast cell migration[J]. Am J Physiol Heart Circ Physiol,2011, 301(2): H514-522.
[13] DETILLIEUX K A, SHEIKH F, KARDAMI E, et al. Biological activities of fibroblast growth factor-2 in the adult myocardium[J]. Cardiovasc Res, 2003, 57(1): 8-19.
[14] SCHEUREN N, JACOBS M, ERTL G, et al. Cyclooxygenase-2 in myocardium stimulation by angiotensin-II in cultured cardiac fibroblasts and role at acute myocardial infarction[J]. J Mol Cell Cardiol, 2002, 34(1): 29-37.
[15] ZYMEK P, BUJAK M, CHATILA K, et al. The role of platelet-derived growth factor signaling in healing myocardial infarcts[J]. J Am Coll Cardiol, 2006, 48(11): 2315-2323.
[16] JUGDUTT B I. Remodeling of the myocardium and potential targets in the collagen degradation and synthesis pathways[J]. Current Drug Targets Cardiovas Haematol Disord,2003, 3(1): 1-30.
[17] CHU H, CHEN C W, HUARD J, et al. The effect of a heparin-based coacervate of fibroblast growth factor-2 on scarring in the infarcted myocardium[J]. Biomaterials, 2013, 34(6): 1747-1756.
[18] GUIMARÃES G G, SANTOS S H S, OLIVEIRA M L, et al. Exercise induces renin-angiotensin system unbalance and high collagen expression in the heart of Mas-deficient mice[J]. Peptides, 2012, 38(1): 54-61.
[19] WEBER K T, SUN Y, TYAGI S C, et al. Collagen network of the myocardium: function, structural remodeling and regulatory mechanisms[J]. J Mol Cell Cardiol, 1994, 26(3):279-292.
(本文编辑:丁敏娇)
Effect of microparticles derived from bone marrow mesenchymal stem cells on cardiac fibroblasts
CHEN Mian1, WANG Jue2, GENG Zhimin3, PAN Lulu4, JIN Zengyou3, JIA Lianhong3, LU Jiacheng3, HUANG Niannian3, CHU Maoping4. 1.Department of Paediatrics, Taizhou Hospital Affiliated to Wenzhou Medical University, Taizhou, 317000; 2.Department of Cardio-Thoracic Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Paediatrics, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 4.Children’s Heart Center, the Second Affiliated Hospital & Yuying Children’s Hospital, Institute of Cardiovascular Development and Translational Medicine, Wenzhou Medical University, Wenzhou, 325027
Objective: To study the effects of microparticles derived from bone marrow mesenchymal stem cells (MSC-MPs) on proliferation, migration and collagen synthesis of cardiac fibroblast. Methods: MSCs were obtained from SD mice and cultured under the condition of serum free in hypoxia. Then the conditioned media were collected and microparticles were then isolated from the media. MSC-MPs were used to treat cardiac fibroblast. CCK-8 assay and cell scratch method were used to detect the effect of MSC-MPs on proliferation and migration of cardiac fibroblast, seperately. The expression of collagens I and III, α-SMA, vimentin and fibronectin in cardiac fibroblast were measured by means of qRT-PCR. Results: The proliferation ability of cardiac fibroblast was enhanced after treated with MSC-MPs. The migration ability was not significantly affected. The expression of collagens I and III, vimentin and fibronectin in cardiac fibroblast were promoted. Conclusion: MSC-MPs can enhance the proliferation ability and collagen synthesis of cardiac fibroblast to improve the cardiac function.
bone marrow mesenchymal stem cells; microparticles; cardiac fibroblast; proliferation; migration;collagen synthesis
R331.31
A
10.3969/j.issn.2095-9400.2016.09.001
2016-03-10
浙江省自然科学基金资助项目(LY14H020008);浙江省医药卫生科技计划项目(2010KYA13);浙江省中医药科技计划项目(2010ZA089);温州市科技局科研基金资助项目(Y20130169)。作者简介:陈棉(1982-),女,浙江黄岩人,主治医师,在职硕士生。
褚茂平,主任医师,Email:chmping@hotmail.com。

