低温耗氮技术在低醇白葡萄酒酿造中的应用
吕文,唐敏慧,崔艳
(1.中法合营王朝葡萄酿酒有限公司,天津300402;2.天津农学院食品科学与生物工程学院,天津300384)
低温耗氮技术在低醇白葡萄酒酿造中的应用
吕文1,唐敏慧2,崔艳2
(1.中法合营王朝葡萄酿酒有限公司,天津300402;2.天津农学院食品科学与生物工程学院,天津300384)
采用低温耗氮方式进行了低醇葡萄酒的发酵工艺研究。在发酵过程中摸索了不同的拉低温时机、低温温度及去除部分生物量等对于低醇葡萄酒发酵中的酵母生长代谢、总氮量、α-氨基氮、还原糖、总酸等理化、感官指标以及稳定性的影响,进而评价低温耗氮技术酿造较高稳定性的低醇葡萄酒的可能性。结果表明,发酵前期拉低温处理和去除部分生物量能够明显增加酵母菌的耗氮,改变其生长代谢状况。在发酵36 h时拉低温至0℃处理,之后低温离心并回填1/5酵母生物量至醪液继续正常发酵的低醇葡萄酒,酒精度更易控制在低醇范围,微生物稳定性更好,且葡萄酒具有更好的品种特性。
低温;低醇;生物量移除;耗氮;葡萄酒
低醇葡萄酒因其酒精度低,契合当前人们的健康生活理念,所以越来越受到市场的亲睐,也引起了更多研究人员和相关企业的关注。但是低醇葡萄酒由于残糖高、发酵终止困难,往往导致最终的低醇葡萄酒稳定性较低,且过短的发酵时间使得葡萄的香气风味成分以及有益的酵母次级代谢产物不能充分在酒体中积累,从而使得酒体单薄,口感寡淡,缺乏层次。尽管目前国外已经有采用脱糖、脱醇、有机溶剂萃取、超临界二氧化氮萃取等多种方式生产低醇葡萄酒,但这些技术对葡萄酒的酒体香气或风味均有一定程度的损害,另外其高昂的附加成本仍然是国内消费者所不能接受的。
在葡萄酒发酵过程中,酿酒酵母通常是在发酵生长期的前24~48 h更多地利用氮源,而在氮源接近耗尽时,它会促使酵母生长进入稳定期[1],而糖类的代谢则多是在氮源相对缺乏时更加明显[2]。因此可以说氮源的利用不仅会影响酵母的生长状况,发酵速率,还会影响发酵持续的时间和糖代谢的速率[3],甚至由于酵母可利用氮(YAN)中的α-氨基酸是某些香气成分的前体物质,它还会影响葡萄酒中酯类物质、高级醇和脂肪酸等物质的生成[4]。当葡萄醪液中氮源降低到一定程度时,酵母菌发酵活力降低,其生长速率也会随之降低[5-7]。所以利用好发酵葡萄浆中的氮源是决定低醇葡萄酒品质好坏的关键因素之一。目前国内关于葡萄酒酵母对氮源利用方面的研究较少,国外则在葡萄汁氮源及发酵助剂的添加对发酵酒精动力学及葡萄酒香气的产生及其基因表达方面做了较多的研究[8-10]。
本研究利用了酵母菌在发酵前期大量消耗氮源这一特点,在发酵前期的24~48 h中,取出部分发酵醪液将其置于低温下处理,因为酵母在低温下会发生聚集沉淀,酵母细胞变大,细胞核消失,芽细胞处的隔壁消失,其活性因此而受到明显的抑制。同时去除部分生物量,然后将剩余生物量回填至发酵醪液中继续发酵,使其再度重复生长初期的耗氮阶段,通过氮源的消耗以及生物量的减少,控制酵母的生长代谢状况,一方面适当延长低醇葡萄酒的发酵时间,利于代谢的香气、风味及营养物质的积累,另一方面使得终止发酵变得容易,利于保持较恒定的低酒精度和稳定的酒体。本研究的成果可对了解这一技术在低醇葡萄酒方面的应用提供一定的参考数据。
1 材料与方法
1.1材料、试剂及设备
玫瑰香葡萄:采自天津汉沽葡萄基地。
菌种及耗材:酿酒酵母QA23(法国Laffort公司),果胶酶(LATAZYMCL公司),偏重亚硫酸钾、硫酸铜、硫酸钾、甲基红、茚三酮、果糖、碘酸钾、甘氨酸(天津市天大化工实验厂)。
仪器设备:HHBII600恒温培养箱,天津天宁技术实业有限公司;UDK140凯氏定氮仪,意大利VELP公司。
1.2实验方法
1.2.1操作
将新鲜无腐败无烂果的玫瑰香葡萄,去皮破碎打浆,同时添加二氧化硫,然后加果胶酶0.2 g/L,在12℃下隔夜静置8 h后过滤。将在40℃水浴中活化好的酿酒酵母(QA23)接种(2.15×106个/mL)至果汁中,置于恒温培养箱开始发酵,温度设定为19℃。当发酵进行到24 h、36 h、48 h时,分别取出部分发酵醪液放置在0℃和4℃的温度下进行低温处理,时间均为24 h。然后将上述醪液进行低温离心(4℃,4000 r/min,20 min),收集沉淀后以酵母活菌计数分别取1/5、1/3、1/2的酵母生物量回填到上清液中,同时以0℃和4℃下未离心的组(即不回填组)作为该温度下的对照组,将回填后的发酵葡萄醪及各自温度下的对照组一起放回19℃培养箱中继续发酵。当酒精度达到目标值7%vol时,添加60 mg/L的SO2终止发酵,置于0℃下保存7 d后,用一定量的皂土进行澄清处理7 d,澄清过滤获得低醇玫瑰香葡萄原酒,置于4℃下保存待测。整个发酵过程中每隔12 h测定酵母数、残糖、总氮量以及α-氨基氮含量,最后检测成品酒的酒精度、残糖、总酸及冷、热稳定性。以19℃下正常发酵的低醇葡萄酒作为对照组。试验中的每个组均设3个平行样。
1.2.2检测方法
理化指标:α-氨基氮采用茚三酮法,总氮量测定采用凯氏定氮法(GB 5009.5—2010)[11],酒精度测定采用密度瓶法,还原糖测定采用斐林法,总酸测定采用指示剂法(GB/T 15038—2006)[12]。
菌落计数:采用平板菌落计数及血球计数板。
稳定性检测:冷稳定性,-4℃下维持3 d观察;热稳定性,85℃下15 min保温观察。
感官指标:选10位评审专家对所酿低醇葡萄酒进行外观、香气、滋味和典型性评价(GB/T 15038—2006)。
2 结果与分析
2.1低温耗氮对发酵过程中酵母菌细胞生长代谢的影响(图1、图2、图3)
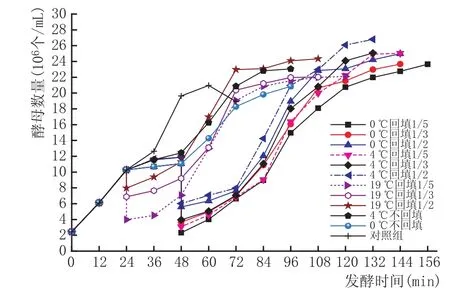
图1 24h时拉低温处理对酵母菌生长代谢的影响
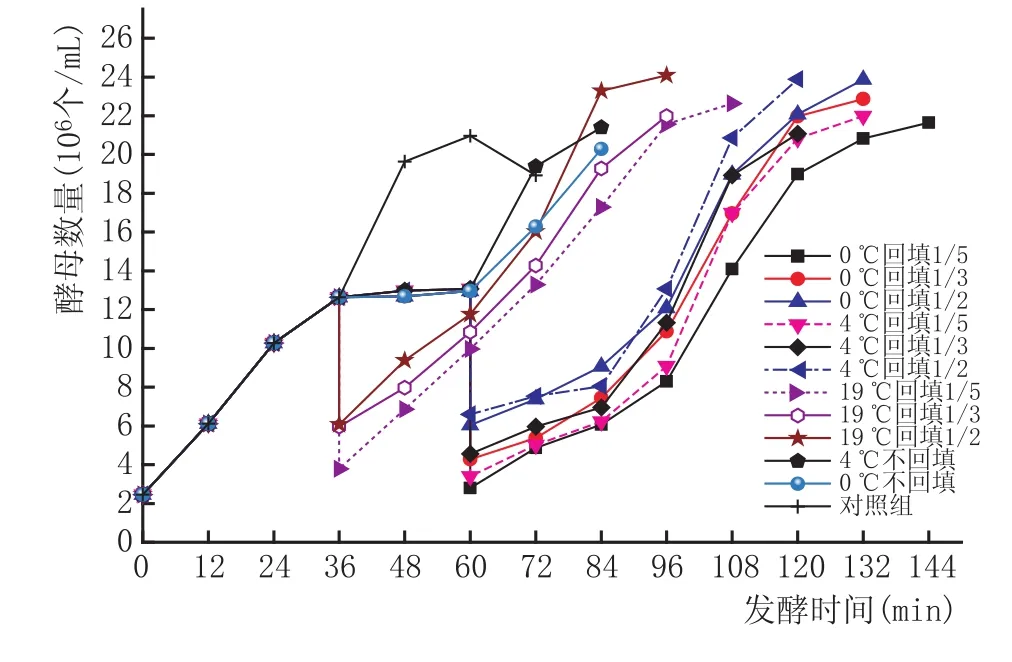
图2 36h时拉低温处理对酵母菌生长代谢的影响
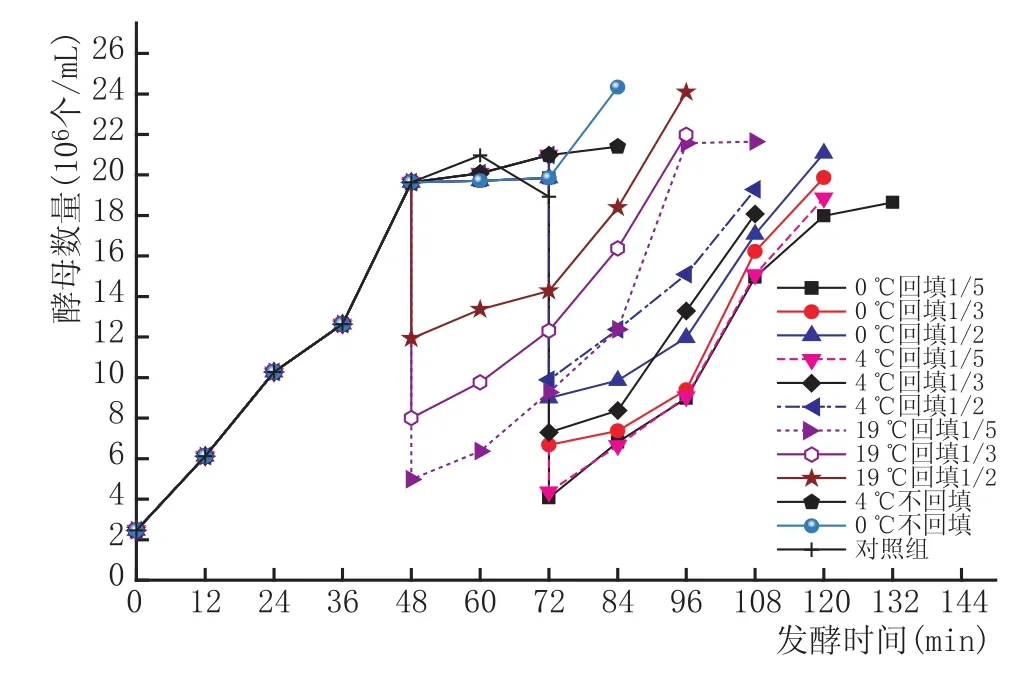
图3 48h时拉低温处理对酵母菌生长代谢的影响
由图1、图2、图3可以看出,在发酵过程中低温处理、去除酵母量以及拉低温处理时机均不同程度地改变了酵母菌的生长轨迹,延长了发酵时间,而对照组仅72 h的酒精度就达到了目标值7%vol。仅从低温处理来看,0℃的效果要好于4℃,除去低温放置时间24 h外,它对延长发酵期的影响并不太大,只是通过降温处理钝化了酵母,对酵母数的影响并不明显。仅从去除酵母生物量可以看出,回填量越大,继续发酵后酵母起酵越快,回填量1/2的酵母数的增长要明显高于1/3和1/5的。但当去除生物量再低温处理以后,可以明显看出,拉低温后回填部分生物量的组酵母菌的发酵期延长,均在120 h以后达到较为理想的酒精度时而终止发酵,说明低温处理有助于确定回填生物量的准确性,因为低温处理一定时间后,绝大部分酵母钝化而通过离心进入沉淀,通过酵母菌落计数也发现,此时离心后上清液的酵母数相比未低温处理的要少很多。而拉低温处理的时机也决定了当回填酵母菌再次起酵后的生长特征,在24 h拉低温的图中,可以看出当发酵进行到60 h时,回填后的酵母再次起酵,当发酵到理想酒精度时,酵母的生长曲线已经开始进入稳定期,其酵母生长速率逐渐平稳。36 h拉低温组同样在发酵到72 h时再次起酵,由于拉低温时机较晚,故其酵母量要高于24 h组,因此回填量也高于24 h,起酵也较24 h更快,因此发酵到132 h时,基本上达到目标酒精度,且此时酵母菌生长也接近平稳,生长速率已开始下降。而48 h拉低温组再次起酵时酵母量过高,且酵母生长已经进入稳定期,即酒精度已经有一定积累,因此更接近终点,当发酵终止时,重新起酵后的酵母菌生长依然旺盛,处于对数上升期,会造成发酵终止的困难。
2.2低温耗氮对α-氨基氮的影响
α-氨基氮是酵母可利用氮的主要来源[13],研究过程中,发现总氮量和α-氨基氮随着发酵时间的变化,其变化趋势大体相同(图4、图5、图6)。从图中的对照组线可以看出,发酵中12~36 h之间α-氨基氮降低最快,从222.8 mg/L降到了130.2 mg/L,降低了92.6 mg/L,可能是因为酵母在这个时间段对氮源的需求量最大,这和Tesniere C等[14]的研究基本一致,此时氮源主要被酵母菌用来构建自身所需的蛋白质。实验也发现,在低醇葡萄酒的发酵过程中,碳源消耗最快的阶段是在60~72 h之间,说明氮源的利用优先于碳源。在拉低温处理或回填处理后,曲线比对照组曲线更陡,说明拉低温或者回填处理能再次增大酵母菌对氮源的消耗,应该是部分回填及低温处理使得酵母菌再次处于发酵初期的起酵阶段,重新开始进入生长期,重复利用更多的氮源用于自身的生长繁殖,从而使得氮源的消耗速度要快于对照组。
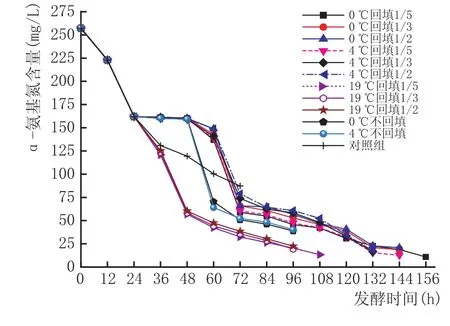
图4 24h进行拉低温温度及回填量对于原酒中α-氨基氮的影响
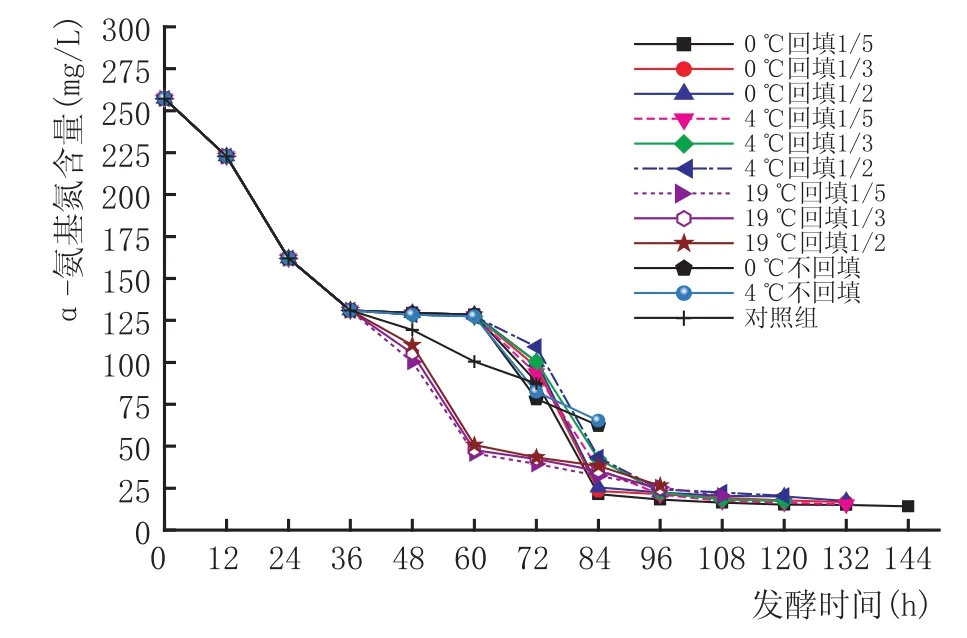
图5 36h进行拉低温温度及回填量对于原酒中α-氨基氮的影响
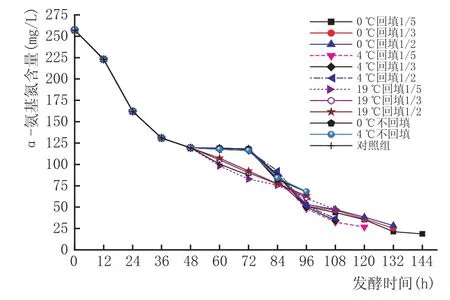
图6 48h进行拉低温温度及回填量对于原酒中α-氨基氮的影响
从拉低温时机看,48 h拉低温后的曲线较平缓,24 h和36 h的曲线则较陡,原因可能是24 h、36 h组比48 h组的葡萄醪液中氮含量多,酵母菌再次起酵后重复快速耗氮。但同时发现,36 h和48 h拉低温组再次耗氮的量要大于19℃组,而24 h的则直到发酵结束时,总的耗氮量和19℃组的基本接近。可能是因为氮源被利用最多的是在起酵后的24~48 h。明显看出,36 h拉低温后,无论是耗氮的速度还是耗氮总量上均优于其他2个时机。从低温处理来看,0℃和4℃对α-氨基氮影响的区别并不大,但均大于19℃组,说明拉低温处理是有效的。而回填量的不同在回填后的48 h内均显示出1/5回填量耗氮多于其他的量,可能是因为酵母量少时它需要更多的可利用氮来生长繁殖,发酵到后期,随着酵母数的不断增多,这3个回填量的耗氮量差别不再明显。
2.3低温耗氮对低醇葡萄酒其他指标的影响(表1)
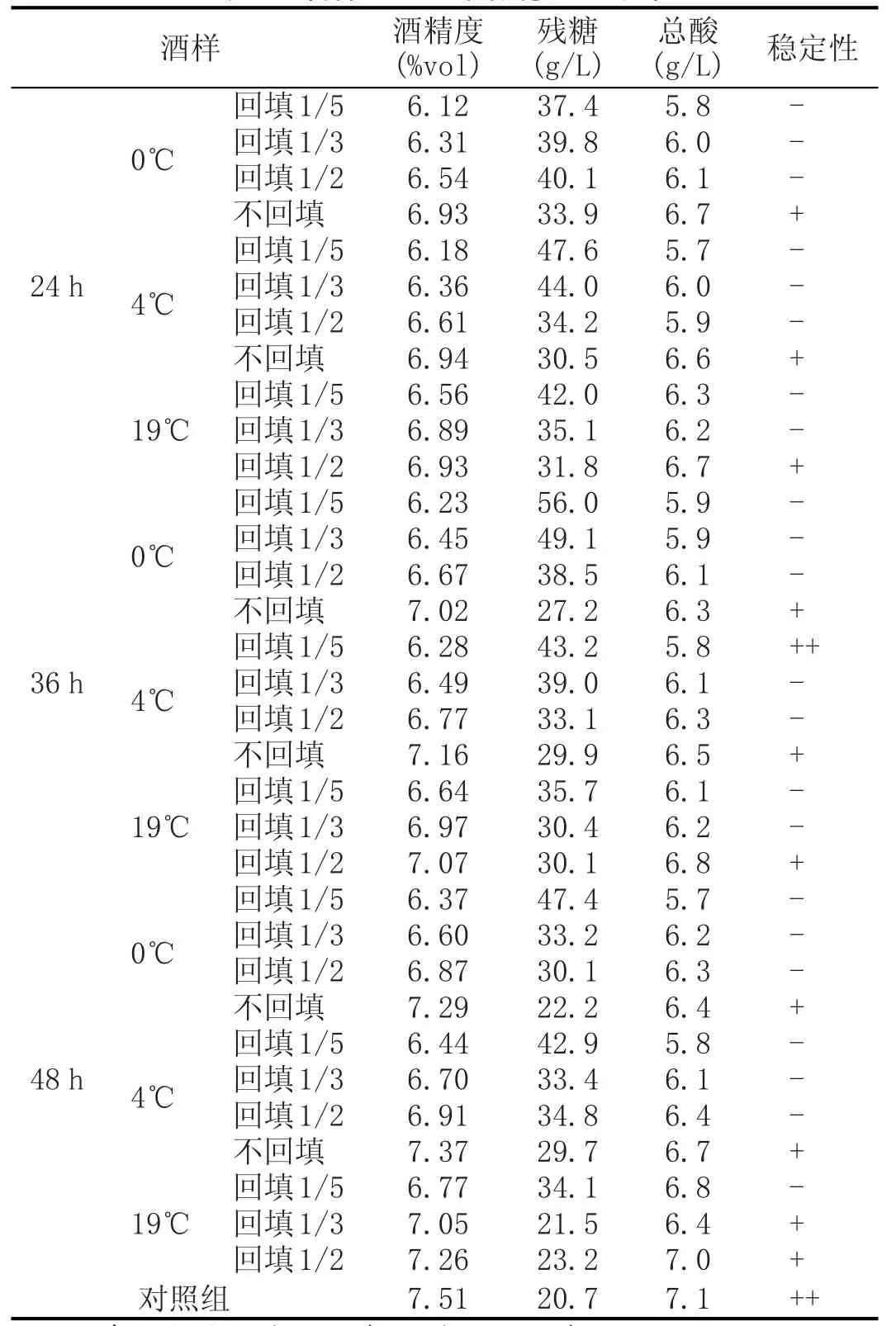
表1 酒样的理化指标稳定性结果
按照低醇葡萄酒的要求,本研究目标酒精度低于7%vol,对照组终止发酵时酒精度为6.89%vol,但是在保存2周后发现仍有气泡产生,热稳定性检测出现了絮状物,冷稳定性有少量的白色沉淀,且酒精度上升到7.51%vol。拉低温处理组和回填生物量组的酒精度和总酸均比对照组低,说明耗氮培养对酵母菌的糖代谢有一定的影响。且0℃较4℃的酒精度低,19℃最高,说明0℃对酵母菌的抑制作用更强;但低温组中不回填组均出现了稳定性不合格的问题,说明仅降低温度能在一定程度上钝化酵母,抑制其活性,延迟酵母的生长期,但随着继续回到培养箱发酵后很快酵母就会恢复。回填1/ 5酵母量的酒精度要低于其他的回填量,而且酒体更稳定,说明酵母菌数对酒精度的影响很大,以36 h为例,回填1/5的酵母数约为2.43×106个/mL,酵母菌利用氮源和碳源合成自身所需物质的需求要大于酒精代谢,从而当发酵快结束,氮源消耗低至一定量的时候,由于酵母菌的生长速率下降,发酵终止变得相对容易,使得酒精度稳定在低醇范围之内,而不会因为残糖高而引发贮藏过程中的微生物不稳定问题,这和郭凡移除生物量酿造低醇苹果酒的研究结果相近[15]。而不回填组除酒精度较高外,也在贮藏期间发生产气和浑浊现象。从拉低温时机来看,24 h组的酒精度总体最低,因为此时酵母数量较少,同样的回填量也是最少的,因此酒精度相对较低,其次是36 h,最高的是48 h,但是因为36 h拉低温的耗氮量最大,所以其最终酒精度和24 h组的差别较小。总酸除对照组略高以外,其他组的差别并不大。
通过10位专家小组成员的感官评价,24 h、36 h拉低温至0℃处理,且酵母生物量回填为1/5的组,各批次低醇葡萄酒的最终酒精度较低而且保持稳定,且后续的贮藏期间无气泡、无浑浊产生。酒体呈淡黄绿色,澄清透明,酸甜适宜,舒顺易饮,层次结构感较强,并无因酒精度低而带来的寡淡单薄的口感,且清爽的果香味明显,有较为典型的葡萄品种香气。
3 结论
通过以上研究表明,采用发酵过程中拉低温处理结合部分去除酵母生物量的低温耗氮技术确实可以用来进行低醇葡萄酒的酿造。综合研究数据、稳定性及感官评价认为最佳低温耗氮条件为:在葡萄醪液正常发酵(19℃)至36 h时,取出醪液置于0℃下进行低温处理(24 h),然后低温离心,将离心沉淀中酵母生物量的1/5回填至离心上清液中置于19℃下继续发酵直至达到理想酒精度。结果显示回填酵母菌重复生长初期的耗氮可以达到降低酒精度的目的。且利用该技术酿造的低醇葡萄酒酒精度较低,酒体澄清透明、稳定性好,具有葡萄品种的典型性,且层次丰富,酸甜适宜,舒顺易饮。该工艺是在工业生产需求的基础上做的研究,充分考虑了进一步扩大的可能性及操作的可行性,具有一定的推广和参考价值。
[1]Brice C,Sanchez I,Tesniere C,et al.Assessing the mechanisms responsible for differences in nitrogen requirements between Saccharomyces cerevisiae wine yeasts in alcoholic fermentation[J].Applied and Environmental Microbiology,2014,80:1330-1339.
[2]Novo M T,Betltran G,Rozes N,et al.Effect of nitrogen limitation and surplus upon trehalose metabolism in wine yeast[J].Applied Microbiology and Biotechnology,2005,66:560-566.
[3]Barbosa C,Falco V,Mendes-faiaA,et al.Nitrogen addition influences formation of aroma compounds,volatile acidity and ethanol in nitrogen deficient media fermented by Saccharomyces cerevisiae wine strains[J].Journal of Bioscience and Bioengineering,2009,108(2):99-104.
[4]Hernandez-orte P,Bely M,Cacho J,et al.Impact of ammonium additions on volatile acidity,ethanol,and aromatic compound production by different Saccharomyces cerevisiae strains during fermentation in controlled synthetic media[J]. Australian Journal of Grape and Wine Research,2006,12:150-160.
[5]Ugliano M,Siebert T,Mercurio M,et al.Volatile and color composition of young and model-aged Shiraz wines as affected by diammonium phosphate supplementation before alcoholic fermentation[J].Journal ofAgricultural and Food Chemistry,2008,56:9175-9182.
[6]Varela C,Pizarro F,Agosin E.Biomass content governs fermentation rate in nitrogen deficient wine musts[J].Applied and Environmental Microbiology,2004,6:3392-3400.
[7]Orlic S,Arroyo-lopez F N,Huic-babic K,et al.Acomparative study of the wine fermentation performance of Saccharomyces paradoxus under different nitrogen concentrations and glucose/ fructose ratios[J].Journal ofApplied Microbiology,2010,108:73-80.
[8]周光荣,杨雪峰,段雪荣,等.葡萄酒发酵过程中氮源的控制与管理[J].应用科技,2014(24):287-288.
[9]Garde-cerdan T,Martinez-gilAM,Lorenzo C,et al. Implications of nitrogen compounds during alcoholic fermentation from some grape varieties at different maturation stages and cultivation systems[J].Food Chemistry,2011,124:106-116.
[10]Callejon R M,TroncosoAM,Morales M L.Determination of amino acids in grape-derived products:Areview[J].Talanta,2010,81:1143-1152.
[11]食品安全国家标准食品中蛋白质的测定:GB 5009.5—2010[S].北京:中国标准出版社,2010.
[12]中国轻工业联合会.葡萄酒、果酒通用分析方法:GB/T 15038—2006[S].北京:中国标准出版社,2008.
[13]Maisonnave P,Sanchez I,Moine V,et al.Stuck fermentation: development of asynthetic stuck wine and study of a restart procedure[J].International Journal of Food Microbiology,2013,163:239-247.
[14]Tesniere C,Brice C,Blondin B.Responses of Saccharomyces cerevisiae to nitrogen starvation in wine alcoholic fermentation[J].Applied Microbiology and Biotechnology,2015,99:7025-7034.
[15]郭凡,唐圣云,王戎,等.生物量移除技术发酵低醇苹果酒[J].中国酿造,2012,31(9):186-189.
Application of Low Temperature and Nitrogen Consumption Technology in Brewing of Low-Alcohol Wine
LV Wen1,TANG Minhui2and CUI Yan2
(1.Sino-French Joint-venture Dynasty Winery Co.Ltd.,Tianjin 300402;2.School of Food Science and Bioengineering,TianjinAgricultural University,Tianjin 300384,China)
In this paper,we studied the brewing of low-alcohol white wine by low temperature treatment combined with nitrogen consumption technology.The temperature,the timing of lowering the temperature,and biomass reduction amount were explored to study their influence on the yeast metabolism,total nitrogen,α-amino nitrogen,reducing sugar,total acids,sensory indexes,wine stability,etc.,and to evaluate the possibility of brewing stable low-alcohol wine by low temperature treatment combined with nitrogen consumption technology.The results showed that,low temperature treatment combined with biomass reduction during the early stage of fermentation could significantly increase the nitrogen consumption of yeasts,and change their metabolism conditions.The optimal technique conditions were as follows:lowering temperature to 0℃after 36 h fermentation,then backfilling 1/5 of the biomass into the fermentation liquid after cryogenic centrifugation.Under above conditions,the alcohol content was easier to control,the wine body was stable,and the wine had a typical varietal taste.(Trans.by HUANG Xiaoli)
low temperature;low alcohol;biomass reduction;nitrogen consumption;grape wine
TS262.6;TS261.4
A
1001-9286(2016)10-0056-05
10.13746/j.njkj.2016215
天津市农业科技成果转化与推广项目(201502130)。
2016-06-30
吕文(1973-),男,高级工程师,硕士,研究方向:葡萄酒工艺技术。
崔艳,女,副教授,硕士,研究方向:葡萄酒酿造与分析。

